Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.27 supl.2 Bogotá Dec. 2012
VII. Hepatitis C en pacientes con insuficiencia renal
Juan Carlos Restrepo G., MD, MSc, PhD. (1), Rolando José Ortega Q., MD.(2)
(1) Médico y Cirujano, Especialista en Medicina Interna, Hepatología clínica. Magister en Trasplante de órganos y tejidos, PhD en Ciencias Médicas. Unidad de Hepatología y Programa de Trasplante de Hígado del Hospital Pablo Tobón Uribe. Jefe sección de Gastrohepatología, Facultad de Medicina, Universidad de Antioquia. Jefe Postgrado Hepatología Clínica, Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
(2) Médico y Cirujano, Especialista en Medicina Interna, Gastroenterología Clínica y Endoscopia Digestiva. Research Fellow y Becario de Hepatología. Director División de Hepatología. Instituto de Enfermedades Hepáticas y Digestivas. Organización Clínica General del Norte, Barranquilla. Director Instituto de Investigaciones Biomédicas (IDIBAM). Facultad de Ciencias de la Salud. Universidad de San Buenaventura, Cartagena, Colombia.
EPIDEMIOLOGIA
En Latinoamérica, la hepatitis C tiene una de las prevalencias más bajas del mundo, estimada en 1,2% aproximadamente, aunque varía de región en región incluso dentro de un mismo país. La infección por el virus de la hepatitis C (VHC) es la causa más frecuente de enfermedad hepática en los pacientes con insuficiencia renal crónica terminal (IRCT) en terapia sustitutiva en hemodiálisis (HD) y con trasplante renal (TR). Los genotipos y subtipos se identifican con test algo más complejos y su utilidad consiste en conocer la distribución geográfica de la epidemiología molecular de VHC en la población de pacientes en HD y TR, con el objeto de conocer si existe relación con la supervivencia del paciente en diálisis, trasplantado o del injerto. Los estudios efectuados muestran que la mayoría de pacientes en HD o TR están infectados por los genotipos 1a y 1b, y ninguno ha podido establecer ninguna correlación con la supervivencia del injerto ni del paciente (1-6).
FACTORES DE RIESGO
Los principales factores de riesgo para la transmisión del VHC en pacientes con IRCT y/o en HD son las transfusiones de sangre a partir de donantes no tamizados en el pasado, el uso de medicamentos parenterales, y la transmisión nosocomial horizontal (5, 6). Se sabe que el virus puede permanecer activo en jeringas contaminadas más de 60 días (7). Se estima que el uso de medicamentos parenterales es responsable de aproximadamente dos millones de infecciones al año, lo que representa hasta 40% de las infecciones a nivel mundial en la población general (8).
BIOSEGURIDAD
Se ha objetivado que la viremia puede disminuir durante el periodo de HD, hecho que se ha atribuido a la absorción en la membrana debido a que el tamaño de poro que se ha utilizado hasta ahora es pequeño y no pasa el virus. La identificación precoz de los pacientes infectados o potencialmente infectados es muy importante, para poder establecer las medidas de aislamiento y evitar la transmisión nosocomial horizontal que en el momento actual es la principal vía de transmisión (6).
VIROLOGIA
El VHC es un virus RNA de cadena simple positiva, envuelto, que pertenece a la familia Flaviviridae y al género Hepacivirus. Se conocen seis genotipos que muestran una variación en su secuencia de nucleótidos de 30% a 35%, que se nombran del 1 al 6. Dentro de cada genotipo hay más de 50 subtipos que se denominan a, b, c, d, y así sucesivamente, y dentro de cada individuo infectado se encuentran cuasi especies, representando la gran heterogeneidad genética de este virus (9, 10).
MANIFESTACIONES CLINICAS
La infección aguda en los paciente con IRCT es usualmente asintomática y por lo tanto rara vez se diagnostica (9, 11). El RNA del VHC se puede detectar en el suero de los pacientes entre 1 y 2 semanas después de la exposición, en tanto que la aparición de anticuerpos solo comienza a hacerse evidente después de 8 a 12 semanas (12, 13). De 15% a 25% de los pacientes con hepatitis aguda pueden eliminar la infección, en tanto que de 75% a 85% progresan a la fase crónica. De los infectados crónicamente, 20% desarrolla cirrosis hepática y de estos, 6% hace falla hepática terminal, y entre 1% y 4% desarrolla carcinoma hepatocelular (9, 12, 14, 15).
DIAGNOSTICO
Las pruebas serológicas se usan para la tamización y diagnóstico de la infección por el VHC. La especificidad de estas pruebas es mayor de 99% (6, 16). Las pruebas virológicas que detectan el RNA del VHC pueden ser cualitativas o cuantitativas (13). La genotipificación, por su parte, debe hacerse antes de iniciar el tratamiento, ya que determina su indicación, la duración y dosis del mismo, y el procedimiento para monitorear el tratamiento (2). Los anticuerpos no comienzan a hacerse visibles antes de las 8 a 12 semanas y su hallazgo no permite diferenciar entre infección aguda, crónica o resuelta (13). Es importante tener en cuenta que en pacientes inmunosuprimidos, o en HD puede haber resultados negativos en la prueba de anticuerpos aunque existan viriones circulantes e infección actual (17). El estudio de la carga viral y la genotipificación del virus se reservan para el momento de tomar decisiones terapéuticas (6, 18). El diagnóstico de infección por VHC se efectuará por la positividad de anticuerpos anti-VHC y la presencia de ARN-VHC en suero, si la presencia de viremia persiste más de 6 meses se considerará que ha desarrollado una infección crónica. El diagnóstico de hepatitis crónica por VHC se establecerá por la presencia de infección por VHC, asociada a la presencia de lesión histológica de hepatitis
crónica o elevación de los niveles de aminotransaminasa de la alanina (ALT). Los estudios efectuados han constatado que una proporción importante de pacientes con infección por VHC en HD cursan de forma asintomática y con niveles de transaminasas normales. Las cifras de ALT, en general, no son un buen indicador de hepatitis crónica en estos pacientes, debido a que solo entre 12% y 31% de los pacientes, anti-VHC y ARN-VHC positivo, y 33% de los pacientes con histología de hepatitis crónica cursan con niveles de ALT elevado (6). En los pacientes con IRCT infectados por el VHC y pendientes de trasplante renal es necesario efectuar el diagnóstico histológico con el objeto de excluir una hepatitis crónica grave (estadio 3/4, metavir) con o sin cirrosis. En caso de confirmarse esta, deberá evaluarse al paciente para un posible doble trasplante (hígado y riñón), debido a que la lesión hepática grave implica un mal pronóstico después del TR y, en una proporción importante de casos, es la causa de muerte por insuficiencia hepática. Respecto a la biopsia hepática, debemos considerar que una proporción de pacientes cursa con trastornos de la coagulación debido al síndrome urémico y el riesgo de hemorragia en la punción percutánea es mayor que en aquellos pacientes con hepatitis crónicas no dializados. La punción por vía transyugular permite obtener habitualmente material adecuado para el estudio histológico de la hepatitis crónica y, además, permite efectuar un estudio hemodinámico (6). Las lesiones histológicas en los pacientes en HD tienden a ser más leves que en los pacientes con VHC sin insuficiencia renal y que la mayoría de estos presenta una lesión hepática inespecífica o una hepatitis crónica leve y que la proporción de pacientes con cirrosis hepática es menor. Este hecho se atribuye a la inmunosupresión de los pacientes con insuficiencia renal, que favorece que la infección sea menos activa y con menor tendencia a la progresividad. No obstante, en todos los estudios histológicos del hígado practicados en pacientes hemodializados se objetiva que una proporción no superior a 10% tiene ya cirrosis hepática. Los pacientes con fibrosis significativa suelen haber estado en hemodiálisis durante más tiempo que aquellos sin fibrosis e igualmente los que habían recibido uno o más trasplantes de riñón con anterioridad tienen también más fibrosis. Por tanto, la mayoría de estudios concluye que en el grupo de pacientes con VHC en hemodiálisis la hepatitis crónica y el estado de portador sano es común y la cirrosis hepática infrecuente (6).
TRATAMIENTO
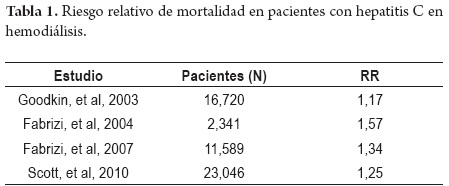
La infección por el virus de hepatitis C aumenta la mortalidad en pacientes con IRCT en programa de hemodiálisis con un riesgo relativo que oscila entre 1,17 y 1,57 (tabla 1). La mortalidad de causa hepática por cirrosis y hepatocarcinoma tiene un riesgo relativo de 5,89 y también es mayor la mortalidad cardiovascular con un riesgo relativo de 1,8. De manera similar, la mortalidad en pacientes con trasplante renal y la pérdida del injerto es mayor en aquellos pacientes con hepatitis C que en trasplantados no infectados, alcanzando un riesgo relativo de 1,79 y 1,56 respectivamente (19, 20). La diferencia en la sobrevida es más notoria después de la segunda década del trasplante renal, siendo de 77% vs. 90% en los primeros 5 años y 50% vs. 79% a los 10 años para trasplantados con y sin hepatitis C. Además de la mortalidad hepática y cardiovascular, la hepatitis C predispone a una glomerulonefritis de novo mediada por complejos inmunes en el injerto, una nefropatía aguda y crónica del injerto, una microangiopatía trombótica en el injerto, un alto riesgo de diabetes mellitus posterior al trasplante y sepsis (21-23).
Una de las manifestaciones extrahepáticas más comunes de la hepatitis C es la glomerulonefritis membranoproliferativa en pacientes con una crioglobulinemia mixta tipo II, que se asocia al depósito de complejos inmunes formados por antígenos del virus, anticuerpos tipo IgG, factor reumatoideo IgM, y complemento en la pared del capilar glomerular, el intersticio y los túbulos. El tratamiento de esta complicación está basado en la inmunosupresión con corticoides, rituximab y plasmaféresis para los casos severos con síndrome nefrítico/nefrótico y la posterior terapia antiviral combinando interferón pegilado (IFN-PEG) y dosis bajas de ribavirina. Otras formas de presentación son la glomerulonefritis membranoproliferativa sin crioglobulinas, la nefritis membranosa, glomerulonefritis proliferativa y la esclerosis glomerular focal y segmentaria. A pesar de estas formas de presentación, no se ha demostrado que la hepatitis C aumente el riesgo de IRC como sí se ha demostrado claramente para la diabetes mellitus y la hipertensión arterial (24). En un estudio de cohortes que incluyó 167.569 pacientes (154.185 con hepatitis C vs. 13.384 sin hepatitis C), la prevalencia basal de IRC fue de 5,3% y 5,1% respectivamente (p= 0,3) (25).
Las indicaciones para tratamiento y el régimen más óptimo para los pacientes con IRC en términos de eficacia y seguridad están por definir. La decisión de tratar está basada en la histología hepática, la edad, la presencia de comorbilidades, la tolerancia y la expectativa de vida. En pacientes en lista de espera, 46% está en estadio F0-F1, 30% en estadio F2-F3 y 24% está cirrótico (F4). Si el paciente es candidato para trasplante renal debe iniciarse tratamiento aun en aquellos con poca lesión hepática evidente (F0F1), debido a los beneficios que se obtienen después del trasplante al reducir las complicaciones renales y el riesgo de diabetes mellitus. En todos los casos de IRCT deberá iniciarse tratamiento cuando la fibrosis sea igual o mayor de F2 (fibrosis periportal y fibrosis en puentes) y en pacientes cirróticos si la enfermedad está compensada. En este grupo de pacientes, si se consigue una respuesta viral sostenida y no hay evidencia de hipertensión portal (Estadio 1) se recomienda trasplante renal aislado. Debe hacerse seguimiento después del trasplante para hepatocarcinoma con ecografías frecuentes cada 3 a 6 meses (19, 26, 27). En pacientes con cirrosis descompensada está indicado doble trasplante hígado-riñón. Para pacientes con IRC en estadios 1-4 deben adaptarse las recomendaciones de tratamiento aplicadas a la población general ya que no hay estudios disponibles que tengan como blanco esta población específica.
FARMACOCINETICA DE LOS MEDICAMENTOS
Interferón pegilado
La pegilación consiste en unir una molécula de polietilenglicol (PEG) a un compuesto biológico. Hay dos tipos de interferones pegilados; el alfa 2a que tiene unida una molécula ramificada de 40 kD, con un volumen de distribución de 6 a 14 litros por lo que no debe hacerse ajuste de dosis y es metabolizado por endopeptidasas. Se ha demostrado que las dosis de 135 mcg y 180 mcg semanales son similares en eficacia, pero ocurren más efectos secundarios con las dosis altas. El IFN-PEG alfa 2b tiene unida una cadena lineal de 12 kD, un volúmen de distribución de 40 litros y eliminación por vía renal por lo que debe hacerse ajuste de dosis en los pacientes, prefiriéndose 1 mcg por kg. Con los filtros que usan poros de tamaño mediano entre 27 y 33 A, ninguno de los interferones pegilados es removido durante la hemodiálisis, lo que no es el caso para los interferones convencionales que son completamente removidos y deben administrarse después de cada sesión (28).
Ribavirina
Es un análogo nucleósido cuyo mecanismo de acción antiviral no ha sido completamente dilucidado. Se utiliza combinado con el interferón para aumentar su eficacia al disminuir las recaídas después de alcanzar la respuesta. En pacientes con función renal normal la respuesta es dosis dependiente por lo que mayores dosis consiguen más
altas respuestas. El principal problema de la ribavirina es la anemia hemolítica que aumenta los riesgos de la anemia relacionada con la IRC. Esta molécula tiene aclaramiento predominantemente renal y no es removida en forma eficiente por la diálisis. La anemia inducida por la ribavirina es dependiente de las concentraciones plasmáticas y resulta de una disminución de la actividad de la bomba de Na-K, el aumento del cotransporte K-Cl, el depósito de IgG-C3 y la producción de trifosfato de ribavirina en el eritrocito. Los ensayos para medir niveles séricos (10-15umol/L) utilizan cromatografía de gases, no están ampliamente disponibles y la anemia puede ocurrir aun dentro de estos rangos terapéuticos. El uso de ribavirina no se recomienda con un aclaramiento de creatinina menor de 50 ml/min fuera de ensayos controlados (28, 29).
Boceprevir
Los nuevos antivirales de acción directa con efecto en la región NS3 (proteasa) de la región no estructural del genoma viral, han sido aprobados recientemente e ingresados al armamentario terapéutico. La farmacocinética del boceprevir ha sido evaluada en estudios realizados en pacientes con IRC e IRCT en hemodiálisis. Después de dosis únicas de 800 mg (día 1 y 4) la Cmax de boceprevir y el área bajo la curva fueron comparables en pacientes con IRC y sujetos sanos, lo que indica que la eliminación fue similar y que no es necesario hacer ajustes de dosis en esta población. Adicionalmente, el boceprevir no es removido por hemodiálisis, por tanto esta técnica no resultaría útil para retirar el exceso en caso de urgencia. La mayoría de la dosis fue recuperada en las heces soportando un aclaramiento predominante por vía hepática. Queda por definir la utilidad junto al IFN-PEG y dosis bajas de ribavirina, ya que su uso solo con interferones aumenta el riesgo de resistencia (30). Con telaprevir no es necesario ajustes en pacientes con insuficiencia renal y tiene farmacocinética similar al boceprevir.
Tratamiento de la hepatitis C en hemodiálisis y lista de espera de trasplante
El objetivo del tratamiento en pacientes con hepatitis C es la erradicación del virus expresada como una respuesta viral sostenida (RVS) o sea un RNA viral negativo entre 12 y 24 semanas después de finalizado. El tratamiento actual de los pacientes con hepatitis C, sin insuficiencia renal, se basa en la combinación de IFN-PEG, ribavirina y uno de los nuevos antiproteasas (telaprevir y boceprevir). En pacientes naive, no cirróticos, se alcanza una respuesta viral sostenida que va entre 63 y 75%, muy superior a 40% de la terapia dual previa (31-33).
El beneficio potencial de la terapia en pacientes con IRCT incluye enlentecer la enfermedad hepática y reducir el riesgo de complicaciones después del trasplante. La dificultad en estos pacientes es que la ribavirina puede inducir una anemia hemolítica que aumenta claramente los riesgos de isquemia cardíaca en pacientes con una enfermedad cardiovascular de base. Además, el uso de EPO tiene complicaciones en dosis altas relacionadas con trombosis venosa profunda. El trabajo conjunto entre nefrólogos y hepatólogos es de capital importancia para un estricto monitoreo de los pacientes ya que no hay un régimen óptimo de tratamiento (19, 27).
Monoterapia con interferones
La respuesta a la monoterapia con interferón es mayor en pacientes con IRCT en hemodiálisis que en pacientes con función renal normal. Esto podría estar relacionado con la menor carga viral (destrucción de partículas y adherencia en la membrana del filtro), producción de interferón endógeno, niveles altos de factor de crecimiento hepatocitario y un menor daño hepático al momento de iniciar el tratamiento. El papel del genotipo como predictor de la respuesta al interferón es menos claro y más debatible. La dosis recomendada es tres millones tres veces por semana por 12 meses para interferón convencional, 135 mcg semanal para IFN-PEG alfa 2a y 1 mcg/kg semanal para IFN-PEG alfa 2b (tabla 2) (24). Un estudio comparando dosis de 135 mcg semanales vs. 90 mcg semanales de IFN-PEG alfa 2a, encontró iguales tasas de RVS (39,5% vs 34,9%) (34). Se mantiene el criterio de respuesta viral temprana como una disminución de la carga viral mayor de 2 log a la semana 12 para continuar el tratamiento y virus indetectable a las 48 semanas como respuesta al final de tratamiento (31).
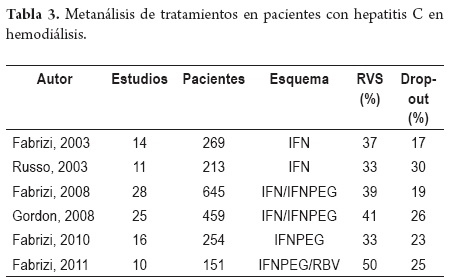
Dos metanálisis con interferones convencionales que incluyeron 17 estudios (269 pacientes) y 11 estudios (213 pacientes) respectivamente, administrados tres veces por semana durante 4 a 12 meses (dosis de 3 a 6 millones) mostraron una RVS entre 33% y 37%, significativamente más alta que la alcanzada con monoterapia en pacientes con función renal normal que es de 20%. Para el genotipo 1 la
RVS estuvo entre 26 y 30%. La tasa de drop-out se encontró entre 17 a 29% relacionada con síntomas flu-like (17%), neurológicos (21%), gastrointestinales (18%) (35, 36).
Dos metanálisis con pacientes tratados con interferones convencionales y pegilados que incluyeron 28 estudios (645 pacientes) y 25 estudios (459 pacientes) respectivamente, mostraron una tasa de RVS para interferón convencional entre 33%-39% y 41%. Para IFN-PEG (la mayoría con IFN-PEG alfa 2a) la RVS estuvo entre 31% y 37% respectivamente, lo que indica que no es superior a los interferones convencionales. La tasa de drop-out fue de 19% a 26% con los interferones convencionales y 27% a 28% con los interferones pegilados. Los efectos adversos más frecuentes que motivaron retirar el tratamiento fueron síntomas flu-like, síntomas gastrointestinales y cambios hematológicos. La respuesta del genotipo 1 fue informada en el primer metanálisis y fue de 33% (37, 38).
Recientemente, un metanálisis de pacientes con monoterapia con IFN-PEG que incluyó 16 estudios (254 pacientes) mostró una RVS de 33% y un drop-out de 23% por efectos secundarios hematológicos (18%) y gastrointestinales (14%) (39).
Queda evidente en estos metanálisis que el tratamiento con los interferones pegilados no adiciona beneficio en términos de respuesta virológica en relación con la monoterapia con interferón convencional y sí aumenta discretamente los efectos adversos. Quizá el único beneficio sea la aplicación una vez por semana en pacientes que reciben EPO subcutánea dos a tres veces por semana.
Terapia combinada
En cuanto a la terapia combinada con ribavirina se han estudiado distintos esquemas con dosis diarias de 200 mg, interdiarias de 200-400 mg y medición de niveles séricos, todo ello dirigido a disminuir los efectos adversos relacionados con la anemia hemolítica. Un metanálisis que incluyó 10 estudios (151 pacientes) tratados con la combinación de interferón convencional o IFN-PEG más ribavirina mostró una RVS de 56% con un drop-out de 25%. Los efectos adversos más frecuentes que motivaron el retiro del tratamiento fueron anemia (26%) y falla cardíaca (9%). Sin embargo, los estudios incluidos fueron muy heterogéneos y con un número pequeño de pacientes que no permiten sacar conclusiones definitivas. Reportes de casos han informado mortalidad con la ribavirina lo que indica que los pacientes deben ser tratados dentro de estrictos protocolos (40). La tabla 3 resume los metanálisis de tratamientos.
Las guías KDIGO recomiendan usar dosis bajas de ribavirina diaria o interdiaria de 200 mg con estricto seguimiento de la hemoglobina y uso de dosis altas de EPO.
Un estudio reciente que incluyó 32 pacientes tratados con terapia combinada de IFN-PEG alfa 2a y ribavirina evaluó dos esquemas de tratamiento con EPO. El primero una estrategia adaptativa con dosis de ribavirina de 600 mg por semana (200 mg interdía), en la cual la EPO se iniciaba cuando la Hb bajaba de 10 g y una estrategia preventiva con dosis de ribavirina de 1.000 mg semana (200 mg día de lunes a viernes) y EPO dosis altas desde el comienzo. En el primer grupo con la estrategia adaptativa, se observó una mayor caída de la Hb y mayor requerimiento de trasfusiones a pesar de las menores dosis de ribavirina, sin diferencias en la respuesta viral sostenida que alcanzó 50% en ambos grupos (41).
La RVS alcanzada es duradera y estudios a 48 meses de seguimiento muestran que 86% de los pacientes en hemodiálisis permanecen con RNA negativo y 95% de los pacientes trasplantados se mantienen negativos. Los mejores predictores de respuesta son las dosis altas de interferón convencional, tratamiento a 12 meses, completar > 80% de la dosis, sexo femenino y baja carga viral (42, 43).
Tratamiento de pacientes con hepatitis C aguda en hemodiálisis
Los pacientes en programa de hemodiálisis tienen controles de aminotransferasas cada mes y de anti-VHC cada 3-6 meses. Entre 80 a 90% de los pacientes con hepatitis C aguda, definida por una elevación de aminotransferasas mayor de 15 veces y seroconversión hacia anti-VHC positivo (con RNA positivo) permanecen con el virus desarrollando una infección crónica. Se recomienda en estos casos una observación de 16 semanas y si mantiene la elevación de aminotransferasas con RNA positivo, debe iniciarse monoterapia con IFN-PEG durante 24 semanas. Se han descrito tasas de RVS entre 80 y 90% de allí la importancia de la detección de la infección en esta fase temprana (44).
Tratamiento de pacientes con trasplante renal
La infección por el virus de hepatitis C en receptores de trasplante renal se asocia con una disminución significativa en la sobrevida del paciente y del injerto. La terapia inmunosupresora tiene el riesgo de acelerar la progresión del daño hepático y se ha observado una elevación entre 1,8 y 30,3 veces la carga viral. Sin embargo, no es claro porque no siempre hay progresión histológica lo que pudiera estar relacionado con el tipo de inmunosupresión ya que se ha descrito una acción antiviral para la ciclosporina y el micofenolato mofetil. Aun cuando se ha postulado que la evolución de los pacientes trasplantados con hepatitis C es mejor que la de los que permanecen en hemodiálisis, algunos grupos evidencian menor carga viral en los pacientes que permanecen en diálisis con menor progresión hacia la cirrosis (10% hemodiálisis vs 25-40% en trasplantados) (26, 45, 46). Estudios prospectivos deberán aclarar la evolución real de estos pacientes. Todos los candidatos a trasplante renal deberán recibir tratamiento para erradicar el virus con el fin de reducir las complicaciones renales, la diabetes mellitus, el riesgo de sepsis y la mortalidad del paciente después del trasplante. El tratamiento antiviral después del trasplante tiene el riesgo de ocasionar un rechazo mediado por anticuerpos resistente a corticoides en un 50 a 70%, por lo que solo debe emplearse en casos de hepatitis colestásica fibrosante o una vasculitis que comprometa la vida del paciente. La monoterapia con ribavirina tiene un aceptable perfil de seguridad, disminuye a carga viral y puede ser considerada en receptores de trasplante renal con fibrosis severa en espera de nuevas estrategias antivirales (47, 48).
El trasplante combinado hígado-riñón debe considerarse en candidatos con cirrosis debido al riesgo de hepatocarcinoma. Las recomendaciones actuales son:
- Pacientes con IRCT y cirrosis con hipertensión portal evidente o GPVH > de 10 mmHg.
- Falla hepática e IRC con aclaramiento renal < de 30 mil/min.
- Síndrome hepatorrenal con creatinina < de 2 mg/dl y hemodiálisis > de 8 semanas.
- Falla hepática e IRC con una biopsia que muestre más de 30% de glomerulosclerosis y/o fibrosis.
Los pacientes con doble trasplante toleran mejor la terapia antiviral dual con IFN-PEG y ribavirina con menos riesgo de rechazo que los pacientes con trasplante renal aislado, lo que sugiere un efecto protector del injerto hepático (19, 26, 45).
REFERENCIAS
1. Restrepo JC, Toro AI. Hepatitis C. Medicina & Laboratorio 2011; 17(11-12).
2. Chevaliez S, Pawlotsky JM. Hepatitis C virus: virology, diagnosis and management of antiviral therapy. World J Gastroenterol 2007; 13: 2461-2466
3. Mendez-Sanchez N, Gutierrez-Grobe Y, Kobashi-Margain RA. Epidemiology of HCV infection in Latin America. Ann Hepatol 2010; 9: 27-29.
4. Soza A, Riquelme A, Arrese M. Routes of transmission of hepatitis C virus. Ann Hepatol 2010; 9: 33.
5. Shepard CW, Finelli L, Alter MJ. Global epidemiology of hepatitis C virus infection. Lancet Infect Dis 2005; 5: 558567.
6. Barrera J, Campistol JM. Gastroenterol Hepatol 2006; 29(Supl. 2): 158-62.
7. Paintsil E, He H, Peters C, Lindenbach BD, Heimer R. Survival of hepatitis C virus in syringes: implication for transmission among injection drug users. J Infect Dis 2010; 202: 984-990.
8. Hauri AM, ArmB GL, Hutin YJ. The global burden of disease attributable to contaminated injections given in health care settings. Int J STD AIDS 2004; 15: 7-16.
9. Chen SL, Morgan TR. The natural history of hepatitis C virus (HCV) infection. Int J Med Sci 2006; 3: 47-52.
10. Simmonds P, Bukh J, Combet C, Deleage G, Enomoto N, Feinstone S, et al. Consensus proposals for a unified system of nomenclature of hepatitis C virus genotypes. Hepatology 2005; 42: 962-973.
11. Modi AA, Liang TJ. Hepatitis C: a clinical review. Oral Dis 2008; 14: 10-14.
12. Thomas DL, Seeff LB. Natural history of hepatitis C. Clin Liver Dis 2005; 9: 383-398.
13. Latin American Association for the Study of the Liver Practice Guidelines. Diagnosis, management, and treatment of hepatitis C. Ann Hepatol 2010; 9: 8-26.
14. Fattovich G, Stroffolini T, Zagni I, Donato F. Hepatocellular carcinoma in cirrhosis incidence and risk factors. Gastroenterology 2004; 127: S35-50.
15. Restrepo JC. Hepatitis virales. In: Vélez H, Rojas W, Borrero J, Restrepo J, editorial Fundamentos de Medicina. Enfermedades infecciosas. Editorial Corporación para Investigaciones Biológicas CIB. Sexta edición; 2003. p. 169-174.
16. Gadano A, Galdame O, Marciano S. Diagnosis of patients with suspected chronic hepatitis C infection. Ann Hepatol 2010; 9: 34-38.
17. OâLeary JG, Davis GL. Hepatitis C. In: Feldman M, Friedman LS, Brandt LJ (Eds.). Feldman: Sleisenger and Fordtranâs Gastrointestinal and Liver Disease, 9th ed. Philadelphia: Saunders, an imprint of Elsevier; pp. 13131331, 2010.
18. Moradpour D, Cerny A, Heim MH, Blum HE. Hepatitis C: an update. Swiss Med Wkly 2001; 131: 291-298.
19. Carbone M, Cockwell P, Neuberger J. Hepatitis C and kidney transplantation. Inter J Nephrol 2011; 1: 1-17.
20. Aoufi Rabih S, García Agudo R. Management of HCV infection in chronic kidney disease. Rev Nefrol 2011; 3: 26-267.
21. Fabrizi F, Messa P, Basile C, Martin P. Hepatic disorders in chronic kidney disease. Nat Rev Nephrol 2010; 6: 395-403.
22. Okoh E, Bucci J, Simon J, Harrison S. HCV in patients with end-stage renal disease. Am J Gastroenterol 2008; 103: 2123-2134.
23. Martin P, Fabrizi F. Hepatitis C and kidney disease. J Hepatol 2008; 49: 613-624.
24. Pipili Ch, Ilonidis G, Cholongitas E. Hepatitis C virus and kidney: a B association with different clinical aspects. Liver Intern 2011; 1: 1-10.
25. Asrani S, Buchanan P, Pinski B, Rocca Rey L, Schntzler M, Kanwal F. Lack of association between hepatitis C infection and chronic kidney disease. Clin Gastroenterol Hepatol 2010; 8: 79-84.
26. Vallet-Pichard A, Fontaine H, Mallet V, Pol S. Viral hepatitis in solid organ transplantation other than liver. J Hepatol 2011; 55: 474-482.
27. Ortega R. Hepatitis C en unidades de diálisis. Rev Col de Gastroenterol 2010; 25:4-6
28. Ortega R. Hepatitis C en hemodiálisis. Rev Col de Gastroenterol 2005; 20: 32-42.
29. Carrion A, Fabrizi F, Martin P. Should ribavirin be used to treat hepatitis C in dialysis patients? Sem In Dialysis 2011; 24: 272-274.
30. Treitel M, Marbury T, Preston R, Triantafyllow I, Feely W, OâMara E, et al. Single-dose pharmacokinetics of boceprevir in subjects with impaired hepatic or renal function. Clin Pharmacokinet 2012; 51: 620-628.
31. Sarrazin C, Hezode C, Zeuzem S, Pawlosky JM. Antiviral strategies in hepatitis C virus infection. J Hepatol 2012; 1: S75-S88.
32. Wilby K, Partovi N, Ford J, Greanya E, Yoshida E. Review of Boceprevir and Telaprevir for the treatment of chronic hepatitis C. Can J Gastroenterol 2012; 28: 205-210.
33. Ramachandran P, Fraser A, Agarwal K, Austin AS, Brown A, Foster G, et al. UK consensus guidelines for the use of the protease inhibitors boceprevir and telaprevir in genotype 1 chronic hepatitis C infected patients. Aliment Pharmacol Ther 2012; 35: 647-662.
34.Peck M, Boletis J, Besisk F, Ferraz M, Alric L, Samuel D, et al. Low-dose Peginterferon alfa 2a is a safe and produce a sustained virological response in patients with chronic hepatitis C and end-stage renal disease. Clin Gastroenterol Hepatol 2011; 9: 242.248.
35. Fabrizi F, Dulai G, Dixit V, Bunnapradist S, Martin P. Metaanalysis: interferon for the treatment of chronic hepatitis
36. Russo M, Goldsweig C, Jacobson I, Brown R. Interferon monotherapy for dialysis patients with chronic hepatitis C. Am J Gastroenterol 2003; 98: 1610-1615.
37. Fabrizi F, Dixit V, Messa P, Martin P. Interferon monotherapy of chronic hepatitis C in dialysis patients: a meta-anaysis of clinical trials. J Viral Hepatitis 2008; 15: 79-88.
38.Gordon C, Uhlig K, Lau J, Schmid E, Levey A, Wong J. Interferon treatment in hemodialysis patients with chronic hepatitis C virus infection. Am J Kidney Dis 2008; 51: 263277.
39. Fabrizi F, Dixit V, Messa P, Martin P. Pegylated interferon monotherapy of chronic hepatitis C in dialysis patients: meta-analysis of clinical trials. J Med Virol 2010; 82: 768775.
40. Fabrizi F, Dixit V, Martin P, Messa P. Combined antiviral therapy of hepatitis C virus in dialysis patients: meta-analysis of clinical trials. J Viral Hepatitis 2011; 18: 263-269.
41. Deltenre P, Moreno C, Tran A, Provot F, Stanke F, Lazrek M, et al. Anti-viral therapy in haemodialyzed HCV patients: efficacy, tolerance and treatment strategy. Aliment Pharmacol Ther 2011; 34: 454-461.
42. Gordon C, Uhlig K, Schmid Ch, Levey A, Wong J. Longterm viral negativity after interferón for chronic hepatitis C virus infection in hemodialysis. Clin J Am Soc Nephrol 2011; 6: 1-9.
43. Gordon C, Uhlig K, Lau J, Schmid Ch, Levey A, Wong J. Interferon for hepatitis C virus in hemodialysis: an individual patient meta-analysis of factors associated with sustained virological response. Clin J Am Soc Nephrol 2009; 4: 1449-1458.
44. Liu Ch, Liang Ch, Liu Ch, Lin J, Chen S, Hung P, et al. Pegylated interferon alfa 2a monotherapy for hemodialysis patients with acute hepatitis C. Clin Infect Dis 2010; 51: 451-548.
45. Berenguer M. Treatment of chronic hepatitis C in hemodialysis patients. Hepatology 2008; 48: 1690-1699.
46. Huskey J, Wiseman A. Chronic viral hepatitis in kidney transplantation. Nat Rev Nephrol 2011; 7: 156-165.
47. Ashry O, Gheith A. Dilemma of HCV infection in renal transplantation recipients. Inter J Nephrol 2011; 10: 1-6.
48. Kim E, Ko H, Yoshida E. Treatment issues surrounding hepatitis C in renal transplantation: A review. Ann Hepatol 2011; 10: 4-14.