Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.2 Bogotá Apr./June 2013
Estudio aleatorizado comparando una primera línea de terapia estándar contra Helicobacter pylori con claritromicina versus levofloxacina por 10 días
Rodrigo Castaño Llano MD.(1), Mario H. Ruiz Vélez MD. (2), Germán Campuzano-Maya MD.(3), Eugenio Sanín Fonnegra MD. (4), Juan D. Puerta Díaz MD. (5), Víctor Calvo-Betancur (6), Luis Miguel Ruiz Velásquez (7), Alejandra Álvarez Diazgranados (7)
(1) Grupo de Gastrohepatología Universidad de Antioquia, Hospital Pablo Tobón Uribe. Medellín, Colombia.
(2) Cirugía General y Endoscopia, Hospital Pablo Tobón Uribe. Medellín, Colombia.
(3) Hematología y Patología Clínica, Director Médico, Laboratorio Clínico Hematológico, Profesor Universidad de Antioquia. Medellín, Colombia.
(4) Gastroenterólogo. Medellín, Colombia.
(5) Cirujano General. Coloproctólogo. Profesor de Cirugía General. Universidad Pontificia Bolivariana. Clínica las Américas. Medellín, Colombia.
(6) Estadístico, Instituto de Alta Tecnología Médica de Antioquia-IATM. Medellín, Colombia.
(7) Estudiante, Universidad Pontificia Bolivariana. Medellín, Colombia.
Fecha recibido: 22-01-13 Fecha aceptado: 16-04-13
Resumen
Antecedentes: Hay una creciente evidencia de que la terapia triple estándar contra la infección por H. pylori viene perdiendo efectividad clínica. Una terapia triple con levofloxacina, amoxicilina y un inhibidor de la bomba de protones es efectiva y bien tolerada, e incluso este régimen se ha sugerido como una alternativa para la terapia de primera línea. El propósito de este estudio aleatorizado, multicéntrico y controlado es comparar el éxito en la erradicación de dos líneas de terapia triples como son la claritromicina, amoxicilina y omeprazol (CAO) versus levofloxacina, amoxicilina y omeprazol (LAO).
Materiales y métodos: Un total de 317 pacientes con diagnóstico por biopsia de infección por H. pylori fueron aleatorizados a dos regímenes de terapia por 10 días: terapia estándar CAO (n= 160) o LAO (n= 157). La erradicación fue evaluada por la prueba de aliento optimizada. Los efectos adversos y la tolerancia también fueron evaluados.
Resultados: El análisis por intención de tratar fue: CAO, 68,8% (110/160) y LAO, 84,1% (132/157) p= 0,0021. Por protocolo las tasas de erradicación fueron: CAO, 71,9% (105/146) y LAO, 89,3% (125/140) P=0,0004. Hubo diferencias estadísticas en la efectividad entre los dos grupos de tratamiento. Además, no hubo diferencias en la tolerancia y los efectos adversos entre los dos grupos. Conclusiones: El tratamiento con una terapia estándar con base en levofloxacina para la infección por H. pylori es una mejor alternativa para la erradicación del H. pylori sobre la triple terapia basada en claritromicina en el presente estudio.
Palabras clave
Helicobacter pylori, terapia, claritromicina, levofloxacina.
INTRODUCCION
La infección por Helicobacter pylori (H. pylori) es la principal causa de gastritis crónica, úlcera péptica, adenocarcinoma gástrico y linfoma asociado a las mucosas, de allí que la erradicación efectiva del germen es un imperativo (1, 2).
Las guías actuales para la erradicación de H. pylori para Europa o Norte América recomiendan regímenes terapéuticos que logren una tasa de erradicación por intención de tratar de 80% o más, con la combinación de un bloqueador de bomba más dos antibióticos (claritromicina más amoxicilina) como el régimen preferido (3, 4).
La claritromicina fue reconocida como el antibiótico con el mayor poder bacteriostático contra H. pylori, comparada contra las otras moléculas disponibles (5). Desafortunadamente, la resistencia primaria a la claritromicina se está incrementando en todo el mundo y está contemplada como el principal factor de una reducida eficacia en la erradicación de H. pylori (6, 7). Aun con lo regímenes de terapia más efectivos que incluyen un bloqueador de bomba de protones (BBP) y dos antibióticos, hasta en un 20-30% la terapia falla y la infección por H. pylori persiste (8). La erradicación de H. pylori evita la recurrencia de la úlcera duodenal y disminuye el riesgo de cáncer gástrico (9). Recientemente, en nuestra región hemos demostrado que la terapia con claritromicina por 7 ó 10 días no logra los niveles óptimos de erradicación de la bacteria. Después de casi 30 años de implementar terapias para H. pylori, el régimen ideal de tratamiento aún no está definido (7).
Actualmente, las terapias basadas en la claritromicina parece que ofrecen una insuficiente tasa de erradicación en algunas regiones, por lo que se han evaluado otras alternativas de terapia. La levofloxacina presenta una destacada actividad in vitro contra H. pylori y surge como una alternativa esperanzadora. La levofloxacina se ha evaluado más como una segunda línea de terapia, cuando falla una o más terapias contra H. pylori, con tasas de erradicación de 75-86%, estudios con escasos pacientes han evaluado la combinación de BBP con amoxicilina y levofloxacina como primera línea de terapia (10-12). Algunos estudios han mostrado excelentes resultados con tasas de erradicación entre 85 y 92% (12-17). Además, la levofloxacina ofrece un excelente perfil de seguridad, sin embargo, se ha descrito recientemente un incremento en la resistencia de H. pylori a esta quinolona lo que podría poner en riesgo su uso en el futuro (18-20).
El objetivo principal de este estudio es evaluar y comparar la real efectividad clínica de una terapia triple estándar con claritromicina, amoxicilina y omeprazol versus un régimen alternativo que sustituye la claritromicina por la levofloxacina como primera línea de terapia. Como objetivos secundarios se evaluará la efectividad en la erradicación según el diagnóstico endoscópico o la carga de H. pylori según la histología y el control clínico a un año en pacientes con dispepsia ulcerosa y no ulcerosa.
METODOS
El presente es un ensayo clínico aleatorizado, abierto, realizado en población urbana de la consulta externa de los diferentes autores entre enero de 2008 y julio de 2011. Las características del estudio fueron presentadas en una publicación previa reciente (7).
Población de estudio
Se incluyeron pacientes mayores de 18 años y menores o igual a 70 años, con diagnóstico histológico de infección por H. pylori, en muestras obtenidas por endoscopia y teñidas con hematoxilina-eosina. Se excluyeron pacientes con antecedente de gastrectomía, complicaciones por úlcera péptica como estenosis o sangrado, mujeres embarazadas o lactando, hallazgos endoscópicos de linfoma MALT, cáncer gástrico, o que hayan recibido cualquier tratamiento para H. pylori.
Para prevenir interferencias con el tratamiento de H. pylori, se excluyeron pacientes con antecedente en el último mes de consumo de antibióticos o compuestos con bismuto, bloqueadores de los receptores H2 de la histamina, probióticos o BBP. Además, se excluyeron pacientes con trastorno psiquiátrico mayor, alergia a la penicilina o historia de enfermedad maligna concurrente, falla hepática o renal.
Diseño del estudio
El estudio se realizó en pacientes con biopsias positivas para H. pylori de diferentes instituciones hospitalarias de la ciudad de Medellín y de la práctica privada de varios de los autores. Se evaluaron dos terapias estándar para erradicar H. pylori, ambas por 10 días, una con claritromicina, amoxicilina y omeprazol (CAO) y otra con levofloxacina (Truxa ®), amoxicilina y omeprazol (LAO). Para la selección de la muestra se utilizó una diferencia de proporciones poblacionales donde se asumió un error tipo I de 0,05 y tipo II de 0,2, una proporción de efectividad en la erradicación en el grupo de levofloxacina de 0,9, una proporción de efectividad en la erradicación del grupo con claritromicina de 0,78 para una diferencia absoluta entre proporciones de 0,12 y una tasa de asignación entre los grupos de 1. Con los parámetros descritos el tamaño de muestra calculado por el programa "Tamaño de muestra" versión 1.1 fue de 140 pacientes por cada grupo de estudio.
Se evaluaron las características demográficas de los pacientes y los resultados endoscópicos, en los cuales se consideraron los siguientes hallazgos: gastritis sin componente erosivo, gastritis asociada a componente erosivo, úlcera gástrica o úlcera duodenal. La densidad de la infección por H. pylori en el examen histológico de no menos de 2 biopsias del antro fue categorizada en dos grupos: escasa (1 ó 2 cruces) o abundante (3 ó 4 cruces). Solo se utilizó la coloración de hematoxilina-eosina.
Se realizó un control por consulta de 1 a 3 semanas después de terminar el tratamiento donde se evaluó si hubo efectos adversos relacionados con el tratamiento, la tolerancia a la terapia y se registró si el tratamiento se hizo completo, definiéndolo como el consumo de más de 70% de la prescripción (7 ó más de los 10 días ordenados).
Grupos de estudio
Los pacientes recibieron triple terapia y fueron asignados aleatoriamente a dos grupos; claritromicina 500 mg, amoxicilina 1 gr, omeprazol 20 mg por 30 días, todos VO cada 12 horas (Grupo 1-CAO) o terapia con levofloxacina-Truxa ® 500 mg, amoxicilina 1 gr, omeprazol 20 mg por 30 días, todos VO cada 12 horas (Grupo 2-LAO). Para el momento del inicio del estudio la única levofloxacina del mercado era la Truxa ® y la terapia con este antibiótico se mantuvo durante todo la investigación. Se generó una secuencia de aleatorización mediante el paquete estadístico EPIDAT ® 3.1. Se obtuvo la secuencia y se asignó el tratamiento a los pacientes. A los pacientes se les conminó para que no fumaran durante la administración de la terapia.
Evaluación de la erradicación
A los pacientes se les practicó en el Laboratorio Clínico Hematológico S.A. de la ciudad de Medellín, Colombia, una prueba de aliento optimizada entre 4 y 6 semanas después de haber terminado la terapia. La prueba de aliento optimizada con urea marcada con carbono (13C-urea) tiene una sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo de 100% (21).
Se evaluó como desenlace primario la erradicación de la infección por H. pylori medida con la prueba de aliento con 13C-urea, informada por el laboratorio como negativa. Como desenlaces secundarios se evaluó la adherencia al tratamiento y se definió como cumplido, el consumo mayor o igual de 70% del esquema de tratamiento el cual fue evaluado en cita revisión por consulta posterior a la terminación de la terapia antibiótica y fueron tomados en cuenta en el análisis por protocolo y por intención a tratar.
Las pruebas de aliento se hicieron por un investigador que desconocía (ciego) la terapia implementada en el paciente.
Evaluación del tratamiento al año
Se evaluó al momento de la prescripción de la terapia y al año después del tratamiento de la erradicación para H. pylori la condición clínica de los pacientes, con base en los criterios de Roma III para los trastornos gastrointestinales funcionales del adulto. Se registró la condición clínica al año de la terapia y se determinó si esta condición clínica estaba mejor, igual o peor. En el análisis al año se hizo especial énfasis en el diagnóstico inicial endoscópico del paciente, y la relación de la erradicación de H. pylori con la condición clínica al año de la evaluación.
Análisis estadístico
Para el análisis descriptivo se utilizaron distribuciones absolutas, relativas y medidas de resumen (media aritmética y desviaciones estándar). Las características demográficas de ambos grupos fueron comparadas por intervalo de confianza para la diferencia de proporciones de muestras independientes. La tasa de erradicación de H. pylori fueron analizadas por la intención de tratar (AIT) o por protocolo (APP). Todos los pacientes del estudio fueron evaluados por el AIT. En el APP se consideraron solo los pacientes con el tratamiento completo. Las diferencias en las tasas de erradicación de H. pylori y los intervalos de confianza 95% se calcularon para AIT y APP. Se espera que la erradicación de H. pylori en la terapia con CAO (grupo 1) sea inferior a la terapia con LAO (grupo 2). Se consideró un margen de no inferioridad de 12% con base en estudios controlados previos (12-17, 20). También se comparó la incidencia de efectos adversos entres los dos grupos usando la diferencia de proporciones para muestras independientes, bajo el supuesto de que el estadístico de esta diferencia sigue una distribución normal. La respuesta clínica al año de seguimiento se evaluó comparando los dos grupos de tratamiento usando el test de chi-cuadrado. Valores de p < 0,05 se considera estadísticamente significativo.
Aspectos éticos
Esta investigación se clasificó de acuerdo con la declaración internacional de Helsinki, el informe de Belmont y la resolución colombiana 8430 de 1993 como una investigación sin riesgos biológicos, fisiológicos, psicológicos y sociales. Además, se tuvo en cuenta la resolución 1995 de 1999 por la cual se establecen normas para el manejo de la historia clínica.
RESULTADOS
Pacientes
Entre enero de 2008 y julio de 2011 un total de 317 pacientes fueron tratados para la erradicación de H. pylori. Los pacientes tenían el diagnóstico de infección por H. pylori por biopsia endoscópica tomada en el último mes antes del inicio de la terapia. De los 317 pacientes del estudio un total de 160 pacientes fueron aleatorizados al grupo con tratamiento CAO (grupo 1) y 157 pacientes a la terapia con LAO (grupo 2). Los hallazgos endoscópicos de gastritis, gastritis erosiva y úlcera duodenal o gástrica fueron similares para los dos grupos de tratamiento. No se encontraron diferencias sociodemográficas significativas entre los dos grupos (tabla 1).
Tasas de erradicación
La tasa de erradicación de los pacientes tratados con CAO fue menor a los tratados con LAO en ambos análisis, AIT y APP, sin embargo, solo la terapia con LAO logró unas cifras óptimas de erradicación de la bacteria (tabla 2).
Al discriminar si las tasas de erradicación se relacionaban con el grado de infección por H. pylori de acuerdo con lo reportado en la biopsia, se encontró que eran similares para ambas terapias, independiente de la carga bacteriana (tabla 3).
Tampoco se demostró una diferencia significativa en el grado de infección por H. pylori y el tipo de hallazgo endoscópico, sea DNU o DU (tabla 4).
Reacciones adversas
De los 160 pacientes tratados con el esquema CAO, en 14 se suspendió el tratamiento por intolerancia, mientras que de los 157 tratados con LAO, en 14 el tratamiento no se completó. Para el APP se incluyeron 146 pacientes del grupo CAO y 143 del grupo LAO. Los efectos adversos se observaron en 33,1% de los pacientes tratados con CAO días y en 41,4% de los tratados con LAO días, sin observarse una diferencia estadísticamente significativa (p= 0,392).
Los síntomas más frecuentes para ambos grupos fueron el dolor epigástrico, náuseas y vómitos (con sabor metálico en boca), mialgias, diarrea y la presencia de brote cutáneo, sin evidenciarse diferencias entre los dos grupos (tabla 5).
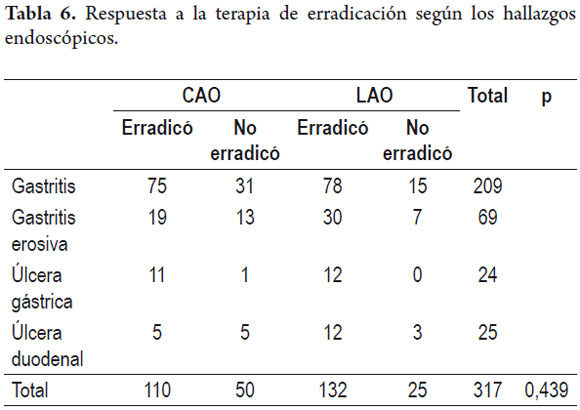
Respuesta a la terapia de erradicación según el diagnóstico inicial
Se presentó una tasa similar de erradicación para las diferentes terapias y los diferentes hallazgos endoscópicos (tabla 6).
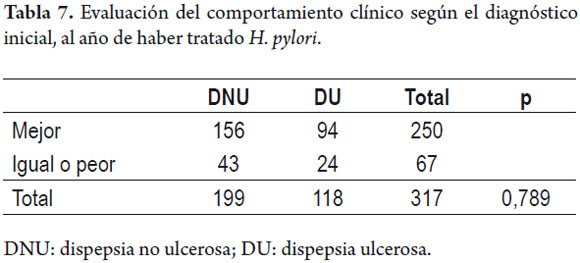
Seguimiento al año
Un año después de haber recibido la terapia, los pacientes fueron contactados personalmente o telefónicamente y se evaluaron sus manifestaciones gastrointestinales, cuando las había, de acuerdo con los criterios de Roma III. Se registró si los síntomas un año después del tratamiento habían mejorado, o bien empeoraron o estaban iguales, haciendo énfasis en el diagnóstico inicial si se trataba de una dispepsia funcional o había una enfermedad ácido-péptica con componente estructural (erosiones o úlcera) a la endoscopia. No se encontró una diferencia significativa entre los diferentes tratamientos y las manifestaciones clínicas al año de seguimiento.
Sin embargo, al evaluar la respuesta clínica según el diagnóstico inicial, se encontró que de cien pacientes con dispepsia no ulcerosa mejoraron 78,4% mientras que en los 118 pacientes con dispepsia ulcerosa (ulcera duodenal, gástrica o gastritis erosiva) 79,6% mejoraron los síntomas (tabla 7).
DISCUSIÓN
El presente estudio, aleatorizado, controlado y multicéntrico que incluye un total de 317 pacientes demuestra que, en un país donde se ha confirmado una alta prevalencia de resistencia a la claritromicina (mayor al 15%), la tasa de erradicación con la terapia triple con levofloxacina es superior que la terapia triple estándar con claritromicina, con resultados estadísticos significativos.
Al momento de planear la terapia de esta infección, el profesional médico debe idealmente estar seguro de la prevalencia de la resistencia antimicrobiana locorregional, así como la eficacia del tratamiento en su práctica diaria. Infortunadamente, no existen estudios de sensibilidad local (Medellín) de H. pylori; sin embargo, un estudio local nuestro sugiere que la terapia con claritromicina no es útil ni por 7 ó ni por 10 días (7). Esto es explicado por la creciente resistencia de H. pylori a la claritromicina, como lo sugieren estudios de sensibilidad en el país (22).
La levofloxacina se ha utilizado más frecuentemente como una terapia de segunda línea (23-25), y hasta tercera línea (26), cuando la terapia estándar con claritromicina y metronidazol han fallado (16, 27-29) con metanálisis que sustentan su uso (10). Incluso se han descrito terapias cortas por 5 días con éxito (30). Sin embargo, su papel como terapia de primera línea no ha sido evaluado en nuestro medio, aunque existen reportes en la literatura que sugieren su utilidad en este ámbito (20, 31, 32), aunque con limitaciones (33). La resistencia primaria a la levofloxacina se ha descrito en 3% en otras latitudes (34).
Recientemente, un estudio de Taiwán compara los dos regímenes (CAO y LAO) como primera línea de terapia y segunda línea y muestra superioridad con la levofloxacina solo como segunda línea de terapia (74% vs. 84%), aunque con limitaciones en la dosis (750 mg/d) y el tiempo de terapia (7 días) (35). Estas tasas de erradicación están por debajo de esquemas con levofloxacina en primera línea (> 90%) usadas en países como Italia y Holanda (14-17, 36). Este aumento en la resistencia de H. pylori a las quinolonas se ha demostrado en Bélgica (16,8%), en Italia (23,1%) y un incremento de 3% en 1999 a 15% en 2004 en Francia, así como en Alemania y España (18, 19, 37-41). El consenso de Maastricht-Florencia IV sobre el tratamiento de la infección por H. pylori del pasado octubre de 2011 recomienda el uso de la triple terapia estándar como primera línea de tratamiento en regiones en que la resistencia de H. pylori a la claritromicina no sea superior a 15% (42). Una reciente revisión del papel de las quinolonas en primera línea de terapia de H. pylori ha sido publicada (43). Los autores concluyen que no todas las quinolonas pueden ser recomendadas como primera línea de terapia en la erradicación de H. pylori, sin embargo, pueden ser consideradas como la primera línea de terapia en situaciones específicas, principalmente dependiendo de la resistencia primaria local a quinolonas y macrólidos. Y sugieren la implementación de estudios aleatorizados para determinar el papel de estas quinolonas como primera línea de terapia.
En vista de la poca efectividad de la terapia estándar para erradicar H. pylori en nuestro medio, se evaluó la terapia con levofloxacina comparada con claritromicina, encontrando una tasa de erradicación para la terapia con LAO de 89,3% en el análisis por protocolo y de 84,1% en el análisis por intención de tratar, contra 71,9% y 68,8% para la claritromicina. La tasa de erradicación para la triple terapia estándar con levofloxacina está por encima de la recomendada "regla de 80%". Considerando que los reportes recientes en que se evalúa la triple terapia, hasta 60% de los estudios han fallado en alcanzar 80% de erradicación H. pylori en el AIT, la encontrada en este estudio es mejor de lo esperado (44).
No se encontraron diferencias entre las dos líneas de terapia en los efectos adversos, y el abandono del tratamiento fue similar (14 pacientes) para ambos grupos, siendo las náuseas y vómitos con la epigastralgia los eventos adversos más frecuentes para ambos grupos de terapia. Una reciente revisión sistemática, la incidencia de efectos adversos y de efectos adversos severos fue de 18% y 3% lo que concuerda con nuestros resultados (10). Finalmente, un reciente metanálisis mostró una menor incidencia de efectos adversos con la terapia basada en levofloxacina que con las combinaciones cuádruples (45).
Los esfuerzos deben estar dirigidos a encontrar terapias que garanticen unas tasas de erradicación superiores a 90% en la primera línea de tratamiento. Según las recomendaciones de expertos, los regímenes cuádruples (principalmente las terapias secuenciales y concomitantes) parecen ser valiosas alternativas como primera línea de terapia, por sus altas tasas de erradicación y su capacidad de superar la creciente resistencia de H. pylori a la claritromicina (43, 44).
Nuestros resultados con la combinación de levofloxacina, amoxicilina y BBP por 10 días, con una tasa de erradicación por intención de tratar de 84,1% y de 89,3% por protocolo en terapia de primera línea para erradicar H. pylori son alentadores. Otros autores han informado favorables experiencias con la levofloxacina, pero estos estudios la han evaluado como terapia de segunda línea, después de una o más terapias fallidas (46). Sin embargo, otros estudios que han evaluado el régimen LAO como primera línea de terapia presentan un número bajo de pacientes (menos de 50 pacientes), pero con altas tasas de erradicación de 87% (16), 90% (13, 14), y 92% (15). Se ha recomendado la terapia de primera línea con el esquema LAO para erradicar H. pylori en áreas donde la resistencia primaria a la levofloxacina sea menor a 10% (15); esta resistencia no se ha medido en nuestro medio para la levofloxacina, mientras que para la claritromicina esta resistencia es superior a 50% (22).
Estudios muestran que los regímenes con base en claritromicina adquieren una mayor tasa de erradicación en pacientes con úlcera péptica comparada con la erradicación por dispepsia funcional (47, 48); sin embargo, la tasa de curación para ambas entidades fue similar en nuestro estudio.
En resumen, la triple terapia con LAO por 10 días representa una mejor alternativa que la terapia estándar de primera línea con base en claritromicina, al cumplir con las metas propuestas para erradicar H. pylori, como son: efectividad (> 80% de tasa de erradicación) simplicidad (dos veces al día, con excelente adherencia) y seguridad (pocos y leves efectos adversos).
REFERENCIAS
1. Gasparetto M, Pescarin M, Guariso G. Helicobacter pylori Eradication Therapy: Current Availabilities. ISRN gastroenterology 2012; 2012: 186734. [ Links ]
2. Varbanova M, Schulz C, Malfertheiner P. Helicobacter pylori and other gastric bacteria. Dig Dis 2011; 29: 562-9. [ Links ]
3. Malfertheiner P, Megraud F, O'Morain C, et al. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report. Gut 2007; 56: 772-81. [ Links ]
4. Chey WD, Wong BC. American College of Gastroenterology guideline on the management of Helicobacter pylori infection. The American journal of gastroenterology 2007; 102: 1808-25. [ Links ]
5. Megraud F. H. pylori antibiotic resistance: prevalence, importance, and advances in testing. Gut 2004; 53: 1374-84. [ Links ]
6. Vakil N, Megraud F. Eradication therapy for Helicobacter pylori. Gastroenterology 2007; 133: 985-1001. [ Links ]
7. Castaño R, Ruiz MH, Martínez C, et al. Evaluación para comparar dos esquemas de terapia estándar (7 frente a 10 días) contra el H. pylori, con seguimiento clínico a un año. Rev Col Gastroenterol 2012; 27: 80-7. [ Links ]
8. Gisbert JP, Pajares JM. Review article: Helicobacter pylori "rescue" regimen when proton pump inhibitor-based triple therapies fail. Alimentary pharmacology & therapeutics 2002; 16: 1047-57. [ Links ]
9. McColl KE. Clinical practice. Helicobacter pylori infection. The New England journal of medicine 2010; 362: 1597-604. [ Links ]
10. Gisbert JP, Morena F. Systematic review and meta-analysis: levofloxacin-based rescue regimens after Helicobacter pylori treatment failure. Alimentary pharmacology & therapeutics 2006; 23: 35-44. [ Links ]
11. Gisbert JP, Perez-Aisa A, Castro-Fernandez M, et al. Helicobacter pylori first-line treatment and rescue option containing levofloxacin in patients allergic to penicillin. Digestive and liver disease: official journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver 2010; 42: 287-90. [ Links ]
12. Gisbert JP, Bermejo MF, Infante JM, et al. Levofloxacin, Amoxicillin, and Omeprazole as first-line triple therapy for Helicobacter pylori eradication. Journal of clinical gastroenterology 2009; 43: 384-5. [ Links ]
13. Cammarota G, Cianci R, Cannizzaro O, et al. Efficacy of two one-week rabeprazole/levofloxacin-based triple therapies for Helicobacter pylori infection. Alimentary pharmacology & therapeutics 2000; 14: 1339-43. [ Links ]
14. Di Caro S, Zocco MA, Cremonini F, et al. Levofloxacin based regimens for the eradication of Helicobacter pylori. European journal of gastroenterology & hepatology 2002; 14: 1309-12. [ Links ]
15. Marzio L, Coraggio D, Capodicasa S, Grossi L, Cappello G. Role of the preliminary susceptibility testing for initial and after failed therapy of Helicobacter pylori infection with levofloxacin, amoxicillin, and esomeprazole. Helicobacter 2006; 11: 237-42. [ Links ]
16. Antos D, Schneider-Brachert W, Bastlein E, et al. 7-day triple therapy of Helicobacter pylori infection with levofloxacin, amoxicillin, and high-dose esomeprazole in patients with known antimicrobial sensitivity. Helicobacter 2006; 11: 39-45. [ Links ]
17. Rispo A, Di Girolamo E, Cozzolino A, Bozzi R, Morante A, Pasquale L. Levofloxacin in first-line treatment of Helicobacter pylori infection. Helicobacter 2007; 12: 364-5. [ Links ]
18. O'Connor A, Gisbert J, O'Morain C. Treatment of Helicobacter pylori infection. Helicobacter 2009; 14 Suppl. 1: 46-51. [ Links ]
19. Cuadrado-Lavin A, Salcines-Caviedes JR, Carrascosa MF, et al. Antimicrobial susceptibility of Helicobacter pylori to six antibiotics currently used in Spain. The Journal of antimicrobial chemotherapy 2012; 67: 170-3. [ Links ]
20. Cuadrado-Lavin A, Salcines-Caviedes JR, Carrascosa MF, et al. Levofloxacin versus clarithromycin in a 10 day triple therapy regimen for first-line Helicobacter pylori eradication: a single-blind randomized clinical trial. The Journal of antimicrobial chemotherapy 2012; 67: 2254-9. [ Links ]
21. Campuzano-Maya G. An optimized 13C-urea breath test for the diagnosis of H. pylori infection. World J Gastroenterol 2007; 13: 5454-64. [ Links ]
22. Yepes CA, Rodríguez A, Ruiz A, Ariza B. Resistencia antibiótica del Helicobacter pylori en el Hospital Universitario San Ignacio de Bogotá. Acta Med Col 2008; 33. [ Links ]
23. Yahav J, Shmuely H, Niv Y, Bechor J, Samra Z. In vitro activity of levofloxacin against Helicobacter pylori isolates from patients after treatment failure. Diagnostic microbiology and infectious disease 2006; 55: 81-3. [ Links ]
24. Gisbert JP, Perez-Aisa A, Bermejo F, et al. Second-line Therapy with Levofloxacin after failure of treatment to eradicate Helicobacter pylori infection: Time Trends in a Spanish Multicenter Study of 1000 Patients. Journal of clinical gastroenterology 2012. [ Links ]
25. Gatta L, Zullo A, Perna F, et al. A 10-day levofloxacin-based triple therapy in patients who have failed two eradication courses. Alimentary pharmacology & therapeutics 2005; 22: 45-9. [ Links ]
26. Tursi A, Picchio M, Elisei W. Efficacy and tolerability of a third-line, levofloxacin-based, 10-day sequential therapy in curing resistant Helicobacter pylori infection. Journal of gastrointestinal and liver diseases. JGLD 2012; 21: 133-8. [ Links ]
27. Watanabe Y, Aoyama N, Shirasaka D, et al. Levofloxacin based triple therapy as a second-line treatment after failure of helicobacter pylori eradication with standard triple therapy. Digestive and liver disease: official journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver 2003; 35: 711-5. [ Links ]
28. Bilardi C, Dulbecco P, Zentilin P, et al. A 10-day levofloxacin-based therapy in patients with resistant Helicobacter pylori infection: a controlled trial. Clinical gastroenterology and hepatology: the official clinical practice journal of the American Gastroenterological Association 2004; 2: 997-1002. [ Links ]
29. Matsumoto Y, Miki I, Aoyama N, et al. Levofloxacin- versus metronidazole-based rescue therapy for H. pylori infection in Japan. Digestive and liver disease: official journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver 2005; 37: 821-5. [ Links ]
30. Federico A, Nardone G, Gravina AG, et al. Efficacy of 5-day levofloxacin-containing concomitant therapy in eradication of Helicobacter pylori infection. Gastroenterology 2012; 143: 55-61 e1; quize e13-4. [ Links ]
31. Polat Z, Kadayifci A, Kantarcioglu M, Ozcan A, Emer O, Uygun A. Comparison of levofloxacin-containing sequential and standard triple therapies for the eradication of Helicobacter pylori. European journal of internal medicine 2012; 23: 165-8. [ Links ]
32. Romano M, Cuomo A, Gravina AG, et al. Empirical levofloxacin-containing versus clarithromycin-containing sequential therapy for Helicobacter pylori eradication: a randomised trial. Gut 2010; 59: 1465-70. [ Links ]
33. Molina-Infante J, Perez-Gallardo B, Fernandez-Bermejo M, et al. Clinical trial: clarithromycin vs. levofloxacin in first-line triple and sequential regimens for Helicobacter pylori eradication. Alimentary pharmacology & therapeutics 2010; 31: 1077-84. [ Links ]
34. Romano M, Iovene MR, Russo MI, et al. Failure of first-line eradication treatment significantly increases prevalence of antimicrobial-resistant Helicobacter pylori clinical isolates. Journal of clinical pathology 2008; 61: 1112-5. [ Links ]
35. Liou JM, Lin JT, Chang CY, et al. Levofloxacin-based and clarithromycin-based triple therapies as first-line and second-line treatments for Helicobacter pylori infection: a randomised comparative trial with crossover design. Gut 2010; 59: 572-8. [ Links ]
36. Schrauwen RW, Janssen MJ, de Boer WA. Seven-day PPI-triple therapy with levofloxacin is very effective for Helicobacter pylori eradication. The Netherlands journal of medicine 2009; 67: 96-101. [ Links ]
37. Bogaerts P, Berhin C, Nizet H, Glupczynski Y. Prevalence and mechanisms of resistance to fluoroquinolones in Helicobacter pylori strains from patients living in Belgium. Helicobacter 2006; 11: 441-5. [ Links ]
38. Perna F, Zullo A, Ricci C, Hassan C, Morini S, Vaira D. Levofloxacin-based triple therapy for Helicobacter pylori re-treatment: role of bacterial resistance. Digestive and liver disease : official journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver 2007; 39: 1001-5. [ Links ]
39. Miyachi H, Miki I, Aoyama N, et al. Primary levofloxacin resistance and gyrA/B mutations among Helicobacter pylori in Japan. Helicobacter 2006; 11: 243-9. [ Links ]
40. Cattoir V, Nectoux J, Lascols C, et al. Update on fluoroquinolone resistance in Helicobacter pylori: new mutations leading to resistance and first description of a gyrA polymorphism associated with hypersusceptibility. International journal of antimicrobial agents 2007; 29: 389-96. [ Links ]
41. Glocker E, Stueger HP, Kist M. Quinolone resistance in Helicobacter pylori isolates in Germany. Antimicrobial agents and chemotherapy 2007; 51: 346-9. [ Links ]
42. Malfertheiner P, Megraud F, O'Morain CA, et al. Management of Helicobacter pylori infection--the Maastricht IV/ Florence Consensus Report. Gut 2012; 61: 646-64. [ Links ]
43. Berning M, Krasz S, Miehlke S. Should quinolones come first in Helicobacter pylori therapy? Therapeutic advances in gastroenterology 2011; 4: 103-14. [ Links ]
44. Graham DY, Fischbach L. Helicobacter pylori treatment in the era of increasing antibiotic resistance. Gut 2010; 59: 1143-53. [ Links ]
45. Saad RJ, Schoenfeld P, Kim HM, Chey WD. Levofloxacin-based triple therapy versus bismuth-based quadruple therapy for persistent Helicobacter pylori infection: a meta-analysis. The American journal of gastroenterology 2006; 101: 488-96. [ Links ]
46. Gisbert JP, Gisbert JL, Marcos S, Moreno-Otero R, Pajares JM. Third-line rescue therapy with levofloxacin is more effective than rifabutin rescue regimen after two Helicobacter pylori treatment failures. Alimentary pharmacology & therapeutics 2006; 24: 1469-74. [ Links ]
47. Calvet X, Ducons J, Bujanda L, Bory F, Montserrat A, Gisbert JP. Seven versus ten days of rabeprazole triple therapy for Helicobacter pylori eradication: a multicenter randomized trial. The American journal of gastroenterology 2005; 100: 1696-701. [ Links ]
48. Broutet N, Tchamgoue S, Pereira E, Lamouliatte H, Salamon R, Megraud F. Risk factors for failure of Helicobacter pylori therapy--results of an individual data analysis of 2751 patients. Alimentary pharmacology & therapeutics 2003; 17: 99-109. [ Links ]











 text in
text in