Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.2 Bogotá Apr./June 2013
Rendimiento diagnóstico y hallazgos de cápsula endoscópica en pacientes con sangrado digestivo de origen oscuro en el Hospital Pablo Tobón Uribe en Medellín - Colombia
Fabián Juliao Baños, MD (1), Edison Muñoz Ortiz, MD (2), Carlos Enrique Yepes Delgado. MD (3)
(1) Gastroenterólogo Clínico, Hospital Pablo Tobón Uribe. Profesor Universidad de Antioquia y Universidad Pontificia Bolivariana. Medellín, Colombia.
(2) Médico Internista Universidad de Antioquia. Medellín, Colombia.
(3) Epidemiólogo. Unidad de Investigación Hospital Pablo Tobón Uribe. Profesor Universidad de Antioquia. Medellín, Colombia.
Fecha recibido: 07-01-13 Fecha aceptado: 16-04-13
Resumen
Objetivos: La cápsula endoscópica (CE) ha revolucionado la evaluación diagnóstica de pacientes con sangrado gastrointestinal de origen oscuro (SGO). El objetivo de nuestro estudio fue evaluar el rendimiento diagnóstico de CE en pacientes con SGO en nuestro centro.
Métodos: Se realizó un estudio descriptivo y retrospectivo, revisando historias clínicas en 60 pacientes consecutivos llevados a CE con indicación de SGO, entre septiembre de 2009 y septiembre de 2011, en el Hospital Pablo Tobón Uribe. Los hallazgos en CE se interpretaron según el grado de relevancia clínica para el diagnóstico definitivo: normales (P0), poco (P1) y altamente relevante (P2).
Resultados: El rendimiento diagnóstico de CE en pacientes con SGO fue de 57%. No se encontró diferencia significativa en la presencia de lesiones relevantes (P2), entre pacientes con SGO evidente y oculto (63% vs. 52%, p: 0,49); 26% de lesiones significativas (P2) en CE, se encontraban al alcance de endoscopia alta (17%) o colonoscopia total (9%). En cuanto al tipo de lesión P2 encontrada, 47% fueron vasculares, 44% inflamatorias y 9% neoplásicas. Los pacientes con lesiones P2 eran de mayor edad, comparados con aquellos con lesiones P1 y P0 (p: 0,05).
Conclusión: El rendimiento diagnóstico de CE en SGO, en nuestra serie, es muy similar al reportado en publicaciones internacionales. El tipo de lesión significativa (P2) más frecuentemente encontrada fue la vascular.
Palabras clave
Cápsula endoscópica, sangrado gastrointestinal oscuro, rendimiento diagnóstico, angiectasias.
INTRODUCCIÓN
Con el advenimiento de nuevos métodos diagnósticos, la clasificación del sangrado digestivo según la localización ha cambiado. Hoy en día se considera sangrado digestivo superior a aquel que se origina desde la boca hasta la ampolla de Vater, medio cuando proviene desde la ampolla de Vater hasta la válvula ileocecal, e inferior cuando se localiza en el colon. Lo anterior se basa en que el sangrado digestivo superior es fácilmente detectado por una endoscopia alta, el sangrado digestivo medio requiere estudio con cápsula endoscópica (CE) o enteroscopia asistida por balón (EAB), y el inferior se encuentra al alcance de una colonoscopia (1). El sangrado gastrointestinal de origen oscuro (SGO) es definido como sangrado recurrente o persistente de origen desconocido después de una evaluación diagnóstica inicial negativa, que incluye la realización de endoscopia digestiva alta, colonoscopia hasta íleon terminal, y la realización de un estudio radiológico de intestino delgado (tránsito intestinal con o sin enteroclisis). El SGO se clasifica en sangrado visible o evidente, si hay evidencia de sangrado por boca o recto, los cuales se manifiestan como hematemesis, melenas o hematoquexia; o sangrado oculto, definido por la presencia de anemia por deficiencia de hierro o sangre oculta en materia fecal positiva persistente (2). La anemia por deficiencia de hierro ocurre en 2-5% de hombres adultos y mujeres postmenopáusicas, y es causa de 4-13% de remisiones al gastroenterólogo (22).
Al SGO le corresponde 5% de todos los sangrados gastrointestinales, de ellos 75% proviene de intestino delgado, lo cual representa un reto para el gastroenterólogo; 25% de lesiones restantes se encuentran en esófago, estómago, duodeno o colon, las cuales no son visualizadas durante la evaluación endoscópica inicial (3).
El estudio endoscópico del intestino delgado ha evolucionado en el siglo XXI, donde ha sido posible avanzar de la enteroscopia intraoperatoria invasiva, pasando por el enteroscopio sonda, enteroscopio "push", hasta el estudio con CE, la cual ha revolucionado el estudio de patologías de intestino delgado, ya que permite su visualización completa en un alto porcentaje de casos (85-90%), de manera no invasiva y es muy bien tolerada por el paciente. Dentro de sus limitaciones se incluye que no puede ser maniobrada y no es posible tomar biopsias, por lo que el diagnóstico es basado en la apariencia endoscópica, además no es un estudio terapéutico, la visualización depende de la preparación de la mucosa, la calidad de la lectura requiere entrenamiento previo y experiencia, y por último, tiene riesgo de retención en zonas de estenosis (1-1,5%) (4). Al tiempo con la aparición de la CE y teniendo en cuenta las limitaciones anteriores, se ha desarrollado la enteroscopia profunda con enteroscopios que avanzan asistidos por balón (EAB) o por un espiral, y permiten realizar intervención terapéutica, lo cual complementa la CE en el estudio de patologías de intestino delgado (5).
Una reciente revisión sistemática, de 227 artículos publicados entre los años 2000 a 2008, con 22.840 estudios de CE evaluados, encontró un rendimiento diagnóstico de 60,5%, en 66% la indicación fue SGO, hallando lesiones vasculares tipo angiectasias en 50%, úlceras en 26,8% y neoplasias en 8,8% (6). Un metanálisis analizando 20 estudios prospectivos, en 537 pacientes con SGO, demostró que la CE tiene mayor rendimiento diagnóstico que la enteroscopia push (56% vs. 26%, p < 0,00001), y que estudios radiológicos de intestino delgado (42% vs. 6%, p < 0,00001), el número necesario a diagnosticar (NND) para CE comparado con las otras pruebas fue de 3, siendo más útil para el diagnóstico de lesiones vasculares e inflamatorias (7). Un segundo metanálisis, con 17 estudios y 526 pacientes, mostró que en el subgrupo de pacientes con SGO, la CE presenta una tasa superior de detección diagnóstica comparado con enteroscopia push y estudios radiológicos, con un NND de 3 (8).
El propósito de este estudio fue establecer el rendimiento diagnóstico y tipo de hallazgos en CE, como también determinar el seguimiento, en una serie de pacientes en nuestra institución con indicación de SGO.
MATERIALES Y MÉTODOS
Diseño del estudio
Desde el año 2009 se cuenta con el servicio de CE en el Hospital Pablo Tobón Uribe de la ciudad de Medellín, con entrenamiento previo de personal médico y de enfermería para la realización de dicho procedimiento. Se realizó un estudio descriptivo y retrospectivo, revisando historias clínicas y estudios con CE de pacientes con diagnóstico de SGO, y en caso de necesitar datos adicionales, se les realizaba llamada telefónica. Todos los hallazgos de CE fueron revisados y clasificados según su relevancia clínica por uno de los autores de este estudio (FJ). A todos los pacientes se les había realizado endoscopia digestiva alta y colonoscopia total por lo menos 6 meses antes de realizar la CE. En los pacientes con antecedente de ingesta de antiinflamatorio no esteroideos (AINE's), se difería el estudio hasta pasados dos meses de la última dosis, según recomendaciones internacionales (9). Todos los sujetos sometidos a CE, se preparaban el día anterior con dieta líquida y se les administraba 2 litros de polietilenglicol. Lo anterior basado en un metanálisis reciente (10), el cual demostró un mayor rendimiento diagnóstico y mejor visualización de la mucosa de intestino delgado en pacientes con preparación previa con laxantes, comparados con aquellos sin preparación. El día del examen los pacientes se presentaban en ayunas mínimo de 8 horas, e ingerían inicialmente una tableta de 10 miligramos de domperidona como proquinético, 30 minutos antes de la ingesta de la CE. Los estudios se realizaron con la endocápsula, marca Olympus, que logra captar dos imágenes por segundo a través del tubo digestivo, las cuales son transmitidas por medio de radiofrecuencia a un capturador externo, la batería de la cápsula tiene una duración de 8-9 h, posterior a esto se desconecta la grabadora y se descargan las imágenes en el computador para su posterior lectura. La lectura del estudio se realiza a una velocidad de 10-15 imágenes por segundo. La medición del tiempo de tránsito intestinal se obtiene estableciendo el tiempo transcurrido desde la entrada al píloro hasta la llegada al ciego. Todos los estudios se monitorizaban en tiempo real una hora después de ingerida la cápsula, en caso de no avanzar al intestino delgado, se monitorizaba nuevamente a las 2 horas y si permanecía en estómago, se realizaba endoscopia alta, se capturaba la cápsula con canastilla de Dormia y se avanzaba a duodeno dirigida con el endoscopio. Después de confirmado el paso de CE a intestino delgado, el paciente se envía a casa si era ambulatorio, a las 2 horas se iniciaba dieta líquida y a las 4 horas ingería dieta normal y regresaba a las 8 horas a la institución.
Medición de desenlaces y definiciones
El SGO se definió como sangrado evidente (recurrente o persistente), u oculto (anemia ferropénica o SOMF positiva), de origen desconocido después de una evaluación diagnóstica inicial negativa. Esta evaluación incluye la realización de endoscopia digestiva alta, colonoscopia hasta íleon terminal, y la realización de un estudio radiológico de intestino delgado (tránsito intestinal con o sin enteroclisis). Según la Organización Mundial de la Salud, se define anemia como una concentración de hemoglobina < 13 g/dl en hombres > de 15 años y < 12 g/dl en mujeres > de 15 años, no gestantes, y ferropénica cuando los niveles de ferritina son < 15 mg/l, en ausencia de inflamación (22).
Los hallazgos en CE se interpretaron según el grado de relevancia para el diagnóstico definitivo del paciente: normales (P0), hallazgos clínicamente poco relevantes (P1) y altamente relevantes (P2), como se ha establecido en estudios previos. Se tuvieron en cuenta solo lesiones significativas (P2) como la presencia de angiectasias, masas, erosiones y úlceras, para determinar el rendimiento diagnóstico, otro tipo de lesiones como flebectasias, linfangiectasias, xantomas, entre otras, se consideraban de poca relevancia clínica (P1). Se definió rendimiento diagnóstico como la identificación de una lesión clínicamente significativa (P2), responsable del SGO (11). La calidad de preparación se consideraba adecuada, cuando se observaba escaso líquido y residuos que no interfieren con la visualización completa de la mucosa, e inadecuada cuando hay presencia de líquidos y residuos digeridos que dificultan o impiden la visualización completa de la mucosa (12, 13). Se definió como recurrencia del sangrado, a la presencia de anemia ferropénica, SOMF (+) o de sangrado evidente, durante el seguimiento.
En una base de datos con formato SPSS, se recolectaron los siguientes datos de cada paciente para el análisis:
1. Tipo de SGO: evidente u oculto.
2. Edad al momento del estudio.
3. Género del paciente.
4. Fecha de realización de CE.
5. Procedencia del paciente: hospitalizado o ambulatorio.
6. Antecedente de hospitalizaciones previas.
7. Nivel de hemoglobina (g/dl) previo a la realización de CE.
8. Realización de otros estudios adicionales a endoscopia alta y colonoscopia (tomografía abdominal computarizada, arteriografía, gammagrafía, etc.) previo a CE.
9. Tiempo transcurrido entre la presencia de sangrado y realización de CE, en pacientes con SGO evidente.
10. Calidad de preparación de CE.
11. Localización anatómica de la lesión en CE.
12. Visualización completa del intestino delgado.
13. Complicaciones asociadas al procedimiento.
14. Tipo vascular, inflamatoria o neoplásica) y relevancia (P0, P1 y P2) de las lesiones encontradas en CE.
15. Tipo de tratamiento: médico, endoscópico, radiológico o quirúrgico, realizado posterior al estudio.
16. Recurrencia de anemia ferropénica o sangrado evidente durante el seguimiento.
Análisis estadístico
Se realizó un análisis descriptivo de frecuencias de las variables clínicas categóricas y se calcularon la media y la mediana con sus respectivas medidas de variabilidad, según la distribución de normalidad de las mismas, para las variables continuas. Se hizo análisis con la prueba de Chi2 de Pearson para cruzar variables categóricas, prueba U de Mann Whitney para comparar rangos, y prueba de ANOVA no paramétrica de Kruskall Wallis. Se corrió una regresión logística en la cual la variable dependiente es que los hallazgos fueran explicativos comparada con que fueran no explicativos, o que no hubiese hallazgos. Los análisis se realizaron en el software estadístico SPSS 19.
Aspectos éticos
El protocolo de este estudio se sometió con anterioridad a juicio del Comité de investigaciones y ética del Hospital Pablo Tobón Uribe, donde fue aprobado. Se garantizó la confidencialidad de la información y no fue necesaria la realización de consentimiento informado por no implicar intervención adicional en los pacientes y recoger la información en forma retrospectiva de registros clínicos, siendo esta una investigación "Sin riesgo" según el artículo 11 de la Resolución 8430 de 1993 del Ministerio de Salud de Colombia.
RESULTADOS
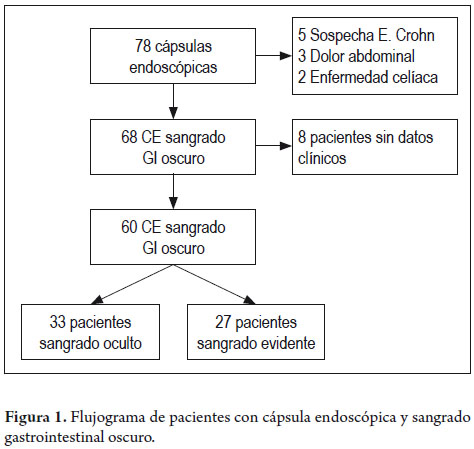
Entre septiembre de 2009 y septiembre de 2011, se realizaron 78 estudios de CE en el Hospital Pablo Tobón Uribe, de los cuales se tuvieron en cuenta 68 (87,1%) con indicación de SGO, tanto evidente como oculto. De los 68 CE, en 8 no se logró obtener datos clínicos y los 60 estudios restantes se incluyeron en el análisis para este estudio, de los cuales 33 (55%) presentaban SGO oculto y 27 (45%) SGO evidente (figura 1).
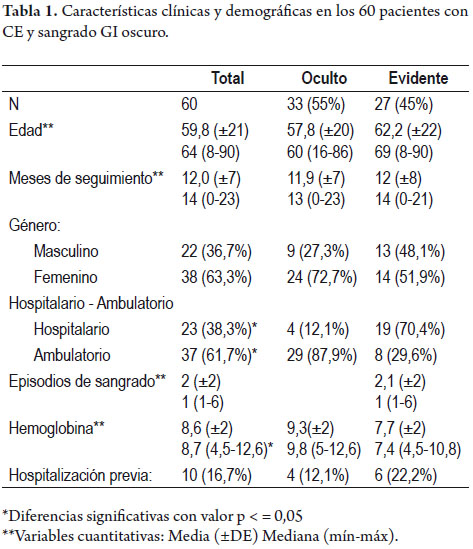
La mediana de seguimiento de los pacientes fue de 14 meses (Rango: 0-23). Aquellos con SGO oculto se siguieron en promedio 13 meses (0-23) y con SGO evidente, 14 meses (0-21). Esta diferencia no fue significativa, p: 0,84. La mediana de edad total de los pacientes fue de 64 años (8-90), para SGO evidente fue 69 años (8-90 años) y para SGO oculto fue 60 años (16-86 años), esta diferencia no fue significativa, (p: 0,34). En cuanto al género, de los 60 pacientes con SGO, 22 eran hombres (37%) y 38 mujeres (63%). Entre los sujetos con SGO evidente 48% eran hombres, y en los que presentaban SGO oculto solo 27%. Esta diferencia no fue significativa (p: 0,09) (tabla 1).
La CE se realizó en forma hospitalaria en 62% y ambulatoria en 38% de los individuos. Por tipo de sangrado, en los pacientes con SGO evidente la CE se realizó hospitalaria en 70%, y en aquellos con SGO oculto fue ambulatoria en 88% de los casos, esta diferencia fue significativa, (p: 0,0001). Los pacientes con SGO evidente en promedio habían presentado 2 episodios de sangrado (1 a 6). Los niveles de hemoglobina previo a la realización de CE, eran en promedio 9,2 g/dl (5,0-12,6 g/dl) para SGO oculto y 7,7 g/dl (4,5-10,8 g/dl) para SGO evidente. Esta diferencia fue significativa (p: 0,02). En cuanto a la tasa de hospitalización, 4 pacientes (12%) con SGO oculto lo habían estado, comparado con 6 individuos (22%) con SGO evidente, esta diferencia no fue estadísticamente significativa (p: 0,24) (tabla 1).
Todos los pacientes tenían endoscopia alta y colonoscopia total previa a la realización de CE, y 8 (13%) de los 60 pacientes tenían estudios adicionales: tomografía computarizada de abdomen (3), arteriografía de vasos mesentéricos (2), gammagrafía con glóbulos rojos marcados (2) y enteroscopia de doble balón (1).
Hallazgos de CE
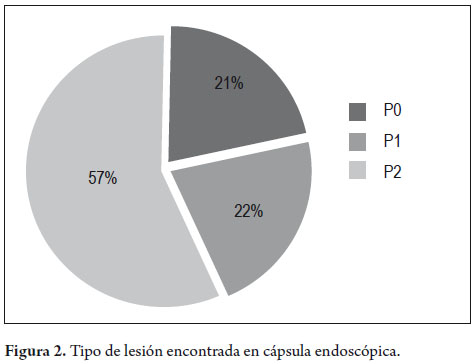
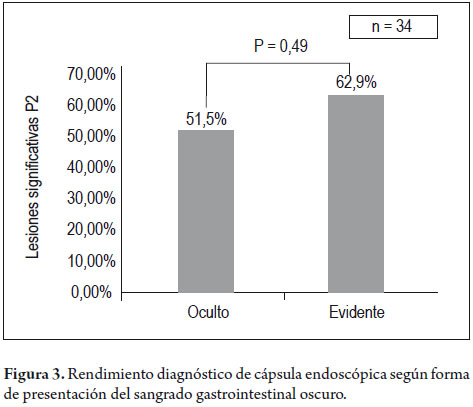
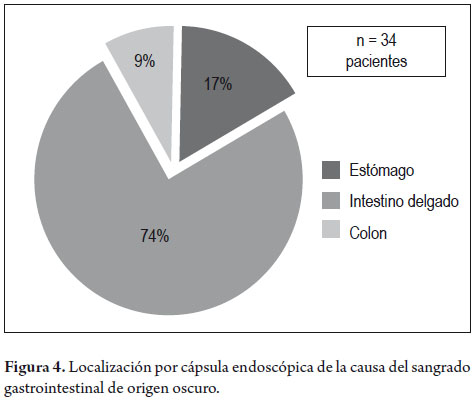
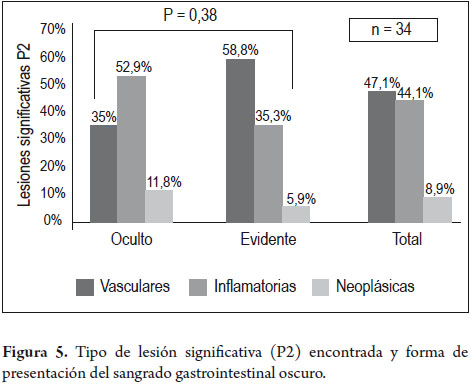
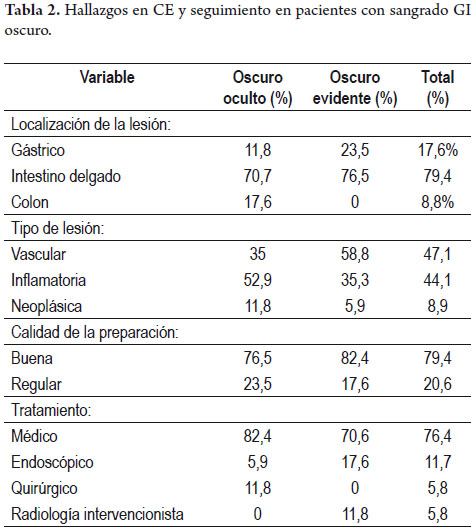
En general, se encontraron lesiones significativas que explicaban causa de sangrado (P2) en 34 (57%) de los 60 pacientes del estudio (figura 2). De estos 17/33 (52%) presentaban SGO oculto y 17/27 (63%) con SGO evidente, esta diferencia no fue significativa (p: 0,49) (figura 3). De los restantes 26 pacientes, 13 tuvieron CE normales (P0) y 13 (22%) presentaban lesiones no significativas (P1). En cuanto a la localización anatómica de la lesión causante de sangrado (P2) en los 34 pacientes, era en el estómago en 6 sujetos (17%), en intestino delgado en 25 (74%) y 3 en el colon (9%). En total, de 34 pacientes con lesiones significativas causante de SGO, en 9 (26%), se encuentran al alcance de una endoscopia alta o colonoscopia total (figura 4). El tipo de lesión significativa causante del sangrado (P2) en los 34 pacientes fueron: 16 (47%) vasculares, 15 (44%) inflamatorias, 3 (9%) neoplásicas. Las causas del sangrado en los 17 pacientes con SGO evidente y lesiones tipo P2 eran: vasculares 10 (59%), inflamatorias 6 (35%) y 1 (6%) neoplásica. De otro lado, en los 17 sujetos con SGO oculto con lesiones tipo P2, las causas eran: inflamatorias 9 (53%), vasculares 6 (35%), y neoplásicas 2 (12%). Estas diferencias no fueron significativas (p: 0,38) (figura 5).
Se alcanzó a visualizar el ciego durante el periodo de captura de CE en 55 (92%) de los 60 pacientes, y no se presentaron complicaciones incluyendo retención en ninguno. En cuanto a la calidad de preparación, 50 (83%) de los 60 pacientes, presentaban adecuada preparación, mientras que en 10 (17%) la preparación era inadecuada. No encontramos diferencia significativa entre la tasa de detección de hallazgos significativos (P2) y la calidad de preparación adecuada vs inadecuada (54,0 vs. 70,0%), p: 0,56 (tabla 2).
En el grupo de pacientes con SGO oculto, todos presentaban anemia ferropénica y 25 de los 33 pacientes (76%) tenían sangre oculta en materia fecal (SOMF) positiva; se encontró una diferencia clínica pero no estadísticamente significativa entre el porcentaje de hallazgos de lesiones que expliquen la causa de sangrado (P2), comparando los subgrupos de pacientes con SOMF positiva vs. negativa: 62,5% (10/16) vs. 33,3% (3/9), p: 0,11.
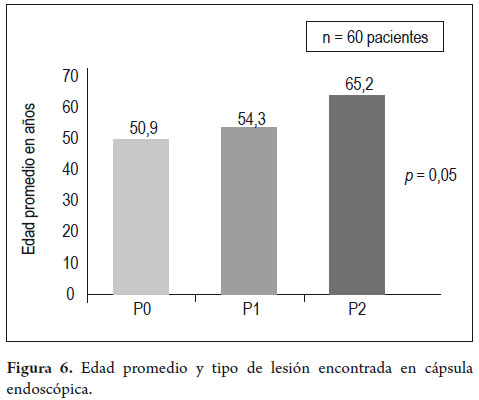
La edad promedio de los pacientes con hallazgos P0 fue 50,9 años (media 37,3-64,4), en los pacientes con P1 fue 54,3 años (media 41,1-67,4) y con P2 65,2 años (media 58,4-72,0), esta diferencia fue estadísticamente significativa entre P2 y las demás (p: 0,05) (figura 6). Se realizó un análisis multivariado de regresión logística y se encontró que por cada año de edad se incrementa en 5% la probabilidad de que los hallazgos sean clínicamente significativos en CE (P2) (p: 0,001). No encontramos diferencia significativa entre el rendimiento diagnóstico (lesiones P2) de la CE y el género, 54,5% (Hombres) y 57,9% (Mujeres), p: 0,96.
Dentro del grupo de 27 pacientes con SGO evidente, a 5 (18,5%) se les realizó CE en las primeras 48 horas posterior al episodio de sangrado, a 13 (48,1%) entre 48 horas y 7 días, a 6 (22,2%) entre 7 y 30 días, y a 3 pacientes (11,1%) después de 30 días del episodio de sangrado. Se encontraron hallazgos significativos (P2) en 3/5 pacientes (60%) a quienes se les realizó CE en las primeras 48 horas, 7/13 (54%) entre 48 horas y 7 días, 4/6 (67%) entre 7 y 30 días, y por último en 2/3 pacientes (67%), después de 30 días del episodio de sangrado. No hubo diferencia significativa entre el rendimiento diagnóstico de la CE y el tiempo de realización de la misma en pacientes con SGO evidente (p: 0,88).
El nivel de hemoglobina promedio en pacientes con CE normales P0 fue 8,7 g/dl (DS: 2,5), en aquellos con lesiones no significativas P1 fue 8,6 g/dl (DS: 1,8) y en sujetos con lesiones significativas P2 fue 8,5 g/dl (DS: 1,6). No hubo diferencias significativas (p: 0,94). Los pacientes a quienes se les realizó la CE hospitalizados tuvieron similar proporción de lesiones significativas (P2), comparados con aquellos a quienes se les realizó la CE en forma ambulatoria (47% vs. 53%).
Desenlaces posteriores a CE
En cuanto al desenlace clínico posterior de los 34 pacientes sometidos a CE con hallazgos significativos (P2), a 26 pacientes (76%) se les realizó tratamiento médico (suplencia de hierro oral o intravenoso, tratamiento E. Crohn, etc.), a 4 pacientes (12%) se les practicó manejo endoscópico, a 2 sujetos (9%) manejo quirúrgico, y a 2 individuos (6%) tratamiento por radiología intervencionista. De los restantes 26/60 pacientes con CE normales (P0) o sin hallazgo significativo que expliquen el sangrado (P1), 65% recibieron tratamiento médico y no presentaron recurrencia de SGO durante el seguimiento. Dentro del subgrupo de pacientes con SGO evidente a 70% se les realizó solo tratamiento médico, comparado con 82% de sujetos con SGO oculto (tabla 2).
En cuanto a la evolución clínica posterior a la realización de la CE y el tipo de hallazgo encontrado (P0, P1 y P2), encontramos que de los 13 pacientes con CE sin hallazgos (P0), 6 (46%) no presentaron recurrencia de sangrado durante el seguimiento, 5 presentaron anemia ferropénica (39%) y solo 2 (15%) tuvieron sangrado evidente recurrente. De igual forma, de los 13 pacientes con hallazgos no significativos (P1) en CE, 11 (85%) no presentaron recurrencia de sangrado durante el seguimiento, ninguno presentó recurrencia de anemia ferropénica y solo 2 (15,4%) tuvieron sangrado evidente recurrente. Del mismo modo, de los 34 pacientes con hallazgos significativos (P2) en CE, 16 (47%) no presentaron recurrencia de sangrado durante el seguimiento, 15 (44%) presentaron anemia ferropénica, y solo 3 (9%) tuvieron sangrado evidente recurrente.
Comparando las tasas de recurrencia de sangrado o anemia ferropénica entre pacientes con hallazgos significativos (P2) y aquellos con resultados de CE no relevantes (P0, P1), fueron 53% y 35%, respectivamente. Lo cual es clínicamente importante pero no presentó significancia estadística (p: 0,07).
DISCUSIÓN
La CE es una muy buena herramienta diagnóstica en pacientes con SGO y con criterios estrictos, nosotros pudimos establecer el rendimiento diagnóstico, hallazgos y evolución clínica en 60 pacientes consecutivos a quienes se realizaron CE en nuestro centro. La indicación de CE más frecuente fue SGO (87%). El rendimiento diagnóstico obtenido en nuestro estudio (57%) es similar al obtenido en otras publicaciones. Carey (14), en 260 pacientes y utilizando criterios diagnósticos similares, encontró un rendimiento diagnóstico de 53%, siendo mayor para SGO evidente (60%) que para SGO oculto (46%), parecida a la proporción encontrada en nuestro estudio (63% vs. 52%). En diferentes series el rendimiento diagnóstico oscila entre 30 a 92% dependiendo de la definición de hallazgos significativos y del tipo de SGO estudiado (15-19, 35, 36). Una serie canadiense con el mayor número de estudios de CE (698) en SGO reportados de un solo centro fue publicada recientemente, encontrando un rendimiento diagnóstico de 42% (36).
Una revisión sistemática de 227 artículos publicados, encontró un rendimiento diagnóstico para CE de 60,5% en pacientes con SGO oscuro (6). Recientemente, se publicó una revisión sistemática de 26 estudios solo con SGO oculto y anemia ferropénica y 1960 pacientes, encontrando un rendimiento diagnóstico para CE de 66,6%, con predominio de lesiones vasculares (31%) (34). Adicionalmente, un metanálisis, con 10 estudios comparando CE con enteroscopia de doble balón (EDB) en SGO oscuro, encontró un rendimiento diagnóstico de 60% (25).
Las características demográficas de nuestra población son muy similares a otras series, con una edad promedio relativamente avanzada (64 años), y adicionalmente, encontramos un predominio del sexo femenino en sujetos con SGO oculto, esto fue estadísticamente significativo. La edad promedio de los pacientes con hallazgos significativos (P2) en CE (65,2 años) fue superior, cuando se comparó con la de sujetos con hallazgos no significativos (P0, P1), esta diferencia fue estadísticamente significativa (p: 0,05). Un estudio reciente encontró la edad > 60 años como un predictor clínico de hallazgos significativos en CE (OR 1,2), en pacientes con SGO (35).
En cuanto a la localización anatómica de la lesión sangrante significativa (P2), llama la atención que en 9 de los 34 pacientes (26%), se encontraba en estómago o colon, pudiéndose evitar la realización de CE, si se hubiese realizado endoscopia alta o colonoscopia total previamente, con menos costos para el sistema de salud. Otros estudios han encontrado 10%, 12,6%, 17,8% y 24,3% de lesiones en CE al alcance de endoscopia alta y colonoscopia, en este mismo grupo de pacientes (14, 20, 35, 36). Los motivos pueden ser diversos, algunas lesiones han parado de sangrar, lo hacen en forma muy lenta o intermitente, otras no se visualizan ante hallazgos como coágulos imposibles de movilizar, la presencia de anemia e hipovolemia las hacen ver menos obvias, o por mala preparación en el caso de la colonoscopia (3).
En pacientes con SGO evidente nosotros no encontramos diferencia significativa en el rendimiento diagnóstico de CE, entre diferentes tiempos de realización de la misma posterior al último episodio de sangrado, a diferencia de otros estudios que sugieren mayor rendimiento diagnóstico si se realiza CE temprana (14, 17, 23). Los sujetos con SGO oculto con anemia ferropénica y SOMF positiva presentaban mayor rendimiento diagnóstico comparados con aquellos con SOMF negativa (62,5% vs. 33,3%), sin embargo, y a pesar de que es una diferencia clínica importante, no fue estadísticamente significativa (p: 0,11). Adicionalmente, tampoco encontramos diferencia estadística entre la detección de hallazgos significativos (P2) y la calidad de preparación del intestino delgado. Un metanálisis reciente encontró en 7 estudios una preparación adecuada en 69,5% de los pacientes preparados con laxantes, en nuestro estudio fue un poco más alta (83%); sin embargo, los criterios de preparación adecuada/inadecuada en los 7 estudios no son homogéneos, lo cual podría explicar esta diferencia (10). Liao et al (6), en una revisión sistemática encontraron 83,5% de visualización completa del intestino delgado por CE, en nuestro estudio logramos 92%, debido en parte a que nosotros monitorizamos en tiempo real la localización de la CE durante las primeras dos horas posterior a la ingesta y en caso de permanecer en estómago, la avanzamos por vía endoscópica como se ha descrito previamente (21).
En general, el tipo de lesiones causantes de sangrado (P2) más frecuentemente encontradas fueron vasculares (47%), muy similares al 50% reportado como causa de SGO en un metanálisis reciente (6). Sin embargo, en sujetos con SGO oculto hubo un predominio no significativo de lesiones inflamatorias sobre las vasculares, esto se debe en parte a que nuestro hospital es centro de referencia de pacientes con enfermedad inflamatoria intestinal.
La tasa de recurrencia de SGO en nuestro estudio durante el seguimiento fue alta (45%), siendo más frecuente en CE positivas (53%), que en CE con hallazgos no relevantes (35%), en 14 meses de seguimiento. En otras publicaciones, Mc Donald et al, encontraron en 49 pacientes una tasa de recurrencia de sangrado de 28%, siendo más alta en CE positiva (42%) comparada con un resultado negativo (11%), a 17 meses de seguimiento (27). Sin embargo, Park et al, en un estudio coreano más reciente, encontraron una tasa de recurrencia de sangrado más alta de 35,3% en 51 pacientes, a 31,7 meses de seguimiento, no encontrando diferencias significativas según el resultado positivo o negativo de la CE (34,8% vs. 35,7%) (28). Laine, et al encontraron una tasa de recurrencia de sangrado de CE en 30% de pacientes con SGO a 12 meses de seguimiento (29).
A pesar de que la CE permite detectar lesiones que explican la causa de SGO, muchas veces estas lesiones no son susceptibles de manejo definitivo endoscópico, quirúrgico, ni radiológico, y debemos ofrecer solo manejo médico en muchas situaciones, como lo realizamos en 76% de nuestros pacientes con lesiones significativas (P2). El 65% de los pacientes con hallazgos P0 y P1 en CE recibieron tratamiento médico, y no presentaron recurrencia de anemia ferropénica ni sangrado evidente durante el seguimiento, lo que habla de un buen pronóstico clínico con un hallazgo negativo o no significativo en una CE inicial, por lo tanto en este tipo de población un manejo médico es una opción razonable, como lo mencionan otros autores (30).
Adicionalmente, por edad avanzada y comorbilidades asociadas, a veces no es posible realizar tratamiento más agresivo como enteroscopia intraoperatoria o EAB. De de otro lado, una parte de los pacientes con CE que se realizan en nuestra institución son remitidos y no asisten a nuestra consulta posterior a la realización del procedimiento, por lo tanto no es posible un seguimiento y manejo estricto, lo cual es importante sobre todo en aquellos individuos con hallazgos significativos en CE, a pesar de colocar sugerencias de manejo en el informe. Otra dificultad radica en que algunas aseguradoras no autorizan fácilmente por costos la realización de EAB, al no encontrarse en el plan obligatorio de salud (POS), como en los casos de manejo de lesiones vasculares con coagulación con argón plasma, y el paciente persiste con sangrado GI. Todo lo anterior puede contribuir a la alta tasa de recurrencia de sangrado en nuestro estudio durante el periodo de seguimiento.
La presencia de sangrado recurrente con un resultado previo negativo de CE, puede ser secundario a no visualización de la lesión por la CE, debido a que no es un estudio perfecto, factores como la peristalsis, la preparación de la mucosa, los pliegues en la superficie de la mucosa, el ángulo limitado de visualización, falta de insuflación, la captura no continua de imágenes (2 por segundo) y la visualización incompleta en algunos casos del intestino delgado, entre otros, pueden contribuir a un resultado negativo. Por lo anterior, algunos autores recomiendan repetirla en pacientes de alto riesgo ("second look"), como lo señala un estudio reciente que muestra un rendimiento diagnóstico de 41,6% en 293 pacientes con CE previas negativas, sobre todo a individuos en quienes descienda la hemoglobina > 4 g/dl o que el SGO pase de oculto a evidente, los cuales fueron predictores de un resultado positivo (31).
La tasa promedio de retención de CE es alrededor de 1,2% (6), en nuestro estudio no se presentaron retenciones en las CE analizadas, esto en parte a una evaluación clínica e interrogatorio de síntomas obstructivos abdominales por parte del gastroenterólogo y enfermera en todos los pacientes, previo a la realización de CE. Además, se descarta ingesta de AINE's en los dos meses previos al estudio, antecedentes de radiación abdominal y se solicitan estudios radiológicos de intestino delgado previo a la realización de CE en pacientes con sospecha clínica de obstrucción intestinal y enfermedad de Crohn, este último es responsable de una tercera parte de las CE retenidas según se ha descrito en la literatura (6). Adicionalmente, en caso de que el paciente no refiera salida en materia fecal de la CE, a todos los pacientes les realizamos rayos X de abdomen simple a los 15 días de realizado el estudio para confirmar su expulsión.
En una publicación colombiana previa de Galiano y cols (32), con 100 estudios de CE, encontraron lesiones en 91% de los pacientes, en nuestro trabajo encontramos 79% (P2 + P1) de las CE revisadas. Un hallazgo interesante adicional fue que en 12% de CE encontraron parasitismo intestinal, en nuestro centro de las 78 CE realizadas, solo una paciente presentó ascaris lumbricoides en intestino delgado.
Diversos estudios han demostrado que el rendimiento diagnóstico de la CE es muy similar al encontrado para EAB, en el estudio de pacientes con SGO (6, 24, 25, 26, 33); sin embargo, las ventajas de realizar CE como examen de primera línea incluyen que es un estudio fácil de realizar, no invasivo, seguro, no requiere sedación, con una tasa más baja de complicaciones y una mayor tasa de visualización completa de intestino delgado (83,5% vs. 44%), comparado con EAB; además permite determinar la vía de realización de EAB (anterógrada o retrógrada). Un reciente metanálisis (25) propone reservar la EDB como un estudio terapéutico en CE con hallazgos (+), de esta manera el rendimiento diagnóstico encontrado para EDB es mayor cuando se realiza al subgrupo de pacientes con CE (+) comparado con todos los pacientes con EDB: 75% vs. 27,5%, OR: 1,79. Con base en esto, en nuestro centro tenemos de primera elección la CE para el estudio de pacientes con SGO, y reservamos realizar EDB solo en pacientes con CE (+), en quienes amerite realizar intervencionismo terapéutico.
En conclusión, en nuestro estudio encontramos un rendimiento diagnóstico para CE en pacientes con SGO similar a lo reportado en la literatura universal, el cual se incrementa con la edad del paciente, y los individuos con CE (-) o sin lesiones significativas, tienen buen pronóstico durante el seguimiento. Dentro de las limitaciones de este estudio, reconocemos que es retrospectivo con relativamente poco tiempo de seguimiento.
REFERENCIAS
1. Ell C, May A. Mid-gastrointestinal bleeding: capsule endoscopy and push-and-pull enteroscopy give rise to a new medical term. Endoscopy 2006; 38: 73-75. [ Links ]
2. Gralnek IM. Obscure-Overt Gastrointestinal Bleeding. Gastroenterology 2005; 128: 1424-1430. [ Links ]
3. Raju GS, Gerson L, et al. American Gastroenterological Association (AGA) Institute Technical Review on Obscure Gastrointestinal Bleeding. Gastroenterology 2007; 133: 1697-1717. [ Links ]
4. Juliao F. Sangrado gastrointestinal oscuro: ¿Cuál es el mejor abordaje diagnóstico? What is the best diagnostic approach for obscure gastrointestinal bleeding? Rev Col Gastro 2010; 25(2): 177-184. [ Links ]
5. May A. How to Approach the Small Bowel with Flexible Enteroscopy. Gastroenterol Clin N Am 2010; 39: 797-806. [ Links ]
6. Liao Z, Gao R, Xu C, Li ZS. Indications and detection, completion, and retention rates of small-bowel capsule endoscopy: a systematic review. Gastrointest Endosc 2010; 71: 280-6. [ Links ]
7. Triester SL, Leighton JA, Leontiadis GI, Fleischer DE, Hara AK, Heigh RI, Shiff AD, Sharma VK. A meta-analysis of the yield of capsule endoscopy compared to other diagnostic modalities in patients with obscure gastrointestinal bleeding. Am J Gastroenterol 2005; 100: 2407-2418. [ Links ]
8. Marmo R, Rotondano G, Piscopo R, et al. Meta-analysis: capsule enteroscopy vs. conventional modalities in diagnosis of small bowel diseases. Aliment Pharmacol Ther 2005; 22(7): 595-604. [ Links ]
9. Ladas SD, Triantafyllou K, Spada C, et al. European Society of Gastrointestinal Endoscopy (ESGE): Recommendations (2009) on clinical use of video capsule endoscopy to investigate small-bowel, esophageal and colonic diseases. Endoscopy 2010; 42: 220-227. [ Links ]
10. Rokkas T, Papaxoinis K, Triantafyllou K, Pistiolas D, Ladas SD. Does Purgative Preparation Influence the Diagnostic Yield of Small Bowel Video Capsule Endoscopy? A Meta-Analysis. Am J Gastroenterol 2009; 104: 219-227. [ Links ]
11. Saurin JC, Delvaux M, Gaudin JL et al. Diagnostic value of endoscopic capsule in patients with obscure digestive bleeding: blinded comparison with video push enteroscopy. Endoscopy 2003; 35: 576-584. [ Links ]
12. Viazis N, Sgouros S, Papaxoinis K, et al. Bowel preparation increases the diagnostic yield of capsule endoscopy: a prospective, randomized, controlled study. Gastrointest Endosc 2004; 60: 534-8. [ Links ]
13. Brotz C, Nandi N, Conn M, et al. A validation study of 3 grading systems to evaluate small-bowel cleansing for wireless capsule endoscopy: a quantitative index, a qualitative evaluation, and an overall adequacy assessment. Gastrointest Endosc 2009; 69: 262-70. [ Links ]
14. Carey EJ, Leighton JA, Sharma VK, Fleischer DE, et al. A Single-Center Experience of 260 Consecutive Patients Undergoing Capsule Endoscopy for Obscure Gastrointestinal Bleeding. Am J Gastroenterol 2007; 102: 89-95. [ Links ]
15. Ell C, Remke S, May A, et al. The first prospective controlled trial comparing wireless capsule endoscopy with push enteroscopy in chronic gastrointestinal bleeding. Endoscopy 2002; 34: 685-9. [ Links ]
16. Costamagna G, Shah SK, Riccioni ME, et al. A prospective trial comparing small bowel radiographs and video capsule endoscopy for suspected small bowel disease. Gastroenterology 2002; 123: 999-1005. [ Links ]
17. Pennazio M, Santucci R, Rondonotti E, et al. Outcome of patients with obscure gastrointestinal bleeding after capsule endoscopy: Report of 100 consecutive patients. Gastroenterology 2004; 126: 643-53. [ Links ]
18. Adler DG, Knipshield M, Gostout C. A prospective comparison of capsule endoscopy and push enteroscopy in patients with GI bleeding of obscure origin. Gastrointest Endosc 2004; 59: 492-8. [ Links ]
19. Scapa E, Jacob H, Lewkowicz S, et al. Initial experience of wireless-capsule endoscopy for evaluating occult gastrointestinal bleeding and suspected small bowel pathology. Am J Gastroenterol 2002; 97: 2776-9. [ Links ]
20. Fry LC, Bellutti M, Neumann H, et al. Incidence of bleeding lesions within reach of conventional upper and lower endoscopes in patients undergoing double-balloon enteroscopy for obscure gastrointestinal bleeding. Aliment Pharmacol Ther 2009; 29: 342-349. [ Links ]
21. Carey EJ, Heigh RI, Fleischer DE. Endoscopic delivery of capsule endoscope for patients with dysphagia, anatomical abnormalities, or gastroparesis. Gastrointest Endosc 2004; 59: 423-7. [ Links ]
22. Goddard AF, James MW, McIntyre AS, et al. Guidelines for the management of iron deficiency anemia. Gut 2011; 60: 1309-1316. [ Links ]
23. Bresci G, Parisi G, Bertoni M, Tumino E, Capria A. The role of video capsule endoscopy for evaluating obscure gastrointestinal bleeding: usefulness of early use. J Gastroenterol 2005; 40: 256-9. [ Links ]
24. Pasha SF, Leighton JA, Fleischer DE, et al. Double-Balloon Enteroscopy and Capsule Endoscopy Have Comparable Diagnostic Yield in Small-Bowel Disease: A Meta-Analysis. Clin Gastro & Hepatol 2008; 6: 671-676. [ Links ]
25. Teshima CW, Kuipers EJ, Van Zanten SV, Mensink PB. Double balloon enteroscopy and capsule endoscopy for obscure gastrointestinal bleeding: An updated meta-analysis. J Gastroenterol Hepatol 2011; 26: 796-801. [ Links ]
26. Arakawa D, Ohmiya N, Nakamura M, et al. Outcome after enteroscopy for patients with obscure GI bleeding: diagnostic comparison between double-balloon endoscopy and videocapsule endoscopy. Gastrointest Endosc 2009; 69: 866-74. [ Links ]
27. Macdonald J, Porter V, McNamara D. Negative capsule endoscopy in patients with obscure GI bleeding predicts low rebleeding rates. Gastrointest Endosc 2008; 68: 1122-7. [ Links ]
28. Park JJ, Cheon JH, Kim HM et al. Negative capsule endoscopy without subsequent enteroscopy does not predict lower long-term rebleeding rates in patients with obscure GI bleeding. Gastrointest Endosc 2010; 71: 990-7. [ Links ]
29. Laine L, Sahota A, Shah A. Does capsule endoscopy improve outcomes in obscure gastrointestinal bleeding? Randomized trial versus dedicated small bowel radiography. Gastroenterology 2010; 138: 1673-1680. [ Links ]
30. Keum B, Chun HJ. Capsule endoscopy and double balloon enteroscopy for obscure gastrointestinal bleeding: Which is better? J Gastroenterol Hepatol 2011; 26: 794-795. [ Links ]
31. Viazis N, Papaxoinis K, Vlachogiannakos J, et al. Is there a role for second look capsule endoscopy in patients with obscure GI bleeding after a non-diagnostic first test? Gastrointest Endosc 2009; 69: 850-6. [ Links ]
32. Galiano MT, Sánchez F, Pineda LF. Experiencia clínica del uso de la videocápsula endoscópica en el diagnóstico de patología del intestino delgado. Rev Col Gastroenterol 2009; 24(1): 17-25. [ Links ]
33. Xin L, Liao Z, Jiang Y-P, Li Z-S. Indications, detectability, positive findings, total enteroscopy, and complications of diagnostic double-balloon endoscopy: a systematic review of data over the first decade of use. Gastrointest Endosc 2011; 74: 563-70. [ Links ]
34. Koulaouzidis A, Rondonotti E, Giannakou A, et al. Diagnostic yield of small-bowel capsule endoscopy in patients with iron-deficiency anemia: a systematic review. Gastrointest Endosc 2012; 76: 983-92. [ Links ]
35. Lepileur L, Dray X, Antonietti M, et al. Factors Associated with Diagnosis of Obscure Gastrointestinal Bleeding by Video Capsule Enteroscopy. Clin Gastro & Hepatol 2012; 10: 1376-1380. [ Links ]
36. Shahidi NC, Ou G, Svarta S, et al. Factors Associated with Positive Findings from Capsule Endoscopy in patients with Obscure Gastrointestinal Bleeding. Clin Gastro & Hepatol 2012; 10: 1381-1385. [ Links ]











 text in
text in