Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.2 Bogotá Apr./June 2013
Hepatopatología para gastroenterólogos y hepatólogos
Rocío del Pilar López Panqueva, MD (1)
(1) Jefe Sección Anatomía Patológica Hospital Universitario Fundación Santa fe de Bogotá. Profesora Facultad de Medicina Universidad de Los Andes. Bogotá, Colombia. e-mail: rocio.lopez@fsfb.org.co rolopez@uniandes.edu.co
Fecha recibido: 08-05-13 Fecha aceptado: 27-05-13
Resumen
Para entender los mecanismos de enfermedad hepática es indispensable unir los conceptos anatomo-histológicos con los procesos fisiopatológicos que ocurren en cada enfermedad. En este primer artículo de una serie se desarrollan los conceptos básicos del diagnóstico histopatológico.
Palabras clave
Hígado, biopsia, patología, diagnóstico, técnicas histopatológicas.
En la práctica diaria de la hepatología clínica, se requiere el amplio conocimiento no solo de la anatomía y fisiología hepática, sino de los mecanismos fisiopatológicos, que tienen una expresión morfológica no siempre bien entendida por el médico clínico.
El objetivo de esta serie es lograr un fácil entendimiento de los hallazgos histopatológicos observados en las patologías más frecuentes de la práctica clínica, para su adecuada correlación clínico-patológica:
1. Generalidades del diagnóstico histopatológico.
2. Terminología útil en la interpretación de los hallazgos histopatológicos.
3. Patología de las hepatitis crónicas.
4. Enfermedad hepática grasa.
5. Aproximación diagnóstica de las enfermedades colestásicas.
6. Toxicidad medicamentosa.
7. Neoplasias hepáticas más frecuentes, su diagnóstico diferencial y utilidad de los estudios de inmunohistoquímica y moleculares.
8. Patología del trasplante hepático.
9. Algoritmos diagnósticos en patología hepática, basados en patrones de daño hepático.
10. ¿Es útil la biopsia hepática?, visión del patólogo.
BASES DEL DIAGNÓSTICO HISTOPATOLÓGICO
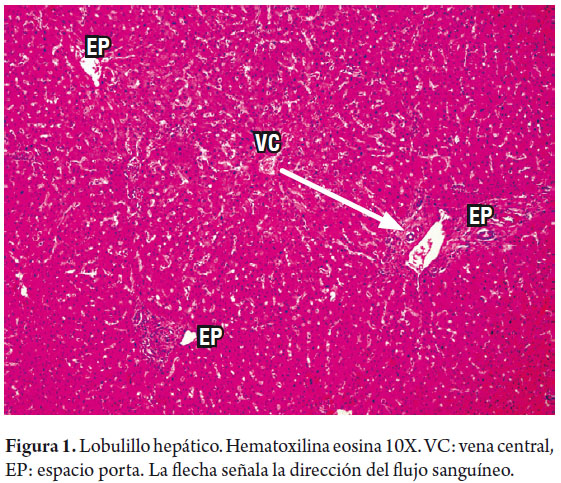
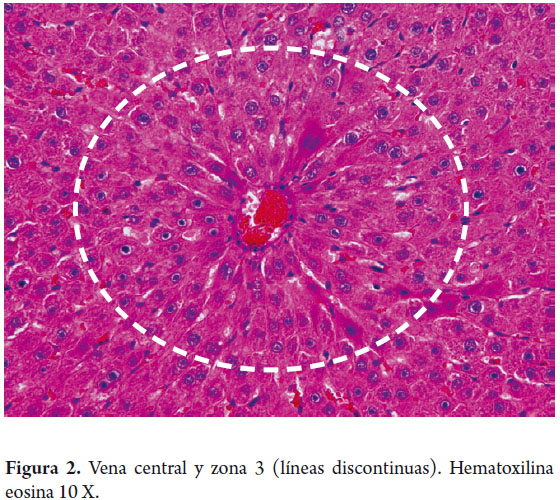
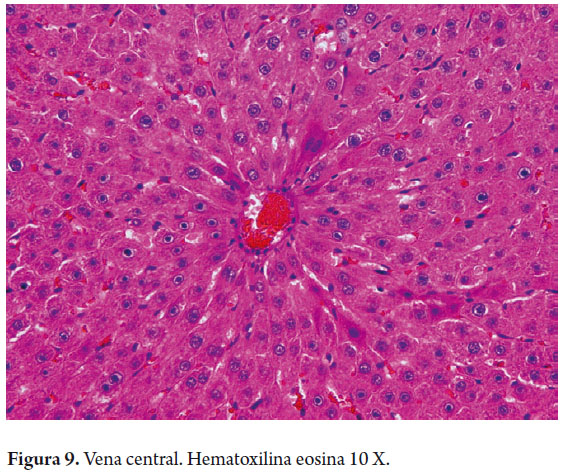
Iniciaremos por recordar la microestructura del hígado, en la cual la organización microscópica está directamente relacionada con la suplencia sanguínea y su drenaje biliar. Tradicionalmente conocemos la disposición en lóbulos hexagonales cada uno de los cuales tiene una vena central, y triadas portales en los extremos (figura 1). El flujo sanguíneo entra a través de pequeñas ramas de la vena porta y arteria hepática, desembocando en los sinusoides cerca de los espacios porta en la zona periportal la cual es muy rica en nutrientes y oxígeno, llamada zona 1, mientras que la zona central, centrolobulillar o zona 3 (figura 2), recibe un flujo poco oxigenado; el espacio entre ellas es la zona 2. Esta distribución es tridimensional en los acinos hepáticos y considerada mas fisiológica, explica el porqué cada una de estas zonas tiene susceptibilidad mayor a una u otra patología, siguiendo especialmente las zonas acinares pero no necesariamente los lobulillos, que son estructuras bidimensionales (1).
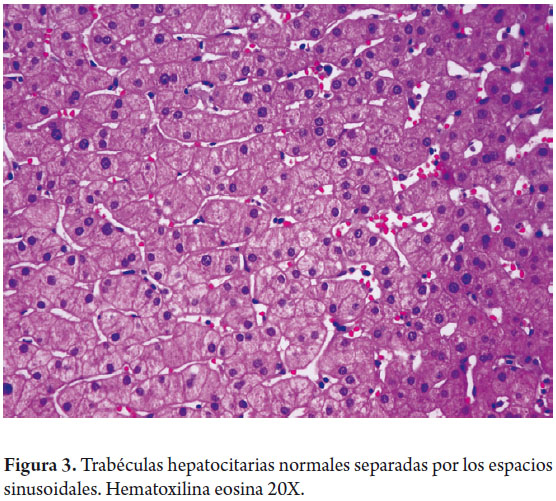
Los hepatocitos constituyen 80% de la población celular hepática, se disponen en cordones distribuidos radialmente entre las áreas portales y la vena central separados por espacios sinusoidales (figura 3) los cuales están revestidos por células endoteliales con características diferentes tanto estructurales como fenotípicas a cualquier otra célula endotelial vascular, son células fenestradas, es decir que carecen de membrana basal lo cual permite que el plasma y sus componentes estén en contacto directo con los hepatocitos en el espacio subendotelial de Dissé, no expresan factor VIII, no contienen moléculas características de los endotelios vasculares como E-selectina, CD31 o CD34 (2). Son más numerosas y grandes en las zonas más distales del sinuoide o zonas perivenulares, las fenestras son estructuras muy lábiles, de diámetro variable según la respuesta a mediadores endógenos como la serotonina o exógenos, como por ejemplo, el alcohol.
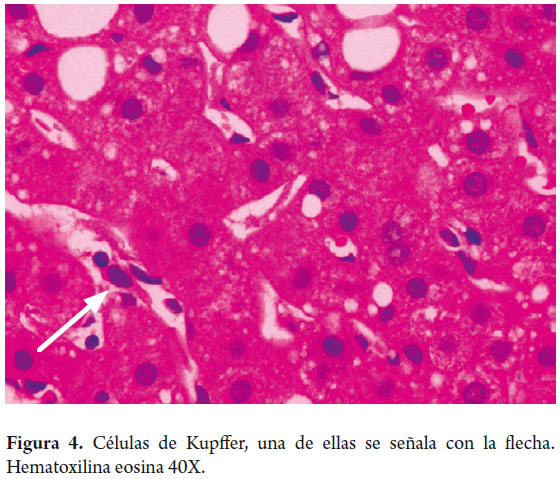
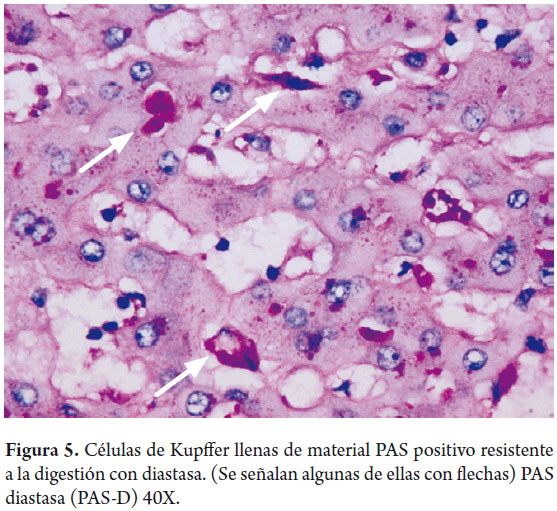
Los macrófagos hepáticos o células de Kupffer, son aproximadamente 4% de la población celular; están presentes en la luz de los sinusoides forman parte del sistema mononuclear fagocítico, su importancia radica en formar parte del sistema de defensa y tienen un rol en la patogénesis de varias enfermedades hepáticas. Son más numerosas en los espacios sinusoidales periportales y migran a las zonas de injuria (figuras 4 y 5).
Las células estrelladas o células de Ito además de almacenar vitamina A en su citoplasma, sintetizan citoquinas proinflamatorias y proteínas de la matriz extracelular que predominantemente constituyen la trama estructural del hígado (3). Juegan un papel muy importante en la biología normal hepática, interactuando en forma muy estrecha en el espacio de Dissé, con las fenestras de las células endoteliales y los hepatocitos, ayudando a mantener su diferenciación, crecimiento y función, por acción de integrinas de superficie y receptores en la superficie de los hepatocitos. La laminina, colágeno IV, heparán sulfato se encuentran en mayor cantidad a nivel de la zona periportal, mientras que la fibronectina, el colágeno III, el dermatán sulfato son abundantes en la zona 3 ó pericentral (4). En condiciones normales estas células están quiescentes siendo activadas ante una injuria hepatocelular, transformándose en células que semejan miofibroblastos, incluso fenotípicamente expresan actina de músculo liso, constituyendo la mayor fuente de colágeno en condiciones anormales, donde las citoquinas secretadas por las células de Kupffer y las células inflamatorias producen la activación de las células estrelladas para que estas se dividan, perpetúen la síntesis de citoquinas proinflamatorias, en especial integrinas y produzcan abundante matriz extracelular. La fibrosis constituye la respuesta del tejido a una lesión persistente que favorece la acelerada generación de matriz extracelular (5, 6).
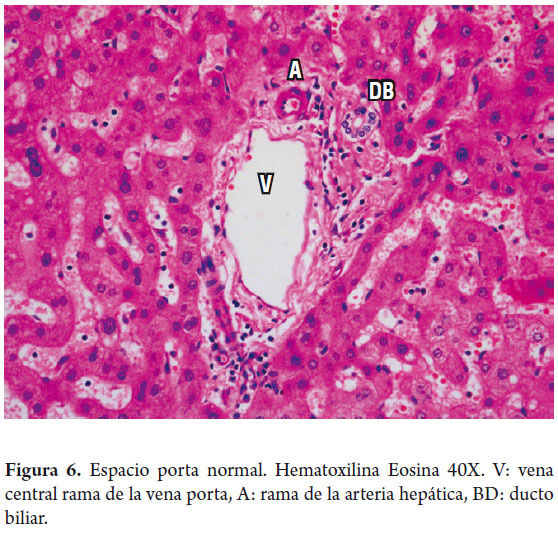
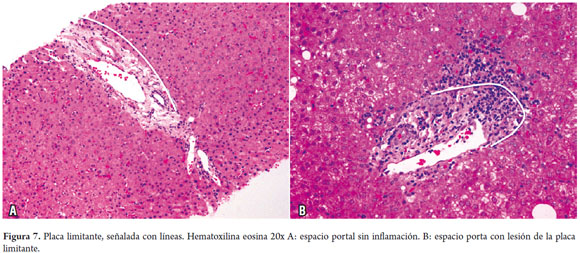
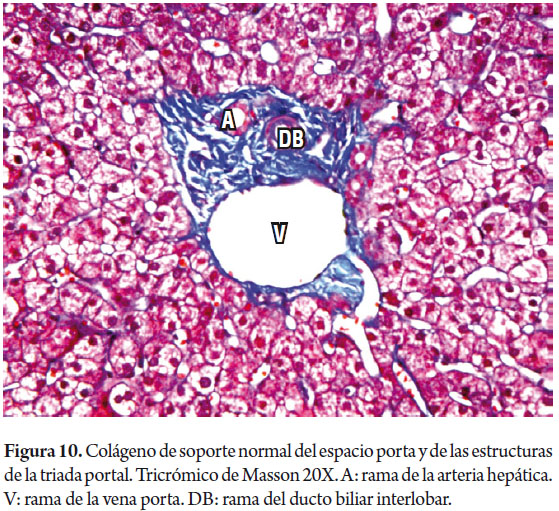
Las áreas portales tienen un soporte de colágeno donde se identifican el ducto biliar interlobar, una rama de la vena porta y una rama de la arteria hepática, el ducto y la arteria tienen aproximadamente el mismo diámetro (figura 6). Los hepatocitos localizados inmediatamente alrededor de los espacios porta constituyen la llamada placa limitante, corresponde a un espacio virtual carente de membrana basal y la cual constituye una zona de vital importancia en las enfermedades necroinflamatorias (figura 7).
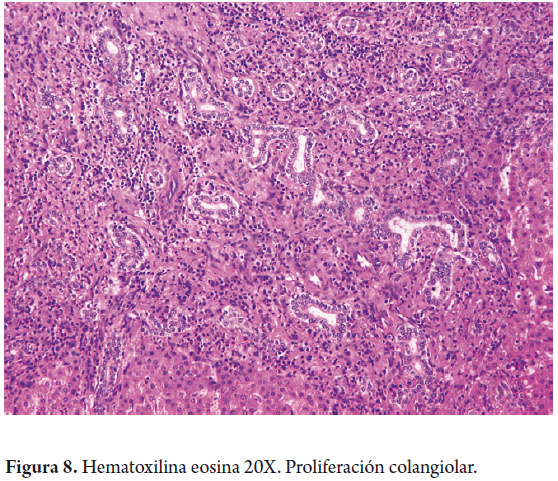
Los colangiocitos delinean el sistema biliar intra y extrahepático, modificando la composición de la bilis durante su tránsito a través de los ductos biliares. Los canalículos biliares forman una malla alrededor de cada hepatocito, drenan cerca de la interfase portal a los canales de Hering, en el hígado normal los ductos o canales de Hering son inconspicuos, midiendo menos de 15 µm de diámetro, localizados en la periferia de las áreas portales en la unión ductular-hepatocelular. Tienen un doble fenotipo al estar delineados por ambos tipos de células y representan la unión fisiológica entre el árbol biliar con el sistema canalicular hepatocitario y se extienden dentro del lobulillo hepático. Además de ayudar a canalizar el flujo biliar hacia el intestino, tiene funciones absortivas y secretoras participando en la producción de bilis (40% de la producción total de bilis es de origen ductal) y juegan un importante papel en los procesos regenerativos / reparativos hepáticos con proliferación de colangiolos (figura 8). Los canales de Hering drenan a los ductulos biliares o colangiolos revestidos por 3 a 6 colangiocitos y en los tractos portales constituyen los ductos biliares interlobulares que se unen para formar los ductos septales hasta los conductos biliares mayores intra y extrahepáticos, aumentando progresivamente su diámetro e igualmente cambian su epitelio de revestimiento de cúbico a cilíndrico simple (figura 9) (7).
Para lograr una óptima interpretación del resultado de una biopsia hepática, el clínico debe conocer cómo ocurre la aproximación diagnóstica del patólogo y entender muy bien el significado de la terminología empleada.
El patólogo debe siempre utilizar un enfoque sistemático en la evaluación de una biopsia, aun cuando su técnica varíe de acuerdo a su propia experiencia. Algunos principios básicos ayudan para obtener una adecuada interpretación y evitar errores en la misma.
Iniciar con una observación de todos los fragmentos al mas bajo poder del microscopio (2x o 4x), con coloración de rutina (hematoxilina & eosina) identificar la preservación o no de su arquitectura, o la presencia de lesiones focales es la forma ideal de iniciar el estudio de una biopsia. La identificación de venas hepáticas terminales o vena central y el tejido hepático que lo rodea es la clave para identificar un número importante de entidades que comprometen la zona perivenular como por ejemplo enfermedades colestásicas hepáticas, hepatitis alcohólica, esteatohepatitis; posteriormente moverse hacia los espacios porta e identificar sus estructuras, corroborar la existencia de ductos portales, y las estructuras vasculares normales o anormales, es importante observar la presencia o no de inflamación, el tipo de célula inflamatoria o de los cambios en el colágeno portal, así como las alteraciones de los ductos biliares, el daño de la placa limitante, o las alteraciones del parénquima lobulillar cualquiera que ella sea. Cada uno de los cambios observados no puede ser interpretado en forma aislada sino en conjunto con la historia clínica completa y con ayuda de técnicas especiales necesarias para complementar el análisis de una biopsia hepática.
La fijación adecuada de los tejidos es el factor preanalítico más importante para cualquier estudio patológico, dado que de esto depende la preservación morfológica así como sus proteínas nucleares cada vez más necesarias para estudios moleculares.
La fijación de rutina debe ser con formol buferado neutro al 10%, una biopsia trucut requiere como mínimo entre 2 y 4 horas de fijación. Biopsias en cuña o resecciones requieren mayor tiempo de fijación, calculando 1 mm/hora. Tejidos en fresco son necesarios para cultivos microbiológicos, o análisis bioquímico en enfermedades del metabolismo. Cortes de tejido en congelado, preservado en nitrógeno líquido o a -70 °C, son indicados para técnicas especiales de histoquímica o inmunofluorescencia como la identificación de grasas neutras o de esteatosis microvesicular, evaluación de porfirinas o vitamina A. Para estudios ultraestructurales debe fijarse un pequeño fragmento no mayor de 5 mm en glutaraldehído al 3% están un poco restringidos al estudio de errores innatos del metabolismo o identificación de algunas infecciones virales (1, 8).
TÉCNICAS DE HISTOQUÍMICA
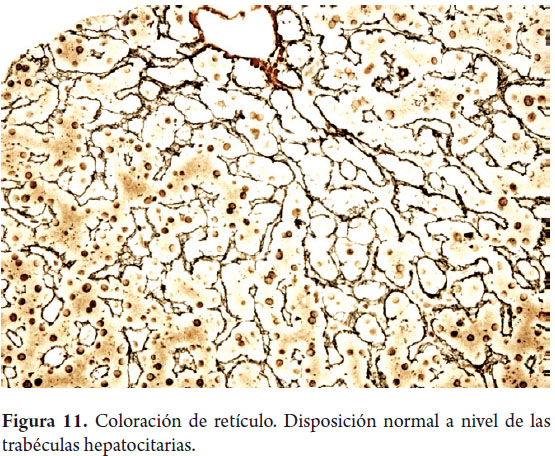
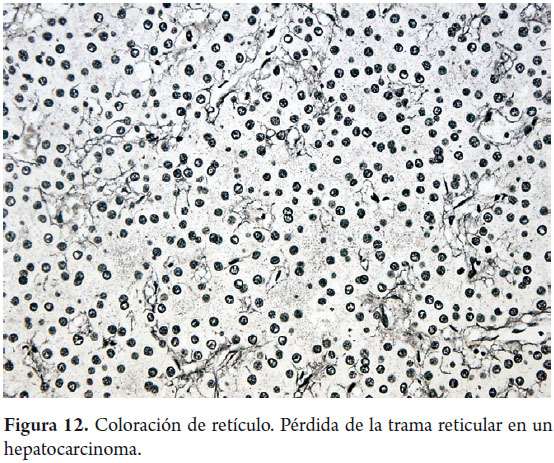
Uno de los principales objetivos de la biopsia hepática es determinar la presencia y severidad de la fibrosis. Coloraciones para tejido conectivo son las más utilizadas, el tricrómico de Masson colorea de azul el colágeno de tipo I y el retículo colorea de negro el colágeno de tipo III. La matriz extracelular está presente en condiciones normales en el colágeno de los espacios porta (figura 10) o en las paredes de las venas hepáticas grandes, es el más utilizado en la evaluación y medición de la fibrosis. El retículo normalmente delinea las trabéculas hepatocitarias (figura 11) muy útil para demostrar por ejemplo colapso, necrosis confluente, atrofia trabecular o pérdida de la trama reticular en lesiones tumorales comopor ejemplo el hepatocarcinoma (figura 12); pero no es posible diferenciar las áreas cicatriciales del colapso, por lo tanto son considerados estudios complementarios (9, 10).
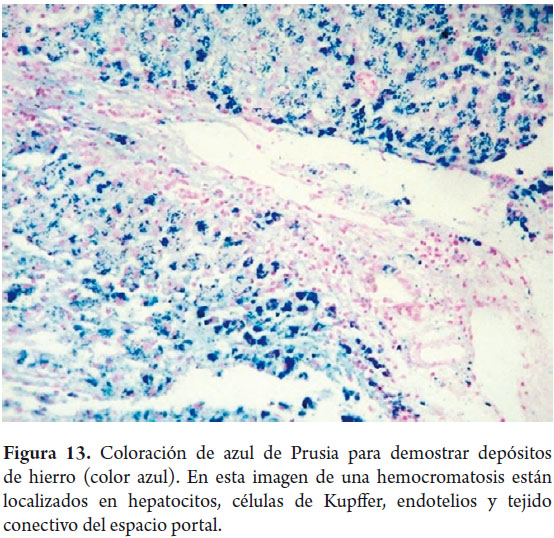
Coloración de azul de Prusia para hierro permite detectar hemosiderina, el depósito de color azul corresponde al depósito de hierro y se evalúa tanto en cantidad como en su localización, hallazgos importantes para definir posibles etiologías (figura 13); a su vez con esta coloración también se acentúan otro tipo de depósitos como la bilirrubina que da una tonalidad verde o lalipofuscina de color amarillo oro o café.
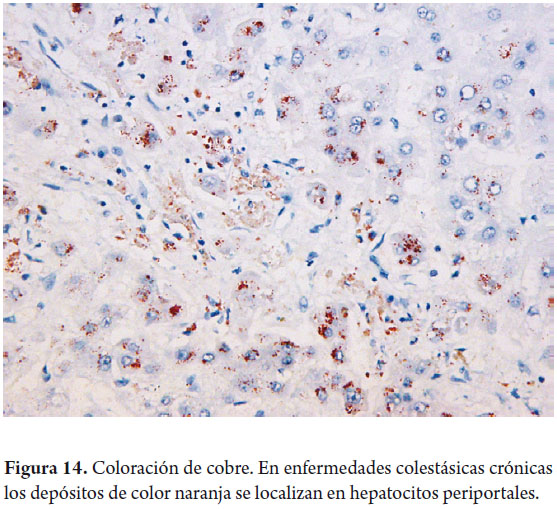
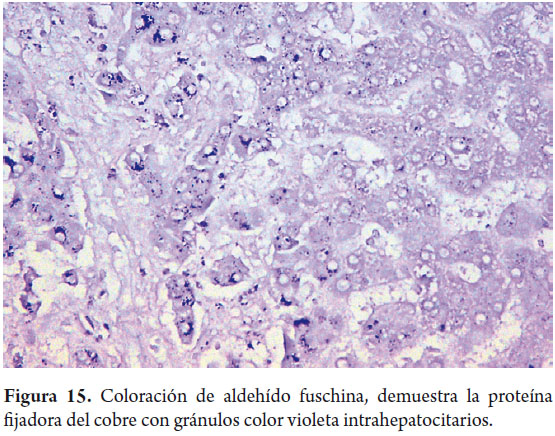
El cobre puede detectarse por métodos de rodamina o de ácido rubeánico, dando una tonalidad naranja en gránulos citoplasmáticos (figura 14). Solo puede ser detectado en tejidos fijados con formol buferado, ningún otro fijador permite su identificación. La determinación de estos depósitos es importante en el diagnóstico de la enfermedad de Wilson y en enfermedades colestásicas crónicas. La proteína fijadora del cobre puede demostrarse con la orceína, aldehído fuschina o victoria blue, estas últimas también permiten identificar depósitos de la proteína fijadora en enfermedades colestásicas (figura 15) e inclusiones en vidrio esmerilado o "groundglass" de la hepatitis B, que corresponden al antígeno de superficie.
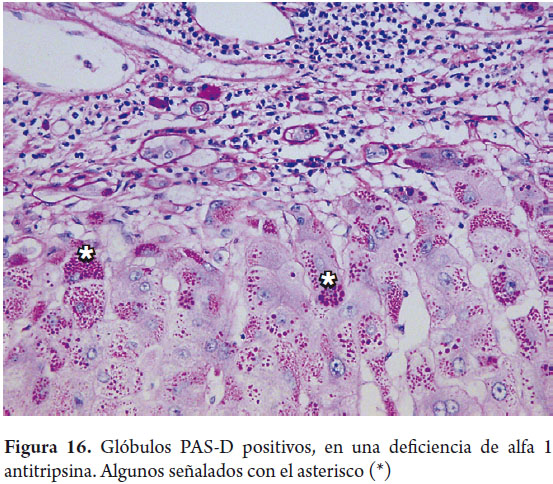
El ácido peryódico de Schiff (PAS), sin y con digestión con diastasa (PAS-D), juega un importante papel en el diagnóstico de la patología hepática. El depósito en las células de Kupffer y en macrófagos portales de lipofuschina o de material ceroide PAS positivo aparecen en focos de injuria hepatocelular reciente, ayuda a demostrar la presencia de membranas basales en ductos biliares y colangiolos, los glóbulos citoplasmáticos periportales indicativos de la deficiencia de α-1 anti tripsina son PAS positivos (figura 16). Es la coloración ideal para demostrar la presencia de glicógeno, sin embargo, la fijación con formol permite la salida del glicógeno de las células, por lo que si es necesario demostrarlo el tejido debe ser idealmente fijado en alcohol.
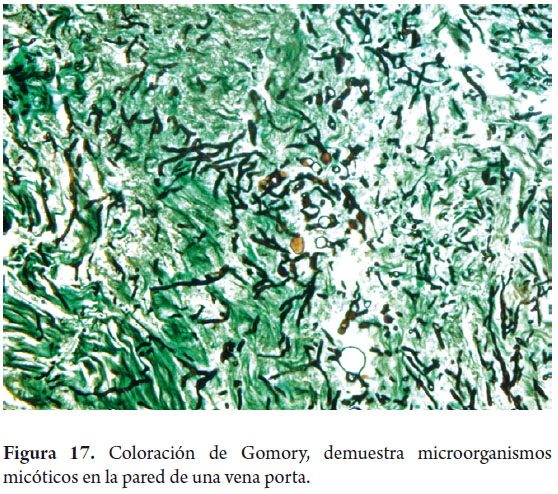
Adicionalmente a estos estudios considerados de rutina es posible realizar pruebas histoquímicas para microorganismos (bacterias, hongos) (figura 17), amiloide, fibrina o cualquier otra que el caso así lo amerite (10).
LAS TÉCNICAS DE INMUNOHISTOQUÍMICA
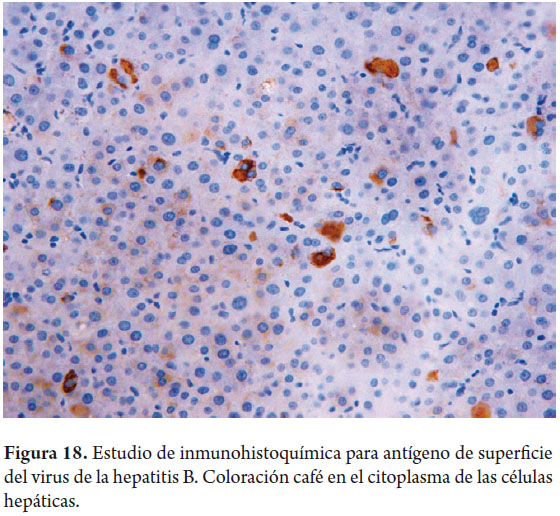
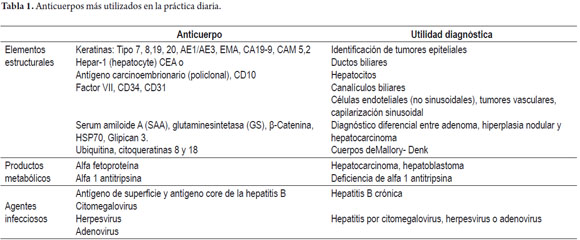
Son actualmente procedimientos de rutina en la práctica de los laboratorios de patología. En la actualidad, uno de los mayores roles de la inmunohistoquímica se da en la fenotipificación de las neoplasias hepáticas primarias y metastásicas (11, 12). También resulta útil para subtipificar el adenoma hepático con base en la expresión inmunohistoquímica de sus mutaciones, útil también en el diagnóstico diferencial con el hepatocarcinoma bien diferenciado y la hiperplasia nodular focal (13, 14). Para demostrar la presencia de ductos biliares en especial cuando nos enfrentamos a enfermedades con disminución o ausencia de los mismos, para confirmar presencia de microorganismos o inclusiones virales, de glóbulos de α1 antitripsina, antígeno de superficie (figura 18) o core del virus de la hepatitis B, entre otros (11, 12). En la tabla 1 se ejemplifican algunos de los anticuerpos más utilizados en la práctica diaria.
TÉCNICAS MOLECULARES
Se dividen en dos tipos, aquellas basadas en hibridización "in situ" (ISH), cromogénica (CISH) o fluorescente (FISH) y las técnicas "ex situ" que requieren la extracción preliminar de la molécula blanco, al obtener componentes celulares con suficiente ADN o RNA, que puedan ser amplificados usando técnicas de PCR (reacción en cadena de la polimerasa). La eficiencia de la extracción La fijación adecuada es fundamental dado que la calidad e integridad de los ácidos nucleicos depende de ella, así como la eficiencia de la extracción es inversamente proporcional al tiempo de fijación, por lo que los procesos defijación deben estar muy bien estandarizados. La técnicas in situ son especialmente utilizadas para la detección del virus del Epstein Barr (EBV RNA) en el diagnóstico de los desórdenes linfoproliferativos postrasplante, CMV u otras subproteínas, o en el diagnóstico de patologías tumorales. Los test moleculares incluyen pruebas de clonalidad, análisis de mutaciones, hibridización genómica comparativa, entre otros (1, 14).
REFERENCIAS
1. Burt A, Portmann B, Ferrel L. MacSween's Pathology of the Liver. Sixth edition. Churchill Livingstone Elsevier 2012. [ Links ]
2. Scoazec JY, Feldman G. In Situ phenotyping study of endotelial cells of the human hepatic sinusoid: results and functional implications. Hepatology 1991; 14: 789-97. [ Links ]
3. Asahina K. Hepatic stellate cell progenitor cells. J Gastroenterol Hepatol 2012; 27 Suppl. 2: 80-4. [ Links ]
4. Reid LM, Fiorino AS, Sigal SH, et al. Extracellular matrix gradients in the space of Disse: relevance to liver biology. Hepatology 1992, 15: 1198-1203. [ Links ]
5. Enzan H, Himeno H, et al. Sequential changes in human to cells and their relation to postnecrotic liver fibrosis in massive and submassive hepatic necrosis. Virchows Arch 1995; 426: 95-101. [ Links ]
6. Eleonora Patsenker, Felix Stickel. Role of integrins in fibrosing liver diseases. Am J Physiol Gastrointest Liver Physiol 2011; 301: G425-G434. [ Links ]
7. Strazzabosco M, Fabris L. Functional anatomy of normal bile ducts. Anat Rec 2008; 291(6): 653-60. [ Links ]
8. Bonin S, Hlubek F, Benhattar J, et al. Multicentric validation study of nucleic acids extraction from FFPE tissues. Virchows Arch 2010; 457(3): 309-317. [ Links ]
9. Feldmann G. Critical analysis of the methods used to morphologically quantify hepatic fibrosis. J Hepatol 1995; 22: 49-54. [ Links ]
10. Lefkowich JH. Special Stains in diagnostic liver pathology. Sem Diagn Pathol 2006; 23: 190-198. [ Links ]
11. Roskams T. The role of immunohistochemistry in diagnosis. Clin Liver Dis 2002; 6: 571-589 [ Links ]
12. Geller SA, Dhall D, Alsabeh R. Application of immunohistochemistry to liver and gastrointestinal neoplasms: liver, stomach, colon and pancreas. Arch Pathol Lab Med 2008; 132: 409-499. [ Links ]
13. Jessica Zucman-Rossi et al. Genotype-Phenotype Correlation in Hepatocellular Adenoma: New Classification and Relationship with HCC. Hepatology 2006; 24: 515-24. [ Links ]
14. Paulette Bioulac-Sage, et al. Hepatocellular Adenoma Subtype Classification Using Molecular Markers and Immunohistochemistry. Hepatology 2007; 46: 740-748. [ Links ]











 text in
text in