Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.3 Bogotá jul./set. 2013
Manejo endoscópico de los pseudoquistes pancreáticos
Martín Alonso Gómez Zuleta, MD. (1)
(1) Profesor asistente de Gastroenterología. Departamento de Medicina Interna. Universidad Nacional de Colombia. Gastroenterólogo Hospital El Tunal. Bogotá, Colombia.
Fecha recibido: 03-10-12 Fecha aceptado: 26-06-13
Resumen
La pancreatitis aguda es una enfermedad de alta prevalencia en nuestro medio, una de sus complicaciones es la formación de pseudoquistes, algunos se reabsorben espontáneamente pero otros requieren una intervención, la cual frecuentemente se realiza por cirugía, generando gran morbimortalidad. Existen otras aproximaciones como la radiológica o la endoscópica que tienen menor morbilidad y mortalidad pero son menos conocidas en nuestro medio.
Este trabajo es una serie de casos de nuestra experiencia en el manejo de esta patología con 9 casos tratados por endoscopia, se muestran los casos brevemente, se hace una revisión del tema y se describe paso a paso el método de drenaje para que sea fácilmente aplicable por los médicos interesados en el tema.
Palabras clave
Pseudoquiste, pancreatitis aguda, endoscopia, drenaje.
El pseudoquiste pancreático (SP) es la complicación tardía más frecuente de la pancreatitis ya sea aguda o crónica, y de los pacientes que presentan un trauma pancreático. Consiste en la acumulación de líquido pancreático rico en amilasas debido a disrupción ductal que surge como consecuencia de la necrosis pancreática limitada (1-3), y que persiste por más de 6 semanas de iniciado el cuadro, característicamente está rodeado por una capa de tejido de granulación y fibroso pero sin un verdadero epitelio, la principal diferencia en comparación con los quistes pancreáticos verdaderos (4).
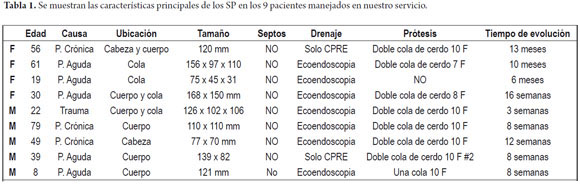
La sintomatología depende de la localización y de la extensión de la colección. Consiste en dolor abdominal, saciedad temprana, náuseas y vómito, obstrucción duodenal o de la vía biliar (ictericia), masa palpable, oclusión vascular, o formación de fistulas (1, 5). A continuación presentamos nuestra experiencia en el último año con 9 pacientes de SP (tabla 1); el promedio de edad de nuestros pacientes fue de 40,1 años (8 años el menor y 78 el mayor), 55,5% de sexo masculino, la mayoría de las lesiones se ubicaron en el cuerpo y/o la cola y en promedio midieron 119,3 mm; todas las lesiones se resolvieron por endoscopia y no se presentó recurrencia con seguimiento en promedio de 11 meses. En 2 casos el drenaje se realizó únicamente con CPRE, en los otros 7 casos se usó primero ecoendoscopia y luego CPRE.
INDICACIONES DE TRATAMIENTO
La resolución espontánea de los SP se presenta solo en 40% de los casos y usualmente en un tiempo de 3 a 6 meses; el tratamiento se indica en paciente que presente síntomas como: saciedad temprana, dolor abdominal, síndrome pilórico, ictericia, signos de infección o aumento del SP después de estas 6 semanas, independientemente del tamaño del mismo (1, 2, 4). En los pacientes asintomáticos existen indicaciones denominadas "profilácticas" (ocurren en menos de 10%), en que el paciente no tiene síntomas pero el SP comprime grandes vasos, presenta hemorragia intraquística, fístula pancreático pleural. También está indicado el drenaje en pacientes con pancreatitis crónica que además tienen litiasis pancreática ya que la tasa de resolución espontánea del SP es muy baja (0-9%) (6, 7).
DESCRIPCIÓN DE CASOS
Caso 1
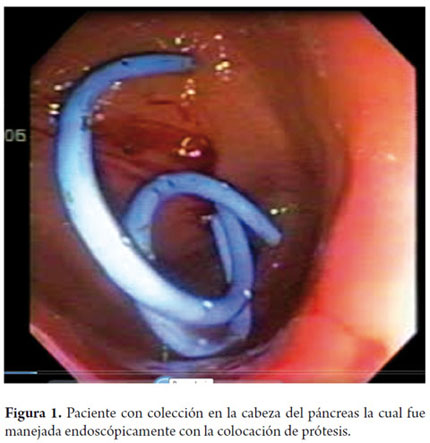
Hombre de 39 años, con cuadro clínico de 4 meses de evolución con sensación de plenitud temprana tras la ingesta, hiporexia, sensación de masa epigástrica que aumentó paulatinamente de tamaño. Como antecedente importante refiere pancreatitis biliar 9 meses antes que solo requirió manejo médico. Ingresa al servicio de urgencias por cuadro de hematemesis, se realiza endoscopia digestiva alta (EVDA) evidenciando compresión extrínseca gástrica, se toma tomografía axial computarizada (TAC) de abdomen que muestra imagen sugestiva de pseudoquiste de 139 x 82 mm sin septos. Se realiza inserción de 2 prótesis doble cola de cerdo con adecuada evolución (figura 1). Diez semanas después se realizó retiro de los mismos sin recurrencia al seguimiento a un año.
Caso 2
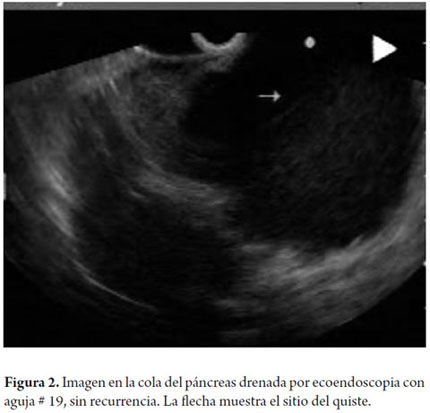
Mujer de 19 años, con antecedente de pancreatitis y colecistectomía vía laparoscópica con adecuada evolución por lo cual se da egreso de la institución, ingresa 6 meses después al servicio de urgencias por dolor abdominal epigástrico y emesis, se realiza TAC de abdomen que evidencia colección en cuerpo y cola de páncreas de 50 x 45 x 31 mm, por lo que se decide drenaje con aguja # 19 y tras adecuada evolución se da egreso 1 día después del drenaje, no ha presentado recurrencia al seguimiento a un año (figura 2).
Caso 3
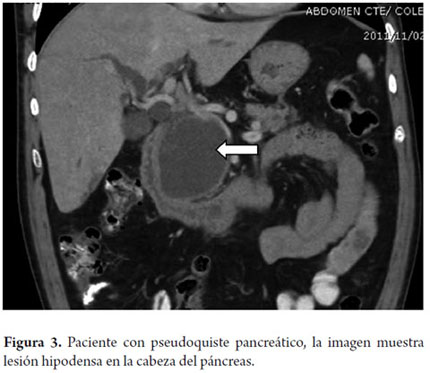
Paciente masculino de 79 años, con antecedente de pancreatitis aguda biliar, se realiza colecistectomía y posterior egreso; 2 meses después, consulta al servicio de urgencias por cuadro de emesis postprandial, dolor epigástrico y sensación de plenitud gástrica, se realiza TAC de abdomen que reporta imagen compatible con lesión quística de 110 x 110 mm (figura 3). Se realiza drenaje guiado por ecoendoscopia transgástrico colocando una prótesis doble cola de cerdo 10 Fr, con adecuada evolución, un día después se da egreso.
Caso 4
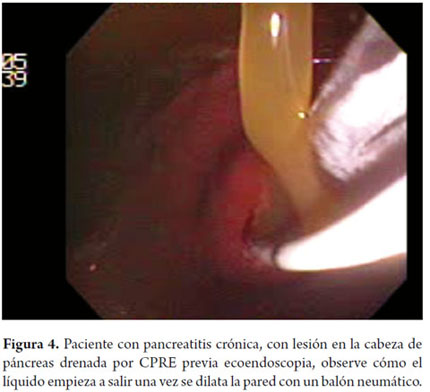
Paciente de 49 años, con antecedente de pseudoquiste pancreático que compromete cabeza pancreática, quien consulta por dolor epigástrico al servicio de urgencias. El TAC de abdomen muestra colección en cabeza de páncreas de 77 x 70 mm, posteriormente se realiza drenaje transgástrico (figura 4), con colocación de prótesis doble cola de cerdo 10 Fr con egreso 2 días después de drenaje y no recurrencia al año de seguimiento.
Caso 5
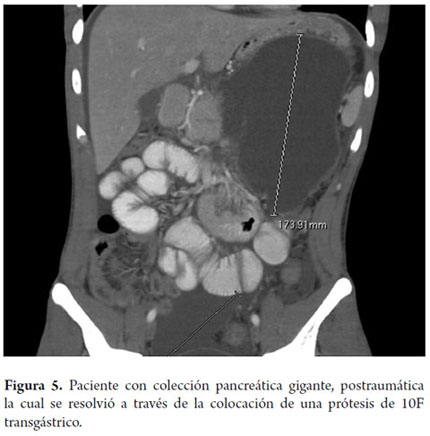
Paciente masculino de 22 años, quien ingresa a otra institución tras trauma cerrado de abdomen, elevación de amilasa, realizan TAC de abdomen que reporta colección en cuerpo y cola de páncreas de 126 x 102 x 106 mm (figura 5), EVDA muestra compresión extrínseca gástrica, por lo cual se realiza drenaje transgástrico guiado por ecoendoscopia con prótesis doble cola de cerdo 10Fr; tiene excelente evolución clínica.
Caso 6
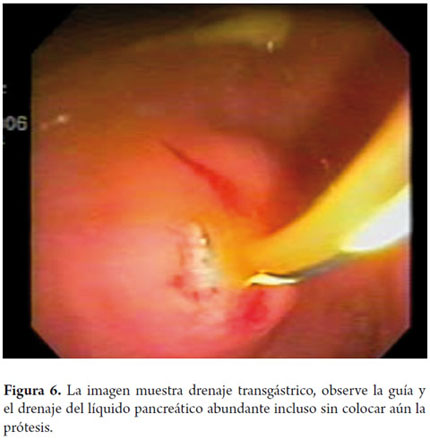
Paciente femenina, de 56 años, con antecedente de pancreatitis, el TAC de abdomen muestra pseudoquiste pancreático de 120 mm, se da manejo médico y durante la hospitalización presenta mejoría clínica y se torna asintomática, por lo cual se decide seguimiento ambulatorio, a los 11 meses presenta nuevamente síntomas y aumento de pseudoquistes; se realiza EVDA sin evidencia de compresión gástrica extrínseca, ecoendoscopia muestra lesión anecoica en páncreas de 120 mm de diámetro comprimiendo cabeza y cuerpo; se realiza drenaje transgástrico (figura 6) guiado por fluoroscopia con prótesis doble cola de cerdo 10 Fr, se da egreso un día después y no ha presentado recurrencia en su seguimiento a 6 meses.
Caso 7
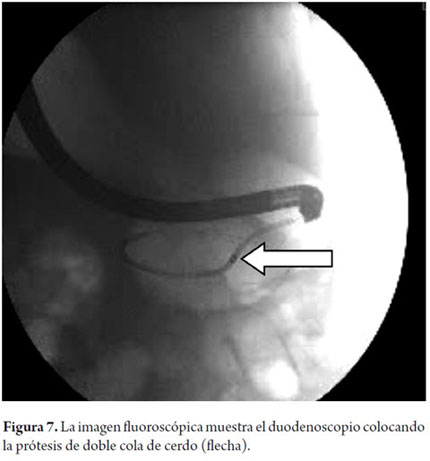
Mujer de 61 años, con antecedente de pancreatitis aguda severa 8 meses antes, con formación de pseudoquiste pancreático, controlada por la consulta externa, y se decide hospitalización para drenaje por desarrollo de sintomatología (dolor epigástrico), con ecografía de abdomen que muestra colección de 156 x 97 x 110 mm, se realiza drenaje transgástrico guiado por ecoendoscopia con prótesis 7Fr (no se disponía de otros diámetros), con adecuada evolución y egreso hospitalario 2 días después (figura 7).
Caso 8
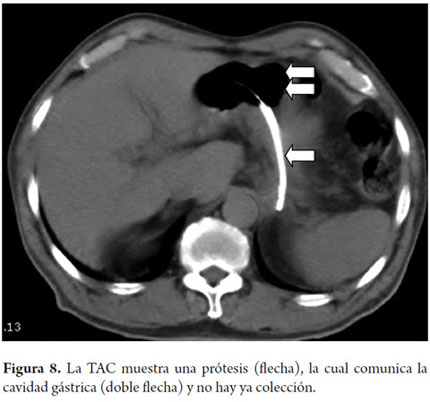
Mujer de 30 años, multigestante, con embarazo de 10 semanas, con antecedente de pancreatitis aguda (1 mes), posteriormente masa epigástrica de crecimiento progresivo, asociado a dolor epigástrico, emesis postprandial, por lo cual ingresa a la institución, se realiza ecografía abdominal que reporta colección hipoecoica de 168 x 150 mm en relación con el cuerpo y la cola del páncreas, se realiza drenaje transgástrico guiado por ecoendoscopia con prótesis doble cola de cerdo 8 Fr; a las 26 semanas la paciente tiene un parto normal y se toma una TAC abdominal 6 meses después en la cual se observa la prótesis y no hay recidiva del quiste (figura 8).
Caso 9
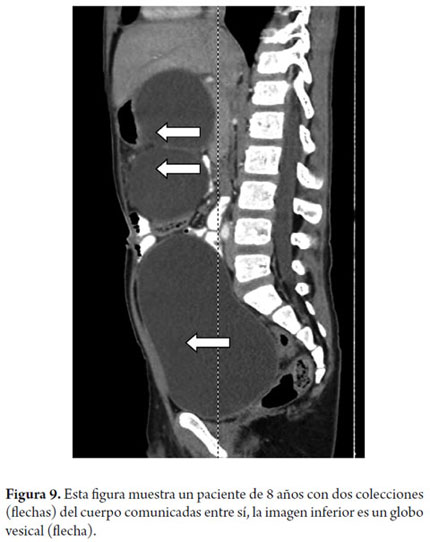
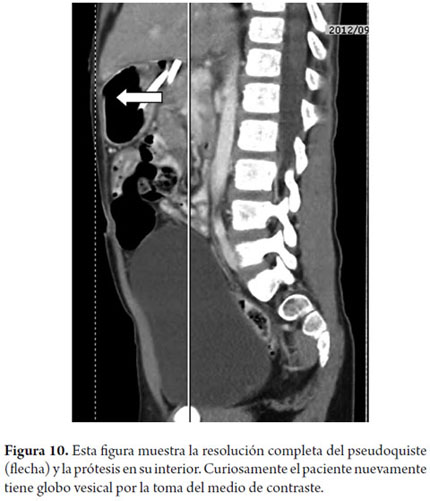
Niño de 8 años de edad que sufre un trauma cerrado de abdomen con pancreatitis aguda severa la cual lo obliga a permanecer 3 semanas en la unidad de cuidado intensivo solo con tratamiento médico. Dos meses posteriores al trauma continúa con saciedad temprana y dolor abdominal por lo que se realiza una TAC de control encontrando dos colecciones gigantes (121 mm) en la cabeza y cuerpo del páncreas que están comunicadas (figura 9). Por la sintomatología se realiza un drenaje transgástrico guiado por ecoendoscopia y se deja una prótesis de 10F con una sola cola de cerdo, la evolución del niño fue muy buena y el TAC control a los 3 meses no evidencia lesión remanente (figura 10) por lo cual se retira la prótesis. Luego de 6 meses de seguimiento no hay recidiva de la lesión y el paciente permanece asintomático.
DISCUSIÓN
Dentro de las opciones de tratamiento para los pacientes con SP está el drenaje percutáneo, quirúrgico o endoscópico, siendo este último aquel con mayores tasas de éxito inicial (90%), con resolución en 70 a 80% de los casos, y una tasa de recurrencia entre 10 y 15%; estas tasas se pueden ver disminuidas en casos de necrosis pancreática, en donde los residuos sólidos interfieren con el adecuado drenaje (6, 8, 9). El tratamiento endoscópico se realiza a través de dos métodos diferentes, por estómago o duodeno (drenaje transmural) o a través de la papila (transpapilar), aunque se pueden realizar combinaciones de los dos métodos. El drenaje a través de la papila aunque tiene menos complicaciones es menos efectivo ya que es aconsejable solo en quistes menores de 5 cm y necesariamente debe existir una conexión con el Wirsung lo cual se presenta en solo alrededor de 40% de los casos (10); en nuestra serie no utilizamos esta técnica.
El éxito técnico se define como la capacidad de insertar al menos una endoprótesis entre el SP y la luz del tracto gastrointestinal (estómago o duodeno) (10, 11), o la resolución de la colección, pero no necesariamente de los síntomas (12). El éxito clínico se define como la resolución completa de los síntomas con una disminución del pseudoquiste de por lo menos 30-50% en el primer mes del tratamiento. En todos nuestros 9 casos tuvimos un éxito técnico y clínico de 100% por el método endoscópico (11).
Existen muchos estudios que soportan la superioridad del tratamiento endoscópico cuando se compara con el quirúrgico; en una serie reciente que comparó las dos técnicas, la endoscópica fue superior a la cirugía en términos de costo, duración de la estancia hospitalaria y calidad de vida (13). En otra revisión que incluyó 787 pacientes la morbilidad fue similar (13,3% vs. 16,0%, respectivamente) y recurrencia a largo plazo del pseudoquiste (10,7% vs. 9,8%, respectivamente), pero se presentó menor mortalidad con el método endoscópico (0,2% frente a 2,5%, respectivamente) (14).
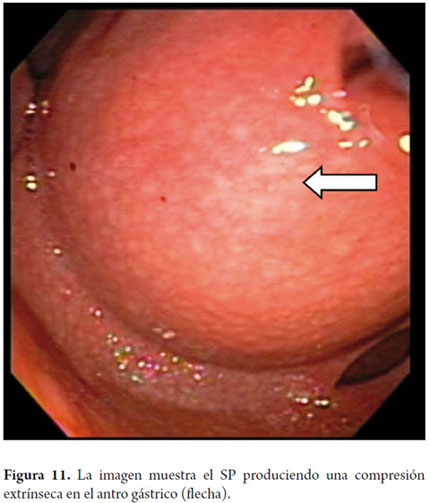
Usualmente se considera que si el pseudoquiste "abomba" o protruye en la cavidad gástrica o el duodeno se pude drenar sin la guía de la ecoendoscopia la cual se reserva solo para los casos donde no se produzca compresión sobre la luz; sin embargo, nuestro grupo considera que todos los pacientes con SP deberían ser drenados con o previa ecoendoscopia dado que siempre existe el riesgo que tenga un vaso en la pared gástrica que separa la colección, además estas lesiones son muy dinámicas y es probable que se puedan romper en el curso de su evolución lo cual se puede detectar con la ecoendoscopia como nos sucedió recientemente en un caso de una niña de 9 años enviada para drenaje, en donde una RNM (figura 11) realizada 8 días antes señalaba el pseudoquiste pero cuando lo evaluamos para su drenaje observamos que se había roto a la cavidad generando una ascitis pancreática. Además, en SP pequeños que requieren drenaje (5 cm) muchas veces es suficiente su aspiración completa con una aguja # 19 guiada por ecoendoscopia. Si elegimos la ruta endoscópica es recomendable hacer el drenaje transduodenal sobre el gástrico si los dos son factibles, también según recomendaciones de la ASGE, se prefiere insertar prótesis de 10F de doble cola de cerdo los cuales tienen menos complicaciones que la prótesis recto, si es posible se deben colocar dos prótesis ya que tienen menos recurrencias que cuando se coloca una sola. El control del paciente se debe hacer a los 2 meses con un TAC y si no hay evidencia de colección remanente se procede a su retiro endoscópico. En nuestra serie la mayoría de los pacientes se resolvió entre 2 y 3 meses y solo un caso requirió dos prótesis.
Una revisión que evaluó 7 estudios en 121 pacientes comparó la cistoduodenostomía (transduodenal) con la cistogastrostomía (transgástrico) y mostró que el éxito a largo plazo fue mayor con el abordaje transduodenal (59/71 [83,1%] frente a 32/50 [64,0%], p = 0,019), con una morbilidad idéntica (10%) (15). Esto podría estar relacionado con una mayor permeabilidad de la fístula cistoduodenal comparada con la cistogástrica que se forma (16, 17), pero en nuestra experiencia es más difícil abordar el duodeno que la cavidad gástrica dada la dificultad para posicionar el equipo.
¿CUÁL ES NUESTRA TÉCNICA?
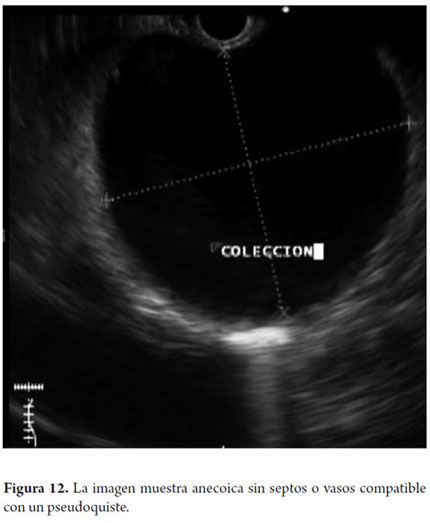
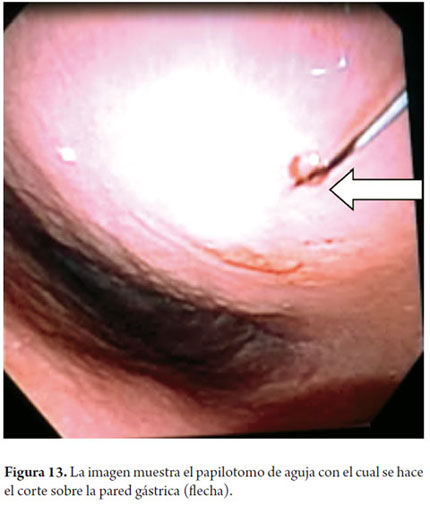
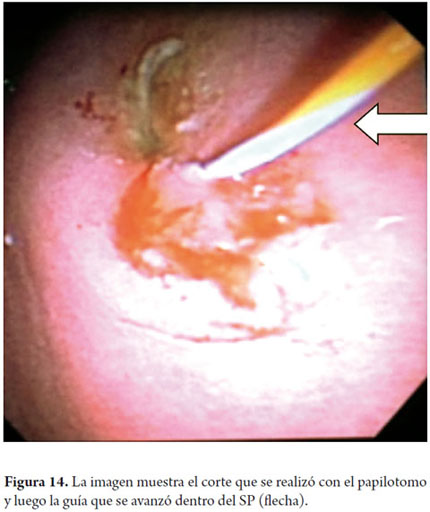
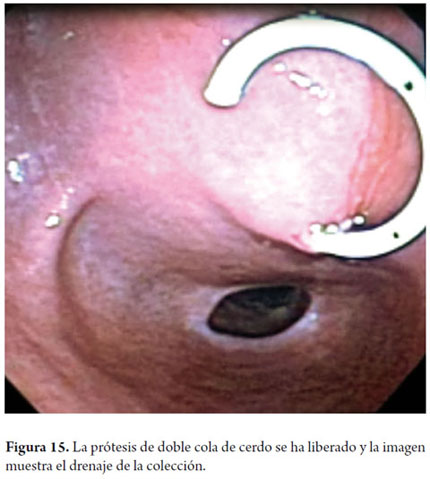
A continuación describiremos la técnica que venimos utilizando en nuestro servicio desde hace aproximadamente 5 años; el paciente bajo sedación guiada por anestesiólogo se coloca en decúbito lateral izquierdo, posteriormente pasamos el ecoendoscopio, ubicamos el pseudoquiste (figura 11) y se evalúa la pared que lo separa de la luz gástrica midiendo su grosor y colocándole la señal Doppler para descartar presencia de vasos (figura 12); una vez se ubica el sitio elegido marcamos esta área con una pinza de biopsia (o también se puede colocar tinta china) posteriormente retiramos el ecoendoscopio y cambiamos por el duodenoscopio ya que consideramos que este equipo permite una mejor angulación para el drenaje. Luego se pasa un papilotomo de aguja con guía, con corriente de coagulación a 30V se perfora la pared (figura 13), una vez se logre la entrada al SP se avanza la guía controlada por fluoroscopia (no es estrictamente necesario, hemos drenado algunos casos en la sala de endoscopia) con el mismo papilotomo se amplía el orificio con el corte de coagulación a 2 ó 3 mm de diámetro (figura 14) para permitir el paso de la prótesis (este paso se puede hacer con un balón de dilatación biliar (pero es más costoso) luego se retira el papilotomo y se avanza la prótesis (figura 15), luego se canula nuevamente el orificio y con el mismo método se pone otra prótesis. Debe colocarse prótesis tipo doble cola de cerdo 10 Fr y posterior al examen se coloca ampicilina sulbactam 1,5 gr oral cada 6 horas y fluconazol 1 tableta al día por 5 días (8, 9). Por las elevadas tasas de recurrencia, las prótesis deben permanecer in situ durante aproximadamente 8 semanas, al cabo de las cuales se toma un TAC abdominal y si no hay lesión residual se procede a retirar la prótesis (4).
Las complicaciones se presentan en relación al procedimiento o a la inserción de la prótesis, el sangrado es una de las complicaciones más temidas, que puede requerir escleroterapia o cirugía; las complicaciones del drenaje transpapilar se relacionan con la realización de CPRE como son pancreatitis, bacteriemia o formación de abscesos, en cuanto a las prótesis la principal complicación es la oclusión y la migración (9).
En conclusión, la terapia endoscópica para el drenaje de pseudoquiste pancreáticos es un procedimiento mínimamente invasivo, efectivo y seguro, el cual puede realizarse incluso de manera ambulatoria. En nuestra serie no se presentaron complicaciones ni recurrencias en el tiempo de seguimiento, por lo cual consideramos que es el procedimiento de elección para el manejo de estos pacientes, reservando la cirugía solo para casos fallidos por endoscopia, o aquellos en los cuales el procedimiento esté contraindicado.
REFERENCIAS
1. Douglas A Howell, Raj J Shah, Christopher Lawrence. Diagnosis and management of pseudocysts of the pancreas, Uptodate, junio 2011. [ Links ]
2. Todd H. Baron. Treatment of Pancreatic Pseudocysts, Pancreatic Necrosis, and Pancreatic Duct Leaks. Gastrointest Endoscopy Clin N Am 2007; 17: 559-579. [ Links ]
3. Steven D Freedman. Complications of chronic pancreatitis, Uptodate, Nov 2008. [ Links ]
4. Cheruvu CV, Clarke MG, Prentice M, Eyre-Brook IA. Conservative treatment as an option in the management of pancreatic pseudocyst. Ann R Coll Surg Engl 2003; 85: 313. [ Links ]
5. Ignacio Esquivel Ledesma. Drenaje abierto de pseudoquiste pancreático. Revista de Especialidades Médico-Quirúrgicas 2011; 16(4): 256-259. [ Links ]
6. Douglas A Howell, Raj J Shah. Endoscopic management of pseudocysts of the pancreas: Efficacy and complications, Uptodate Oct 2010. [ Links ]
7. William H. Nealon, Eric Walser. Main Pancreatic Ductal Anatomy Can Direct Choice of Modality for Treating Pancreatic Pseudocysts (Surgery Versus Percutaneous Drainage). Annals of surgery 2008; 235: 751-758. [ Links ]
8. Güitrón-Cantú A, Adalid-Martínez R, Gutiérrez-Bermúdez J. Drenaje de seudoquistes pancreáticos por vía transpapilar o transmural, Rev Gastroenterol Mex 2005; 5: 38-45. [ Links ]
9. Aghadassi A, Mayerle J, Kraft M, Sielenkämper A. Pancreatic pseudocysts-when and how to treat? HPB (Oxford) 2006; 8: 432-441. [ Links ]
10. Cahen D, Rauws E, Fockens P, et al. Endoscopic drainage of pancreatic pseudocysts: long-term outcome and procedural factors associated with safe and successful treatment. Endoscopy 2005; 37: 977–983. [ Links ]
11. Park DH, Lee SS, Moon SH, et al. Endoscopic ultrasound-guided versus conventional transmural drainage for pancreatic pseudocysts: a prospective randomized trial. Endoscopy 2009; 41: 842-848. [ Links ]
12. Hookey LC, Debroux S, Delhaye M, et al. Endoscopic drainage of pancreatic-fluid collections in 116 patients: a comparison of etiologies, drainage techniques, and outcomes. Gastrointest Endosc 2006; 63: 635-643. [ Links ]
13. Varadarajulu S, Trevino J, Wilcox CM, et al. Randomized trial comparing EUS and surgery for pancreatic pseudocyst drainage. Gastrointest Endosc 2010; 71: AB116-AB116. [ Links ]
14. Rosso E, Alexakis N, Ghaneh P et al. Pancreatic pseudocyst in chronic pancreatitis: endoscopic and surgical treatment. Dig Surg 2003; 20: 397-406. [ Links ]
15. Beckingham IJ, Krige JE, Bornman PC, et al. Endoscopic management of pancreatic pseudocysts. Br J Surg 1997; 84: 1638-1645. [ Links ]
16. Funnell IC, Bornman PC, Krige JE, et al. Endoscopic drainage of traumatic pancreatic pseudocyst. Br J Surg 1994; 81: 879-881. [ Links ]
17. Cremer M, Deviere J, Engelholm L. Endoscopic management of cysts and pseudocysts in chronic pancreatitis: long-term follow-up after 7 years of experience. Gastrointest Endosc 1989; 35: 1-9. [ Links ]











 texto en
texto en