Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.3 Bogotá July/Sept. 2013
Perfil microbiológico de la peritonitis bacteriana espontánea en una ciudad del sur de Brasil
Mariana do Amaral Ferreira, MD. (1), Gabriela Bicca Thiele, MD. (1), Maíra Luciana Marconcini, MD. (1), Esther Buzaglo Dantas-Correa, MD, PhD. (1), Leonardo de Lucca Schiavon, MD, PhD. (1), Janaína Luz Narciso-Schiavon, MD, PhD. (1)
(1) Núcleo de Estudios en Gastroenterología y Hepatología (NEGH) de la Universidad Federal de Santa Catarina (UFSC). Florianópolis, Santa Catarina, Brasil.
Fecha recibido: 07-05-13 Fecha aceptado: 26-06-13
Resumen
Introducción: La peritonitis bacteriana espontánea (PBE) es una de las complicaciones infecciosas más frecuentes que afectan a los pacientes con cirrosis y ascitis descompensadas, la cual presenta un alto índice de mortalidad. Objetivo: Identificar los principales agentes causantes de la PBE en un Hospital Universitario entre los años 2008 y 2011. Métodos: Se llevó a cabo un estudio transversal de resultados positivos de cultivos de líquido ascítico. Se obtuvieron variables clínicas y de laboratorio de los registros médicos.
Resultados: Se incluyeron 47 pacientes de 55,7 ± 15,5 años de edad con cultivos positivos de líquido ascítico, de los cuales 70,2% eran hombres y 53,6% presentaba cirrosis. Todos los pacientes cirróticos presentaron GASA ≥ 1,1 y conteo promedio de neutrófilos en el líquido ascítico de 3.260,8 ± 5.122,9 células. El microbio encontrado más frecuentemente fue el Escherichia coli (25,5%), seguido por el Klebsiella (14,9%), el Enterococcus (8,5%) y el Streptococcus (8,5%). No se observaron diferencias significativas cuando se compararon los pacientes cirróticos con los no cirróticos respecto a la prevalencia del E. coli (19,2% vs. 33,3%; p= 0,270), Klebsiella (19,2% vs. 9,5%; p= 0,436), Enterococcus (7,7% vs. 9,5%; p= 1,000) y Streptococcus (15,4% vs. 0,0%; p= 0,117). La presencia de infección causada por dos o más microbios es más común entre las personas sin cirrosis (11,5% vs. 38,1%; p= 0,047).
Conclusión: El perfil microbiológico de los cultivos de líquido ascítico de este hospital es similar al de otros estudios relacionados con el PBE, con prevalencia de bacterias Gram negativas.
Palabras clave
Cirrosis hepática, peritonitis, líquido ascítico.
INTRODUCCIÓN
La peritonitis bacteriana espontánea (PBE) es una complicación infecciosa frecuente que afecta a pacientes con cirrosis y ascitis (1) descompensadas. Esta enfermedad se caracteriza por una infección del líquido ascítico sin evidencia de una perforación visceral y un foco inflamatorio intraabdominal. Por ejemplo, hay pancreatitis aguda o colecistitis (2-4). La PBE normalmente se produce en la etapa final de las enfermedades del hígado y presenta una alta tasa de recurrencia, aproximadamente 70% en un año (5-7). Además de la cirrosis descompensada, hay otros factores que predisponen a la PBE, los cuales incluyen ictericia, desnutrición y hemorragia digestiva alta (8). Algunos estudios también sugieren una alta mortalidad hospitalaria de los pacientes con cirrosis y ascitis (20% a 40%) (9, 10). Sin embargo, esta tasa ha disminuido en las últimas cuatro décadas gracias al diagnóstico temprano y al uso inmediato de antibioterapia adecuada (11).
Los criterios para el diagnóstico de PBE requieren que se realice paracentesis y se analice el líquido ascítico. El cultivo bacteriano debe ser positivo o el recuento de neutrófilos (polimorfonucleares) en este líquido debe exceder 250 células/mm3 (12). Las manifestaciones clínicas son inespecíficas. Los signos y síntomas más frecuentes son: fiebre, dolor abdominal, encefalopatía hepática, dolor o descompresión abdominal repentina, diarrea, íleo paralítico e hipotermia. Normalmente, la PBE se sospecha cuando el paciente comienza a mostrar signos de encefalopatía hepática o drástica disminución de la función renal, sin que haya ningún factor desencadenante. Aproximadamente 10% de los pacientes con PBE no presenta signos o síntomas (13-16).
La translocación bacteriana a través de la cavidad intestinal a los ganglios linfáticos mesentéricos debe ser el principal mecanismo para el desarrollo de la bacteriemia, la cual precede a las manifestaciones de la PBE. En los individuos con cirrosis hay tres mecanismos implicados en la patogénesis de esta infección: respuesta inmune local deficiente (disminución de la actividad fagocítica de los macrófagos hepáticos), crecimiento excesivo de bacterias en el lumen intestinal, y alteraciones funcionales y estructurales sobre la barrera mucosa intestinal (14, 17). La mayoría de los microorganismos responsables de PBE se derivan de la flora intestinal, principalmente las bacterias aeróbicas Gram negativas. Escherichia coli y Klebsiella pneumoniae son los agentes aislados más frecuentes (18-20). En aproximadamente 25% de los casos, se encuentran bacterias Gram positivas como Streptococcus y Enterococcus. El Streptococcus pneumoniae es el más comúnmente encontrado (21, 22). Por otro lado, las bacterias anaeróbicas nunca son la causa de la PBE, debido a su incapacidad para moverse sobre la mucosa intestinal, y a los altos niveles de oxígeno en la pared intestinal (23).
Con base en las consideraciones anteriores, este estudio tiene como objetivo identificar los microorganismos que se encuentran en cultivos de líquido ascítico y describir las características clínicas relacionadas con la presencia de infecciones del líquido ascítico en pacientes con cirrosis.
MÉTODOS
Casuístico
Entre enero del 2008 y diciembre del 2011 se llevó a cabo un estudio transversal de resultados positivos de cultivos de líquido ascítico en el laboratorio de microbiología del Hospital Polydoro Ernani de São Thiago Universitario de la Universidad Federal de Santa Catarina (UFSC). Se excluyeron los pacientes con datos incompletos en sus historias clínicas, y solo se incluyó el primer cultivo de los que presentaron más de un resultado positivo.
El protocolo de este estudio cumple con las normas éticas de la Declaración de Helsinki y fue aprobado por el Comité de Ética sobre Investigación en Seres Humanos del UFSC (Certificado N. 948).
Métodos
Se revisó la información sobre todos los individuos sometidos a paracentesis y que habían obtenido resultados positivos en el cultivo del líquido ascítico. Las variables clínicas, demográficas y de laboratorio se obtuvieron de los informes médicos. Se estudiaron las siguientes variables: edad (años), género, duración de la estancia (días); microbios aislados en cultivos, serologías positivas para HBsAg, anti-VHC y anti-VIH, creatinina, hemoglobina, conteo de plaquetas, aspartato aminotransferasa (AST), alanina aminotransferasa (ALT), fosfatasa alcalina (AP), gamma glutamiltransferasa (GGT), albúmina sérica, bilirrubina, razón internacional normalizada (RIN) y la actividad de protrombina (PA). Los exámenes bioquímicos hepáticos AST, ALT, FA y GGT fueron expresados a veces al límite superior de la normalidad (xULN). Las otras variables se expresaron en valores absolutos. La bilirrubina, la RIN y la creatinina se utilizaron para encontrar el MELD (Modelo para la enfermedad hepática terminal) (24) en individuos con cirrosis. Solo las pruebas de laboratorio realizadas dentro de los seis meses siguientes al desarrollo del cultivo fueron incluidas en este estudio. Estos cultivos fueron recogidos y sellados al lado de la cama en frascos de hemocultivos (BacT / ALERT ® bioMérieux) o recogidas en tubos secos y sellados en el laboratorio en Blood Agar, MacConkey Agar y Thioglycollate Broth.
Análisis estático
Las variables continuas fueron descritas con medidas de tendencia central y de dispersión, mientras que las variables categóricas se describieron con números absolutos y proporciones. Las variables continuas se compararon mediante la prueba Student's t o mediante la Mann-Whitney según fuera lo adecuado, y las variables categóricas se evaluaron mediante la prueba Chi-squared o la prueba exacta de Fisher, según correspondiera. Los valores de p menores de 0,05 se consideraron estadísticamente significativos. Todas las pruebas fueron de dos colas y se llevaron a cabo utilizando Statistical Package for Social Science software, versión 17.0 (SPSS, Chicago, IL, EE.UU.).
RESULTADOS
Examen caso por caso
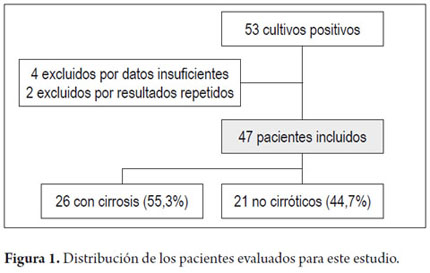
Entre enero de 2008 y diciembre de 2011 se evaluaron 660 cultivos de líquido ascítico, entre los cuales 53 (8,03%) resultaron positivos y fueron evaluados para su inclusión en el estudio. Cuatro cultivos fueron excluidos por tener registros médicos insuficientes y otros dos por presentar resultados reactivos repetidamente (figura 1).
Un total de 47 pacientes presentaron cultivos de líquido ascítico positivo, con una desviación estándar de 55,7 ± 15,5 (55,0) años en promedio de edad, de los cuales 70,2% eran hombres y 26 pacientes (55,3%) tenían cirrosis.
Las patologías más comúnmente encontradas entre los pacientes no cirróticos fueron apendicitis aguda, insuficiencia renal crónica, diálisis y colecistitis aguda.
Entre los individuos con cirrosis, la media del puntaje MELD fue de 16,3 ± 9,3 y el puntaje GASA fue 1,6 ± 0,7 y todos presentaron GASA ≥ 1,1. En cuanto a la albúmina y el conteo de los neutrófilos en el líquido ascítico de este grupo, la media, la desviación estándar y la mediana fueron 0,3 ± 0,2 (0,3) g/dl y 3.260,8 ± 5.122,9 (892) células respectivamente. No se observaron diferencias cuando se compararon la mediana de los neutrófilos del líquido ascítico de pacientes cirróticos con las infecciones producidas por uno o más microbios (892,0 vs. 322,5; P = 0,407).
Evaluación de los pacientes incluidos de acuerdo con el diagnóstico de cirrosis
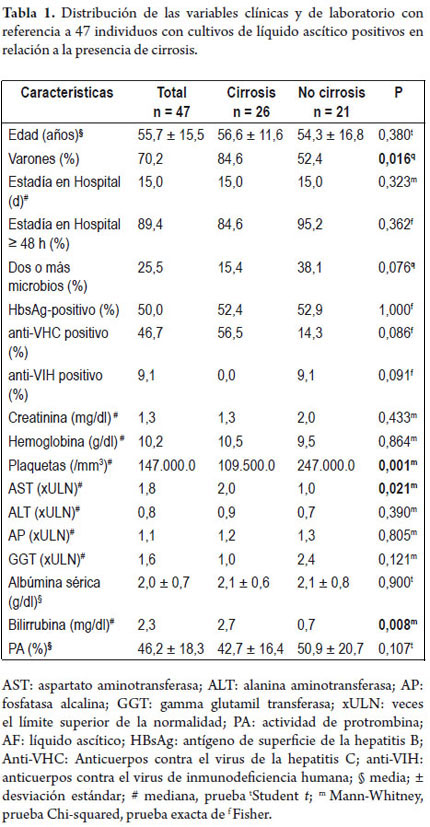
Al comparar los pacientes con cirrosis hepática con otros (tabla 1), observamos una mayor proporción de varones (84,6% vs. 52,4%; p= 0,016), mayor mediana de AST (2,0 vs. 1,0 xULN; p= 0,021) y bilirrubina (2,7 vs. 0,7 g / dl; p= 0,008) y menor mediana de plaquetas (1.095.000 vs. 2.470.000 / mm3; p= 0,001). No se encontraron las diferencias de acuerdo a edad, duración de estadía en el hospital, infección producida por uno o varios microbios, resultados positivos de HBsAg, anti-VHC o anti-VIH. Respecto a las variables laboratoriales, no se encontraron diferencias en cuanto a la creatinina, hemoglobina, plaquetas, ALT, AP, GGT, albúmina y los valores de PA.
Evaluación de los resultados de cultivos de acuerdo a la presencia de cirrosis
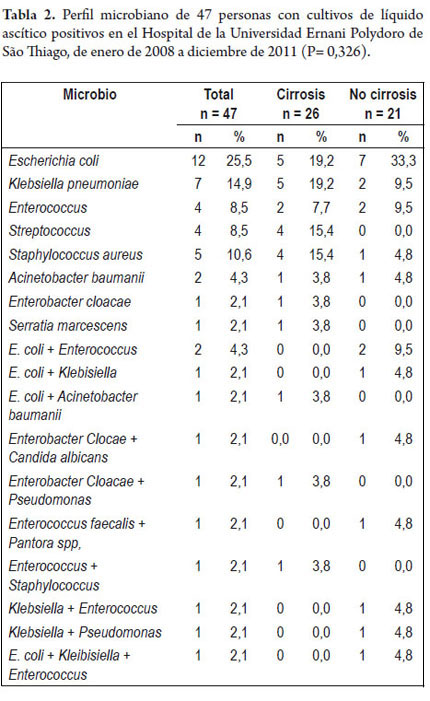
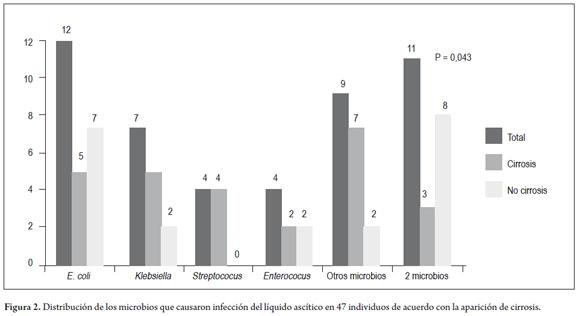
Escherichia coli (25,5%) fue el microbio más frecuentemente encontrado, seguido por Klebsiella (14,9%), Enterococcus (8,5%) y Streptococcus (8,5%). El perfil microbiano detallado se describe en la tabla 2. Al comparar la frecuencia de estos microbios en los cultivos de líquido ascítico de pacientes cirróticos con otros microbios (figura 2), no fue posible observar grandes diferencias en la prevalencia de E. coli (19,2% vs. 33,3%; p= 0,270), Klebsiella (19,2% vs. 9,5%; p = 0,436), Enterococcus (7,7% vs. 9,5%; p= 1.000) y Streptococcus (15,4% vs. 0,0%; p= 0,117). La infección causada por dos o más microbios fue más comúnmente encontrada en individuos sin cirrosis (p= 0,047).
DISCUSIÓN
La media de edad descrita de las personas con PBE que sufren de cirrosis oscila entre 54,3 ± 10 años de edad y 58,3 ± 13,1 años de edad (25-27), muy similar a lo que se encontró en este estudio. Sin embargo, una edad media menor fue reportada por otros autores, la cual oscila entre los 48,3 ± 1,8 y los 49 años de edad (28, 29). Mayor prevalencia entre los varones ha sido reportada por varios autores. Esta puede variar desde 52,3 hasta 78,2% 25,29, y se ha enfatizado hasta en 100% de los casos (29).
Debido a la reducción de endotoxinas y bacterias, la insuficiencia hepática resulta en una mayor susceptibilidad a las infecciones, incluso causando inmunosupresión en algunos pacientes. Aunque Shaw, et al han descrito que la PBE está vinculada a la infección VIH (Virus de inmunodeficiencia humana) en pacientes cirróticos (30), en este estudio ninguno de los pacientes con cirrosis y PBE fueron infectados con el VIH. Así mismo, se observó que entre los pacientes no cirróticos, 9% era VIH positivo, posiblemente debido a la inmunosupresión derivada del VIH, el cual es un factor de riesgo para la infección, independientemente de la presencia de cirrosis.
Este estudio muestra que los pacientes con cirrosis y PBE presentaron disfunción hepática acompañada por un bajo conteo de plaquetas, baja concentración de albúmina sérica, baja PA y alto puntaje MELD, además de la baja concentración de albúmina en el líquido ascítico. Todas estas variables se asocian con un mal pronóstico en pacientes con cirrosis (31, 32). Es claro que la PBE generalmente ocurre en pacientes con cirrosis avanzada. Cuanto más alto es el MELD del paciente, mayor es el riesgo de desarrollar infección del fluido ascítico (33). La media MELD en este estudio fue de 16,3 ± 9,3 para los pacientes cirróticos, similar a Shi, et al (27), que describen una media de MELD de 16,5 ± 5,1 e inferior a aquella presentada por Desai et al (26), de 23,8 ± 8,4. En este estudio, el bajo conteo de plaquetas fue evidente, con una media de 129.650,0 ± 97.739,0/mm3 en los pacientes cirróticos, superior a la media encontrada en otros estudios, la cual osciló entre 77.960,0 ± 48.370,0 y 109.000,0 ± 73.000,0/mm3 (27, 34). En esta investigación, la actividad media de la protrombina en pacientes con cirrosis fue 42,7 ± 16,4%, inferior a la descrita por Shi, et al de 55,4 ± 14,2% (27). La media de la albúmina sérica en pacientes con cirrosis oscila entre 2,0 ± 0,4 y 2,8 ± 0,3 g/dl (28, 34-36), similar a nuestro estudio. Solá, et al reconocieron la tendencia de una mayor incidencia de PBE en individuos con bajas concentraciones de proteínas en el líquido ascítico (37). Se detectó aquí una media de 1,0 ± 0,5 g/dl de proteínas en el líquido ascítico, similar a la encontrada por Kim, et al de 1,2 ± 1,0 g/dl (35). La albúmina del líquido ascítico se describe por los valores de 0,6 ± 0,3 g/dl y 1,0 ± 1,0 g/dl (25, 35). La media del número de neutrófilos en el líquido ascítico en los pacientes con cirrosis y PBE es compatible con la descrita en la literatura, con valores que varían entre 529 y 4.900 células/mm3 (25, 28, 34, 38).
Cuando se utilizan técnicas convencionales de diagnóstico microbiológico de la PBE, el cultivo del líquido ascítico es negativo en más de 60% de los casos, incluso en presencia de manifestaciones clínicas sugerentes (fiebre, dolor abdominal, encefalopatía inexplicable, acidosis, azotemia, hipotensión o hipotermia). Esto ocurre debido a la deficiencia en las técnicas de cultivo. La inoculación del líquido ascítico en frascos de cultivo de sangre, al lado de la cama, con al menos 10 ml de fluido, hace posible aumentar hasta 90% las posibilidades de obtener un cultivo positivo. El transporte del fluido al laboratorio sin utilizar recipientes específicos, tales como una jeringa o tubo, es también un factor que disminuye la sensibilidad de la prueba. En nuestro medio, todavía utilizamos, en gran parte, la recolección de líquido ascítico en un tubo seco, hecho que, tal vez en parte, explica por qué solo 8% de las muestras de líquido ascítico que se evaluó en el laboratorio arrojó resultados positivos (aunque sin conocer la celularidad del líquido ascítico de estas personas, hecho que no fue estimado en este estudio) (39-41).
En los Estados Unidos, Desai, et al (26) examinaron a 55 pacientes con PBE y observaron 40% de cultivos positivos, con 20% de Gram negativos y 5,5% de cultivos positivos de más de un microorganismo. Singh, et al (29) evaluaron a 61 individuos con PBE, con 42 cultivos positivos: 48% Gram positivos, 40% Gram negativos y de especies Candida en 12% de los casos. Con respecto a las bacterias encontradas, se detectó 21,4% de Escherichia coli, 16,7% de Enterococcus faecalis, 14,3% de Streptococcus viridans, 11,9% de Staphylococcus aureus, 7,1% de Klebsiella pneumoniae y 4,7% de Pseudomonas aeruginosa y, adicionalmente, un caso positivo de cada uno de los siguientes microbios Streptocococus pneumoniae, Rhodococcus spp., Klebsiella oxytoca, Enterobacter cloacae y Critrobacter freundii.
En México, Bobadilla, et al (42) evaluaron 31 casos de PBE con 14 cultivos positivos, siendo el Escherichia coli el microbio más común (71,4%), a continuación, Klebsiella pneumoniae (14,2%), Pseudomonas aeruginosa (7,1%), Streptococcus faecalis (7,1 %) y Serratia marcescens (7,1%). En Barcelona, Solà, et al (37) observaron en 13 casos, el 46,2% de Escherichia coli, 23,1% de Neumococos, el 15,4% de Klebsiella pneumoniae, 7,7% de Streptococcus viridans y 7,7% de los Staphylococcus aureus.
En una investigación en Pakistán, realizada por Kamani, et al (34) entre 44 individuos con PBE, 14,9% presentaron cultivos positivos en sangre y 23,5% presentó cultivo positivo de líquido ascítico y 72,7% fue Gram negativo. Escherichia coli fue el microorganismo más comúnmente encontrado (61,3%), seguido por el Streptocococus pneumoniae (11,3%), especies de Pseudomonas (9,0%), especies de Staphylococcus (6,8%), especies de Enterococcus (6,8%), especies de Bacillus (2,2%) y Streptococcus Grupo D (2,2%).
En Egipto, Abd Elaal, et al (36) evaluaron a 36 pacientes con PBE, de los cuales 12 presentaron cultivos positivos en el líquido ascítico. Los microbios más comúnmente encontrados en el estudio fueron Escherichia coli (75,0%), Streptococcus faecalis (16,6%) y Klebsiella pneumoniae (8,3%).
En Corea, en un estudio realizado en la ciudad de Seúl, Kim, et al (35) evaluaron a 130 pacientes con diagnóstico de PBE, entre ellos 37 (28,5%) presentaron cultivo positivo de líquido ascítico. La mayoría de las muestras recogidas fueron de entéricos Gram negativos, Escherichia coli (62,1%). También se encontraron otros microbios, respectivamente: Aeromonas (13,5%), Streptococcus (10,8%), Klebsiella pneumoniae (8,1%), y Pseudomonas en 5,4% de las muestras positivas. En otro estudio local, Song, et al (43) compararon las infecciones del líquido ascítico adquiridas en la comunidad frente a las adquiridas en el hospital. Entre octubre de 1998 y agosto de 2003, estudiaron un total de 106 pacientes con cultivos positivos de líquido ascítico y descubrieron que 32 casos de PBE fueron causados por un foco en el hospital y 74 adquiridos en la comunidad. Los bacilos Gram negativos, como Escherichia coli predominaron en ambos grupos (comunidad y hospital). En 58,5% de las muestras totales, el Escherichia coli se detectó como agente causante de la PBE, y le siguió Klebsiella pneumoniae en 11,3% de los casos. También se aislaron microbios, tales como el Streptococcus pneumoniae (7,5%), otras especies de Streptococcus (7,5%), Enterococco (5,6%), Pseudomonas aeruginosa (1,9%), Acinetobacter baumannii (5,6%) y Aeromonas hydrophila (1,9%).
En la ciudad holandesa de Rotterdam, entre de junio de 1987 y abril de 1991, Siersema, et al (38) compararon los dos métodos más frecuentemente utilizados para el cultivo de líquido ascítico: frascos de hemocultivo y el método convencional de cultivo. En este periodo, 31 casos sospechados de PBE se diagnosticaron en 28 pacientes. Al emplear el método convencional de cultivo, las muestras de líquido ascítico mostraron resultados positivos en 11 de los 31 casos de PBE (35%) contra 26 de los 31 casos (84%) mediante el uso de los viales de cultivos de sangre. En cada muestra en la que el crecimiento bacteriano no ocurrió mientras se utilizaba el método convencional, tampoco sucedió mientras se utilizaba el método de la sangre. En 26 cultivos positivos, se detectaron los bacilos Gram negativos en 17 casos (65%) y los cocos Gram positivos en 9 casos (35%). El mismo estudio aisló a Escherichia coli en 38,5% de los cultivos, Klebsiella pneumoniae (7,7%), Pseudomonas aeruginosa (7,7%), Enterobacter cloacae (3,8%), Acinetobacter sp. (3,8%), Gram negativos no especificados (3,8%), Streptococcus Alpha-hemolytic sp. (7.7%), Enterococcus faecalis (7,7%), Streptococcus pneumoniae (11,5%), Staphylococcus aureus (3,8%) y Staphylococcus epidermidis (3,8%).
Durante 20 años, en Francia, Dupeyron, et al (44) evaluaron un total de 240 casos de PBE en el periodo abril de 1977 a abril de 1997 con el fin de verificar los cambios en el perfil microbiológico de los agentes que causan la PBE. Al final del estudio, la mayoría de las infecciones del fluido ascítico fueron causadas por enterobacterias, sin ningún cambio significativo en el porcentaje al comparar con el periodo inicial al final del estudio. Se observó la prevalencia de Escherichia Coli en 43,3% de los casos, así como Klebsiella pneumoniae (10%), Estreptococcus Grupo D (7,6%), Enterococcus faecalis (6,7%), Serratia marcescens (4,6%), Staphylococcus aureus (4,6 %), Enterobacter cloacae (2,5%), Streptococcus pneumoniae (3,3%), Streptococcus (2,6) entre otros agentes. También encontraron microbios en cantidades más pequeñas tales como: Morganella morganii (0,8%), Citrobacter freundii (0,8%), Providencia stuarttii (0,4%), Pseudomonas aeruginosa (1,3%), Streptococcus pyogenes (0,8%) Streptococcus agalatiae (0,8%), Enterococcus avium (0,4%), Enterococcus faecium (0,4%), Staphylococcus coagulasa negativo (2,9%), Listeria monocytogenes (0,8%), Bacterioides (2,1%), Clostridium (1,7%), Candida albicans (0,4%), Candida glabrata (0,4%), Fusobacterium (0,4%), Aerococcus viridans (0,4%).
En São Paulo, Reginato, et al (25) evaluaron 219 pacientes con PBE y, entre los 123 individuos sometidos a cultivo, 63 (33,8%) tuvieron resultados positivos de cultivo. Como perfil microbiológico, se describió 31,7% de Escherichia coli, 7,9% de Streptococcus pneumoniae, 7,9% de Staphylococcus aureus y 7,9% de Klebsiella pneumoniae. Almeida, et al (45), en el estado de Rio Grande do Sul, han evaluado retrospectivamente individuos cirróticos con PBE cuyo cultivo del líquido ascítico fue positivo, durante dos periodos distintos: 1997-1998 y 2002-2003. En el primer periodo (1997-1998) se incluyeron 33 casos, 3 de ellos (9%) con infección polimicrobiana. Las bacterias más frecuentes fueron: Escherichia coli en 13 casos (36,1%), estafilococos coagulasa negativos en 6 (16,7%), Klebsiella pneumoniae en 5 (13,9%), Staphylococcus aureus en 4 (11,1%) y Streptococcus faecalis en 3 (8,3%). De 2002 a 2003 hubo 43 casos y 2 (5,0%) de ellos fueron con infección polimicrobiana. Las bacterias más frecuentes fueron estafilococos coagulasa negativos en 16 (35,6%), Staphylococcus aureus en 8 (17,8%), Escherichia coli en 7 (15,6%) y Klebsiella pneumoniae en 3 (6,7%). Hubo una modificación en la población bacteriana que causó la peritonitis bacteriana espontánea en los distintos periodos analizados, con predominio de bacterias Gram negativas en el primer periodo y Gram positivas en el segundo.
Los cultivos de líquido ascítico que fueron positivos para múltiples microbios pueden sugerir, además de contaminación, la presencia de peritonitis secundaria hasta una perforación intestinal. Para la aclaración del diagnóstico en estos casos, son indicados los exámenes con pruebas de imagen. En este estudio, tres individuos cirróticos presentaron PBE causada por dos microbios, y en ninguno de ellos fue confirmada la peritonitis secundaria (46).
Las muestras de individuos, con cirrosis y peritonitis bacteriana espontánea, observadas en este estudio, exhiben características similares a aquellas descritas en la literatura, no solo en relación a las características clínicas, sino también a las funciones hepáticas y el perfil microbiano del fluido ascítico. Hubo una mayor prevalencia de enterobacterias, lo cual se refleja en las características generales.
Conflictos de interés
Ninguno.
Reconocimientos
Trabajo presentado como requisito para la obtención del grado de Doctorado Médico (MD) de la Universidad Federal de Santa Catarina.
REFERENCIAS
1. Garcia-Tsao G. Bacterial infections in cirrhosis: treatment and prophylaxis. J Hepatol 2005; 42: 85-92. [ Links ]
2. Berg RD. Mechanisms promoting bacterial translocation from the gastrointestinal tract. Adv Exp Med Biol 1999; 473: 11-30. [ Links ]
3. Guarner C, Soriano G. Bacterial translocation and its consequences in patients with cirrhosis. Eur J Gastroenterol Hepatol 2005; 17: 27-31. [ Links ]
4. Moore K. Spontaneous bacterial peritonitis SBP. En Warrel DA, et al. Oxford Textbook of Medicine, 4th Edition, Oxford University Press, Vol 2. Sections 11-17; 2003. p. 739-41. [ Links ]
5. Runyon BA. Management of adult patients with ascites caused by cirrhosis. Hepatology 1998; 27: 264-72. [ Links ]
6. Navasa M, Rodes J. Management of ascites in the patient with portal hypertension with emphasis on spontaneous bacterial peritonitis. Semin Gastrointest Dis 1997; 8: 200-9. [ Links ]
7. Guarner C, Sorian G. Spontaneous bacterial peritonitis. Semin Liver Dis 1997; 1: 203-17. [ Links ]
8. Arroyo V, Ginès P, Gerbes AL, Dudley FJ, Gentilini P, Laffig G, et al. Definition and diagnosis criteria of refractory ascites and hepatorenal syndrome in cirrhosis. Hepatology 1996; 23: 164-75. [ Links ]
9. Sort P, Navasa M, Arroyo V, Aldeguer X, Planas R, Ruiz-del-Arbol L, et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med 1999; 341: 403-9. [ Links ]
10. Toledo C, Salmeron JM, Rimola A, Navasa M, Arroyo V, Llach J, Ginès A, Ginès P, Rodés J. Spontaneous bacterial peritonitis in cirrhosis: Predictive factors of infection resolution and survival in patients treated with cefotaxime. Hepatology 1993; 17: 251-7. [ Links ]
11. Genuit T, Napolitano L. Peritonitis and abdominal sepsis. E Medicine; 2004. [ Links ]
12. Hoefs JC, Canawati HN, Sapico FL, Hopkins RR, Weiner J, Montgomerie JZ. Spontaneous bacterial peritonitis. Hepatology 1982; 2: 399-407. [ Links ]
13. Levison ME, Bush LM. Peritonitis and intraperitoneal abscesses. En Mandell GL, Bennett JE, Dolin R. Principles and Practice of Infectious Diseases. 6th Edition, Elsevier, Churchill Livingstone, Philadelphia; 2005. p. 927- 51. [ Links ]
14. Such J, Runyon BA. Spontaneous bacterial peritonitis. Clin Infect Dis 1998; 27: 669-74. [ Links ]
15. Parsi MA, Atreja A, Zein NN. Spontaneous bacterial peritonitis: recent data on incidence and treatment. Cleve Clin J Med 2004; 71: 565-69. [ Links ]
16. Angeloni S, Leboffe C, Parente A, Venditti M, Giordano A, Merli M, Riggio O. Efficacy of current guidelines for the treatment of spontaneous bacterial peritonitis in the clinical practice. World J Gastroenterol 2008; 14: 2757-62. [ Links ]
17. Guarner C, Soriano G. Bacterial translocation and its consequences in patients with cirrhosis. Eur J Gastroenterol Hepatol 2005; 17: 27-31. [ Links ]
18. Runyon BA. Management of adult patients with ascites due to cirrhosis. Hepatology 2004; 39: 841-56. [ Links ]
19. Wiest R, Garcia-Tsao G. Bacterial translocation in cirrhosis. Hepatology 2005; 41: 422-33. [ Links ]
20. Strauss E, Caly WR. Spontaneous bacterial peritonitis. Rev Soc Bras Med Trop 2003; 36(6): 711-7. [ Links ]
21. Ginès P, Cárdenas A, Arroyo V, Rodés J. Management of cirrhosis and ascites. N Engl J Med 2004; 350: 1646-54. [ Links ]
22. Thalheimer U, Triantos CK, Samonakis DN, Patch D, Burroughs AK. Infection, coagulation and variceal bleeding in cirrhosis. Recent Advances in Clinical Practice Gut 2005; 54: 556-63. [ Links ]
23. Fernández J, Navasa J, Colmenero J, et al. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis. Hepatology 2002; 35: 140-8. [ Links ]
24. Kamath PS, Wiesner RH, Malinchoc M, et al. A model to predict survival in patients with end-stage liver disease. Hepatology 2001; 33: 464-470. [ Links ]
25. Reginato TJ, Oliveira MJ, Moreira LC, Lamanna A, Acencio MM, Antonangelo L. Characteristics of ascitic fluid from patients with suspected spontaneous bacterial peritonitis in emergency units at a tertiary hospital. Sao Paulo Med J 2011; 129: 315-9. [ Links ]
26. Desai AP, Reau N, Reddy KG, Te HS, Mohanty S, Satoskar R, Devoss A, Jensen D. Persistent spontaneous bacterial peritonitis: a common complication in patients with spontaneous bacterial peritonitis and a high score in the model for end-stage liver disease. Therap Adv Gastroenterol 2012; 5: 275-83. [ Links ]
27. Shi KQ, Fan YC, Ying L, Lin XF, Song M, Li LF, Yu XY, Chen YP, Zheng MH. Risk stratification of spontaneous bacterial peritonitis in cirrhosis with ascites based on classification and regression tree analysis. Mol Biol Rep 2012; 39: 6161-9. [ Links ]
28. Mohan P, Venkataraman J. Prevalence and risk factors for unsuspected spontaneous ascitic fluid infection in cirrhotics undergoing therapeutic paracentesis in an outpatient clinic. Indian J Gastroenterol 2011; 30: 221-4. [ Links ]
29. Singh N, Wagener MM, Gayowski T. Changing epidemiology and predictors of mortality in patients with spontaneous bacterial peritonitis at a liver transplant unit. Clin Microbiol Infect 2003; 9: 531-7. [ Links ]
30. Shaw E, Castellote J, Santín M, Xiol X, Euba G, Gudiol C, Lopez C, Ariza X, Gudiol F. Clinical features and outcome of spontaneous bacterial peritonitis in HIV-infected cirrhotic patients: a case-control study. Eur J Clin Microbiol Infect Dis 2006; 25: 291-298. [ Links ]
31. Deschenes M, Villeneuve JP. Risk factors for the development of bacterial infections in hospitalized patients with cirrhosis. Am J Gastroenterol 1999; 94: 2193-7. [ Links ]
32. Runyon BA. Low-protein-concentration ascitic fluid is predisposed to spontaneous bacterial peritonitis. Gastroenterology 1986; 91: 1343-6. [ Links ]
33. Obstein KL, Campbell MS., Reddy KR, Yang YX. Association between model for end- stage liver disease and spontaneous bacterial peritonitis. Am J Gastroenterol 2007; 102: 2732-6. [ Links ]
34. Kamani L, Mumtaz K, Ahmed US, Ali AW, Jafri W. Outcomes in culture positive and culture negative ascitic fluid infection in patients with viral cirrhosis: cohort study. BMC Gastroenterol 2008; 8: 59. [ Links ]
35. Kim SU, Chon YE, Lee CK, Park JY, Kim do Y, Han KH, Chon CY, Kim S, Jung KS, Ahn SH. Spontaneous bacterial peritonitis in patients with hepatitis B virus-related liver cirrhosis: community-acquired versus nosocomial. Yonsei Med J 2012; 53: 328-36. [ Links ]
36. Abd Elaal MM, Zaghloul SG, Bakr HG, Ashour MA, Abdel-Aziz-El-Hady H, Khalifa NA, Amr GE. Evaluation of different therapeutic approaches for spontaneous bacterial peritonitis. Arab J Gastroenterol 2012; 13: 65-70. [ Links ]
37. Solà R, Andreu M, Coll S, Vila MC, Oliver MI, Arroyo V. Spontaneous bacterial peritonitis in cirrhotic patients treated using paracentesis or diuretics: results of a randomized study. Hepatology 1995; 21: 340-4. [ Links ]
38. Siersema PD, de Marie S, van Zeijl JH, Bac DJ, Wilson JH. Blood culture bottles are superior to lysis-centrifugation tubes for bacteriological diagnosis of spontaneous bacterial peritonitis. J Clin Microbiol 1992; 30: 667-9. [ Links ]
39. Rimola A, Garcia-Tsao G, Navasa M, Piddock LJ, Planas R, Bernard B, Inadomi JM. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. J Hepatol 2000; 32: 142-53. [ Links ]
40. Castellote J, López C, Gornals J, Tremosa G, Fariña ER, Baliellas C, Domingo A, Xiol X. Rapid diagnosis of spontaneous bacterial peritonitis by use of reagent strips. Hepatology 2003; 37: 893-6. [ Links ]
41. Runyon BA. Strips and tubes: refining the diagnosis of spontaneous bacterial peritonitis. Hepatology 2003; 37: 745-7. [ Links ]
42. Bobadilla M, Sifuentes J, Garcia-Tsao G. Improved method for bacteriological diagnosis of spontaneous bacterial peritonitis. J Clin. Microbiol 1989; 27: 2145-7. [ Links ]
43. Song JY, Jung SJ, Park CW, Sohn JW, Kim WJ, Kim MJ, Cheong HJ. Prognostic significance of infection acquisition sites in spontaneous bacterial peritonitis: nosocomial versus community acquired. J Korean Med Sci 2006; 2 1: 666-71. [ Links ]
44. Dupeyron C, Campillo B, Mangeney N, Richardet JP, Leluan G. Changes in nature and antibiotic resistance of bacteria causing peritonitis in cirrhotic patients over a 20 year period. J Clin Pathol 1998; 51: 614-6. [ Links ]
45. Almeida PR, Camargo NS, Arenz M, Tovo CV, Galperim B, Behar P. Spontaneous bacterial peritonitis: impact of microbiological changes. Arq Gastroenterol 2007; 44: 68-72. [ Links ]
46. Akriviadis EA, Runyon BA. The value of an algorithm in differentiating spontaneous from secondary bacterial peritonitis. Gastroenterology 1990; 98: 127-33. [ Links ]











 text in
text in