Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.3 Bogotá July/Sept. 2013
Avances en el manejo del carcinoma precoz de esófago
Vitor Arantes, MD (1), Elías Alfonso Forero Piñeros, MD (2), Takashi Toyonaga, MD (3)
(1) Profesor Adjunto, Departamento de Cirugía Endoscópica, Instituto Alfa de Gastroenterología, Facultad de Medicina, Universidad Federal de Minas Gerais, Belo Horizonte – Brasil.
(2) Director del Servicio de Endoscopía y Gastroenterología, Hospital de la Policía, Bogotá, Colombia.
(3) Profesor Asociado, Departamento de Gastroenterología, Hospital de la Universidad de Kobe. Kobe, Japón.
Fecha recibido: 12-08-12 Fecha aceptado: 26-06-13
Resumen
El carcinoma de células escamosas del esófago (CCE) tiene un mal pronóstico debido a que la detección ocurre generalmente en etapas avanzadas. Sin embargo, el desarrollo de la endoscopia de alta resolución con recursos de cromoscopia digital y con lugol ha favorecido el diagnóstico del CCE en estadios iniciales. En paralelo hubo un importante progreso de las técnicas endoscópicas para la resección endoluminal del tumor en bloque, a partir del desarrollo del procedimiento denominado disección endoscópica de la submucosa (DES). Estos avances han permitido la expansión de las indicaciones del tratamiento endoscópico mínimamente invasivo con potencial curativo en pacientes con CCE. El presente artículo de revisión tiene como objetivo principal contribuir a la comprensión de los avances recientes más importantes relacionados al manejo del CCE precoz de esófago. Como objetivo secundario se pretende ofrecer una revisión detallada de la técnica de la DES desarrollada por los expertos japoneses, a fin de contribuir a la difusión de este concepto y a la incorporación de estas nuevas tecnologías en la endoscopia latinoamericana.
Palabras clave
Carcinoma precoz de esófago, resección endoscópica, disección endoscópica.
INTRODUCCIÓN
El cáncer esofágico es la tercera causa de muerte por cáncer digestivo (1), y presenta una tasa de supervivencia en cinco años de solo 15% (2). El carcinoma de células escamosas (CCE) del esófago predomina en hombres (3,6:1) entre la quinta y séptima décadas de la vida (3). Cuando el diagnóstico de CCE de esófago se hace temprano, el pronóstico es mejor, con tasas de supervivencia a los 5 años de hasta 95% (4).
Esta revisión tiene por objeto describir los principales avances recientes ocurridos en el tratamiento del cáncer esofágico precoz, con énfasis en el papel actual de la endoscopia de alta resolución y de la cromoendoscopia para el diagnóstico de las formas tempranas de la enfermedad y la importancia de las nuevas técnicas japonesas de resección endoluminal por vía endoscópica, llamada disección endoscópica submucosa (DES).
MÉTODOS
Se realizó una revisión bibliográfica en las bases de datos Medline (PubMed) de los artículos originales más importantes en el idioma inglés a partir de 1990, tomando en cuenta las palabras clave "esophageal squamous cell carcinoma", "endoscopic submucosal dissection", "management" y "lugol chromoscopy". Para la descripción técnica del procedimiento de DES se dio prioridad a los artículos publicados por el coautor de este manuscrito (TT), que tiene una de las mayores series personales de DES (4.000 casos realizados hasta 2012), y una línea de investigación dedicada al desarrollo de nuevos accesorios y al perfeccionamiento de la técnica de DES.
DIAGNÓSTICO
El gran desafío en Latinoamérica y en los países occidentales es el de establecer el diagnóstico de cáncer de esófago en una etapa temprana, cuando los pacientes son asintomáticos y los cambios macroscópicos son de difícil reconocimiento. El mejor método para la detección de cáncer de esófago es la endoscopia, especialmente si se combina con las técnicas de cromoscopia (5, 6). La realización de la endoscopia en la población en general para el tamizaje de cáncer CCE de esófago no está justificada por los costos del procedimiento, pero en una población de alto riesgo, un programa de tamización endoscópica puede ser costo-efectiva. Hay una asociación del CCE de esófago con ciertos factores de riesgo, en especial el abuso de alcohol y tabaco, el consumo de mate, historia de CCE de las vías aerodigestivas superiores (VADS), lesiones cáusticas del esófago, megaesófago e infección por papiloma virus humano (5, 6). Entre todos estos factores, la historia de la CCE de VADS es lo que se relaciona más consistentemente con neoplasia sincrónica o metacrónica de esófago y por lo tanto, se recomienda realizar sistemáticamente una endoscopia digestiva alta para tamización en esta población (5, 6).
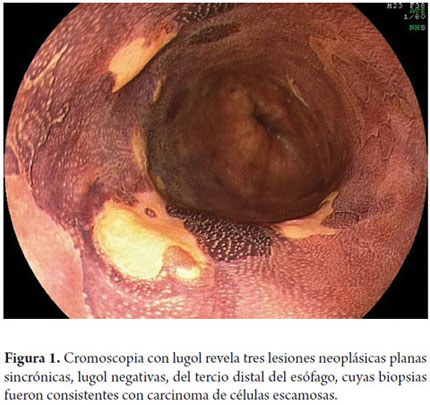
La cromoscopia utilizando la solución de lugol es el método de elección para el diagnóstico de CCE precoz de esófago (3). El lugol es un colorante de reacción, en la que el yodo tiñe fuertemente las células escamosas de esófago ricas en glucógeno, y no tiñe las células neoplásicas y displásicas, que son pobres en glucógeno. Un aspecto importante de la cromoscopia con lugol descrito recientemente, y con frecuencia no valorado por algunos endoscopistas, es el "signo del color rosa" (7, 8). Esta señal es la transformación del color amarillo de la lesión neoplásica lugol-negativa en color rosa al cabo de 3 a 5 minutos. Esta transformación se debe a los bajos niveles de glucógeno existentes en las células neoplásicas del esófago, y su aparición indica existencia de displasia de alto grado o carcinoma de células escamosas con alta especificidad (7, 8). Desde 2009, uno de los autores (VA) comenzó un programa de escrutinio de cáncer del esófago en pacientes con CCE de VADS a través de endoscopia transnasal sin sedación asociada con cromoendoscopia digital y con lugol. Entre los 106 pacientes examinados hasta el año 2011, se identificó CCE de esófago en 13 casos (12,3%), de los cuales, en 77% de los pacientes el cáncer estaba en una etapa temprana, lo que permitió el tratamiento por vía endoscópica en 8 casos (9). Esta elevada incidencia ilustra la importancia de hacer seguimiento de estos pacientes de alto riesgo también en Latinoamérica.
CLASIFICACIÓN Y ESTADIFICACIÓN DE LA NEOPLASIA SUPERFICIAL DE ESÓFAGO
De acuerdo con la clasificación endoscópica de las lesiones superficiales publicada en el Consenso París (10), neoplasia superficial comprende la lesión cuyo aspecto morfológico sugiere compromiso de las capas mucosa y submucosa, sin infiltración de la muscular propia. En Japón, las lesiones superficiales convencionalmente se denominan de tipo 0, en referencia a la clasificación de Borrmann de los tumores gástricos avanzados (12). Existen tres subtipos de lesiones superficiales: protruida (tipo 0-I), plana (tipo 0-II) y excavada (tipo 0-III). Las lesiones que sobresalen se subclasifican en pedunculadas (0-Ip), subpedunculadas (0-ISP) y sésiles (0-Is). En el esófago predominan las neoplasias superficiales planas que se subdividen en superficialmente elevadas en relación a la mucosa adyacente (IIA), planas (IIB) y deprimidas (IIC), siendo raras las formas protruidas y excavadas (10). Las neoplasias superficiales son además subdivididas de acuerdo al grado de penetración transmural. M1 corresponde al epitelio y la capa basal, M2 a la lámina propia o corión y M3 a la muscular de la mucosa. El compromiso de la submucosa también se subdivide en SM1 (tercio superior), SM2 (promedio) y SM3 (tercio inferior).
En cuanto a la descripción histopatológica de los tumores superficiales, la recomendación actual es utilizar la clasificación de Viena (11), que a su vez se basa en la clasificación TNM-p ("p" de la patología). En ausencia de invasión de la lámina propia, la lesión se llama neoplasia intraepitelial de grado bajo o alto, y también se puede utilizar el término carcinoma in situ (pTis). Cuando existe invasión de la lámina propia esofágica la neoplasia es llamada carcinoma intramucoso o microinvasivo (pT1m). Cuando hay infiltración de la submucosa, la neoplasia se considera invasiva (pT1sm). La importancia de estas subdivisiones se debe al hecho que el riesgo de metástasis en ganglios linfáticos en el cáncer superficial tiene estrecha relación con su profundidad de invasión vertical en la pared del órgano. Este dato es un criterio fundamental para la selección de candidatos para terapia endoscópica con fines curativos. Cuando el compromiso neoplásico se limita a la porción epitelial superficial (M1 y M2), el riesgo de compromiso linfonodal es cercano a cero y el realizar la escisión por vía endoscópica es suficiente para obtener cura (10, 12). Cuando el cáncer invade la muscularis mucosa (M3) y la porción proximal de la submucosa a una profundidad de 200 μ (SM1) conceptualmente este riesgo puede llegar de 9% a 19%, respectivamente. En estos casos, que se sitúan en el límite del tratamiento endoscópico curativo, una mayor evaluación es esencial que observe cuidadosamente los siguientes parámetros: tamaño del tumor, presencia de invasión linfática-vascular y la extensión horizontal (ancho) de la invasión de la lamina muscularis de la mucosa. En el estudio de análisis multivariado de Choi, et al (13), en el que se evaluaron 190 piezas de esofagectomía, los autores observaron que los tumores que afectaban de manera focal M3/SM1, cuando el tamaño de la lesión neoplásica es inferior a 3 cm, no hay invasión linfático-vascular; y si el compromiso de la lamina muscularis mucosa tiene una anchura inferior a 3 mm, el riesgo de metástasis en los ganglios linfáticos es muy bajo (1 de cada 63 casos ó 1,5%). En presencia de infiltración masiva de la submucosa (SM2 y SM3) se encuentran metástasis de ganglios linfáticos en aproximadamente el 40% de los casos.
En la estadificación inicial del cáncer esofágico, además de la evaluación detallada de las características morfológicas de la endoscopia, se puede utilizar la ultrasonografía endoscópica. El ecoendoscopio convencional opera en frecuencias bajas (5-12 MHz), las cuales permiten dividir la pared del tracto gastrointestinal en 5 capas, y por tener una mayor penetración puede apreciar completamente el mediastino y el tronco celíaco, en busca de ganglios linfáticos. Las minisondas de alta resolución poseen frecuencias más altas (15 a 30 MHz), que permiten una descripción más detallada de la diferenciación de la pared del tracto gastrointestinal dividiéndolo hasta en 7 ó 9 capas; Con estos miniprobes se puede obtener una evaluación bastante exacta del grado de invasión vertical del tumor. Buskens, et al (14) analizaron la precisión de la ecoendoscopia en la estadificación de 77 pacientes con lesiones esofágicas displásicas y de carcinoma temprano que fueron sometidos a esofagectomía, y compararon la exactitud del método contra el patrón oro que consiste en la exanimación de la pieza quirúrgica. Los autores encontraron que la ecografía endoscópica demostró correctamente la ausencia de afectación ganglionar metastásica en 93% de los casos. El valor predictivo negativo de la ecografía endoscópica para detectar la ausencia de invasión de la submucosa fue de 95%.
Para maximizar la precisión de la ecografía endoscópica del esófago para CCE, se recomienda combinar el uso de minisonda de alta frecuencia para el estadio T y con ecoendoscopios convencionales realizar la evaluación de los ganglios linfáticos. La presencia de metástasis ganglionares sugiere que la lesión neoplásica no es curable solo por resección local. A pesar de los buenos resultados mencionados anteriormente (14) el principal factor limitante en la evaluación ecoendoscópica de la neoplasia de esófago temprana es la reacción desmoplásica causada por la respuesta inflamatoria subyacente a la neoplasia, que puede llevar a sobreestadificación del compromiso, lo que es un factor que puede provocar un direccionamiento incorrecto de los pacientes a otras formas de tratamiento diferentes al endoscópico. La ausencia de invasión de la capa submucosa y de ganglios linfáticos malignos soportan la resección endoscópica. El pronóstico final será dictado por la evaluación histológica sistemática de la pieza resecada; si esta evaluación identifica invasión de M3 ó SM, invasión linfática o vascular o afectación de margen de profundidad por el tumor, el tratamiento del paciente debe ser redirigido (quimioterapia y radioterapia o cirugía). Considerando que la evaluación histológica será el factor decisivo para definir la conducta final, todos los esfuerzos deben ser implementados para maximizar la calidad de la muestra y prevenir que la neoplasia del esófago sea fragmentada (como en mucosectomia "piecemeal"), ya que este método impide un análisis adecuado de los márgenes e impide la caracterización de la resección endoscópica como R0 (extirpación completa del tumor).
INDICACIONES PARA EL TRATAMIENTO ENDOSCÓPICO DE NEOPLASIA DE ESÓFAGO SUPERFICIAL
Los criterios clásicamente aceptados para la resección endoscópica con fines curativos del cáncer superficial de esófago (15) incluyen: profundidad del compromiso restringida a las capas M1 y M2 (epitelio y lámina propia), longitud máxima de 3 cm y la extensión lateral de menos de ¾ de la circunferencia, máximo de 4 lesiones. Con técnicas mejoradas para la resección endoscópica, especialmente después de la llegada de la DES, estos criterios tienden a ampliarse, al aceptar el tratamiento endoscópico de las lesiones mayores de 3 cm, ocupando toda la circunferencia del esófago y sin límite en el número de lesiones, siempre que sean intramucosas.
Las modalidades de tratamiento endoscópico del cáncer de esófago incluyen las técnicas de resección (resección de la mucosa o DES) y las técnicas de ablación. Los métodos de la ablación incluyen la terapia fotodinámica, el argón plasma, el láser YAG, la electrocoagulación multipolar y, más recientemente, la ablación por radiofrecuencia. Todos estos métodos tienen el inconveniente de la imposibilidad de la información del análisis histopatológico de la lesión neoplásica erradicada, que es crucial para estimar la posibilidad de curación con la intervención endoscópica. Por lo tanto, los actuales métodos ablativos no deben ser realizados para el tratamiento endoscópico del CCE de esófago. En este trabajo se discuten en detalle el papel de la DES y de la mucosectomía en el tratamiento del cáncer de esófago superficial.
PRINCIPIOS TÉCNICOS DE LA RESECCIÓN MUCOSAL ENDOSCÓPICA
La pared del tubo digestivo está formada por dos componentes principales: la mucosa y la muscularis propia. Estos elementos están unidos por una capa de tejido conectivo suelto (submucosa). La pared del esófago tiene un espesor entre 3,5 y 4 mm, así que para extirpar una lesión neoplásica superficial se corre el riesgo de lesión involuntaria de la capa muscular y de la consiguiente perforación visceral. Para evitar estas complicaciones, es necesaria la inyección de la submucosa para separarse la lesión a tratar de la capa muscular propia. La solución más utilizada es la solución salina al 0,9%. La desventaja de la solución salina es su rápida disipación en la pared gastrointestinal que hace que la eliminación de las lesiones mayores de 1 cm no sea posible, solo con esta sustancia. Para estos casos se han desarrollado soluciones viscosas que promueven el efecto de la "burbuja" por un periodo más prolongado (16). Las más conocidas son el hialuronato de sodio, la glicerina y la hidroxipropilemetilcelulosa (16). La elevación de la lesión neoplásica después de la infiltración de la submucosa indica que no hay invasión de la profundidad por el cáncer. Tras la inyección de un volumen suficiente de solución en la submucosa, la lesión elevada puede ser captada por el asa de diatermia y posibilita la resección con adecuado margen de seguridad; este procedimiento se llama mucosectomía.
Hay variaciones en las técnicas descritas de mucosectomía: inyección y asa; inyección, cap de mucosectomía con la ayuda de la succión; mucosectomía después de la aplicación de bandas elásticas. La resección endoscópica de la mucosa con la ayuda del cap es el método recomendado para su aplicación en esófago (15, 17).
Resultados de la mucosectomía en el esófago
Los resultados más consistentes sobre el uso de la resección endoscópica de la mucosa en el cáncer de esófago se derivan de la experiencia japonesa. Inoue (17) publicó una serie de 142 pacientes con cáncer de esófago sometidos a mucosectomía con fines curativos y realizó seguimiento de hasta 9 años. Cuando todos los criterios de selección se cumplieron no hubo ningún caso de recidiva local o metástasis. La tasa de supervivencia a los 5 años fue de 95% y no hubo muertes relacionadas con el cáncer. Endo, et al (18) reportaron los resultados de la mucosectomía esofágica para cáncer intramucoso menor de 2 cm y ocupando menos de un tercio de la circunferencia. La tasa de supervivencia a los 5 años fue de 100%, la recurrencia local se produjo en 7% y se trató en todos los casos con la repetición del tratamiento endoscópico. Yoshida, et al (19) no encontraron ninguna diferencia en la supervivencia a los 5 años en pacientes con cáncer de esófago con compromiso de M1 y M2 tratados por resección de la mucosa (86% de supervivencia a 5 años) o con esofagectomía (83,2% de supervivencia a 5 años).
La eficacia de la resección endoscópica de la mucosa para el tratamiento curativo cuando todos los criterios de inclusión se cumplen ha sido bien demostrada, sin ninguna ventaja de la esofagectomía en este subgrupo de pacientes (19). Sin embargo, aun cuando ciertos criterios son violados, algunos autores han propuesto tratamientos alternativos a la cirugía. Shimizu, et al (20) reportaron una serie de 16 pacientes que fueron sometidos a tratamiento endoscópico de lesiones de la mucosa que tenían invasión de la muscularis mucosa y de la submucosa y que se negaron a someterse a esofagectomía. Estos pacientes recibieron radioterapia y la quimioterapia adyuvante después de la mucosectomía. El autor comparó los resultados de estos pacientes con otros 39 pacientes con cáncer de esófago tratados con esofagectomía. Ningún paciente del grupo de mucosectomía y quimiorradioterapia presentó recurrencia local o metástasis. La supervivencia a 5 años del grupo que fue tratado endoscópicamente fue de 100% y la de los pacientes operados fue de 87,5%. Aunque no es un estudio aleatorizado y controlado, los resultados de esta investigación sugieren que cuando los criterios para la resección endoscópica curativa son incompletos, la terapia complementaria con la quimioterapia y la radioterapia parece ser una alternativa igual de eficaz que la esofagectomía. Actualmente existe un estudio multicéntrico japonés en curso que busca evaluar la eficacia terapéutica de la EDS asociada con quimiorradioterapia adyuvante en pacientes con neoplasia M3 y SM1.
DISECCIÓN ENDOSCÓPICA DE LA SUBMUCOSA
La técnica de DES fue desarrollada en el Japón en los últimos 10 años con el fin de permitir la resección en bloque de lesiones neoplásicas mayores de 2 cm (21-23). La DES tiene beneficios secundarios, como la producción de una muestra adecuada para el estudio histológico, y desde el punto de vista clínico, para lograr una resección local con el mayor potencial de curación y la menor tasa de recurrencia (24). Esta técnica se diseñó originalmente para su aplicación en el estómago. Su uso en el esófago se desarrolló más lentamente, porque en éste órgano es un procedimiento de mayor complejidad y de aplicación técnica más difícil, debido al pequeño espacio luminal del esófago, en comparación con el estómago. El refinamiento y la estandarización de la DES, así como el desarrollo de nuevos accesorios, ha hecho posible extender la aplicación de esta modalidad en el manejo de CCE de esófago. Además de estos factores, el aumento en la detección de los tumores en una etapa temprana por el creciente uso de la endoscopia de alta resolución y de la cromoendoscopia, sumadas a la alta morbilidad y mortalidad asociadas con la esofagectomía, han estimulado el desarrollo y la mejora de las intervenciones terapéuticas endoluminales, las cuales permitan conservar el órgano y mantener la calidad de vida de los pacientes. En la actualidad, el DES es el método preferido para la resección endoscópica del cáncer esofágico temprano en Japón, y este procedimiento se está construyendo poco a poco en Latinoamérica y en otros países occidentales.
EQUIPOS Y ACCESORIOS
Para la realización de DES se recomiendan los siguientes equipos:
- Endoscopio de alta resolución y magnificación para la demarcación de los márgenes de resección y con canal específico de irrigación de agua (en función de waterjet). Canal de trabajo terapéutico es deseable. Endoscopio de doble canal no es recomendable.
- Bomba para la infusión de agua a presión controlada.
- Insuflador de CO2.
- Unidad electroquirúrgica especializada para su uso en endoscopia. Actualmente los únicos modelos validados para su uso en DES son el cauterio ERBE (ICC 200 y VIO 300), que tienen el modo de corte pulsátil endocut, además de los software dry-cut, soft coagulation, forced coagulation e swift coagulation. Cada operador dispuesto a realizar DES debe tener profundo conocimiento de las propiedades electroquirúrgicas y de los parámetros específicos para cada paso del procedimiento. Entre los accesorios utilizados para la DES, hay una serie de estiletes y productos desarrollados por expertos japoneses, entre ellos:
- Estiletes: Flush-Knife (en línea recta y con punta de bola), IT-Knife, Hook Knife, Flex Knife, Dual-Knife, Hybrid Knife, - - Safe Knife, y el Swam Blade Knife (figura 1).
- Catéteres para inyección de la submucosa calibre 25.
- Hemostasia: pinza de biopsia caliente (Hot biopsy) o fórceps de coagulación.
- Endoclips desechables para el manejo de perforaciones.
- Dispositivos plásticos de fijación en la punta del endoscopio (cáps).
- Pinza de cuerpos extraños y asas con red para la recuperación del espécimen
- Sobretubo con válvula de control de fuga de aire.
- Soluciones para la inyección submucosa: hialuronato de sodio (no está disponible en Latinoamérica), hidroxipropilmetilcelulosa 0,4%, manitol 20%, solución salina 0,9%.
Técnica de DES
El paciente debe someterse a una evaluación preoperatoria y del riesgo quirúrgico, ya que la mayoría de los pacientes con cáncer de esófago son alcohólicos y fumadores crónicos. El tratamiento debe realizarse bajo hospitalización. En el Japón, los procedimientos de DES se realizan bajo sedación. Sin embargo, para los principiantes en la técnica, o cuando el tiempo de ejecución estimado es superior a dos horas, se recomienda la asistencia de un anestesiólogo y el uso de anestesia general con intubación orotraqueal (25). Así, el endoscopista puede concentrarse en el procedimiento endoscópico y no hay riesgo de aspiración pulmonar. Monitoreo cardiopulmonar y oximetría de pulso son obligatorios en todos los casos, así como el uso de sonda urinaria para los procedimientos prolongados. Aunque no hay evidencia científica para justificar el uso de antibioticoprofilaxis para la DES de esófago, esta práctica está muy extendida en los centros japoneses con el uso de cefalosporinas de segunda generación mantenido durante 3 días por vía intravenosa.
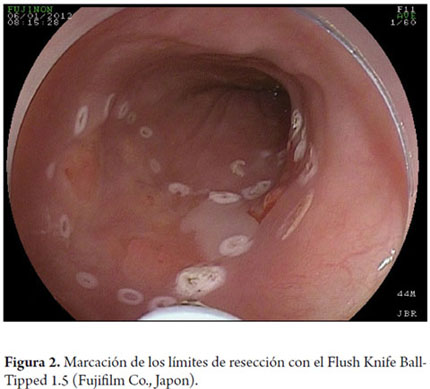
Existen varias técnicas descritas de DES. En esta revisión se describen brevemente dos técnicas distintas. La primera técnica fue propuesta por uno de los coautores (TT), desarrollada en la Universidad de Kobe y descrita previamente (26-29). Inicialmente se debe inspeccionar a fondo la extensión de la lesión utilizando endoscopios con magnificación óptica y cromoscopia digital que tienen además en su extremo distal un dispositivo de plástico acoplado corto (cap) con 4 mm de longitud. En seguida se debe proceder a cromoscopia con lugol al 0,8% para el trazado preciso de los límites de la lesión. En el esófago se realiza el procedimiento con estilete de aguja corta de 1,5 mm de largo con punta redondeada, diseñado por uno de los autores (TT), que permite realizar todos los pasos de la DES: marca, incisión, disección de la submucosa, inyección simultánea de solución salina y hemostasia de los vasos sanguíneos (Flush Knife-Ball-tiped 1,5, Fujifilm Fujinon Co., Japón) (27). Se recomienda emplear la unidad de electrocirugía VIO 200D o 300D (ERBE Elektromedizin, Turbingen, Alemania). La tabla 1 muestra los parámetros utilizados para electrocauterización quirúrgica de la DES de esófago en la Universidad de Kobe. Después de la cromoendoscopia, se procede a marcar los límites de resección con el Flush Knife (FK), respetando los márgenes mínimos de 2-5 mm (parámetros: Soft coagulation, Efecto 5, 100 vatios). Los márgenes proximal y distal deben ser grandes en el esófago (5 mm), mientras que los márgenes laterales pueden ser más conservadores (2 mm) para minimizar el riesgo de estenosis esofágicas circunferenciales secundarias a las resecciones. Después se procede a la inyección submucosa con agujas de calibre 25 (TOP Corporation, Japón). Inicialmente se realiza una primera burbuja submucosa con solución salina 0,9% y luego se inyecta una solución viscosa de ácido hialurónico (Muco-Up ®, Seikagaku, Japón) que mantiene elevada la submucosa por un periodo más largo. La inyección submucosa se debe iniciar en el margen proximal (oral) de la lesión, y se debe continuar con inyecciones sucesivas de 1-3 ml adicionales en los márgenes laterales (izquierdo o derecho) y, finalmente, en el borde distal (anal); se debe observar una elevación satisfactoria de la lesión (signo del levantamiento). Se deben evitar inyecciones transfixiantes en el centro de la lesión neoplásica para minimizar el riesgo de siembras del tumor en la capa muscular propia. Luego se procede a la incisión de la mucosa con el FK (Endocut I Efecto 4, duración de corte 2, intervalo de corte 3). La incisión sigue la siguiente secuencia: margen anal - incisión transversal, margen lateral - incisión longitudinal; margen oral - incisión transversal, creando un contorno en forma de "C". Después se procede a la disección de la capa submucosa con el FK en el sentido oral-anal (coagulación forzada efecto 2, 40 vatios), creando un colgajo de incisión en la sentido lateral en dirección al centro de la lesión, siempre precediendo a la aplicación de corte eléctrico de más inyecciones de solución salina en la submucosa. La disección se debe realizar en capa submucosa profunda, entre la muscular propia y la capa vascular submucosa del esófago, para que sea mas eficiente, y optimice el control vascular. La hemostasia perfecta de los vasos submucosos es esencial para un procedimiento seguro y un campo exangüe, como ya se ha descrito (30, 31). Los vasos perforantes del esófago se deben identificar y aislar, y se les debe realizar hemostasia con la aplicación de FK Soft Coagulation, efecto 5, 100 vatios por 3 a 5 segundos en cada lado del vaso, seguidos por la sección del vaso con coagulación forzada. Si la maniobra hemostática con el FK no es eficaz, después de 3 intentos, se debe proceder a la hemostasia con una pinza fórceps (COAG grasper, Olympus Co. Japón). Después de la disección de 70% a 80% de la lesión, desde su borde oral al margen anal, se debe proceder a la inyección submucosal de hialuronato sódico en el margen lateral que aún no se ha seccionado. A continuación se procede a una incisión longitudinal de la mucosa en este margen lateral en el sentido oral-anal. La disección de la submucosa del colgajo creado previamente se completa, utilizando el cap para exponer el espacio submucoso. El movimiento del FK debe ser siempre paralelo al eje de la pared esofágica y nunca perpendicular a la capa muscular propia. Después de la terminación de la resección, la muestra debe ser recuperada con pinzas de cuerpo extraño, teniendo cuidado de captar la muestra por su lado submucoso, a fin de no dañar la porción mucosa de la muestra. El sitio de la resección debe ser reexaminado, los vasos que sobresalen deben ser coagulados y las laceraciones de la capa muscular deben ser aproximadas por clips. Si el sitio resección presenta una extensión superior a 75% de la circunferencia, se puede agregar la inyección de 4 ml de acetato de triamcinolona de 10 mg/ml, a través de un catéter inyector, lo que representa 20 punciones con alícuotas de 0,2 ml por punción, dirigidas tanto al borde como al centro del sitio de resección teniendo cuidado para inyectar solo en la porción superficial de la capa muscular. Esta medida tiene como objetivo minimizar el riesgo de estenosis esofágica. En un estudio comparativo recientemente publicado con 41 pacientes con resecciones esofágicas circunferenciales, divididos en dos grupos (con y sin inyección de triamcinolona), en el grupo tratado la estenosis esofágica fue de 19% frente a 75% observado en el grupo control (30). En Kobe, las inyecciones de triamcinolona se repiten después de 7 y 14 días. Recientemente se ha propuesto la administración de corticosteroides por vía oral para la prevención de la estenosis esofágica después de la DES circunferencial a dosis inicial de 30 mg de prednisolona, con inició el día tercero del postoperatorio, y continuando el tratamiento durante 8 semanas, con resultados preliminares prometedores (31).
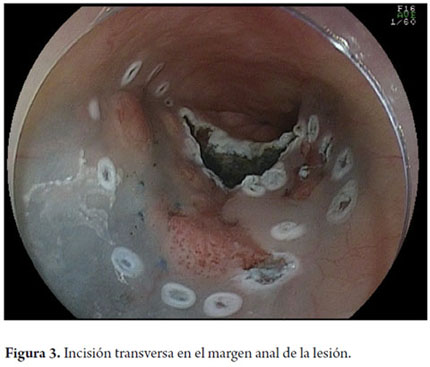
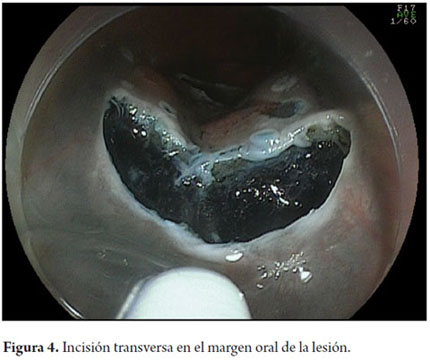
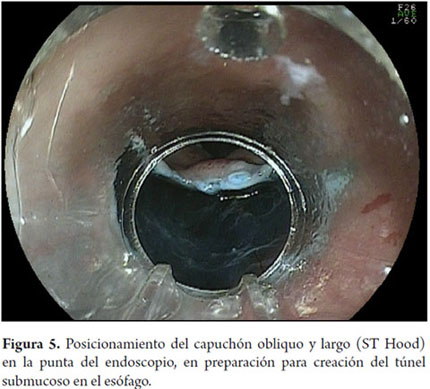
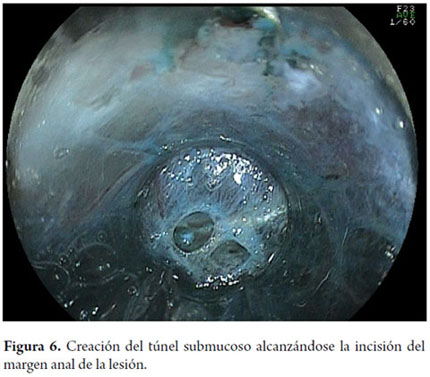
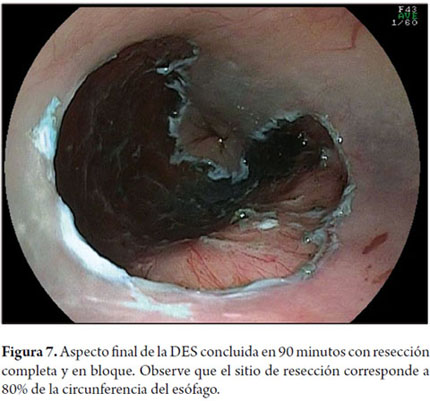
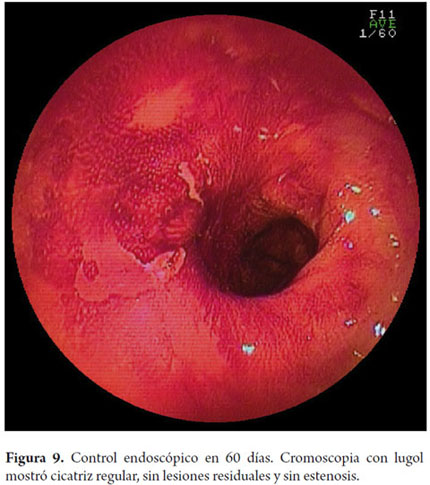
Otra variante técnica de ESD en el esófago, es conocida como el método de tunelización. Esta técnica fue inicialmente desarrollada por Yamamoto. Después de entrenamiento obtenido por uno de los autores (VA) con el inventor del método, esta técnica fue aplicada en 22 pacientes consecutivos con CCE precoz de esófago en Brasil. En la técnica de tunelización, el primer paso, después de la definición de los márgenes, consiste en realizarse la inyección submucosa seguida de la incisión con FK en el margen anal de la lesión. A continuación, se realiza la misma inyección submucosa e incisión transversal en el margen oral de la lesión. La incisión debe ser suficientemente profunda para atingir el plan submucoso junto a la muscular propia. En seguida se mete el endoscopio por la capa submucosa utilizándose un capuchón oblicuo largo en la punta del endoscopio (ST Hood, Fujinon Co., Japón). Se crea un túnel en la submucosa en el sentido oral-anal, a través de la disección bajo visión de las fibras submucosas y coagulación de los vasos perforantes del esófago frente a la muscular propia. Después de creado el túnel y atingido la incisión transversal del margen anal, se diseca la submucosa en el sentido transversal desde un extremo al otro de la lesión. El paso final consiste en realizar nueva inyección submucosa en los márgenes laterales derecho e izquierdo de la lesión seguido de las incisiones laterales en sentido oral-anal para finalizar el procedimiento. Las figuras 1, 2, 3, 4, 5, 6, 7, 8 y 9 son representativas de la técnica de tunelización.
Recuperación y preparación del espécimen resecado
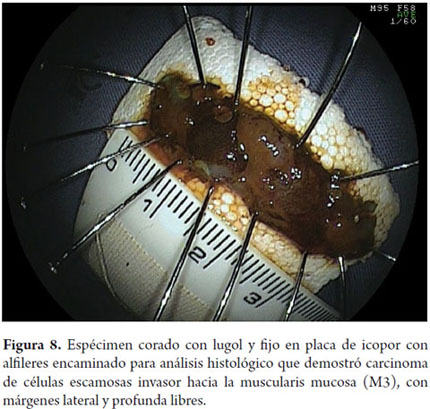
Este es un paso fundamental en el tratamiento endoscópico de los tumores superficiales que a menudo es pasado por alto por los endoscopistas occidentales y que es llevado a cabo de forma sistemática por los japoneses. La muestra recuperada se fija con alfileres en icopor o goma y se coloca en formol. El patólogo debe cortar la muestra en fragmentos paralelos de 2 mm de ancho, y la debe evaluar de acuerdo a la clasificación Viena (11), que indica el grado de diferenciación tumoral, la profundidad de la invasión y si la resección fue completa o no. En todo caso deben ser evaluados cuidadosamente todos los márgenes proximal, distal, lateral y vertical. En las piezas quirúrgicas que contienen mucosa, submucosa, muscular propia y adventicia, un análisis semicuantitativo de la profundidad de la invasión submucosa es confiable, ya que se puede dividir la submucosa en tres segmentos de igual espesor (SM1, SM2 y SM3). En las piezas de resección endoscópica, la submucosa no siempre es completa y esta distinción es menos confiable. En estos casos, se adopta una medida cuantitativa midiendo en micras (μ) la invasión de la submucosa, a partir de la última capa de la muscularis mucosa, estableciéndose un punto de corte a partir del cual se considera existe un mayor riesgo de metástasis en los ganglios linfáticos (SM2), que en el que esófago se sitúa por debajo 200μ (10).
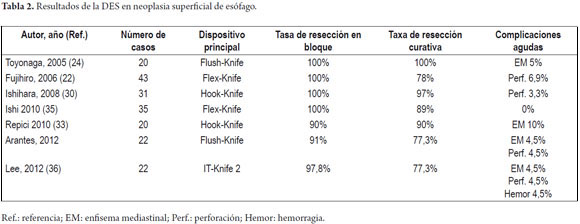
Resultados de DES en cáncer temprano de esófago
Existen pocos estudios publicados en la literatura sobre el uso de DES en los tumores del esófago y el resumen de los resultados de las principales publicaciones se describen en la tabla 2. Solo cinco años después del uso de la DES en el estómago, se llevaron a cabo los primeros experimentos con el uso de la DES en el esófago y en el colon. Toyonaga, et al están entre los primeros en informar acerca de la aplicación de DES en los tumores del esófago en 2005 (26). Los autores reportaron 20 pacientes con CCE del esófago, que se sometieron a la DES con el FK, con la obtención de la resección en bloque y con márgenes libres en el 100% de los casos, con un diámetro medio de la muestra de 47 mm, y con un tiempo promedio de 65 minutos. En esta serie solo hubo una complicación, enfisema mediastinal, que se manejó clínicamente. Fujishiro, et al (24) mostraron resultados similares en 43 pacientes, obteniéndose 100% de la resección en bloque, pero en 22% de los casos la resección endoscópica no fue curativa, debido a compromiso de los márgenes verticales o laterales. Hubo cuatro casos de perforación tratados de forma conservadora. Ishihara, et al (32) publicaron un análisis comparativo de los resultados de la DES en comparación con la mucosectomía en pacientes con cáncer esofágico inferior a 20 mm. Las tasas de resección en bloque y la resección curativa de los casos de DES fueron superiores a los de las técnicas de resección mucosal endoscópica con cap y con strip biopsy (respectivamente 100% y 97%, 87% y 71%, 71% y 46%). No hubo diferencias en las tasas de complicación entre las tres técnicas, señalando que cuando el endoscopista tiene la suficiente formación, la tasa de complicación de la DES es similar a la mucosectomía.
Solo recientemente surgieron los dos primeros experimentos con DES para el cáncer de esófago en el Occidente, tanto en Europa (33) como en Brasil (34) (tabla 2).
En el Instituto Alfa de Gastroenterología los procedimientos de DES en el esófago comenzaron a ser realizados de forma rutinaria en el año 2009, iniciados a partir de la formación del autor principal (VA) en el Hospital de la Universidad Nacional de Singapur y el Hospital de la Universidad de Kobe en Japón. Hasta el momento se han realizaron 22 DES por cáncer de esófago en este centro utilizándose el método de tunelización, logrando tasas de resección en bloque de 91% y tasas de resección curativa de 77,3%, en consonancia con los resultados de la literatura mundial (24, 33, 35, 36). Hubo dos complicaciones en esta serie: un paciente con enfisema mediastínico y subcutáneo sin perforación aparente tratado de forma conservadora y una perforación de esófago tratada mediante la aplicación de clips y con manejo clínico. No hay casos de recurrencia local en el periodo de seguimiento que va desde 3 meses a 2 años (datos presentados para su publicación).
CONSIDERACIONES FINALES
El DES es una realidad en Asia y se considera el tratamiento de elección del CCE temprano. La experiencia es todavía insuficiente para concluir si es factible la aplicación de la DES para el tratamiento del cáncer esofágico superficial a gran escala en los centros occidentales, como sucede habitualmente hoy en Japón y en Corea del Sur. En los países occidentales, especialmente en Latinoamérica, el mayor reto sigue siendo promover el diagnóstico precoz de la neoplasia de esófago a través de la adecuada formación de los endoscopistas y del establecimiento de programas de tamizaje en los pacientes de alto riesgo. Además, es esencial formar centros de referencia con recursos humanos especializados y entrenados, y apoyados de una infraestructura completa, para que pueda ocurrir una expansión de la DES en estos países, con sus beneficios evidentes en la calidad de vida y en la reducción de la morbilidad y de la mortalidad.
REFERENCIAS
1. Blot WJ. Esophageal cancer trends and risk factors. Semin Oncol 1994; 21: 403-10. [ Links ]
2. Remontet L, Esteve J, Bouvier Am, et al. Cancer incidence and mortality in France over the period 1978-2000. Ver Epidemiol Sante Publique 2003; 51: 3-30. [ Links ]
3. Yokoyama A, Ohmori T, Makuuchi H, et al. Successful screening for early esophageal cancer in alcoholics using endoscopy and mucosa iodine staining. Cancer 1995; 76: 928-34. [ Links ]
4. Fagundes RB, de Barros SGS, Pütten ACK, et al. Occult dysplasia is disclosed by lugol chromoendoscopy in alcoholics at high risk for squamous cell carcinoma of the esophagus. Endoscopy 1999; 31: 281-5. [ Links ]
5. American Society for Gastrointestinal Endoscopy. ASGE guideline: the role of endoscopy in the surveillance of premalignant conditions of the upper GI tract. Gastrointest Endosc 2006; 63: 570-80 [ Links ]
6. Dubuc J, Legoux JL, Winnock M, et al. Endoscopic screening for esophageal squamous-cell carcinoma in high-risk patients: A prospective study conducted in 62 French endoscopy centers. Endoscopy 2006; 38: 690-5. [ Links ]
7. Shimizu Y, Omori T, Yokyama A, et al. Endoscopic diagnosis or early squamous neoplasia of the esophagus with iodine staining: High-grade intraepithelial neoplasia turns pink within a few minutes. J Gastroenterol Hepatol 2008; 23: 546-50. [ Links ]
8. Ishihara R, Yamada T, Iishi H, et al. Quantitative analysis of the color change after iodine staining for diagnosing esophageal high-grade intraepithelial neoplasia and invasive cancer. Gastrointest Endosc 2009; 69: 213-8. [ Links ]
9. Arantes V, Albuquerque W, Dias CAF, et al. Effectiveness of unseated transnasal endoscopy with white-light, FICE and lugol staining for esophageal cancer screening in high-risk patients. J Clin Gastroenterol 2012 (In press). [ Links ]
10. The Paris endoscopic classification of superficial neoplastic lesions. Gastrointest Endosc 2003; 58(suppl 6): S3-S43. [ Links ]
11. Schempler RJ, Riddel RH, Kato Y, et al. The Vienna classification of gastrointestinal epithelial neoplasia. Gut 2000; 47: 251-5. [ Links ]
12. Inoue H, Fukami N, Yoshida T, Kudo S. Endoscopic mucosal resection for esophageal and gastric cancers. J Gastroenterol Hepatol 2002; 17: 382-8. [ Links ]
13. Choi JI, Park YS, Jung HY, et al. Feasibility of endoscopic resection in superficial esophageal squamous carcinoma. Gastrointest Endosc 2011; 73(5): 881-9. [ Links ]
14. Buskens CJ, Westerterp M, Lagarde SM, Bergman J, ten Kate FJW, van Lanschot JJB. Prediction of appropriateness of local endoscopic treatment for high-grade dysplasia and early adenocarcinoma by EUS and histopathologic features. Gastrointest Endosc 2004; 60: 703-10. [ Links ]
15. Inoue H, Fukami N, Yoshida T, Kudo S. Endoscopic mucosal resection for esophageal and gastric cancers. J Gastroenterol Hepatol 2002; 17: 382-8. [ Links ]
16. Arantes V, Albuquerque W, Benfica E, et al. Submucosal injection of 0,4% hydroxypropyl methylcellulose facilitates endoscopic mucosal resection of early gastrointestinal tumors. J Clin Gastroenterol 2010; 44(9): 615-9. [ Links ]
17. Inoue H. Endoscopic mucosal resection for esophageal and gastric mucosal cancers. Can J Gastroenterol 1998; 12: 355-9. [ Links ]
18. Endo M, Takeshita K, Inoue H. Endoscopic mucosal resection of esophageal cancer. Gan To Kagaku Ryoho 1995; 22: 192-5. [ Links ]
19. Yoshida M, Hanashi T, Momma K, Yamada Y, Sakaki N, Koike M, et al. Endoscopic mucosal resection for radical treatment of esophageal cancer. Gan To Kagaku Ryoho 1995; 22: 847-54. [ Links ]
20. Shimizu Y, Kato M, Yamamoto J, Nakagawa S, Tsukagoshi H, Fujita M, Hosokawa M, Asaka M. EMR combined with chemoradiotherapy: a novel treatment for superficial esophageal squamous-cell carcinoma. Gastrointest Endosc 2004; 59(2):199-204. [ Links ]
21. Ono H, Kondo H, Gotoda T, et al. Endoscopic mucosal resection for treatment of early gastric cancer. Gut 2001; 48: 225-9. [ Links ]
22. Ookuwa M, Hosokawa K, Boku N, et al. New endoscopic treatment for intramucosal tumors using an insulated-Tip diathermic knive. Endoscopy 2001; 33: 221-6. [ Links ]
23. Yamamoto H, Kawata H, Sunada K, et al. Success rate of curative endoscopic mucosal resection with circumferential mucosal incision assisted by submucosal injection of sodium hyaluronate. Gastrointest Endosc 2002; 56: 507-12. [ Links ]
24. Fujishiro M, Yahagi N, Kakushima N, et al. Endoscopic submucosal Dissection of Esophageal Squamous Cell Neoplasms. Clin Gastroenterol Hepatol 2006; 4: 688-694. [ Links ]
25. Fujishiro M, Kodashima S, Goto O, et al. Endoscopic submucosal dissection for esophageal squamous cell neoplasms. Digestive Endoscopy 2009; 21: 109-15. [ Links ]
26. Toyonaga T, Nishino E, Hirooka T, et al. Use of short needle knife for esophageal endoscopic submucosal dissection. Digestive Endoscopy 2005; 17: 246-52. [ Links ]
27. Toyonaga T, Man-I M, Fujita T, et al. The performance of a novel ball-tipped Flush Knife for endoscopic submucosal dissection: a case-control study. Aliment Pharmacol Ther 2010; 32: 908-15. [ Links ]
28. Toyonaga T, Nishino E, Hirooka T, Ueda C, Noda K. Intraoperative bleeding in endoscopic submucosal dissection in the stomach and strategy for prevention and treatment. Digestive Endoscopy 2006; 18 (suppl 1): S123-7. [ Links ]
29. Toyonaga T, Nishino E, Dozaiku T, Ueda C, Hirooka T. Management to prevent bleeding during endoscopic submucosal dissection using the flush knife for gastric tumors. Digestive Endoscopy 2007; 19 (suppl 1): S14-8. [ Links ]
30. Hashimoto S, Kobayashi M, Takeuchi M, sato Y, Narisawa R, Aoyagi Y. The efficacy of endoscopic triamcinolone injection for the prevention of esophageal stricture after endoscopic submucosal dissection. Gastrointestinal Endosc 2011; 74 (6): 1389-92. [ Links ]
31. Isomoto H, Yamaguchi N, Kakayama T, et al. Management of esophageal stricture after complete circular endoscopic submucosal dissection for esophageal squamous cell carcinoma. BMC Gastroenterology 2011; 11: 46. [ Links ]
32. Ishihara R, Ishi H, Uedo N, et al. Comparison of EMR and endoscopic submucosal dissection for en bloc resection of early esophageal cancers in Japan. Gastrointest Endosc 2008; 68: 1066-72. [ Links ]
33. Repici A, Hassan C, Carlino A, et al. Endoscopic submucosal dissection in patients with early esophageal squamous cell carcinoma: Results from a prospective Western series. Gastrointest Endosc 2010; 71: 715-21. [ Links ]
34. Chaves DM, Maluf Filho F, de Moura EG, et al. Endoscopic submucosal dissection for the treatment of early esophageal and gastric cancer – initial experience of a western center. Clinics 2010; 65: 377-82. [ Links ]
35. Ishi N, Horiki N, Itoh T, et al. Endoscopic submucosal dissection with acombination of small-caliber tip transparent hood and flex knife is a safe and effective treatment for superficial esophageal neoplasias. Surg Endosc 2010; 24: 335-42. [ Links ]
36. Lee CT, Chang CY, Tai CM, et al. Endoscopic submucosal dissection for early esophageal neoplasia: A single center experience in Taiwan. Journal of the Formosan Medical Association 2012, in press. [ Links ]











 text in
text in