Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.3 Bogotá July/Sept. 2013
Síndrome de enterocolitis inducido por proteínas de la dieta: Reporte de casos
Wilson Daza, MD (1), Silvana Dadán, MD (2), María Carolina Uribe, MD (3)
(1) Gastroenterólogo pediatra, Magíster Nutrición Clínica, Director de Gastronutriped y del Postgrado Gastroenterología Pediátrica Universidad El Bosque. Bogotá, Colombia.
(2) Nutricionista clínica, Magíster Nutrición Clínica, Profesor Asistente postgrados de Pediatría y Gastroenterología Pediátrica. Universidad El Bosque. Bogotá, Colombia.
(3) Fellow de Gastroenterología Pediátrica, Universidad El Bosque. Bogotá, Colombia.
Fecha recibido: 29-01-13 Fecha aceptado: 26-06-13
Resumen
A propósito de 2 casos clínicos de pacientes con antecedente de enterocolitis neonatal, se presenta el tema de síndrome de enterocolitis inducido por proteínas de la dieta. Este es un tipo de alergia alimentaria no mediada por Ig E, de presentación severa, con incidencia y prevalencia desconocidas y cuya sospecha clínica, diagnóstico y manejo oportuno, se anteponen al desarrollo de complicaciones severas que incluso pueden llevar a la muerte.
Palabras clave
Síndrome de enterocolitis inducido por proteínas de la dieta, reto oral, skin prick test, alergia alimentaria, alergia a la proteína de leche de vaca, introducción de alimentos sólidos, lactancia materna.
INTRODUCCIÓN
En los últimos años, las alergias han ido en aumento y las alergias a las proteínas de la dieta no son la excepción, de hecho, más de 5% de los niños desarrolla alergia a las proteínas de la leche u otra clase de proteínas (Walker-Smith, Murch, Wood). Existen diferencias geográficas, es decir, diferencias en la incidencia de las alergias a determinados alérgenos alimentarios entre países, en parte, por variaciones genéticas de la respuesta inmune según la etnia o costumbres alimentarias, entre otras, que condicionan distintas expresiones de la patología a nivel mundial.
Existen tres tipos de reacciones que median los mecanismos fisiopatológicos y explican el desarrollo de una alergia alimentaria: mediados por inmunoglobulina E (Ig E) o hipersensibilidad inmediata, no mediados por Ig E o respuesta tardía o mixta, que involucran ambos tipos (tabla 1). Es fundamental tener presente este espectro de manifestaciones y mediadores para poder hacer diagnóstico oportuno, considerando que las pruebas de rutina para alergia tales como las pruebas cutáneas e Ig E específicas pueden resultar negativas.
Se presentan dos casos con relación al síndrome de enterocolitis inducido por proteínas de la dieta (FPIES), que ilustran cómo la enfermedad alérgica puede confundirse con enfermedades de presentación pediátrica común, y en este sentido, la relación temporal entre la sintomatología y la exposición a los alimentos brindan una guía clave para el abordaje y el diagnóstico diferencial.
Caso 1
Paciente de género masculino, remitido por cirugía pediátrica a la edad de 8 meses, por antecedente de enterocolitis necrotizante (ECN), producto del primer embarazo controlado, pretérmino de 37 semanas, con un peso al nacer de 2.500 gramos y talla de 51 cm. La madre cursó con ruptura prolongada de membranas y al nacer documentaron bajo peso por lo cual lo hospitalizan en Unidad de Recién Nacidos. Recibió lactancia materna exclusiva por 8 días, y desde entonces alimentación mixta con fórmula de inicio con la que continuó hasta el sexto mes. Durante la estancia hospitalaria neonatal presentó deterioro clínico, emesis, distensión abdominal, deposiciones sanguinolentas, con una radiografía de abdomen que mostró perforación intestinal, por lo que diagnosticaron ECN III B. Necesitó manejo quirúrgico, donde se encontró un colon "acartonado", requirió colostomía y se sospechó aganglionosis por lo que se tomaron biopsias con las que se descartó enfermedad de Hirschprung. No obstante, hubo hallazgos de folículos linfoides hiperplásicos, infiltrado linfohistoplasmocitario, inflamación crónica leve, colitis crónica con actividad y recuento de eosinófilos aumentados. Durante el seguimiento, realizaron colon por enema sin evidencia de zonas de transición, por lo que cirugía pediátrica programó cierre de colostomía cuando el niño tenía 5 meses de vida. Al segundo día de postoperatorio presentó deterioro con perforación colónica y peritonitis, en esta oportunidad la biopsia mostró colitis crónica moderada activa focal con ulceración. Inició ablactación a los 6 meses de edad con cereales, a los 7 meses de edad se introduce leche de vaca sin modificar, pescado, soya, maní (en forma de chocolatina). Dada la historia de 2 eventos de enterocolitis, histopatología que muestra hiperplasia folicular, infiltración inflamatoria y eosinofilia, hallazgo en colonoscopia extra institucional de colitis, Rast positivo clase I para clara de huevo, antecedentes de prematurez, alimentación láctea mixta, ablactación con inclusión de alérgenos alimentarios, bronquiolitis, 2 episodios importantes de diarrea y persistencia crónica de deposiciones alteradas (Bristol 6 fétidas por colostomía y rectorragia a pesar de colostomía), se correlaciona el cuadro con alergia alimentaria tipo FPIES. Por lo anterior, se inicia fórmula semielemental y se eliminan leche de vaca y huevo de su alimentación. Con este nuevo tratamiento se observó evolución favorable, disminución en la frecuencia de las deposiciones que además alcanzaron consistencia normal, y hubo progresión ponderal sostenida.
Caso 2
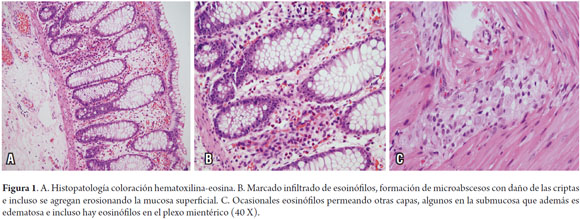
Paciente de 1 mes, de género masculino, remitido por cirugía pediátrica en postoperatorio tardío de colostomía. Producto de primer embarazo controlado, parto vaginal, con peso al nacer de 3.090 gramos, talla 52 cm; primera deposición a las 48 horas de vida. Desde los tres días de vida, posterior a recibir la primera y única toma con fórmula de inicio, presentó emesis biliosa y deposiciones escasas, con deterioro progresivo dado por distensión abdominal, letargia y dificultad respiratoria. Por lo anterior, acudió a urgencias, sospecharon enterocolitis y documentaron obstrucción intestinal, por lo que requiere sigmoidectomía y colostomía. El reporte de biopsia indicó inervación normal con marcado infiltrado de eosinófilos, con formación de microabscesos y erosiones de la mucosa, además, edema de submucosa e incluso hay eosinófilos en el plexo mientérico (figura 1). En los paraclínicos, se encuentra eosinofilia periférica (Recuento absoluto 991), sangre oculta en heces positiva, hematíes en heces 8-10 por campo. Se descartó fibrosis quística. En la valoración antropométrica se documenta desnutrición proteico-calórica compensada y al examen físico, eczema generalizado con placa eritematosa en región lateral izquierda del cuello. Con base en lo anterior, se sospecha FPIES, y como el niño se alimenta con leche materna y fórmula, se indica a la mamá una dieta restrictiva para leche de vaca, soya, frutos secos y semillas y al niño, además de leche materna con dieta de eliminación, se le prescribe una fórmula extensamente hidrolizada para complementar. A los 6 meses de edad se inicia complementaria, con emesis importante ante la ingesta de aguacate y papaya que requiere manejo en urgencias, por tanto, se deciden suspender temporariamente de la dieta. Independiente de lo anterior, el niño ha mostrado buena evolución clínica.
DISCUSIÓN
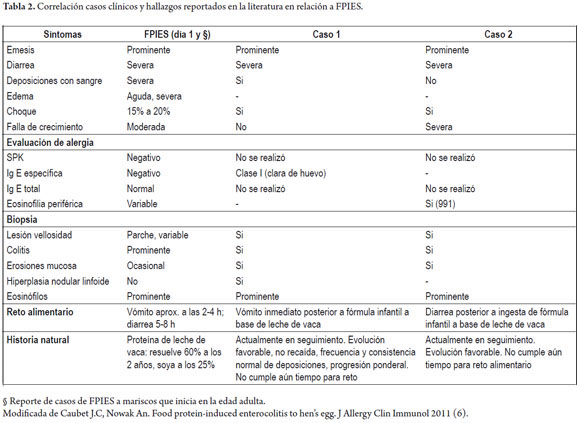
El síndrome de enterocolitis inducido por proteínas alimentarias (FPIES) es una respuesta de hipersensibilidad no mediada por inmunoglobulina E, caracterizada por síntomas gastrointestinales y respuesta inflamatoria sistémica, que se presenta en niños (1) (tabla 2).
Este síndrome fue descrito por primera vez por Rubin, en un paciente con diarrea sanguinolenta severa que resolvió con restricción de leche de vaca; en 1960, Ikol refiere reacciones gastrointestinales severas en respuesta a ingesta de arroz y trigo consistentes con FPIES. Gryboski, en 1967 mostró 21 niños con alergia gastrointestinal después de la ingesta crónica de leche, manifestada como diarrea (15/21), vómito (5/21), vómito y diarrea (1/21) y cólico (2/21), los síntomas mejoraron cuando las proteínas causales se eliminaron de la dieta y recurrieron con su reintroducción. Posteriormente, Powell caracterizó esta condición como enterocolitis inducida por proteínas de la leche de vaca y de soya; 20 años más tarde, Sicherer y colaboradores describen otros 22 pacientes, que reaccionaron a la leche, soya y 31% a ambos (4).
A partir de estas descripciones iniciales han surgido reportes adicionales; sin embargo, persiste el desconocimiento de la entidad y por ende, falta diagnóstico o el diagnóstico es erróneo, la falta de exámenes diagnósticos específicos, así como las presentaciones atípicas hacen que esta patología no se identifique apropiada y oportunamente (1).
Generalmente, se presenta en lactantes menores de 9 meses, con síntomas gastrointestinales como vómitos repetidos, diarrea o ambos en las primeras 24 horas posterior a la ingesta de proteína, en ausencia de síntomas mediados por Ig E, como rash, urticaria o síntomas respiratorios. Cuando se emplea una prueba de "eliminación" de la leche de vaca de la dieta desaparecen (5).
Katz y colaboradores, en una cohorte de recién nacidos israelíes, muestran una incidencia acumulativa de 0,34% al año de edad de FPIES secundario a las proteínas de la leche de vaca, comparada con 0,5% de alergia mediada por Ig E en la misma población; en 65% de los casos la edad promedio de presentación es a los 30 días, los síntomas aparecen con la primera exposición, 16% después de 4 días y el restante luego de 2-4 semanas posterior a la exposición. Sin embargo, faltan estudios que permitan extrapolar los datos a la población general.
Algunas investigaciones muestran predominancia en el género masculino (52-60%), lo cual guarda relación con los dos casos que se presentan en este artículo; entre 30-60% tienen enfermedad atópica como dermatitis, asma, rinitis alérgica, alergia alimentaria mediada por Ig E, esofagitis eosinofílica e hipersensibilidad a drogas. La historia familiar de atopia es positiva en aproximadamente 50-80% de los casos, incluyendo 20% familiar con historia de alergia alimentaria mediada por Ig E. Asimismo, se ha descrito FPIES de presentación típica en gemelos idénticos (1).
Los agentes causales más comunes son las proteínas de la leche de vaca, soya y arroz. Las alergias desencadenadas por leche de vaca y soya son típicamente diagnosticadas entre 1 y 3 meses de edad. La presentación clínica puede retrasarse en niños que reciben lactancia materna exclusiva. El FPIES inducido por alimentos es diagnosticado típicamente a edades más tardías, aproximadamente entre los 4 y 8 meses, en relación con el tiempo de introducción de sólidos. La edad promedio para el desarrollo de FPIES es a los 5,5 meses.
Otros alimentos que se han correlacionado con el desarrollo de FPIES son cereales como avena, cebada y trigo, aves de corral (pavo y pollo), leguminosas (arvejas, lentejas), habichuelas, maní, batata, calabaza, clara de huevo, algunas frutas, papa, cordero y pescado.
En el estudio publicado por Nowak-Wegrzyn y colaboradores, 80% de los niños con FPIES reaccionan a más de un alimento, 65% tienen diagnóstico previo de FPIES a las proteínas de la leche o soya. Existen pocos casos reportados con relación al trigo, considerado a través de la historia como potencialmente alergénico ya que su introducción tardía al igual que la de otros alimentos, más allá de la ventana de susceptibilidad inmunológica, constituyen el gatillo para desarrollar FPIES (1, 6).
A pesar de que el arroz es considerado un alimento hipoalergénico, algunos describen el FPIES secundario a ingesta de arroz, como una de las formas de presentación más severas, con múltiples episodios, hospitalizaciones frecuentes y evaluaciones extensas, determinando que el diagnóstico sea tardío.
La lactancia materna brinda protección a través de múltiples mecanismos, especialmente a través de anticuerpos de tipo Ig A, así como mediante el pasaje de proteínas parcialmente procesadas al niño, entre otros. Adicionalmente, la cantidad de proteínas que pasan a través de la leche pueden ser inferiores a las necesarias para desencadenar los síntomas. Sin embargo, existen casos de FPIES asociados con la ingesta de leche materna, es por esto que los alimentos que se sospechan como desencadenantes deben ser retirados de la dieta materna si ocurren reacciones asociadas.
La fisiopatología es pobremente entendida, se cree que existen antígenos específicos contra células T, respuesta humoral de anticuerpos específicos y citoquinas inflamatorias que modifican la permeabilidad de la barrera intestinal involucrada. Los hallazgos endoscópicos con relación a la mucosa friable, colitis difusa, compromiso ileal variable, las ulceraciones rectales y el sangrado, se consideran respuesta inflamatoria local ante la ingesta de antígenos, que llevan al aumento en la permeabilidad intestinal y cambio en el fluido, resultando en emesis, diarrea, deshidratación y letargia.
Algunos estudios han demostrado aumento de los receptores para el factor de necrosis tumoral (TNF alfa) y disminución del factor de crecimiento transformante beta (TGF-b) en la mucosa intestinal en el FPIES; igualmente, se ha implicado a la interleucina 17. Sin embargo, faltan estudios que comprueben su papel en la patogénesis (2).
Los síntomas incluyen vómito profuso y diarrea que inicia 1 a 3 horas posterior a ingesta del agente causal y que determina deshidratación, hipotensión y choque, hipotermia, palidez y letargia (3).
En niños más grandes y adultos se presentan náuseas severas, dolor abdominal y vómito luego de la ingesta de alimentos, especialmente pescados y mariscos. También se han relatado casos de FPIES en adultos (1).
Las formas agudas y crónicas difieren en su presentación; cuando el alimento causal es parte de la dieta regular, el FPIES se presenta con síntomas crónicos, como ocurre en los dos casos presentados. No obstante, existen informes de casos severos en los primeros días de vida. Los síntomas crónicos resuelven entre los 3-10 días después de retirar el agente causante. Las manifestaciones agudas ocurren cuando el alimento causal es ingerido de manera intermitente o después de largos periodos de haberlo evitado, los síntomas ocurren horas después de su ingesta e incluso se ha reportado con la primera exposición a un alimento (1).
En el abordaje de urgencia, signos y síntomas llevan a hacer diagnóstico diferencial con sepsis, gastroenteritis viral e incluso, valoración por el grupo quirúrgico; análisis en sangre, radiológicos, enemas de bario y endoscopias. El tratamiento frecuentemente requiere rehidratación endovenosa y antibióticos por la presunta sepsis. En otros casos, ante la sospecha de abdomen quirúrgico son intervenidos (1).
Las manifestaciones del FPIES se sobreponen con otras reacciones de hipersensibilidad gastrointestinal, no mediada por IgE, incluyendo proctocolitis, enteropatía inducida por proteínas de la dieta y otros desórdenes gastrointestinales eosinofílicos (tabla 1).
Los criterios diagnósticos no se han establecido, no obstante, entre ellos se han propuesto algunos, como edad menor a 9 meses al momento del diagnóstico, la exposición repetida a los alimentos provoca síntomas gastrointestinales sin otra causa justificada, ausencia de síntomas que puedan sugerir una reacción mediada por Ig E, al retirar el alimento causante resuelven los síntomas y la reexposición o el reto oral desencadena la sintomatología en un tiempo promedio de 4 horas (1). Todos los anteriores, coinciden con los casos presentados.
El vómito es el síntoma más común, la diarrea se presenta en alrededor de una cuarta parte de los pacientes. En 35% existe metahemoglobinemia, estos niños tienen apariencia pálida grisácea, se ha descrito en casos en casos de reacciones severas, pudiendo requerir tratamiento con bicarbonato; sin embargo, se desconoce la causa, se propone que la inflamación intestinal determina la disminución de la actividad catalasa e incremento de los nitratos. En 75% de los casos el niño luce enfermo y en 15-20% desarrolla hipotensión y choque que requiere hospitalización; 50% necesita líquidos endovenosos y algunos pocos vía oral (1).
Los hallazgos en el laboratorio incluyen incremento en el número de neutrófilos mayor a 3500/mm3 a las 5 u 8 horas después de iniciado el reto oral, aunque no es necesario para hacer el diagnóstico.
Existe controversia en cuanto a la realización o no del reto oral, algunos consideran que debe hacerse para confirmar el diagnóstico y la resolución del FPIES. Otros, sugieren que el diagnóstico se base en criterios clínicos, porque el reto alimentario en ellos se estima como un procedimiento de alto riesgo, debido a que 50% de estos pacientes requiere hidratación endovenosa. El diagnóstico de preferencia es acorde con criterios clínicos.
Algunas investigaciones reportan relación con hipoalbuminemia y poca ganancia de peso, menor a 10 gr/día como factores predictores de FPIES ante la ingesta de proteínas de la leche de vaca. El test de parche ha demostrado ser útil en el seguimiento y para predecir desenlaces, sin embargo, sus resultados aún no son validados. Muchos niños con FPIES tienen Skin Prick Test (SPT) negativo y niveles indetectables de Ig E específica para alérgenos alimentarios al momento del diagnóstico. Sicherer y colaboradores observaron que niños con niveles de Ig E detectables tienen un curso más grave y están en riesgo de desarrollar síntomas inmediatos mediados por Ig E (1).
Otros estudios han demostrado leucocitos elevados en jugo gástrico, no obstante, su utilidad también debe ser validada con más estudios (1).
Las biopsias generalmente revelan atrofia de la vellosidad, edema tisular y abscesos crípticos, así como incremento en el número de linfocitos, eosinófilos, células mastocíticas e inmunoglobulina M y A (1).
Es una patología frecuentemente subdiagnosticada y requiere hacerse diagnóstico diferencial con formas agudas de anafilaxia, sepsis, infecciones gastrointestinales, desórdenes metabólicos y emergencias quirúrgicas (5, 6).
En los niños que presentan sangrado en las deposiciones (visible u oculta), el diagnóstico diferencial incluye condiciones comunes como fisuras anales, colitis infecciosa e hiperplasia nodular linfoide. Se deben tener en cuenta algunas condiciones menos comunes como enterocolitis necrotizante, intususcepción intestinal, púrpura de Henoch-Shonlein, fiebre familiar del mediterráneo, divertículo de Meckel, pancreatitis, enterocolitis secundaria a aganglionosis en la enfermedad de Hirschsprung, colitis amebiana y enfermedad inflamatoria intestinal. Es un verdadero reto diferenciar FPIES de otros desórdenes gastrointestinales inducidos por proteínas de la dieta, incluyendo proctocolitis, enteropatía y gastroenteropatía eosinofílica, los cuales difieren en severidad y persistencia (6).
Para el manejo de FPIES, el paso principal implica evitar el contacto y consumo de las proteínas alimentarias desencadenantes. En caso de alergia a las proteínas de la leche de vaca se necesita usar una fórmula a base de hidrolizado de caseína o suero, y recordar que hasta 60% de estos niños pueden hacer reacción cruzada o tener alergia concomitante a la soya, por lo cual el uso de fórmulas con base en soya no se recomienda en este tipo de pacientes; aproximadamente 20% de los niños requiere fórmula elemental (1).
El tratamiento de las formas agudas incluye fluidos intravenosos y esteroides (dosis única); epinefrina en caso de hipotensión sin respuesta a líquidos. Cuando se titulan niveles de inmunoglobulina E específica para proteínas alimentarias, epinefrina y antihistamínicos pueden aliviar los síntomas mediados por IgE.
Debido a que los episodios de FPIES frecuentemente no se reconocen en la presentación aguda, es fundamental que familiares o pacientes informen de la entidad cuando llegan a urgencias.
Cuando el diagnóstico acontece previo al inicio de la alimentación complementaria, se aconseja evitar proteínas de la leche de vaca y soya, antes del primer año de vida o de la resolución de la entidad, así como tener precaución con la selección e introducción de cereales y leguminosas, ya que son los alérgenos más frecuentemente asociados con esta patología.
Estas recomendaciones son empíricas, no existen estudios controlados que determinen el tiempo óptimo de introducción de estos alimentos en niños con FPIES (1).
El reto alimentario se hace dentro de los 12 a 18 meses posterior a la reacción FPIES o según el tipo de alérgeno y el tiempo establecido para reintroducir el alimento en la dieta, de esta manera se vigila si la tolerancia inmunológica se ha establecido (6).
Algunos estudios reportan que a la edad de 3 años la resolución es de 60% de los FPIES secundarios a proteínas de la leche, 27% de la soya, 40% arroz y 67% a los vegetales. Otros estudios reportan tasas de resolución más altas (1).
Los niveles de anticuerpos específicos tipo Ig E cuando fueron positivos al diagnóstico, deben chequearse durante el seguimiento y antes del reto.
CONCLUSIONES
La prevalencia de FPIES es relativamente alta, por tanto, los pediatras deben estar alertas y tener en cuenta esta condición dentro de los diagnósticos diferenciales para evitar hospitalizaciones innecesarias o sobretratamiento. Se debe sospechar en aquellos lactantes con factores de riesgo para alergia alimentaria, que debutan con vómito o diarrea y en algunos casos con signos de bajo gasto como hipotensión, deshidratación, hemorragia digestiva, choque y hasta la muerte, con el fin de evitar complicaciones.
REFERENCIAS
1. Leonarda S, Nowak-Wegrzy. Clinical diagnosis and management of food protein induced enterocolitis síndrome. Wolters Kluwer Health 2012; 24: 1040-8703. [ Links ]
2. Shoda T, Hashimoto K, Morita. Elevation of Serum IL-17 Levels was demonstrated after Oral Food Challenge in Infants with Food Protein-Induced Enterocolitis Syndrome. J Allergy Clin Immunol 2012; 127: 2. [ Links ]
3. Katz Y, Rajuan N, Goldberg M, Cohen A. The Incidence, Manifestations and Natural Course of Food Protein Induced Enterocolitis Syndrome (FPIES). J Allergy Clin Immunol 2012; 125: 2. [ Links ]
4. Morita H, Nomura I, Matsuda A. Food protein-specific lymphocyte proliferation assay for the diagnosis of Food Protein-Induced Enterocolitis Syndrome. J Allergy Clin Immunol 2010. [ Links ]
5. Katz Y, Goldberg M, Rajuan N. The prevalence and natural course of food protein–induced enterocolitis syndrome to cow's milk: A large-scale, prospective population-based study. J Allergy Clin Immunol 2011; 127: 647-53. [ Links ]
6. Caubet JC, Nowak AN. Food protein-induced enterocolitis to hen's egg. J allergy Clin Immunol. December 2011. [ Links ]
7. Allen K, Hill D, Helne R. Food allergy in childhood. MJA 2006; 185(7). [ Links ]











 text in
text in