Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.3 Bogotá jul./set. 2013
Hepatopatología para gastroenterólogos y hepatólogos. Segunda parte
Terminología útil en la interpretación de los hallazgos histopatológicos
Rocío del Pilar López Panqueva, MD (1)
(1) Jefe sección anatomía patológica, Hospital Universitario Fundación Santa Fe de Bogotá. Profesora Facultad de Medicina Universidad de los Andes. Bogotá, Colombia. E-mail: rocio.lopez@fsfb.org.co
Fecha recibido: 24-06-13 Fecha aceptado: 26-06-13
Resumen
Debemos conocer claramente no solo la terminología utilizada en el diagnóstico histopatológico de la patología hepática, sino entender el significado de los cambios morfológicos y su importancia en la adecuada correlación clínico patológica.
Palabras clave
Hígado, biopsia, estudio histopatológico, cambios morfológicos.
En el estudio histopatológico del hígado debemos determinar la existencia de anomalías no solo arquitecturales, sino de cada uno de los componentes celulares. El objetivo de este segundo artículo es mostrarles los cambios morfológicos que pueden ocurrir ante una injuria específica y la terminología que describe cada uno de estos cambios.
CAMBIOS HEPATOCELULARES
Ocurren como respuesta a una lesión de cualquier etiología que altere la homeostasis celular, por lo tanto estos pueden ser observados en una gran cantidad de entidades o ser la clave diagnóstica para otras. La lesión celular puede ocurrir por ejemplo como consecuencia de un evento hipóxico o isquémico, por una infección o injuria tóxico- medicamentosa, también por imbalance metabólico, genético o inmunológico, entre muchos otros. Las expresiones morfológicas son igualmente variables y dependerán del tipo de injuria, de su severidad y de la reversibilidad de los mismos. Enumeraremos los más importantes y frecuentemente utilizados.
Edema celular, cambio balonizante o degeneración balonizante
Es el aumento del volumen celular y puede ser tanto un evento fisiológico con un papel importante en el metabolismo celular como respuesta al estrés oxidativo a cambios medioambientales u hormonales, así como a una respuesta a la injuria celular por depleción del ATP, alteración de la membrana celular con disrupción de la malla de filamentos intermedios citoplasmáticos.
Morfológicamente se observan células más grandes, 2 ó 3 veces el tamaño normal de un hepatocito, con amplio citoplasma claro, vacuolado, el acúmulo de filamentos intermedios se verá como un material rosado amorfo depositado en el citoplasma celular. Ultraestructuralmente se traduce en edema mitocondrial con proyecciones de la membrana celular. Este cambio puede verse aisladamente, en grupos celulares o ser una manifestación difusa (figura 1) (1).
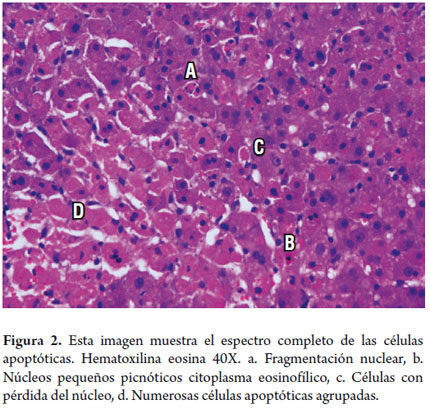
Apoptosis, cuerpos acidofílicos o cuerpos de Councilman
Es una forma de muerte celular en la cual hay ruptura de la membrana citoplasmática con condensación de la cromatina nuclear, fragmentación nuclear y celular. Estos cambios ocurren a consecuencia de la activación de caspasas y endonucleasas que inducen la alteración de las proteínas estructurales y del ADN. La apoptosis es un hallazgo normal durante el desarrollo y la remodelación hepática, así mismo un cambio frecuentemente observado en procesos inflamatorios agudos o crónicos, como hepatitis virales o enfermedad hepática autoinmune, en esteatohepatitis o en la enfermedad hepática inducida por tóxicos o drogas.
Observamos hepatocitos muy disminuidos en su tamaño, de formas romboidales o redondeadas, con citoplasmas intensamente eosinofílicos y núcleos oscuros o picnóticos. Cuando ocurre fragmentación del citoplasma de estas células forman los cuerpos acidofílicos con pérdida completa de sus núcleos (figura 2) y salen al espacio sinusoidal donde posteriormente van a ser fagocitados por las células de Kupffer (2).
Necrosis focal o "Spotty" necrosis y necrosis confluente
Es una forma de muerte celular un poco diferente a la apoptosis en la que ocurre, además de edema celular, vacuolización, cariolisis y liberación del contenido celular.
En la necrosis focal la muerte celular produce una respuesta inflamatoria con acúmulo de linfocitos y de células de Kupffer hipertróficas que contienen material pardo de lipofuschina el cual es PAS diastasa positivos y representan el material lisado y los detritus fagocitados. En estos sitios de necrosis hay colapso y ruptura de la trama reticular.
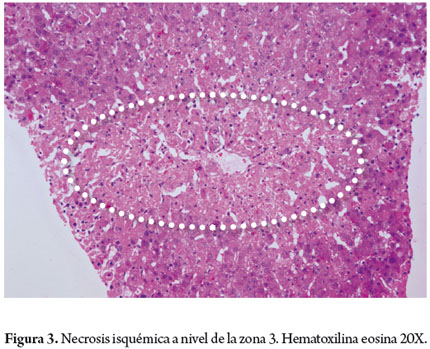
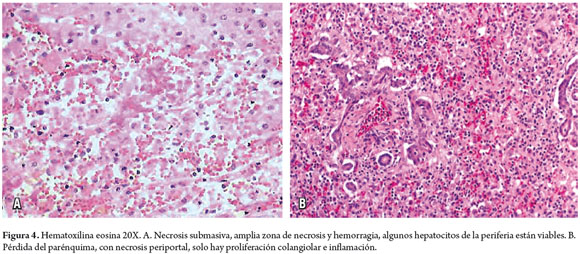
En la necrosis confluente la muerte celular ocurre en una distribución de tipo acinar o zonal, pudiendo comprometer grandes áreas parenquimatosas, con colapso completo de la trama reticular. Dependiendo de la severidad de la lesión puede ser por ejemplo una necrosis centrolobulillar como la observada en un evento isquémico de un choque hipovolémico o por drogas o tóxicos (figura 3), necrosis confluente porta-porta o porta-central en las hepatitis crónicas, necrosis midzonal ocurre en la eclampsia, también pueden comprometer grandes áreas en la necrosis submasiva o masiva como se observa en las hepatitis fulminantes (figura 4) La necrosis zonal periportal es rara (3).
Necrosis de coagulación o degeneración coagulativa
Es la observada en las injurias vasculares como los infartos, en la fiebre amarilla o fiebres hemorrágicas usualmente de etiología viral, algunas injurias tóxicas como envenenamiento por acetaminofén, en las necrosis tumorales o luego de procedimientos como la quimioembolización, ablación por radiofrecuencia o inyección de etanol de enfermedades tumorales como el hepatocarcinoma. Las células son eosinofílicas muy claras, pierden el detalle celular, se identifican "sombras" celulares (figura 5).
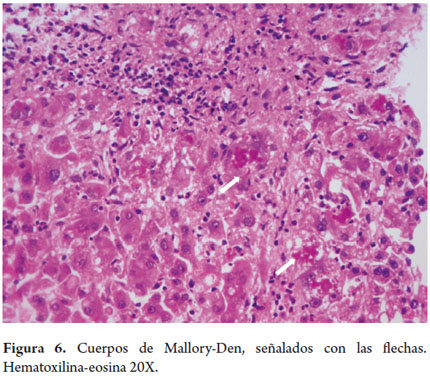
Cuerpos de Mallory, hialina de Mallory o cuerpos de Mallory-Denk
Son células hepáticas siempre balonizadas que contienen acúmulos o inclusiones citoplasmáticas irregulares y eosinofílicas en su citoplasma (figura 6). Estos hepatocitos diferenciados tienen un patrón característico de expresión de queratinas tipo I (CK8) y de tipo II (CK18). Fueron descritos inicialmente en 1911 por el doctor Frank D Mallory y relacionadas con hepatitis alcohólica, pero son observados en un número importante de enfermedades hepáticas como por ejemplo la esteatohepatitis no alcohólica (NASH), enfermedad de Wilson, enfermedades colestásicas crónicas, toxicidad por algunos medicamentos como amiodarona, y en hepatocarcinomas. Recientemente fueron renombrados como cuerpos de Mallory Denk (4, 5).
Cambio oncocítico u oxifílico
Es cuando ocurre una apariencia intensamente eosinofílica, finamente granular en el citoplasma de los hepatocitos e indica la presencia de numerosas mitocondrias. Algunas veces mitocondrias individualmente muy grandes se hacen prominentes son las llamadas megamitocondrias, observadas en pacientes alcohólicos, son PAS negativas a diferencia de los glóbulos de α-1 antitripsina, que son PAS positivos.
Cambio graso o esteatosis
Es el acúmulo de glóbulos de grasa en el citoplasma de los hepatocitos, reflejan un imbalance entre la síntesis y la secreción de lípidos. Puede encontrarse como único hallazgo morfológico o formar parte de otro tipo de injuria hepática.
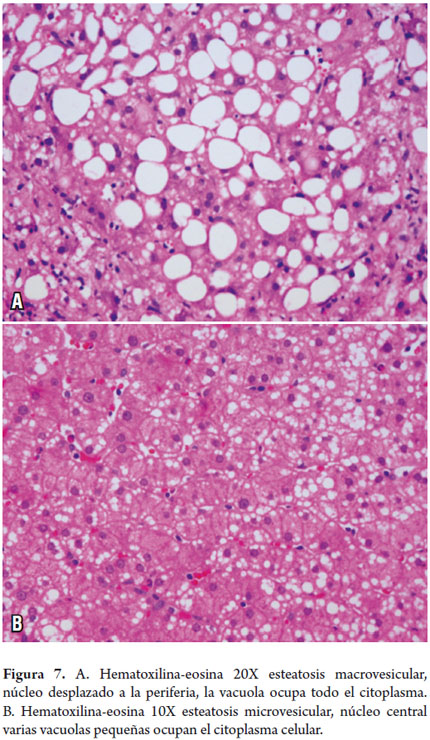
En la esteatosis macrovesicular hay una gran vacuola grasa que desplaza el núcleo hacia la periferia la vemos en enfermedad hepática grasa alcohólica o no alcohólica, obesidad, diabetes, enfermedades relacionadas con anomalías del metabolismo de los lípidos, hepatitis C, malnutrición o toxicidad medicamentosa.
En la esteatosis microvesicular observamos varias pequeñas gotas o vacuolas grasas intracitoplasmáticas que no desplazan el núcleo de la célula hepática como ocurre en el hígado agudo graso del embarazo, síndrome de Reye, en la toxicidad por ácido valpróico o tetraciclina y también en la enfermedad hepática alcohólica (figuras 7A y B) (6).
Degeneración xantomatosa, "Cholate Stasis" y degeneración pseudoxantomatosa
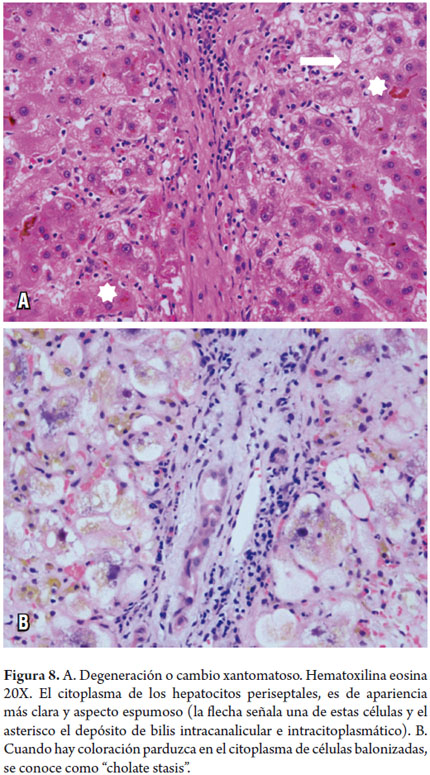
Se observa predominantemente en las enfermedades colestásicas crónicas, o colestásicas obstructivas, cuando por el acúmulo o retención de constituyentes biliares que normalmente son secretadas en la bilis pero donde las sales biliares son tóxicas para el hepatocito, produce edema celular con agregados en el citoplasma con pigmentación parduzca (Cholate stasis), dando una apariencia espumosa y pálida a los hepatocitos, en etapas iniciales de localización periportal (figura 11). No es inusual encontrar además cuerpos de Mallory-Denk. Como el cobre es un metal secretado por la bilis puede ser también demostrado en estas células con coloraciones especiales de cobre o de su proteína fijadora (figura 8) (6, 7).
Citoplasma en vidrio esmerilado o células "Ground- Glass"
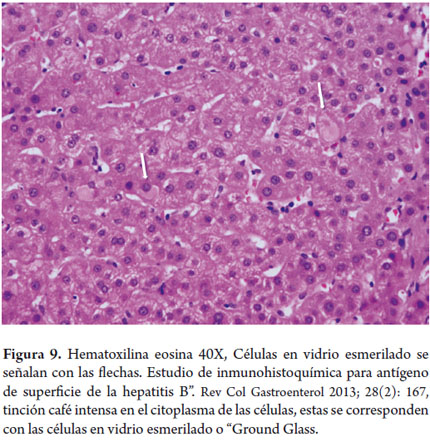
La apariencia de inclusión uniforme, rosada muy pálida en el citoplasma celular, indica la proliferación del retículo endoplásmico liso (figura 9). Se ha observado en hepatitis B por acúmulo de antígeno de superficie (HBsAg) que se mezcla con el retículo endoplásmico; son positivas para orceína, aldehído fuschina, victoria blue o estudios de inmunohistoquímica. También pueden ser vistas como respuesta a la ingestión crónica de algunas drogas como clorpromazina, barbitúricos, azatioprina, esteroides, fenitoína, cianamida, algunos analgésicos o en pacientes con múltiples drogas inmunosupresoras postrasplante hepático. En su diferenciación además de la historia clínica, estudios de histoquímica e inmunohistoquímica son de utilidad (8, 9).
Atrofia celular, atrofia trabecular
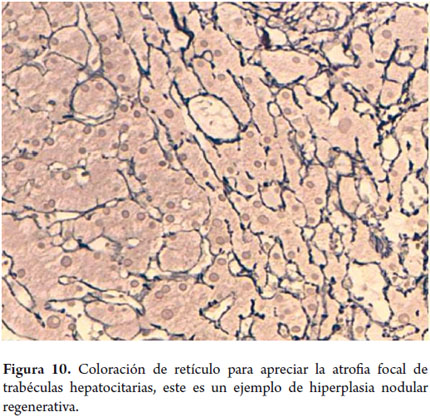
En la que hay atenuación o aplanamiento de los hepatocitos, con disminución de su tamaño (figura 10), y se observan trabéculas adelgazadas con preservación de la trama reticular. Acompaña en especial las enfermedades vasculares, por ejemplo.
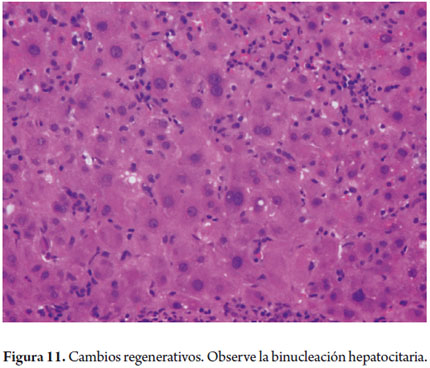
Cambios regenerativos e hiperplásicos
Los cambios regenerativos se expresan morfológicamente como anisonucleosis, nucléolos prominentes, binucleación y mitosis (figura 11).
La arquitectura también puede cambiar con placas dobles, nódulos regenerativos. Transformación gigantocelular o hepatocitos multinucleados, cambio más observado en la hepatitis neonatal.
CAMBIOS EN EL SISTEMA BILIAR
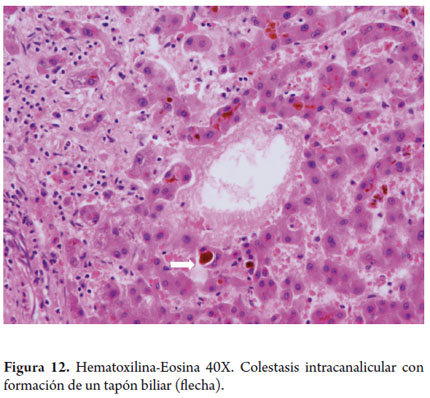
Canalículos biliares
Son observados únicamente cuando están dilatados y en respuesta a la estasis biliar. Mientras que los tapones biliares son canalículos dilatados por acúmulo y precipitación del pigmento biliar, (figura 12) en ocasiones los hepatocitos se disponen alrededor de los canalículos dando una apariencia pseudoglandular (figura 13).
Dúctulos, colangiolos o canales de Hering
Normalmente son inconspicuos o no visibles. La proliferación colangiolar ocurre en múltiples patologías, por ejemplo en las áreas periportales vecinas a las zonas de necrosis o cicatrices, se disponen en la periferia lejos de las ramas arteriales (Rev Col Gastroenterol 2013; 28(2):162, figura 8).
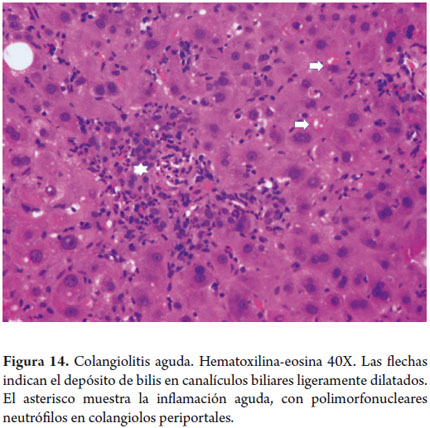
Colangiolitis aguda
La inflamación aguda puede acompañar a la proliferación colangiolar sin tener un significado especial por sí sola; diferente cuando esta se acompaña de estasis biliar con dilatación de colangiolos periportales indicando un proceso infeccioso severo usualmente acompañado de sepsis (figura 14).
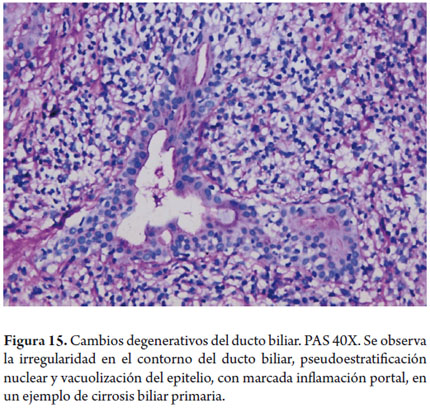
Ductos biliares interlobulares o acinares
El daño del epitelio ductal con cambios degenerativos de vacuolización, seudoestratificación nuclear, permeación intraepitelial de células inflamatorias o destrucción ductal acompaña a muchas enfermedades del tracto biliar, o a fenómenos de tipo rechazo agudo celular en postrasplantados.
La inflamación aguda o colangitis aguda puede indicar obstrucción mecánica, mientras que la inflamación o colangitis no supurativa acompañada de cambios degenerativos se observa especialmente en enfermedades colestásicas crónicas como cirrosis biliar primaria (figura 15) o colangitis esclerosante primaria. La dilatación de ductos biliares con formación de infartos biliares es típica de la obstrucción de ductos grandes.
CAMBIOS VASCULARES
Cuando nos referimos a las estructuras vasculares hepáticas estamos hablando tanto de los vasos grandes como de las ramas de la vena porta, arterias hepáticas, vénulas terminales o centrales y sinusoides. Podemos observar lesiones vasculares en forma primaria o secundaria a varias entidades sistémicas, formas agudas o crónicas, lesiones congénitas o hereditarias y para su clasificación se requiere tanto de una adecuada información clínica correlacionada con los cambios morfológicos observados (10).
Oclusión trombótica
Causa cambios de necrosis de tipo isquémico o congestión sinusoidal. Cuando hay trombosis portal o de las venas hepáticas (síndrome de Budd-Chiari) se plantean múltiples causas como estados de hipercoagulabilidad, presencia de masas, lesiones vasculares inflamatorias, infecciosas o congénitas, manipulación quirúrgica.
Inflamación: produce flebitis o arteritis
Compromiso de la microvasculatura, injuria sinusoidal y enfermedad veno-oclusiva: muestra múltiples patrones morfológicos según sea su etiología, por ejemplo, tóxicos o medicamentos, cambio isquémico, congestión y dilatación sinusoidal, inflamación o infiltración por lesión tumoral, amiloide o cadenas livianas.
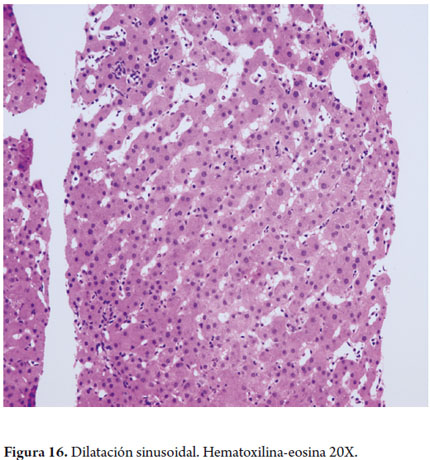
Dilatación sinusoidal: cuando está a nivel de la zona 3 indica obstrucción al flujo venoso de cualquier etiología (figura 16) y en la zona 1 puede ser causada por anticonceptivos orales.
Células de Kupffer se hipertrofian especialmente como respuesta fisiológica o patológica a la fagocitosis.
CAMBIOS INFLAMATORIOS
Observamos su intensidad, localización y tipo celular, pudiendo esto ser la clave diagnóstica en varias entidades (6).
Localización: a nivel periportal y portal se encuentra en las hepatitis crónicas o en enfermedades colestásicas crónicas. Cuando se observa inflamación a nivel acinar se relaciona mas con hepatitis agudas virales, tóxico medicamentosas o en injuria metabólica. A nivel periductal o intraductal nos sugiere enfermedades biliares o vasculares.
Tipo celular: las células plasmáticas y linfocitos acompañan enfermedades autoinmunes, los polimorfonucleares neutrófilos en infecciones agudas por ejemplo bacterianas o colangitis aguda ascendente, en zonas de infartos, los eosinófilos pueden sugerir la posibilidad de injuria inducida por drogas y es un elemento celular importante en el rechazo agudo celular postrasplante. Los granulomas epitelioides con o sin necrosis, con o sin células gigantes multinucleadas, tienen una muy larga lista de diagnósticos diferenciales entre los que se incluyen enfermedades infecciosas, toxicidad medicamentosa, sarcoidosis, reacción a cuerpo extraño, enfermedades autoinmunes
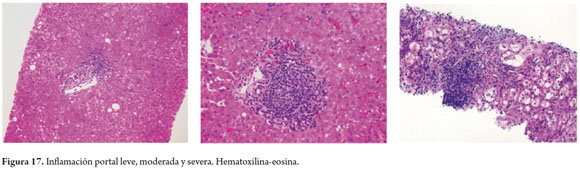
La cantidad y distribución de las células inflamatorias son útiles en la graduación de la severidad del compromiso hepático (figura 17).
FIBROSIS Y CIRROSIS
Al igual que lo descrito con la inflamación, la localización portal, periportal, periductal, intracinar o subsinusoidal, su distribución focal, difusa, segmentaria o lobular y la cantidad o severidad de la fibrosis leve, moderada o severa conformando nódulos cirróticos incompletos o completos; son los indicadores claves en el diagnóstico patológico.
La WHO clasifica la cirrosis basado únicamente en el tamaño de los nódulos siendo micronodular cuando miden menos de 3 mm o macronodular cuando son mayores de 3 mm de diámetro, mixtos cuando observamos una mezcla de los dos (6).
En ocasiones el diagnóstico de cirrosis o fibrosis en una biopsia puede ser muy difícil o imposible, por ejemplo cuando son nódulos cirróticos grandes, si la muestra está muy fragmentada y parcialmente rodeada por tejido fibroso, en biopsias subcapsulares o cuando la biopsia está tomada en una cicatriz.
Para la valoración de la fibrosis son indispensables los estudios de histoquímica los más utilizado son el tricrómico de Masson o retículo.
PATRONES DE INJURIA
La combinación de todos estos cambios dan lo conocido como patrones de daño hepático característicos de muchas entidades, su reconocimiento ayudará a establecer y limitar el diagnóstico diferencial cuando nos enfrentamos al estudio de una biopsia o un tejido hepático. Nombraremos solo algunos de los más frecuentemente encontrados en la práctica clínica y los cuales describiremos posteriormente en esta serie.
Patrón necroinflamatorio: agudo y crónico. Se observa inflamación y muerte celular (apoptosis o necrosis), es característico de las hepatitis virales, autoinmunes y algunas tóxico-medicamentosas.
Patrón de esteatohepatitis: caracterizado por la presencia de esteatosis en la zona 3, inflamación e injuria celular dada por balonización, necrosis o fibrosis pericelular o subsinusoidal.
Patrón colestásico: agudo y crónico. Estasis biliar e inflamación en el primero, depósito de bilis, degeneración xantomatosa, depósito de cobre, cuerpos de Mallory-Denk para el segundo.
Patrón vascular: se puede encontrar atrofia de trabéculas hepatocitarias, dilatación y congestión sinusoidal o infartos.
REFERENCIAS
1. Farber JL, Kyle ME, Coleman JB. Mechanisms of cell injury by activated oxygen species. Lab Invest 1990; 62: 670-679. [ Links ]
2. Bai J, Odin JA. Apoptosis and the liver: relation to autoimmunity and related conditions. Autoimmunity Rev 2003; 2: 36-42. [ Links ]
3. Jaeschke H, Gujral JS, Bajt ML. Apoptosis and necrosis in liver disease. Liver Int 2004; 24: 85- 89. [ Links ]
4. Zatloukal K, French SW, Stumptner C, et al. From Mallory to Mallory-Denk bodies. What, How, and why? Exp Cell Res 2007; 313: 2033-2049. [ Links ]
5. French SW, Bardag-Gorce F, Li J et al. Mallory-Denk body pathogenesis revisited. World J Hepatol 2010; 2: 295-301. [ Links ]
6. Burt A, Portmann B, Ferrel L. MacSween's Pathology of the Liver. Sixth edition. Churchill Livingstone Elsevier 2012. [ Links ]
7. Zollner G, Trauner M. Mechanisms of cholestasis. Clin Liver Dis 2008; 12: 1-26. [ Links ]
8. Vasquez JJ. Ground-glass hepatocytes: light and electron microscopy. Characterization of the different types. Histol Histopathol 1990; 5: 379-386. [ Links ]
9. Lefkowitch JH, Lobritto SJ, Brown Jr RS, et al. Ground-glass polyglucosan-like hepatocellular inclusions: A new diagnostic entity. Gastroenterology 2006; 131: 713-718. [ Links ]
10. Deleve, Valla and Garcia-Tsao. Vascular disorders of the liver. Hepatology 2009; 5: 1729-1764. [ Links ]











 texto en
texto en