Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.4 Bogotá Oct./Dec. 2013
Diagnóstico histopatológico de colitis microscópica: enfoque práctico
Mario Alexander Melo Uribe, MD. (1), Elías Augusto Castilla Puentes, MD. FACP. FASCP. (2)
(1) Médico patólogo, Compensar; Universidad de La Sabana. Bogotá, Colombia.
(2) Médico patólogo, FACP, FASCP, Departamento de Patología, Bethesda North Hospital, Cincinnati. Estados Unidos.
Fecha recibido: 16/10/13 Fecha aceptado: 27/08/13
Resumen
La colitis linfocítica y la colitis colagenosa son las dos formas histológicas de la colitis microscópica (CM), condición médica reconocida hace más de 30 años, habitual en pacientes adultos con diarrea crónica acuosa, sin cambios endoscópicos en la mucosa del colon y cuyo diagnóstico se establece exclusivamente en el examen histopatológico de las biopsias de colon. El objetivo de la presente revisión es familiarizar a los médicos patólogos quirúrgicos en práctica general con la morfología de la colitis linfocítica y la colitis colagenosa, así como con la importancia de los informes de patología y la de una buena comunicación con el médico endoscopista para el correcto diagnóstico de estas entidades, y brindar a estos pacientes el tratamiento adecuado.
Palabras clave
Colitis, colitis microscópica, colitis colagenosa, colitis linfocítica.
INTRODUCCIÓN
Colitis microscópica (CM) es un término utilizado para describir una condición médica caracterizada por diarrea crónica acuosa, una apariencia endoscópica casi normal de la mucosa del colon y cambios histopatológicos típicos (1). Se han descrito dos formas histológicas de CM: colitis linfocítica (CL) y colitis colagenosa (CC); cada una, con epidemiología, enfermedades asociadas y curso clínico semejantes. Adicionalmente, comparten aspectos histológicos similares, como una lámina propia con incremento de células inflamatorias y daño del epitelio superficial.
El término CM se ha utilizado desde 1980 (1), y aunque su incidencia era muy baja para ese entonces, publicaciones recientes demuestran un incremento en el número de casos, pues ahora se sitúa entre el 9,5%-10,2% de los casos de pacientes con diarrea crónica acuosa a quienes se les realiza endoscopia/biopsia (2,3).
Ni la etiología ni la patogénesis tanto de la CL como de la CC son aún muy claras. Sin embargo, estudios observacionales sugieren una asociación entre CM y varias enfermedades autoinmunes, como la tiroiditis autoinmune, la artritis reumatoide, la enfermedad celiaca y otras enfermedades como la enfermedad inflamatoria intestinal (EII) (4-6). El consumo de medicamentos, entre los que se destacan los antiinflamatorios no esteroideos (7), los inhibidores de la bomba de protones (8) y los inhibidores del receptor de histamina (ranitidina y cimetidina) (9,10), se han asociado tanto a CL como a CC.
El examen histopatológico de las biopsias de colon es esencial en el diagnóstico de CM. En general, el reconocimiento de las formas típicas de CL y de CC se logra, en la mayoría de los casos, con un excelente índice de acuerdo inter e intraobservador entre patólogos experimentados en patología gastrointestinal (11), pero las formas menos típicas presentan dificultad para su reconocimiento. El objetivo de la presente revisión es familiarizar a los médicos patólogos sin entrenamiento gastrointestinal específico con la morfología de la CL y de la CC, sugerir la uniformidad en sus informes y resaltar la importancia de una buena comunicación con el médico endoscopista para el correcto diagnóstico de estas entidades.
Para llevar a cabo esta revisión se adelantó una búsqueda de artículos originales y de revisión de tema publicados en inglés y en español, en revistas indexadas en las bases de datos de PubMed y Scielo, y algunos aportes personales de los autores. Se utilizaron para tal propósito las palabras clave, tanto en inglés como español, "Colitis", "Colitis Microscópica", "Colitis Linfocítica" y "Colitis Colagenosa".
COLITIS LINFOCÍTICA
Epidemiología
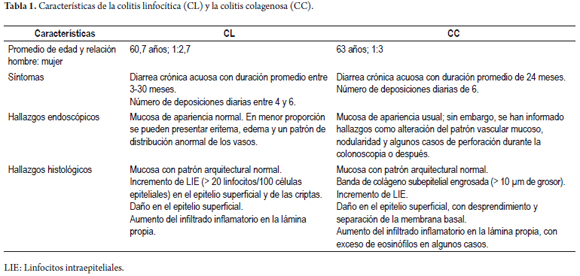
La incidencia de la CL en Europa varía entre 1,1-3,1/100 000 personas por año, con una prevalencia de 10-15,7/100 000 personas (2). En Norteamérica la incidencia era de 5,5/100 000 personas, con una prevalencia de 63,7/100 000 personas, para finales de 2001 (12). En América Latina se conocen cifras aisladas de prevalencia de CM en países como Uruguay (13), y en Colombia no se hallaron publicaciones sobre la epidemiología de la CM en la presente revisión. El promedio de edad de los pacientes al momento del diagnóstico es de 60,7 años, y es hasta 2,7 veces más común en mujeres que en hombres (14).
Sintomatología
Los pacientes con CL presentan diarrea acuosa crónica con una duración promedio antes del diagnóstico de entre 3 y 30 meses y un número de deposiciones diarias de entre 4 y 6 (15). Adicionalmente, otros síntomas, como dolor abdominal, incontinencia, urgencia, flatulencia y pérdida de peso, han sido asociados a la CL (3,16).
Hallazgos endoscópicos
La mayoría de los pacientes tienen una mucosa de apariencia endoscópica normal. En menor proporción pueden presentar eritema, edema y un patrón de distribución anormal de los vasos (17). Los cambios en la CL pueden ser irregulares en cuanto a su distribución por las diferentes porciones del colon, y ser más severos en el colon derecho (18). Se recomienda tomar múltiples biopsias del colon, incluyendo sus porciones ascendente, transversa, descendente y rectosigmoide, y enviarlas, preferiblemente, en recipientes separados (19).
Hallazgos histológicos
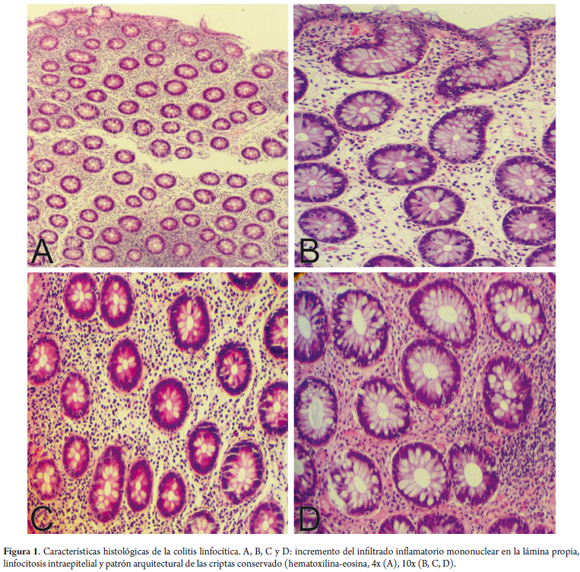
La CL se caracteriza por un incremento de los linfocitos intraepiteliales (LIE) (> 20 linfocitos/100 células epiteliales) tanto en el epitelio superficial como en el epitelio de las criptas (20), en una mucosa con un patrón arquitectural normal; todo ello, acompañado por daño en el epitelio superficial y un infiltrado inflamatorio mononuclear mixto (plasmocitos, linfocitos) y escasos eosinófilos en la lámina propia, en ausencia de un depósito colágeno subepitelial (21) (figura 1). El daño en el epitelio superficial está asociado a la infiltración por los linfocitos y a características degenerativas como vacuolas citoplasmáticas, pérdida de mucina, irregularidad nuclear, picnosis y aplanamiento (20).
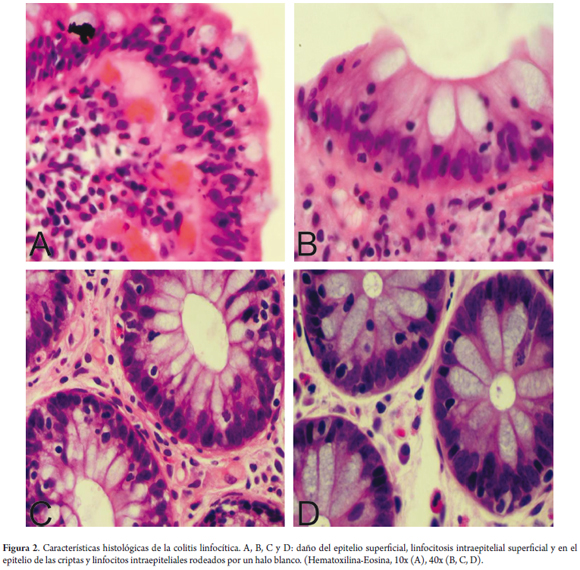
Los LIE tienen un núcleo pequeño y redondo y están rodeados, generalmente, por un halo claro (figura 2). La linfocitosis intraepitelial es evidente sin necesidad de contar, dado que la mayoría de los patólogos tienen una buena idea del patrón normal de distribución de las células inflamatorias en la mucosa del colon; sin embargo, en aquellos casos donde se tenga duda de si el número de LIE está aumentado se debe hacer un conteo de los linfocitos. Es necesario advertir que un aumento de LIE es un hallazgo normal en el epitelio superficial que recubre los agregados linfoides, y no debe ser interpretado como una CL; luego, no se recomienda contar LIE en estas zonas en el contexto de una CM (18).
La utilización de técnicas de inmunohistoquímica no son de vital importancia para el diagnóstico de CL, porque este se realiza, primordialmente, con la tinción de rutina de Hematoxilina-Eosina (HE). Sin embargo, algunas publicaciones concluyen que en un contexto clínico adecuado, la utilización de cluster of differentiation (CD3) puede tener un valor adicional en el diagnóstico de CL (22).
En la literatura han sido descritas dos variantes histopatológicas de CL; cada una de ellas, con muy pocos casos informados y sin aparente significado pronóstico para los pacientes. La primera de ellas es la CL paucicelular, descrita en pacientes con síntomas similares a los ya nombrados, pero histológicamente con focos salteados de leve incremento de LIE e infiltrado linfoplasmocitario en la lámina propia, separados por fragmentos de mucosa normal (23). La segunda variante es la CL con células gigantes, y se refiere a la presencia de células gigantes subepiteliales en el contexto de una CL típica (24).
Diagnóstico diferencial
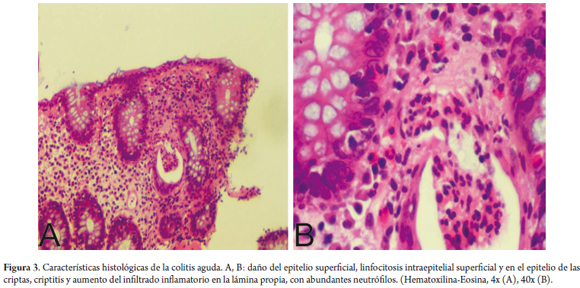
Entre los diagnósticos diferenciales más comunes de CL se pueden encontrar la colitis activa (aguda) en resolución, la CC, la EII y la enteropatía asociada a un linfoma de células T. Diferenciar entre una CL y una colitis activa autolimitada en resolución o una colitis activa superpuesta a una CL se basa en la presencia de neutrófilos en la colitis aguda (figura 3). En ambas entidades se presenta aumento de los LIE, pero los pacientes pueden verse más motivados a consultar en el contexto de una diarrea crónica que empeoró sus características recientemente (colitis activa infecciosa superpuesta).
En aquellos casos donde se presente el patrón de inflamación descrito, y en el contexto clínico adecuado, se recomienda firmarlos de una manera descriptiva, e indicar al médico tratante que se puede tratar de una CL con una colitis activa superimpuesta o de la fase de resolución de una colitis activa autolimitada (tabla 1). Se puede considerar la repetición de la colonoscopia/biopsia en dos o tres meses, si el problema diagnóstico persiste, para establecer el diagnóstico definitivo.
Una evaluación precisa de la banda colágena subepitelial ayuda a diferenciar entre una CL y una CC; sin embargo, en los casos con características limítrofes hacer la tinción de tricrómico de Masson puede ser de utilidad (ver más adelante). Diferenciar entre una CL y EII es sencillo, dada la presencia de una arquitectura anormal de las criptas en EII; no obstante, puede ser difícil en el contexto de una CL con características focales de EII o una verdadera coexistencia de las dos condiciones, que también ha sido informada. La evaluación general del contexto clínico y endoscópico y el patrón de lesión predominante en la biopsia permiten diferenciar entre estas dos entidades (25).
La linfocitosis intraepitelial asociada a un linfoma de células T está ligada fuertemente a enfermedad celiaca, y compromete, principalmente, el intestino delgado, aunque puede afectar también el colon. Histológicamente se observa un infiltrado de linfocitos pequeños, atípicos, que ocupan la pared del intestino y presentan el siguiente perfil de inmunohistoquímica en la mayoría de los casos: CD45(+), CD3(+), CD7(+), CD4(-), CD8(-), TIA-1(+), granzyme B(+), perforina (+) y rearreglos clonales de TCR β y γ (26).
COLITIS COLAGENOSA
Epidemiología
La incidencia anual de CC en Europa varía entre 0,6-5,2/100 000 personas, con una prevalencia de 10-15,7/100 000 personas (2). En Estados Unidos la incidencia era de 3,1/100 000 personas/año, y la prevalencia, de 39,3/100000 personas, a fines de 2001 (12). El promedio de edad de los pacientes al momento del diagnóstico es de 63 años, con un rango de edad entre los 29-93 años (14); es muy raro en niños (27), y 3 veces más común en mujeres que en hombres (14).
Sintomatología
Los pacientes con CC presentan síntomas similares a los de los pacientes con CL; es decir, diarrea acuosa crónica, con una duración promedio antes del diagnóstico de 24 meses y un número de deposiciones diarias de 6 (14).
Hallazgos endoscópicos
La mayoría de los pacientes con CC tienen una mucosa de apariencia usual; sin embargo, se han informado hallazgos como alteración del patrón vascular mucoso, nodularidad (17) y algunos casos de perforación durante la colonoscopia o entre uno y cinco días después del procedimiento (28).
Los cambios en la CC pueden ser irregulares en su distribución, al igual que en la CL, y ser más comunes en el colon proximal (17); sin embargo, la CC no compromete únicamente el colon derecho (19). Por tanto, se recomienda tomar múltiples biopsias de la mucosa, incluyendo el colon derecho, el transverso, el descendente y el rectosigmoide, y enviarlas, preferiblemente, en recipientes separados (19).
Hallazgos histológicos
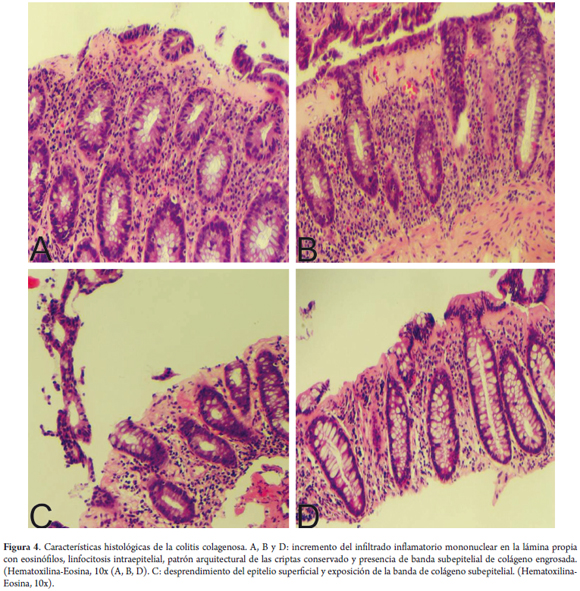
La CC se caracteriza por una banda de colágeno subepitelial engrosada, que por definición mide más de 10 µm de grosor (18); sin embargo, medir dicha banda resulta dispendioso y no es práctico hacerlo. Por ello, está descrito que no solo el aumento del grosor de la banda, sino su patrón de distribución anormal, extendiéndose dentro de la lámina propia y envolviendo y atrapando capilares y fibroblastos, es la clave para el diagnóstico de CC (20) (figura 4).
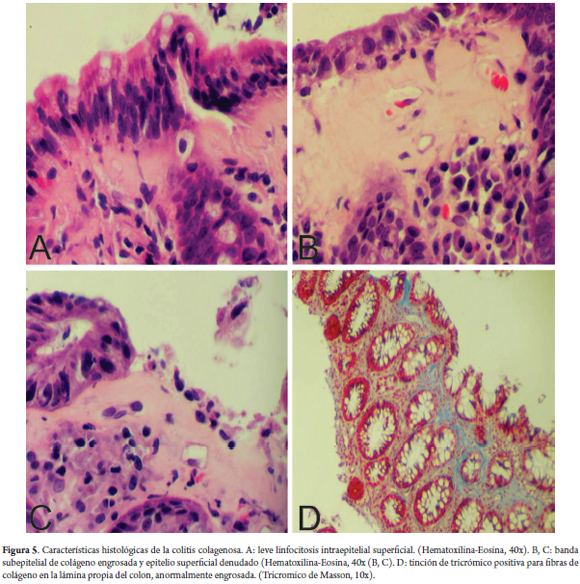
Con la tinción de HE no siempre es evidente el patrón de distribución del colágeno, y es en estos casos cuando resulta de ayuda hacer la tinción de tricrómico de Masson. La presencia de la banda de colágeno anormal por sí sola no es diagnóstica de CC; por tanto, deben hacerse presentes otras características, como el aumento del infiltrado mononuclear en la lámina propia, con abundantes eosinófilos en algunos casos, así como el aumento de los LIE (en menor proporción que en la CL) y el daño del epitelio superficial, que en la CC suele desprenderse y separarse de la membrana basal, y así deja expuesta la banda de colágeno anormal (20) (figura 5).
Resulta útil nombrar en este momento que la evaluación de la banda de colágeno subepitelial debe hacerse en una biopsia bien orientada, porque los cortes tangenciales de la mucosa colónica pueden dar la falsa impresión de que está engrosada.
Al igual que en la CL, en la CC se han descrito variantes histológicas sin aparente significado pronóstico, y entre las cuales se incluyen la CC pseudomembranosa y la CC con células gigantes. La CC pseudomembranosa es muy rara, y se caracteriza por pseudomembranas fibrinopurulentas protruyendo de la mucosa en el contexto de una CC típica (29). La CC con células gigantes consiste en una CC típica con células gigantes subepiteliales CD68+ (24).
Diagnóstico diferencial
Existen otras condiciones que histológicamente pueden cursar con engrosamiento de la banda de colágeno subepitelial, como la isquemia crónica, el prolapso mucoso, la diabetes mellitus y el pólipo hiperplásico, pero todas estas carecen del infiltrado inflamatorio acompañante (30).
La CC puede cursar con características histológicas semejantes a las halladas en la EII, como distorsión arquitectural de las criptas, criptitis, metaplasia de células de Paneth y focos aislados de erosión superficial de la mucosa, en un fondo que, por lo demás, es una CC típica (25).
La distinción entre CC y EII es sencilla, dada la preservación de la arquitectura de las criptas en la CC. Sin embargo, la CC y la EII no se excluyen mutuamente, y se han informado casos de progresión de CC a colitis ulcerativa y transición de colitis ulcerativa a CC (4,5).
CURSO CLÍNICO DE LA CL Y DE LA CC
Entre el 20% y el 48% de los pacientes con CL tienen una remisión clínica espontánea, pero con recaídas tras un seguimiento de 14 meses, lo cual sugiere un curso clínico crónico e intermitente al menos para la mitad de los pacientes (31).
En la CC el panorama es muy similar, con remisión clínica espontánea en el 25% de los pacientes, acompañada de mejoría en los hallazgos histopatológicos (31). Están descritos tratamientos orales con budesonida para la CC, con remisión clínica en el 85,7% de los pacientes; sin embargo, se observan tasas de recaída hasta en el 60% de los casos una vez suspendido el tratamiento oral (31), y por ello el curso clínico de la CC es semejante al de la CL: crónico e intermitente.
CONCLUSIONES
CM es un término clínico e histopatológico que agrupa a la CL y la CC, y se lo utiliza para describir una condición médica que cursa con diarrea crónica acuosa, una mucosa colónica de apariencia endoscópica normal y hallazgos histopatológicos consistentes en aumento del infiltrado inflamatorio mononuclear en la lámina propia, linfocitosis intraepitelial, daño del epitelio superficial, sin alteración del patrón arquitectural de las criptas, y presencia de una banda colágena engrosada en la CC.
La etiología de la CM aún es incierta, pero tanto la CL como la CC tienen asociación a enfermedades autoinmunes y son más habituales en mujeres. Su incidencia y su prevalencia han ido aumentando en los países desarrollados, y aunque en países como Colombia aún no se conocen cifras exactas al respecto, los médicos patólogos deben estar en capacidad de reconocer y diagnosticar tales entidades, para poder brindar el manejo indicado para estos pacientes.
Agradecimientos
Los autores agradecen el apoyo general dado por el laboratorio de patología de Compensar y la Universidad de La Sabana, Colombia, para la realización del presente informe.
REFERENCIAS
1. Read NW, Krejs GJ, Read MG, et al. Chronic diarrhea of unknown origin. Gastroenterology. 1980;78:264-71. [ Links ]
2. Fernández-Bañares F, Salas A, Forné M, et al. Incidence of collagenous and lymphocytic colitis: a 5-year population-based study. Am J Gastroenterol. 1999;94:418-23. [ Links ]
3. Olesen M, Eriksson S, Bohr J, et al. Lymphocytic colitis: a retrospective clinical study of 199 Swedish patients. Gut. 2004;53:536-41. [ Links ]
4. Giardiello FM, Jackson FW, Lazenby AJ. Metachronous occurrence of collagenous colitis and ulcerative colitis. Gut. 1991;32:447-9. [ Links ]
5. Pokorny CS, Kneale KL, Henderson CJ. Progression of collagenous colitis to ulcerative colitis. J Clin Gastroenterol. 2001;32:435-8. [ Links ]
6. Matteoni CA, Goldblum JR, Wang N, et al. Celiac disease is highly prevalent in lymphocytic colitis. J Clin Gastroenterol. 2001;32:225-7. [ Links ]
7. Riddell RH, Tanaka M, Mazzoleni G. Non-steroidal anti-inflammatory drugs as a possible cause of collagenous colitis: a case-control study. Gut. 1992;33:683-6. [ Links ]
8. Thomson RD, Lestina LS, Bensen SP, et al. Lansoprazole-associated microscopic colitis: a case series. Am J Gastroenterol. 2002;97:2908-13. [ Links ]
9. Beaugerie L, Patey N, Brousse N. Ranitidine, diarrhea, and lymphocytic colitis. Gut. 1995;37:708-11. [ Links ]
10. Duncan H, Talbot I, Silk D. Collagenous colitis and cimetidine. Eur J Gastroenterol Hepatol. 1997;9:819-20. [ Links ]
11. Limsui D, Pardi DS, Smyrk TC, et al. Observer variability in the histologic diagnosis of microscopic colitis. Inflamm Bowel Dis. 2009;15:35-8. [ Links ]
12. Pardi DS, Loftus EV, Smyrk TC, et al. The epidemiology of microscopic colitis: a population based study in Olmsted County, Minnesota. Gut. 2007;56:504-8. [ Links ]
13. González N, Guerra L, Sanguinetti A, et al. Prevalence of microscopic colitis in a group of patients from Montevideo, Uruguay. Acta Gastroenterol Latinoam. 2010;40:216-20. [ Links ]
14. Kao KT, Pedraza B, McClune A, et al. Microscopic colitis: a large retrospective analysis from a health maintenance organization experience. World J Gastroenterol. 2009;15:3122-7. [ Links ]
15. Giardiello FM, Lazenby AJ, Bayless TM, et al. Lymphocytic (microscopic) colitis: clinicopathologic study of 18 patients and comparison to collagenous colitis. Dig Dis Sci. 1989;34:1730-8. [ Links ]
16. Fernández-Bañares F, Salas A, Esteve M, et al. Collagenous and lymphocytic colitis. Evaluation of clinical and histological features, response to treatment, and long-term follow-up. Am J Gastroenterol. 2003;98:340-7. [ Links ]
17. Koulaouzidis A, Saeed AA. Distinct colonoscopy findings of microscopic colitis: Not so microscopic after all? World J Gastroenterol. 2011;17:4157-65. [ Links ]
18. Mahajan D, Goldblum JR, Xiao SY, et al. Lymphocytic colitis and collagenous colitis: a review of clinicopathologic features and immunologic abnormalities. Adv Anat Pathol. 2012;19:28-38. [ Links ]
19. Yantis RK, Odze RD. Optimal approach to obtaining mucosal biopsies for assessment of inflammatory bowel disorders of the gastrointestinal tract. Am J Gastroenterol. 2009;104:774-83. [ Links ]
20. Montgomery EA, Voltaggio L. Biopsy interpretation of the gastrointestinal tract mucosa. Volume 1, Non-Neoplasia. Philadelphia, PA: Lippincott Williams & Wilkins; 2012. [ Links ]
21. Lazenby AJ, Yardley JH, Giardiello FM, et al. Lymphocytic ("microscopic") colitis: a comparative histopathologic study with particular reference to collagenous colitis. Hum Pathol. 1989;20:18-28. [ Links ]
22. Mohamed N, Marais M, Bezuidenhout J. Microscopic colitis as a missed cause of chronic diarrhea. World J Gastroenterol. 2011;17:1996-2002. [ Links ]
23. Goldstein NS, Bhanot P. Paucicellular and asymptomatic lymphocytic colitis: expanding the clinicopathologic spectrum of lymphocytic colitis. Am J Clin Pathol. 2004;122:405-11. [ Links ]
24. Brown IS, Lambie DLJ. Microscopic colitis with giant cells: a clinico-pathological review of 11 cases and comparison with microscopic colitis without giant cells. Pathology. 2008;40:671-5. [ Links ]
25. Goldstein NS, Gyorfi T. Focal lymphocytic colitis and collagenous colitis: patterns of Crohns colitis? Am J Surg Pathol. 1999;23:1075-81. [ Links ]
26. Ferry JA. Lymphoid tumors of the GI tract, hepatobiliary tract, and pancreas. En: Odze RD, Goldblum JR, Eds. Surgical pathology of the GI tract, liver, biliary tract, and pancreas. Philadelphia, PA: Saunders Elsevier; 2010, p. 701-32. [ Links ]
27. Gremse DA, Boudreaux CW, Manci EA. Collagenous colitis in children. Gastroenterology. 1993;104:906-9. [ Links ]
28. Allende DS, Taylor SL, Bronner MP. Colonic perforation as a complication of collagenous colitis in a series of 12 patients. Am J Gastroenterol. 2008;103:2598-604. [ Links ]
29. Yuan S, Reyes V, Bronner MP. Pseudomembranous collagenous colitis. Am J Surg Pathol. 2003;27:1375-9. [ Links ]
30. Unal A, Guven K, Yurci A, et al. Is increased colon subepithelial collagen layer thickness in diabetic patients related to collagen colitis? An immunohistochemical study. Pathol Res Pract. 2008;204:537-44. [ Links ]
31. Miehlke S, Madisch A, Karimi D, et al. Budesonide is effective in treating lymphocytic colitis: a randomized-doubleblinded-placebo controlled study. Gastroenterology. 2009;136:2092-100. [ Links ]











 text in
text in