Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.4 Bogotá Oct./Dec. 2013
Helicobacter hepaticus del modelo a la infección: la controversia en hepatocarcinoma humano
Yessica Agudelo Zapata, MD. (1), Rodrigo Castaño Llano, MD. (2), Mauricio Corredor, PhD. (3)
(1) Médica y cirujana general, Universidad de Antioquia; Grupo de Gastrohepatología, Universidad de Antioquia. Medellín, Colombia.
(2) Cirugía gastrointestinal y endoscopia, Grupo de Gastrohepatología, Universidad de Antioquia-Instituto de Cancerología. Medellín, Colombia.
(3) Profesor, Instituto de Biología, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, Grupo GEBIOMIC, Universidad de Antioquia. Medellín, Colombia.
Fecha recibido: 07-05-13 Fecha aceptado: 27-08-13
Resumen
El descubrimiento de Helicobacter, hace 30 años, cambió por completo el pensamiento de las comunidades médica y científica sobre las úlceras péptica y duodenal. El paradigma anterior al descubrimiento de Marshall y Warren planteaba la imposibilidad de supervivencia de microorganismos en el estómago, debido a su pH, y que si algunos sobrevivían se iban a alojar en el duodeno o en otras porciones del intestino. Es indiscutible hoy día el papel en la carcinogénesis de H. pylori, pero poco se conoce sobre especies emergentes del género Helicobacter en el ser humano. Helicobacter hepaticus es una de las especies más estudiadas después de H. pylori. De la bacteria se saben sus características microbiológicas, genéticas y patogénicas, así como su relación con el hepatocarcinoma en modelo murino y su infección en el ser humano. Esta revisión pretende mostrar a las comunidades médica y científica la existencia de nuevas especies de Helicobacter que tienen un potencial patogénico en humanos, y así alentar investigaciones al respecto.
Palabras clave
Helicobacter hepaticus, Helicobacter pylori, Helicobacter spp., Hepatocarcinoma.
INTRODUCCIÓNEl cultivo de Helicobacter pylori y el reconocimiento de su relevancia clínica han servido para renovar el interés en las bacterias de este género, asociadas a los tractos gastrointestinal y hepatobiliar de los seres humanos y otros animales, y a muchas de las cuales se ha identificado ahora como nuevas especies de Helicobacter, un género que se compone de 32 especies validadas (1).
H. pylori fue descrito hace más de un siglo. Se sabe que esta bacteria ha infectado el estómago humano por espacio de milenios; muy probablemente, por millones de años (2), pero no fue tenida en cuenta en la medicina hasta 1983, cuando Warren y Marshall la redescubrieron (3).
La genética de poblaciones de H. pylori imita la del hombre, y parece reflejar las antiguas migraciones humanas. Por tanto, los seres humanos, probablemente, han adquirido H. pylori desde muy temprano en su historia (4). Con excepción del hombre, los únicos huéspedes naturales del H. pylori parecen ser primates, pero la bacteria puede infectar a otros animales, como ratones, perros y jerbos, en experimentos de laboratorio; ello podría sugerir a H. pylori como un marcador evolutivo (4).
H. pylori se ha asociado fuertemente a gastritis, úlcera péptica, cáncer gástrico y linfoma gástrico, o MALToma (2); incluso, es considerado un agente carcinogénico por la Agencia Internacional para el Cáncer (5). Sin embargo, hay otras entidades, llamadas enfermedades extra gastrointestinales, que han sido estudiadas durante el último decenio, y de ellas la púrpura trombocitopenica idiopática (PTI ) es la que tiene más evidencia en la literatura; más aún, se ha demostrado que la erradicación de la bacteria incrementa el recuento de plaquetas (6).
Además de lo anterior, se ha asociado esta bacteria, aunque débilmente, a otras entidades fuera del tracto gastrointestinal en niños y en adultos, como las del hígado y las de la vía biliar, y que incluyen: cirrosis, hepatocarcinoma, colangitis esclerosante primaria y cirrosis biliar primaria (7). Otras enfermedades involucradas son: anemia ferropénica, diarrea crónica, aterosclerosis y problemas en el crecimiento y el desarrollo; todas ellas, con una asociación controversial, sustentada por reportes de casos, pequeños estudios pilotos o datos in vitro (8-10).
H. pylori no es la única especie de Helicobacter humana. Las especies de Helicobacter se pueden dividir en dos grupos: gástricas y enterohepáticas. Dentro de las enterohepáticas se encuentra el Helicobacter hepaticus, otra de las especies de Helicobacter más estudiadas además de H. pylori. Esta bacteria, relativamente nueva, ha sido implicada en hepatitis, hepatocarcinomas, neoplasias biliares en modelos murinos y, recientemente, en muestras humanas, lo cual ha generado controversia en el medio científico, que se pregunta si H. hepaticus es un patógeno humano, y si tiene participación en el hepatocarcinoma o en otra enfermedad, debido a que en modelo murino hay una clara evidencia de que así es (11).
LA CONTROVERSIA
Comprobar que esta bacteria es causante de enfermedad en el ser humano, aun con una implicación en el hepatocarcinoma celular (HCC), no es muy claro dentro de la lógica de las ciencias y de muchos investigadores, que no consideran posible la hipótesis (12). Argumentar la existencia de la causalidad resultará más difícil que lo que fue para Warren y Marshall demostrar la importancia de H. pylori para la humanidad, pues para el estudio sistemático de dichas bacterias se requieren el aislamiento apropiado y métodos de identificación tanto en pacientes sanos como en enfermos (13).
La controversia que genera el tema ha llevado a realizar revisiones, y hasta un metaanálisis, en 2008, sobre la relación entre HCC y las especies de Helicobacter; se halló una asociación positiva entre la bacteria y el riesgo de padecer HCC (14). Sin embargo, los resultados deben ser interpretados con precaución, pues ha habido poco estudios y se requiere que sean mejor diseñados y prospectivos para validar la hipótesis, conclusión que otras revisiones han expuesto (12,14,15).
Durante la última década, los estudios se han centrado en la relación entre la infección crónica por H. pylori y Helicobacter spp., asociados a varias manifestaciones extragástricas; estas incluyen la enfermedad isquémica del corazón, enfermedades del hígado y trastornos hematológicos; todo ello, debido a que la erradicación de H. pylori gástrico es fácil y relativamente barata (16-18), lo cual sería de importancia para la salud pública.
En los seres humanos, la presencia de ADN bacteriano en el hígado de los pacientes afectados por HCC es también un indicativo de la probable presencia de Helicobacter spp. en este órgano. Sin embargo, la dificultad para el cultivo en laboratorio del microorganismo pone en duda la realidad de la infección (principio de Koch) (12). Esto, a su vez, puede ser explicado por la baja carga bacteriana y la adaptación de las bacterias a un medio ambiente especial, como se informó en el hígado de ratón (17). Se requieren, pues, el aislamiento apropiado y métodos de identificación para estas bacterias: solo así se descubrirá si este género influenciará el manejo de las enfermedades intestinales y sistémicas tan dramáticamente como H. pylori impactó el tratamiento de las enfermedades gastroduodenales (13).
La evidencia muestra, y en repetidas ocasiones, que Helicobacter parece tener una asociación a la patogénesis del HCC, además de haber correlación con hepatitis virales y su progreso hacia hepatocarcinoma. Finalmente, como se menciona a raíz de los metaanálisis y las revisiones al respecto, no hay suficientes estudios prospectivos y de buena calidad para validar la hipótesis (12,17).
DEL CÁNCER GÁSTRICO AL CÁNCER DE HÍGADO
El cáncer gástrico y el cáncer de hígado son enfermedades distintas, con agentes etiológicos y mecanismos de carcinogénesis que distan; pero, ¿qué puede encontrar el género Helicobacter en ambos medios para crecer? ¿Cómo puede agredir a dos tipos de células tan diferentes entre sí?
En el caso del cáncer gástrico cabe señalar que su origen es multifactorial, pero H. pylori juega un papel importante en dicho origen, si bien su participación en la carcinogénesis aún es difícil de determinar; por ahora se conocen factores indirectos y directos asociados. Por ejemplo, de manera directa, cuando hay infección por H. pylori, el riesgo de cáncer gástrico es de dos a tres veces, pero si tiene anticuerpos anti-CagA el riesgo aumenta a once veces, y si se combina con la alteración genética del gen que codifica la síntesis de la Interleuquina-1B-511, se incrementa a 87 veces (5). De manera indirecta, la respuesta inflamatoria que se desencadena en el estómago infectado produce cambios moleculares y morfológicos que podrían progresar a cáncer (5).
Por su parte, el HCC es la primera neoplasia primaria maligna del hígado y la quinta causa de consulta por enfermedad maligna del tracto digestivo (19). Su etiología guarda estrecha relación con procesos que desarrollan cirrosis, como la infección crónica por los virus de las hepatitis B y C. Sin embargo, el mecanismo mediante el cual se desarrolla la neoplasia no es muy conocido hasta el momento (19). Se sabe, además, que la aparición del hepatocarcinoma en pacientes sin antecedentes de hepatitis o cirrosis constituye una enfermedad de rápida evolución y alta mortalidad (19).
El antecedente de la relación entre Helicobacter y el hepatocarcinoma se remite a 1992, cuando el Instituto Nacional de Cáncer de Estados Unidos halló una alta tasa de tumores de hígado en ratones infectados con la bacteria (20,21).
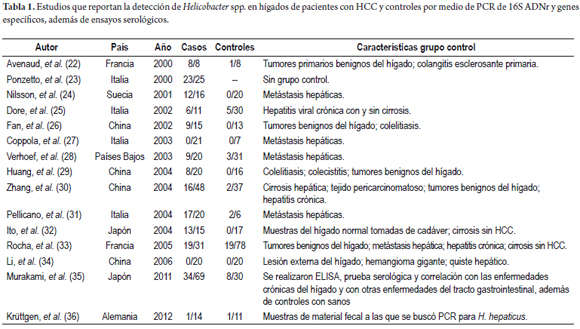
Este hallazgo desencadenó una serie de investigaciones, y para 2000 ya se había encontrado material genético de Helicobacter spp., incluso de H. pylori, en el tejido hepático humano y el de pacientes con HCC. A partir de tales hallazgos numerosos investigadores han reportado ADN de Helicobacter en muestras de tejido de HCC, como se aprecia en la tabla 1 (22-36); sin embargo, las implicaciones de la infección por esta bacteria no han sido bien estudiadas, debido a que todos los estudios trabajan con PCR de 16S ADNr, y no se ha logrado cultivar las especies del hígado, como ya se había mencionado.
Se han relacionado estas bacterias con los virus hepatotropos (B y C), con base en que Helicobacter spp puede jugar un papel en la evolución de lesiones del hígado en las hepatitis virales crónicas a cirrosis y a HCC; sin embargo, los determinantes de dicha evolución no son bien entendidos.
El mismo antecedente es reportado por Rocha et al. (33) y por Dore et al. (25), quienes tratan de demostrar la asociación de las especies de Helicobacter a hepatitis C, cirrosis y HCC. Ambos estudios incluyeron a una amplia serie de pacientes y examinaron muestras de tejido de HCC, de hígado cirrótico y hepatitis de pacientes con VHC. El ADN bacteriano fue hallado en un pequeño porcentaje de biopsias de hígado de los controles, así como en pacientes con hepatitis C crónica, en el 4,2% (33) y el 3,5% (25) de los casos, respectivamente. Sin embargo, la prevalencia de especies de Helicobacter fue alta en pacientes con cirrosis VHC positivos y en aquellos con cirrosis y hepatocarcinoma: 68% y 61%, respectivamente; ello sugiere un posible papel causal de estas bacterias en la progresión hacia HCC.
Además de los anteriores, se han realizado estudios que muestran la correlación serológica entre H. hepaticus, enfermedades hepáticas e infección con VHB y VHC, y los cuales han concluido, con base en ello, que la infección por este Helicobacter puede jugar un papel en el desarrollo de enfermedades del hígado, y, en particular, puede incrementar el riesgo de desarrollar enfermedades hepáticas asociadas a la infección con virus hepatotropos (35,37).
Por otra parte, durante el último año se ha realizado un estudio que no apoya la existencia de un papel patógeno de H. hepaticus en HCC de etiología viral. Los autores llevan a cabo el estudio mediante la presencia de ADN por medio de PCR en muestras de materia fecal de diferentes pacientes con VHC, VHB y otras enfermedades hepáticas y del tracto gastrointestinal; hasta ahora no se ha encontrado asociación. Según los autores, los resultados no descartan un papel de H. hepaticus en los casos de HCC causada por otros agentes cancerígenos, como las aflatoxinas (36).
Entendiendo la fisiopatología de dos procesos de cáncer tan diferentes como el gástrico y el de hígado, es válido preguntarse cómo puede el género Helicobacter infectar ambientes tan disímiles. Cuando la bacteria infecta la mucosa gastroduodenal altera la función y la anatomía, lo cual induce inflamación y favorece la aparición de displasia (38). Para producir estas alteraciones del medio ambiente gastroduodenal la bacteria tiene factores de virulencia como el factor de adherencia, la ureasa, enzimas proteolíticas y varias proteínas como la citotóxica y la vacuolizante, así como proteínas de estrés celular, que le permiten sobrevivir en situaciones adversas (38).
Conocidas las mencionadas características de infección gástrica, se debe ilustrar el medio que representa el hígado para la bacteria: dicho hábitat no presenta las mismas condiciones agrestes del gástrico; por ejemplo, el pH, pues se conocen cifras ligeramente alcalinas o neutrales de la vía biliar, por lo cual la necesidad de factores de virulencia para sobrevivir en el medio, como la ureasa, no son necesarios; de ahí que la presencia o no de ureasa sea lo que diferencia las especies gástricas de las enterohepáticas (39).
Hay otros aspectos sobre el hígado muy diferentes de los propios del estómago, y que representan un reto para la bacteria, como el ingreso al hepatocito o un lugar adecuado dentro del hígado para replicarse.
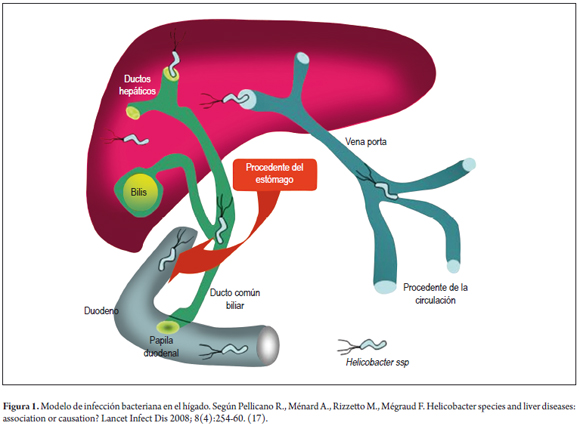
Se han planteado modelos de infección para explicar la interacción entre Helicobacter spp., H. pylori y H. hepaticus con el tejido hepático. Hay para ello al menos dos rutas: una, que las especies asciendan por vía biliar; y otra, que ingresen por vía portal (17), como lo ilustra la figura 1. La primera ruta resulta más expedita.
Ya en el hígado, la adherencia a los hepatocitos ha sido investigada in vitro (7) y se ha demostrado que H. pylori, como modelo de Helicobacter spp, es capaz de adherirse a hepatocitos in vitro e invadirlos, dependiendo de los factores de virulencia, y que persiste en los cultivos celulares. A su vez, la β1-integrina es reconocida como un receptor para internalización de la bacteria en los hepatocitos.
Se ha encontrado que H. pylori afecta la replicación celular; lo hace, principalmente, por inducción de la apoptosis, con un incremento compensatorio en síntesis de ADN, para balancear el incremento de células perdidas. La infección persistente en el hígado puede incrementar tanto la apoptosis como la síntesis de ADN, lo cual sugiere que la persistencia de Helicobacter juega un papel importante en la patogénesis de las enfermedades de hígado y la de los cambios del balance crítico entre la proliferación y la apoptosis celular, que parece involucrar la patogénesis de una variedad de enfermedades humanas, incluido el cáncer (40).
Aunque se ha determinado la persistencia, por métodos moleculares, de Helicobacter spp. (incluso, H. hepaticus y H. pylori) en los hepatocitos, no se la ha podido cultivar directamente del hígado humano, pero eso sí se ha logrado en el de ratón (41), donde, sin embargo, se cultivó dicha bacteria en solo el 11,5% de los casos, mientras que el 66,6% de los casos fueron positivos por PCR en modelo murino (41).
Respecto a marcadores y factores de virulencia, se han estudiado 2 marcadores: el H19 y el factor de trébol intestinal 3, que aumentan su expresión en las células infectadas con displasia hepatocelular progresiva (42). Se han incluido como mecanismos directos las toxinas que causan daño hepatocelular in vivo, como en H. hepaticus, que produce la toxina citoletal de distensión (CDT), y que, a su vez, tiene actividad ADNasa y, posiblemente, favorece el desarrollo de tumores (17,43). Otros factores de virulencia son la VacA, y el sistema de secreción bacteriano tipo 4. En general, Helicobacter spp. es un fuerte inductor de citoquinas proinflamatorias que contribuyen al desarrollo de enfermedades malignas a través de daños en el ADN (43).
H. HEPATICUS EN OTRAS ENFERMEDADES MURINAS Y HUMANAS
Además de tener un hábitat en el hígado y en la vía biliar, se ha demostrado la presencia de H. hepaticus en los intestinos grueso y delgado de ratones, y se la ha relacionado con el síndrome de colon irritable (21), la colitis y la tiflitis. Tales relaciones aún son poco estudiadas, pero parecen ser importantes, y hay evidencias en el modelo murino que sustentan dicha hipótesis (44-46).
Numerosos estudios demuestran la presencia de especies enterohepáticas de Helicobacter en humanos relacionadas con la enteritis, la hepatitis y la colecistitis en pacientes inmunosuprimidos (42), u otros con colitis ulcerativa y enfermedad hepática concomitante, así como en niños con enfermedades hepáticas (47). Con base en otras evidencias, se concluye que H. hepaticus puede asociarse a enfermedades del hígado y de las vías biliares en los seres humanos, como se ha reiterado (48), e, incluso, con el cáncer de vía biliar (49).
ANTECEDENTES DE HELICOBACTER HEPATICUS
La bacteria fue descubierta en 1994 por Fox et al. (41), quienes la aislaron de hígados de ratones con hepatitis crónica activa; la bacteria también coloniza la mucosa colónica de estos roedores. Con base en el análisis de secuencia por genes 16S ARNr, el organismo fue clasificado como un nuevo Helicobacter, nombrado como hepaticus y reconocido como un eficiente colonizador del tracto gastrointestinal, y, además, con un potencial patogénico en la hepatitis persistente y el cáncer de hígado en ratones. Esta bacteria es el prototipo de especie enterohepática de Helicobacter (41), y recientemente se ha descubierto que infecta a los humanos y podría causarles enfermedad (47,48).
Características morfológicas del microorganismo
Es una bacteria con forma espiral y flagelo bipolar. El examen con campo oscuro y microscopía de fase reveló bacterias móviles espirales, Gram negativas, que mide de 1,5-5,0 µm de longitud y de 0,2-0,3 µm de ancho. El organismo varió de forma y tamaño de curvo a espiral, y llegó a tener uno o varios espirales (41).
Características fisiológicas y bioquímicas de la bacteria
Al igual que H. muridarum y H. rappini (otras especies de Helicobacter), H. hepaticus tiene actividad ureasa fuerte, aunque no vive en un ambiente ácido; de hecho, por estudios se sabe que H. hepaticus produce una ureasa similar a la de H. pylori (50); además de ser una ureasa positiva, también es oxidasa y catalasa positiva. Las cepas de H. hepaticus producen, consistentemente, H2S mediante el uso de acetato de plomo; además, reducen nitratos a nitritos. Las bacterias crecen microaerofilicamente a 37 °C. Todas las cepas fueron resistentes a la cefalotina y al ácido nalidíxico, pero sensibles al metronidazol (41).
Genética bacteriana
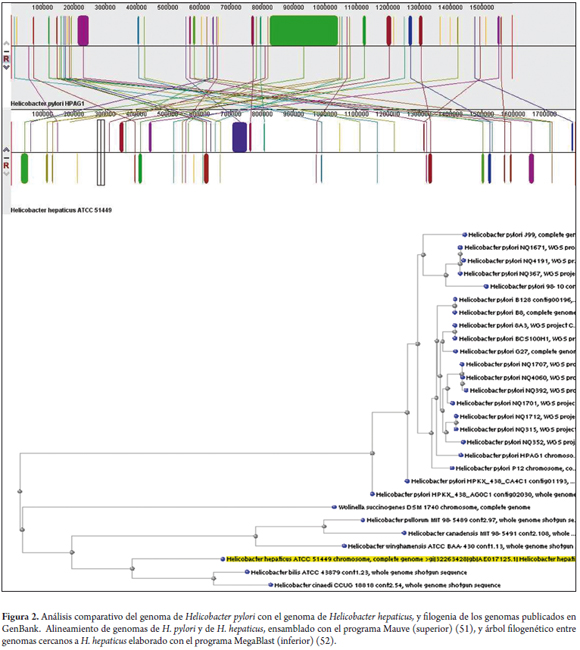
En 2003 se reportó la secuencia completa de la bacteria H. hepaticus ATCC51449 (50). Tiene un cromosoma circular de 1 799 146 pares de bases, que codifican para 1,875 proteínas, y un total de 938 son ortólogas con H. pylori; además, ambas tienen en común algunos factores de virulencia, incluidas adhesinas, citotoxinas VacA y, al menos, todas las islas de patogenicidad Cag, muestran similitud con Campilobacter jejuni y exhiben mecanismos de patogenicidad parecidos (50) (figura 2).
Queda claro que H. hepaticus es un organismo con potencial patogénico, aunque la ausencia de muchos factores de virulencia y de colonización que sí tiene H. pylori explican la inhabilidad de H. hepaticus para colonizar el estómago, y cómo la extensa similitud fisiológica con C. jejuni está relacionada con la colonización entérica. Ni las razones para este tropismo por el tracto hepatobiliar ni, particularmente, el potencial carcinogénico son comprendidos con claridad, pero la disponibilidad de la secuencia del genoma provee la oportunidad para una exploración sistemática de mecanismos de tropismo tisular y carcinogénesis inducida por H. hepaticus.
H. hepaticus tiene muchos factores en común con H. pylori: por ejemplo, ambos infectan persistentemente a sus hospederos, hasta progresar a inflamación crónica, y la inflamación producida por ambos puede progresar a hepatocarcinoma. Sin embargo, H. hepaticus no coloniza el estómago, pero comparte el mismo hábitat del intestino delgado con C. jejuni, una bacteria que a menudo causa diarrea en humanos (21).
INMUNOLOGÍA
Se sabe sobre H. pylori que la infección estimula tanto la respuesta inmune innata como la adquirida. El paso inicial en dicho proceso es el reconocimiento del microorganismo a través de Nod1 (Nucleotide-binding oligomerization domain protein I), al tiempo que el H. pylori también estimula la respuesta inmune innata. Esta respuesta contra el H. pylori incluye la liberación de péptidos antibacterianos y de infiltración de la mucosa por todos los tipos de células inmunológicas efectoras (5,51).
Además de la mencionada respuesta primaria, se desencadena una respuesta inmunológica adquirida celular y humoral, local y sistémica, que persiste durante toda la vida. La respuesta de la célula T es, fundamentalmente, Th1, una respuesta "equivocada", pues H. pylori es un germen extracelular, que, al igual que microorganismos similares, debería desencadenar una respuesta Th2.
La respuesta Th1 produce interferón gamma (IFN γ), factor de necrosis tumoral alfa (TNF -α), IL-12, IL-18 (51). La respuesta Th2 produce IL-4, IL-5, IL-10 y factor de crecimiento β transformador de fibroblastos, inmunoglobulina mucosa IgA e Ig E, y disminuye la inflamación causada por Th1 en respuesta al H. pylori, que afecta la progresión de la gastritis crónica a la atrofia, la displasia y el cáncer (5).
Por otra parte, se sabe que en algunos modelos experimentales en ratones H. hepaticus activa las células Th17, que liberan células citoquinas asociadas a la inflamación, como IL-17, y el factor nuclear kappa B, asociado a la carcinogénesis; sin embargo, hacen falta más estudios para determinar si tiene homología con la respuesta inmune generada por H. pylori (36,51).
Notoriamente, se ha propuesto la relación que puede tener este tipo de bacterias con el sistema inmune, incluso mediante la inmunidad innata, y hasta el posible modelo de explicación de la intervención bacteriana en las enfermedades autoinmunes (52).
CONCLUSIONES
Aún es prematuro afirmar o descartar la relación de H. hepaticus con el carcinoma hepatocelular. Es, incluso, riesgoso, pues ya varios paradigmas han demostrado lo comprometedor que es aseverar sin pruebas experimentales. H. pylori ha sido el ejemplo más palpable a ese respecto, y por su misma época Prusiner ya hablaba de la existencia de los priones, y el virus de la inmunodeficiencia humana (VIH) daba un golpe certero a los avances científicos en salud, prevención y vacunación, pues el hombre había vencido la viruela (todos estos sucesos tuvieron lugar durante la misma década: los años ochenta del siglo XX).
Por lo anterior, los reportes de Rocha et al., Dore et al. y Murakami et al. (25,33,35) sugieren una asociación de Helicobacter spp. en la evolución de las enfermedades crónicas del hígado relacionadas con el virus de la hepatitis C (VHC) y el virus de la hepatitis B (VHB) en los seres humanos.
La imposibilidad del cultivo de Helicobacter spp. posterior al aislamiento en hígado, aún no evidenciado en ningún reporte, genera una enorme dificultad para lo anterior, pues la confianza se basa en una amplificación por PCR, prueba que aún deja enormes interrogantes, por cuanto obvia la propagación de Koch y comienza poco a poco a recibir cuestionamientos, habida cuenta de que algunos no cumplen completamente el principio de Koch.
Como ejemplo de los citados problemas con la propagación de Koch, se cita que el agente infeccioso debe ser aislado del cuerpo en un cultivo puro a partir de las lesiones de la enfermedad, lo cual no se cumple para Mycobacterium leprae; por lo tanto, el incumplimiento del principio de Koch para esta bacteria y otras más (12) no permite hacer conclusiones clásicas y deja abierta la puerta al advenimiento de nuevas técnicas, como alternativas gold standard diagnósticas, como la PCR, y el uso del secuenciamiento profundo utilizando la metagenómica, para dilucidar el microbioma y el virobioma humanos.
REFERENCIAS
1. Hayashi S, Shimomura H, Hirai Y. Latest advances in non-pylori Helicobacter species. Nippon Rinsho. 2009;67:2271-8. [ Links ]
2. Correa P. Impacto social de la infección por helicobacter pylori en Colombia. Rev Acad Nac Med Colomb. 1999;21:51. [ Links ]
3. Marshall B, Warren JR. Unidentified curved bacillus on gastric epithelium in active chronic gastritis. Lancet. 1983;1:1273-5. [ Links ]
4. Eppinger M, Baar C, Linz B, et al. Who ate whom? Adaptive helicobacter genomic changes that accompanied a host jump from early humans to large felines. Plos Gen. 2006;2:1097-110. [ Links ]
5. Otero W, Gómez M, Trespalacios AA. Helicobacter pylori: después de todo. Temas escogidos de gastroenterología. Asoc Colomb Gastroenterol. 2007:43-56. [ Links ]
6. Campuzano G. Proof of an Association between helicobacter pylori and idiopathic thrombocytopenic purpura in Latin America. Helicobacter. 2007;12:265-73. [ Links ]
7. Ito K, Yamaoka Y, Ota H, et al. Adherence, Internalization, and Persistence of Helicobacter pylori in Hepatocytes. Dig Dis Sci. 2008;53:2541-9. [ Links ]
8. Franceschi F. Helicobacter pylori and extragastric diseases. Clin Gastroenterol. 2007;21:325-34. [ Links ]
9. Moyaert H, Franceschi F, Roccarina D, et al. Extragastric manifestations of helicobacter pylori infection: other helicobacters. Helicobacter. 2008;13(Suppl. 1):47-57. [ Links ]
10. Pellicano R, Franceschi F, Saracco G, et al. Helicobacters and extragastric diseases. Helicobacter. 2008;14(Suppl. 1):58-68. [ Links ]
11. Ward J, Anver M, Haines D, et al. Chronic active hepatitis in mice caused by helicobacter hepaticus. Am J Pathol. 1994;145:959-68. [ Links ]
12. Velázquez E, Peix A, Gómez A. Microorganismos y cáncer: evidencias científicas y nuevas hipotésis. Cir Esp. 2011;89:136-44. [ Links ]
13. Orourke J, Grehan M, Lee A. Non-pylori helicobacter species in humans. Gut. 2001;49:601-6. [ Links ]
14. Xin Y, Chen A, Dong Q, et al. Association between the presence of H pylori in the liver and hepatocellular carcinoma: a meta-analysis. World Gastroenterol. 2008;14:307-12. [ Links ]
15. Wu X, Chen D. Helicobacter pylori and hepatocellular carcinoma: correlated or uncorrelated. J Gastroenterol Hepatol. 2006;21:345-7. [ Links ]
16. Tu Q, Okoli AS, Kovach Z, et al. Hepatocellular carcinoma: prevalence and molecular pathogenesis of Helicobacter spp. Comp Med. 2009;59:534-44. [ Links ]
17. Pellicano R, Ménard A, Rizzetto M, et al. Helicobacter species and liver diseases: association or causation? Lancet Infect Dis. 2008;8:254-60. [ Links ]
18. Otero W, Trespalacios A, Otero E. Helicobacter pylori: Tratamiento actual. Un importante reto en gastroenterología. Rev Colomb Gastroenterol. 2009;24:279-92. [ Links ]
19. Argüello P, Albis R, Escovar J, et al. Hepatocarcinoma: patología maligna de mal pronóstico. Rev Colomb Gastroenterol. 2003;18:153-7. [ Links ]
20. Takayama S, Takahashi H, Matsuo Y, et al. Effect of helicobacter bilis infection on human bile duct cancer cells. Dig Dis Sci. 2009;54:123-7. [ Links ]
21. Suerbaum S, Josenhans C, Sterzenbach T, et al. The complete genome sequence of the carcinogenic bacterium Helicobacter hepaticus. Proc Natl Acad Sci USA. 2003;100:7901-6. [ Links ]
22. Avenaud P, Marais A, Monteiro L, et al. Detection of helicobacter species in the liver of patients with and without primary liver carcinoma. Cancer. 2000;89:1431-9. [ Links ]
23. Ponzetto A, Pellicano R, Leone N, et al. Helicobacter infection and cirrhosis in hepatitis C virus carriage: is it an innocent bystander or a troublemaker? Med Hypotheses. 2000;54:275-7. [ Links ]
24. Nilsson HO, Mulchandani R, Tranberg KG, et al. Helicobacter species identified in liver from patients with cholangiocarcinoma and hepatocellular carcinoma. Gastroenterology. 2001;120:323-4. [ Links ]
25. Dore M, Realdi G, Mura D, et al. Helicobacter infection in patients with HCV-related chronic hepatitis, cirrhosis, and hepatocellular carcinoma. Dig Dis Sci. 2002;47:1638-43. [ Links ]
26. Fan X, Peng X, Huang Y, et al. Helicobacter species ribosomal DNA recovered from the liver tissue of Chinese patients with primary hepatocellular carcinoma. Clin Infect Dis. 2002;35:1555-7. [ Links ]
27. Coppola N, de Stefano G, Marrocco C, et al. Helicobacter spp. and liver diseases. Infez Med. 2003;4:201-7. [ Links ]
28. Verhoef C, Pot R, de Man R, et al. Detection of identical Helicobacter DNA in the stomach and in the non-cirrhotic liver of patients with hepatocellular carcinoma. Eur J Gastroenterol Hepatol. 2003;15:1171-4. [ Links ]
29. Huang Y, Fan X, Wang Z, et al. Identification of Helicobacter species in human liver samples from patients with primary hepatocellular carcinoma. J Clin Pathol. 2004;57:1273-7. [ Links ]
30. Zhang SQ, Bao Y, Zu M. The correlation between Helicobacter infection and hepatocellular carcinoma. Zhongguo Zhongliu Linchuang. 2004;31:761-4. [Artículo en chino] [ Links ].
31. Pellicano R, Mazzaferro V, Grigioni W, et al. Helicobacter species sequences in liver samples from patients with and without hepatocellular carcinoma. World J Gastroenterol. 2004;10:598-601. [ Links ]
32. Ito K, Nakamura M, Toda G, et al. Potential role of Helicobacter pylori in hepatocarcinogenesis. Int J Mol Med. 2004;13:221-7. [ Links ]
33. Rocha M, Avenaud P, Menard A, et al. Association of Helicobacter species with hepatitis C cirrhosis with or without hepatocellular carcinoma. Gut. 2005;54:396-401. [ Links ]
34. Li N, Zhang SH, Xuan SY, et al. Study on Helicobacter infection in liver tissue from hepatocellular carcinoma. Zhonghua Liuxingbingxue Zazhi. 2006;27:894-6. [Artículo en chino] [ Links ].
35. Murakami K, Takahashi R, Ono M, et al. Serodiagnosis of Helicobacter hepaticus infection in patients with liver and gastrointestinal diseases: western blot analysis and ELISA using a highly specific monoclonal antibody for H. hepaticus antigen. J Gastroenterol. 2011;46:1120-6. [ Links ]
36. Kruettgen A, Horz H, Weber J, et al. Study on the association of Helicobacter species with viral hepatitis induced hepatocellular carcinoma. Gut Microbes. 2012;3:228-33. [ Links ]
37. Murakami K. Infection of Helicobacter species and liver disease. J Gastroenterol. 2012;47:724-5. [ Links ]
38. Sierra F. Helicobacter pylori y enfermedades gástricas. En: Franco F, Sierra F. Fundamentos de medicina, gas troenterología y hepatología. 5ta. ed. Medellín: CIB; 2004. p. 53-8. [ Links ]
39. Solnick J, Vandamme P. Taxonomy of the Helicobacter Genus. En: Mobley H, Mendz GL, Hazell SL, editores. Helicobacter pylori. Physiology and Genetics. Washington: ASM Press; 2001. Cap. 5. [ Links ]
40. Ito K, Yamaoka Y, Yoffe B, et al. Disturbance of apoptosis and DNA synthesis by Helicobacter pylori infection of hepatocytes. Dig Dis Sci. 2008;53:2532-40. [ Links ]
41. Fox J, Dewhirst F, Tully J, et al. Helicobacter hepaticus sp. nov., a microaerophilic bacterium isolated from livers and intestinal mucosal scrapings from mice. J Clin Microbiol. 1994;32:1238-45. [ Links ]
42. Boutin S. Molecular pathogenesis of Helicobacter hepaticus induced liver disease, Massachusetts Institute of Technology [internet]. 2011 [citado 2012 oct. 15]. Disponible en: http://biblioteca.universia.net/html_bura/ficha/params/id/34665877.html [ Links ]
43. Liyanage N, Manthey K, Dassanayake R, et al. Helicobacter hepaticus cytolethal distending toxin causes cell death in intestinal epithelial cells via mitochondrial apoptotic pathway. Helicobacter. 2010;15:98-107. [ Links ]
44. Li X, Fox J, Whary M, et al. SCID/NCr mice naturally infected with helicobacter hepaticus develop progressive hepatitis, proliferative typhlitis, and colitis. Infect Immun. 1998;66:5477-84. [ Links ]
45. Fox J, Yan L, Shames B, et al. Persistent hepatitis and enterocolitis in germfree mice infected with helicobacter hepaticus. Infect Immun. 1996;64:3673-81. [ Links ]
46. Dieleman L, Arends A, Tonkonogy S, et al. Helicobacter hepaticus does not induce or potentiate colitis in interleukin-10-deficient mice. Infect Immun. 2000;68:5107-13. [ Links ]
47. Casswall T, Németh A, Nilsson I, et al. Helicobacter species DNA in liver and gastric tissues in children and adolescents with chronic liver disease. Scand J Gastroenterol. 2010;45:160-7. [ Links ]
48. Hamada T, Yokota K, Ayada K, et al. Detection of Helicobacter hepaticus in human bile samples of patients with biliary disease. Helicobacter. 2009;14:545-51. [ Links ]
49. Gopal N, Anil K, Vijay K. Role of bacteria in carcinogenesis, with special reference to carcinoma of the gallbladder. World J Gastroenterol. 2010;16:5395-404. [ Links ]
50. Beckwith C, Mcgee D, Mobley H, et al. Expression, and catalytic activity of helicobacter hepaticus urease. Infect Immun. 2001;69:5914-20. [ Links ]
51. Darling AC, Mau B, Blattner FR, Mazmanian S, McBride S. Microbial health factor. The Scientist-Magazine of the Life Sciences [internet]. 2009 [citado 2012 oct. 15]. Disponible en: http://www.the-scientist.com/article/display/55864/#ixzz0mWl9gtq [ Links ]
52. Yanagisawa N, Haruta I, Kikuchi K, et al. Are dysregulated inflammatory responses to commensal bacteria involved in the pathogenesis of hepatobiliary-pancreatic autoimmune disease? an analysis using mice models of primary biliary cirrhosis and autoimmune pancreatitis. ISRN Gastroenterology. 2011:ID 513-4. [ Links ]
53. Altschul S, Gish W, Miller W, Myers E, et al. Basic local alignment search tool. J. Mol. Biol, 1990, 215:403-10. [ Links ]
54. Darling A, et al. Mauve: multiple alignment of conserved genomic sequence with rearrangements. Genome Res. 14, 1394-403. [ Links ]











 text in
text in