Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.4 Bogotá oct./dic. 2013
Helicobacter pylori y enfermedades hematológicas
José Augusto Urrego Díaz, (1), William Otero Regino, MD. (2), Martín Gómez Zuleta, MD. (3)
(1) Estudiante de medicina, Universidad Nacional de Colombia. Bogotá, Colombia.
(2) Profesor de medicina, Unidad de Gastroenterología, Universidad Nacional de Colombia; gastroenterólogo, Clínica Fundadores. Bogotá, Colombia.
(3) Profesor de medicina, Unidad de Gastroenterología, Universidad Nacional de Colombia; gastroenterólogo, Hospital El Tunal, Hospital de Kennedy. Bogotá, Colombia.
Fecha recibido: 17-06-13 Fecha aceptado: 27-08-13
Resumen
Helicobacter pylori es una bacteria Gram negativa espiralada que coloniza el epitelio gástrico humano. Su asociación a múltiples enfermedades gástricas es bien conocida, y tiene un papel en la patogénesis de la gastritis crónica, la úlcera péptica, la dispepsia, el cáncer gástrico y el linfoma MALT. Adicionalmente, ha habido cada vez más evidencia de su asociación a diversas entidades extragástricas, como el cáncer de colon, las enfermedades neurodegenerativas, las hepatopatías, la enfermedad arterial coronaria y las enfermedades hematológicas, entre otras. De las mencionadas, es en tres enfermedades hematológicas donde su asociación ha sido más clara y la evidencia, hasta el momento, es más fuerte: la anemia ferropénica (AF) sin otra explicación, el déficit de cobalamina y la púrpura trombocitopénica inmune. Son muchos los mecanismos patogénicos que han sido propuestos en estos tres desórdenes, y son muchos, así mismo, los estudios que soportan dichas asociaciones. En el presente artículo se revisa el papel de Helicobacter pylori y sus mecanismos patogénicos en el desarrollo de estas tres enfermedades hematológicas.
Palabras clave
Helicobacter, púrpura, anemia, hierro.
INTRODUCCIÓN
Helicobacter pylori (H. pylori) acompaña al ser humano desde hace por lo menos 58 000 años (1), pero su papel como patógeno solo se estableció en 1984, cuando fue exitosamente cultivado en Australia por Warren y Marshall, y asociado a gastritis crónica y úlceras pépticas (2).
En la actualidad se considera que H. pylori infecta al 50% de la población mundial (3,4). Sin embargo, la prevalencia oscila de forma significativa entre diferentes poblaciones, pues alcanza valores tan altos como el 91% en ciertas poblaciones africanas (5), o tan bajos como el 7% en algunos estudios realizados en Estados Unidos (6). Así mismo, hay evidencia de marcadas diferencias según el grupo étnico, etario o económico dentro de mismas zonas geográficas; es mayor en hispanos, afroamericanos y pacientes de edad avanzada, y en poblaciones de bajos ingresos económicos (7-9).
Diez años después del descubrimiento de H .pylori la Organización Mundial de la Salud (OMS) lo catalogó como carcinógeno tipo I, o carcinógeno definido (10). En la actualidad se lo considera la principal causa demostrada de gastritis crónica, úlceras pépticas, linfoma MALT gástrico y cáncer gástrico (CG) (11,12).
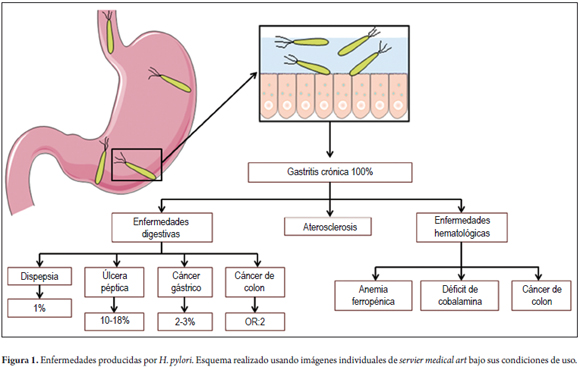
En todos las personas infectadas esta bacteria produce gastritis crónica (13); sin embargo, en la mayoría de los pacientes dicha inflamación gástrica es asintomática, y en menos del 20% se produce una entidad clínica manifiesta: úlceras pépticas en el 15%-18% de los casos; CG, en el 2%-3%, y cáncer gástrico y linfoma MALT gástrico en menos del 0,1% (11-13).
Si bien no se sabe con exactitud por qué solo la quinta parte de los infectados tendrá una enfermedad causada por la infección, se considera que podría deberse a factores genéticos del individuo infectado, a la virulencia de la bacteria y a diversos factores ambientales. El riesgo atribuible para CG es del 75%; es decir, la infección es responsable de por lo menos el 75% de dichos tumores.
Además de las mencionadas enfermedades gastroduodenales, hay fuertes indicios de que H. pylori se asocia positivamente a la aparición de pólipos adenomatosos y al cáncer de colon (14-20), y la asociación es aún mayor para los cánceres distales (figura 1).
Junto con la participación de la infección en las patologías mencionadas, hay cada vez mayor evidencia de la relación entre esta y diversas patologías extragástricas, tales como enfermedades hematológicas, coronarias, hepáticas y neurodegenerativas, e, incluso, con el desarrollo de diabetes mellitus tipo 2 (21-27). Por otra parte, sin embargo, la evidencia actual solo respalda una asociación causal a la AF (28), el déficit de vitamina B12 (DB12) (29) y la púrpura trombocitopénica inmune (PTI) (30), y por ello se ha recomendado erradicar la infección en dichos escenarios, como recientemente ha sido ratificado en el consenso de Maastricht (31).
Teniendo en cuenta la importancia de este microorganismo en las patologías mencionadas, el presente artículo se propone revisar su relación y los mecanismos fisiopatológicos implicados.
METODOLOGÍA
Se hizo una búsqueda de literatura en la base de datos PubMed, usando la siguiente estrategia: (((((Vitamin B 12 OR B 12, Vitamin OR Vitamin B12 OR B12, Vitamin OR Cyanocobalamin OR Cobalamins OR Cobalamin OR Eritron[Title/Abstract])) OR (Anemia, Iron-Deficiency OR Anemia, Iron Deficiency OR Iron-Deficiency Anemia OR Iron Deficiency Anemia OR Iron-Deficiency Anemias OR Iron Deficiency Anemias OR Anemias, Iron-Deficiency OR Anemias, Iron Deficiency[Title/Abstract])) OR (Purpura, Thrombocytopenic, Idiopathic OR Idiopathic Thrombocytopenic Purpura OR Idiopathic Thrombocytopenic Purpuras OR Purpura, Idiopathic Thrombocytopenic OR Purpuras, Idiopathic Thrombocytopenic OR Thrombocytopenic Purpura, Idiopathic OR Thrombocytopenic Purpuras, Idiopathic OR Werlhofs Disease OR Disease, Werlhofs OR Werlhofs Disease OR Purpura, Thrombocytopenic, Autoimmune OR Thrombocytopenic Purpura, Autoimmune OR Werlhof Disease OR Disease, Werlhof OR Autoimmune Thrombocytopenic Purpura OR Autoimmune Thrombocytopenic Purpuras OR Purpura, Autoimmune Thrombocytopenic OR Purpuras, Autoimmune Thrombocytopenic OR Immune Thrombocytopenic Purpura OR Autoimmune Thrombocytopenia OR Autoimmune Thrombocytopenias OR Thrombocytopenia, Autoimmune OR Thrombocytopenias, Autoimmune[Title/Abstract])) AND (Helicobacter pylori OR Campylobacter pylori[Title/Abstract])).
Se limitó la búsqueda a los artículos de los últimos cinco años. De estos se revisaron el título y el resumen, y, según el criterio de los autores, se seleccionaron los que eran pertinentes y aportarían información útil para la revisión, con el fin de, posteriormente, revisarlos en su totalidad.
Se excluyeron, entre otros, los artículos cuya información era redundante respecto a la de otros. Adicionalmente, los autores agregaron a la revisión algunos de los artículos mencionados en las referencias de las publicaciones seleccionadas de la búsqueda inicial.
PÚRPURA TROMBOCITOPÉNICA INMUNE (PTI)
La prevalencia de H. pylori en pacientes con púrpura trombocitopénica inume (PTI) es similar a su prevalencia en controles apareados según la edad y el área geográfica (32); oscila entre niveles tan bajos como el 20% hasta niveles tan altos como el 80%, en diferentes edades y zonas (33-36). Sin embargo, múltiples estudios han mostrado una clara asociación entre la erradicación de H. pylori en pacientes con PTI y la mejoría en sus recuentos de plaquetas (30,37,38).
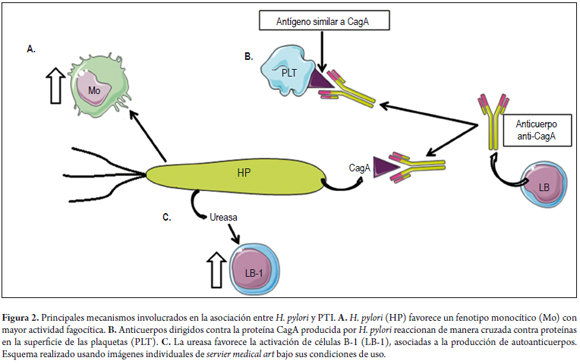
Uno de los posibles mecanismos para el desarrollo de PTI en pacientes infectados por H. pylori es la reactividad cruzada entre anticuerpos dirigidos contra esta bacteria; específicamente, contra su proteína CagA, y proteínas en la superficie de las plaquetas (39); de hecho, la diferencia en el éxito del tratamiento en pacientes con PTI mediante la erradicación de H. pylori entre países como Japón y Estados Unidos (mayor en el primero) podría ser explicada por este mecanismo, pues el primero tiene prevalencias de H. pylori CagA + mayores que el segundo (30,40).
Adicionalmente a lo anterior, se ha encontrado que la infección por esta bacteria disminuye los niveles del receptor Fcγ inhibidor IIB en los monocitos mientras aumentan los niveles del receptor Fcγ, y lleva así a un fenotipo monocítico con mayor actividad fagocítica (41); un estudio demostró que los elementos de H. pylori, particularmente la ureasa, promueven la activación de células B-1, una subpoblación de linfocitos B asociada a la producción de autoanticuerpos (42), los cuales podrían lesionar las plaquetas durante la infección por H. pylori (figura 2).
TRATAMIENTO DE H. PYLORI EN PTI
La erradicación de H. pylori en pacientes con PTI aumenta los recuentos de plaquetas en aproximadamente el 50% de los pacientes (30,37,38). El metaanálisis de Stasi et al. (37) demostró que la respuesta es más exitosa en poblaciones con altas prevalencias de H. pylori o en los pacientes con niveles leves de trombocitopenia. En este metaanálisis, de los estudios realizados en Japón el 57,9% de los pacientes tuvo una respuesta en su conteo de plaquetas, mientras solo lo tuvo el 38,3% de los pacientes de otros países. Por otro lado, el 35,2% de pacientes con recuentos < 30 × 109/L tuvo una respuesta en sus recuentos, en tanto la mejoría se produjo en el 50,3% de los pacientes cuando el valor era superior a ese nivel.
En un metaanálisis sobre los efectos de la erradicación de H. pylori en los pacientes con PTI, que incluyó 11 estudios, la erradicación fue exitosa en 166 (81,0%) de 205 pacientes H. pylori positivos (30). El tratamiento se dio con amoxicilina 750-1500 mg dos veces al día, claritromicina 200-400 mg dos veces al día y un IBP por 7 días, excepto en un estudio donde se dio tratamiento por 14 días.
ANEMIA FERROPÉNICA (AF)
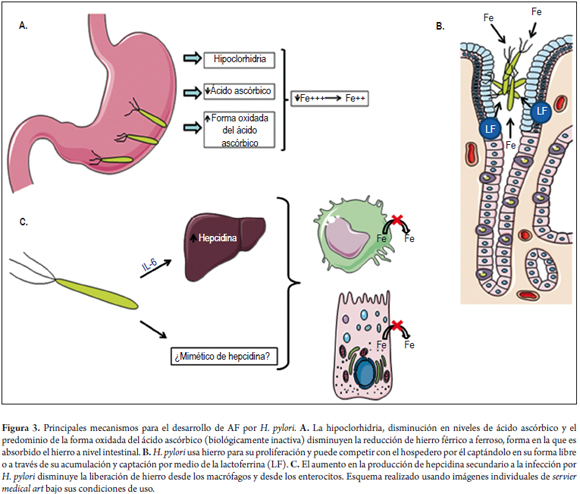
La reducción del hierro férrico a hierro ferroso, o forma como es absorbido en el intestino, es promovida por el pH ácido del estómago y potenciado por el ácido ascórbico (43-45). La disminución en los niveles de ácido ascórbico y de acidez en el estómago, secundaria a los cambios inflamatorios histopatológicos producidos por H. pylori, puede estar de por medio en una inadecuada absorción de hierro, y, por ende, en la patogénesis de la AF (46-51).
Así mismo, es bien sabido que la gastritis, independientemente de su grado, lleva al predominio de la forma oxidada, biológicamente inactiva, del ácido ascórbico en el jugo gástrico (45), lo cual también disminuye la absorción del hierro. Por otro lado, las bacterias necesitan hierro para su crecimiento; de hecho, en ocasiones llegan a competir con el hospedero por dicho mineral (52). Así, La misma presencia de H. pylori, incluso cuando es asintomática, puede disminuir el hierro absorbido de la dieta, al tomarlo directamente de esta, y así disminuir la cantidad disponible para el huésped (53-56).
Adicionalmente a lo anterior, se ha demostrado que H. pylori puede llevar al secuestro de lactoferrina en la mucosa gástrica del huésped (principalmente, en glándulas y neutrófilos) (57), y que puede expresar un receptor para lactoferrina en su membrana, a través del cual puede tomar directamente el hierro (58-60). Otro posible mecanismo para la deficiencia de hierro sería el sangrado, bien sea por úlceras pépticas, por gastritis hemorrágica o por tumores (49,53).
En una población de Alaska, un estudio atribuyó el déficit de hierro al sangrado gastrointestinal oculto (detectado por hemoglobina en las heces), producido por gastritis crónica en pacientes infectados por H. pylori (61); mientras, otros estudios han hallado ulceraciones endoscópicamente (62).
Finalmente, ha sido propuesto un mecanismo relacionado con la regulación del metabolismo del hierro a través de la hepcidina. La hepcidina es un péptido sintetizado en el hígado que actúa como regulador de la absorción intestinal del hierro y de la disponibilidad sistémica de este (63).
La hepcidina se une a la ferroportina, una proteína transmembrana hallada, principalmente, en macrófagos y enterocitos, y que permite el paso del hierro intracelular al espacio extracelular para su disponibilidad sistémica (64). Esta unión lleva a la internalización y la degradación intracelular de la ferroportina, lo que terminará en la retención del hierro tanto en los enterocitos como en los macrófagos (64).
Un posible mecanismo sería que la infección por H. pylori, por medio de una respuesta inflamatoria donde participaría principalmente la IL6 (65), aumente los niveles de hepcidina circulantes del huésped, y así lleve a anemia, tanto por disminución en la absorción de hierro como por bloqueo de la liberación de este por parte de las células inflamatorias, como sucede en las enfermedades inflamatorias crónicas.
En el estudio de Lee S. et al. (66) los niveles de prohepcidina, precursor de la hepcidina, disminuyeron tras el tratamiento de pacientes con AF e infección por H. pylori, independientemente de si recibieron tratamiento con hierro oral, erradicación de H. pylori o ambos.
Además de lo anterior, Beutler E. (67) sugirió que la respuesta inflamatoria sistémica ante H. pylori no era lo suficientemente intensa para generar un aumento de tanta importancia en la hepcidina como para la producción de anemia; por ello, sugirió que si bien no había aumento de la hepcidina se podrían producir algunas moléculas generadas por H. pylori que actúen como miméticas de la hepcidina. Sin embargo, evidencia más reciente sostiene, en efecto, una asociación positiva entre la infección por esta bacteria y el aumento de los niveles séricos de hepcidina (68,69). En cualquiera de los casos, parece factible un mecanismo por el cual H. pylori lleve a disminuir la disponibilidad del hierro sistémico a través de la regulación a la baja de la ferroportina.
Es necesario tener en cuenta que la anemia por deficiencia de hierro solo puede atribuirse a H.pylori cuando otras causas más comunes han sido descartadas (49). Por lo anterior, H. pylori no se considera una causa importante o habitual de AF (figura 3).
TRATAMIENTO DE H. PYLORI EN LA AF
Cinco ensayos clínicos aleatorizados (ECA) fueron seleccionados en el metaanálisis realizado por Qu et al. (28). Tras comparar los cambios en la hemoglobina y la ferritina sérica entre pacientes con AF que recibieron hierro y erradicación de H. pylori contra quienes solo recibieron hierro, se hallaron una diferencia de promedios ponderados (DPP) para la hemoglobina de 4,06 g/L y un DPP para la ferritina sérica de 9,47 μg/L; un aumento no muy importante.
El análisis por subgrupos demostró una mejor respuesta en los niveles de ferritina sérica y de hemoglobina entre los adolescentes y los adultos que entre los niños; así, el DPP para Hb fue de 0,65 g/L en niños y de 25,03 g/L en adolescentes y adultos, mientras que el DPP para la FS fue de 0,70 μg/L en niños y de 14,79 μg/L en adolescentes y adultos. Los 5 ECA utilizaron una terapia triple para la erradicación de H. pylori.
La terapia triple con bismuto mostró mejores resultados que la terapia triple con IBP; el DPP para la FS fue de 11,55 μg/L en la primera y de 7,15 μg/L en la segunda. Los autores del estudio atribuyeron tal diferencia tanto a la disminución en la concentración de ácido ascórbico en el jugo gástrico posterior al tratamiento con IBP (lo que disminuye la absorción de hierro no hem) como a la disminución en la absorción de cobalamina, que también contribuye a la absorción de hierro, con el uso de IBP (70,71).
DEFICIENCIA DE VITAMINA B12
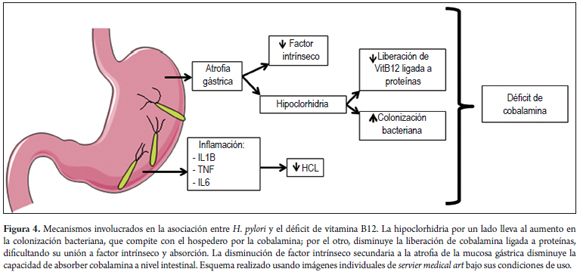
Como mecanismo para esta asociación se propone que la presencia de H. pylori disminuye la secreción de ácido gástrico, y lleva, por ende, a hipoclorhidria (72). Por un lado, se requiere la acción del ácido gástrico para liberar en el estómago la cobalamina ligada a proteínas, y por otro, la hipoclorhidria lleva en el estómago y el intestino al aumento de bacterias que pueden tomar la cobalamina para su propio uso (73). Este mecanismo es respaldado por la disminución en los niveles de cobalamina secundaria al uso crónico de IBP (71,74).
Además de lo anterior, se ha propuesto que la deficiencia de cobalamina es secundaria a la disminución en la producción de factor intrínseco, dada por la gastritis atrófica (anemia perniciosa) producto de la infección crónica por H. pylori (29,75,76). Sin embargo, un estudio concluyó que la asociación entre H. pylori y la deficiencia de cobalamina es independiente de si hay o no gastritis atrófica (77) (figura 4).
Por otro lado, en su revisión sistemática Lahner et al. concluyen que falta evidencia para asegurar cuáles son los posibles mecanismos para la deficiencia de cobalamina secundaria a la infección por H. pylori (29).
TRATAMIENTO DE H. PYLORI EN LA DEFICIENCIA DE COBALAMINA
Un metaanálisis incluyó 5 estudios que evaluaron los niveles de cobalamina antes y después de la erradicación de H. pylori en un total de 283 pacientes H. pylori positivos (29). El tratamiento fue eficaz en 173 pacientes (61,1%), con un período de seguimiento promedio de un mes (0,25-12 meses). El tratamiento fue dado con IBP, amoxicilina, claritromicina y metronidazol en uno de los estudios (78); con IBP, claritromicina y amoxicilina, en otros dos (77,79); IBP y claritromicina, en uno (80), y solo metronidazol, en uno (81). El metaanálisis demostró un aumento en los niveles de cobalamina entre quienes se erradicó H. pylori.
CONCLUSIONES
H. pylori es una bacteria que ha acompañado al ser humano a lo largo de gran parte de su historia (1). Desde hace tiempo se ha evidenciado su asociación a enfermedades gástricas (2), y más recientemente, a enfermedades extragástricas (21-27).
Entre este último grupo H. pylori se ha asociado causalmente, y se ha recomendado su búsqueda y su tratamiento en el caso de déficit de cobalamina, PTI y AF sin otra explicación (31). Sin embargo, adicionalmente a estas, son varias las patologías extragástricas donde dicha bacteria podría jugar un papel; tal es el caso del cáncer de colon, la diabetes mellitus tipo 2, las enfermedades neurodegenerativas, la enfermedad coronaria y la fibrosis hepática (14-24,26).
Para el caso de la PTI, uno de los principales mecanismos patogénicos propuestos es la producción de anticuerpos contra antígenos producidos por H. pylori; principalmente, la proteína CagA, que reaccionará de manera cruzada contra antígenos similares a CagA en la superficie de las plaquetas (39).
En la AF destacan 3 mecanismos a ese mismo respeccto: 1) La disminución en la reducción de hierro férrico a hierro ferroso, secundaria a cambios histopatológicos en el estómago, producidos por H. pylori, lleva a disminuir la absorción intestinal de este mineral (46-51); 2) H. pylori compite por apropiar el hierro que consume el huésped, pues lo necesita para su proliferación (53-56,58-60), y 3) H. pylori aumenta la producción de hepcidina, lo que disminuye la absorción intestinal de hierro y la liberación del hierro que se recicla desde los macrófagos (68,69).
Finalmente, para el caso del déficit de cobalamina, entre los principales mecanismos patogénicos involucrados destaca la disminución de la liberación de esta vitamina desde las proteínas ingeridas por el huésped, secundaria a la hipoclorhidria desencadenada por la infección por H. pylori (72,73).
REFERENCIAS
1. Linz B, Balloux F, Moodley Y, et al. An African origin for the intimate association between humans and Helicobacter pylori. Nature. 2007;445:915-8. [ Links ]
2. Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984;1:1311-5. [ Links ]
3. Dunn BE, Cohen H, Blaser MJ. Helicobacter pylori. Clin Microbiol Rev. 1997;10:720-41. [ Links ]
4. Suerbaum S, Michetti P. Helicobacter pylori infection. N Engl J Med. 2002;347:1175-86. [ Links ]
5. Aje AO, Otegbayo JA, Odaibo GN, et al. Comparative study of stool antigen test and serology for Helicobacter pylori among Nigerian dyspeptic patients-a pilot study. Niger J Clin Pract. 2010;13:120-4. [ Links ]
6. McJunkin B, Sissoko M, Levien J, et al. Dramatic decline in prevalence of Helicobacter pylori and peptic ulcer disease in an endoscopy-referral population. Am J Med. 2011;124:260-4. [ Links ]
7. Grad YH, Lipsitch M, Aiello AE. Secular trends in Helicobacter pylori seroprevalence in adults in the United States: evidence for sustained race/ethnic disparities. Am J Epidemiol. 2012;175:54-9. [ Links ]
8. Epplein M, Signorello LB, Zheng W, et al. Race, African ancestry, and Helicobacter pylori infection in a low-income United States population. Cancer Epidemiol Biomarkers Prev. 2011;20:826-34. [ Links ]
9. Jafar S, Jalil A, Soheila N, et al. Prevalence of helicobacter pylori infection in children, a population-based cross-sectional study in west iran. Iran J Pediatr. 2013;23:13-8. [ Links ]
10. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Schistosomes, liver flukes and Helicobacter pylori. Lyon, 7-14 June 1994. IARC Monogr Eval Carcinog Risks Hum. 1994;61:1-241. [ Links ]
11. Otero W, Gómez M, Castro D. Carcinogénesis gástrica. Rev Col Gastroenterol. 2009;24:314-29. [ Links ]
12. Herrera V, Parsonnet J. Helicobacter pylori and gastric adenocarcinoma. Clin Microbiol Infect. 2009;15:971-6. [ Links ]
13. Otero W, Trespalacios A, Otero E. Helicobacter pylori: Tratamiento actual. Un importante reto en gastroenterología. Rev Col Gastroenterol. 2009;24:279-92. [ Links ]
14. Zumkeller N, Brenner H, Zwahlen M, et al. Helicobacter pylori infection and colorectal cancer risk: a meta-analysis. Helicobacter. 2006;11:75-80. [ Links ]
15. Zhao YS, Wang F, Chang D, et al. Meta-analysis of different test indicators: Helicobacter pylori infection and the risk of colorectal cancer. Int J Colorectal Dis. 2008;23:875-82. [ Links ]
16. Zhang Y, Hoffmeister M, Weck MN, et al. Helicobacter pylori infection and colorectal cancer risk: evidence from a large population-based case-control study in Germany. Am J Epidemiol. 2012;175:441-50. [ Links ]
17. Inoue I, Mukoubayashi C, Yoshimura N, et al. Elevated risk of colorectal adenoma with Helicobacter pylori-related chronic gastritis: a population-based case-control study. Int J Cancer. 2011;129:2704-11. [ Links ]
18. Hong SN, Lee SM, Kim JH, et al. Helicobacter pylori infection increases the risk of colorectal adenomas: cross-sectional study and meta-analysis. Dig Dis Sci. 2012;57:2184-94. [ Links ]
19. Sonnenberg A, Genta RM. Helicobacter pylori is a risk factor for colonic neoplasms. Am J Gastroenterol. 2013;108:208-15. [ Links ]
20. Wu Q, Yang ZP, Xu P, et al. Association between Helicobacter pylori infection and the risk of colorectal neoplasia: a systematic review and meta-analysis. Colorectal Dis. 2013;15:e352-64. [ Links ]
21. Jeon CY, Haan MN, Cheng C, et al. Helicobacter pylori infection is associated with an increased rate of diabetes. Diabetes Care. 2012;35:520-5. [ Links ]
22. Roubaud-Baudron C, Krolak-Salmon P, Quadrio I, et al. Impact of chronic Helicobacter pylori infection on Alzheimers disease: preliminary results. Neurobiol Aging. 2012;33:1009.e11-9. [ Links ]
23. Kountouras J, Tsolaki M, Gavalas E, et al. Relationship between Helicobacter pylori infection and Alzheimer disease. Neurology. 2006;66:938-40. [ Links ]
24. Jafarzadeh A, Esmaeeli-Nadimi A, Nemati M, et al. Serum concentrations of Helicobacter pylori IgG and the virulence factor CagA in patients with ischaemic heart disease. East Mediterr Health J. 2010;16:1039-44. [ Links ]
25. Veneri D, Bonani A, Franchini M, et al. Idiopathic thrombocytopenia and Helicobacter pylori infection: platelet count increase and early eradication therapy. Blood Transfus. 2011;9:340-2. [ Links ]
26. Ki MR, Goo MJ, Park JK, et al. Helicobacter pylori accelerates hepatic fibrosis by sensitizing transforming growth factor-β1-induced inflammatory signaling. Lab Invest. 2010;90:1507-16. [ Links ]
27. Papagiannakis P, Michalopoulos C, Papalexi F, et al. The role of Helicobacter pylori infection in hematological disorders. Eur J Intern Med. 2013. doi: 10.1016/j.ejim.2013.02.011. [ Links ]
28. Qu XH, Huang XL, Xiong P, et al. Does Helicobacter pylori infection play a role in iron deficiency anemia? A meta-analysis. World J Gastroenterol. 2010;16:886-96. [ Links ]
29. Lahner E, Persechino S, Annibale B. Micronutrients (Other than iron) and Helicobacter pylori infection: a systematic review. Helicobacter. 2012;17:1-15. [ Links ]
30. Arnold DM, Bernotas A, Nazi I, et al. Platelet count response to H. pylori treatment in patients with immune thrombocytopenic purpura with and without H. pylori infection: a systematic review. Haematologica. 2009;94:850-6. [ Links ]
31. Malfertheiner P, Megraud F, OMorain CA, et al. Management of Helicobacter pylori infection-the Maastricht IV/ Florence Consensus Report. Gut. 2012;61:646-64. [ Links ]
32. Liebman HA, Stasi R. Secondary immune thrombocytopenic purpura. Curr Opin Hematol. 2007;14:557-73. [ Links ]
33. Russo A, Eboli M, Pizzetti P, et al. Determinants of Helicobacter pylori seroprevalence among Italian blood donors. Eur J Gastroenterol Hepatol. 1999;11:867-73. [ Links ]
34. Graham DY, Malaty HM, Evans DG, et al. Epidemiology of Helicobacter pylori in an asymptomatic population in the United States. Effect of age, race, and socioeconomic status. Gastroenterology. 1991;100:1495-501. [ Links ]
35. Michel M, Cooper N, Jean C, et al. Does Helicobater pylori initiate or perpetuate immune thrombocytopenic purpura? Blood. 2004;103:890-6. [ Links ]
36. Hayashi H, Okuda M, Aoyagi N, et al. Helicobacter pylori infection in children with chronic idiopathic thrombocytopenic purpura. Pediatr Int. 2005;47:292-5. [ Links ]
37. Stasi R, Sarpatwari A, Segal JB, et al. Effects of eradication of Helicobacter pylori infection in patients with immune thrombocytopenic purpura: a systematic review. Blood. 2009;113:1231-40. [ Links ]
38. Franchini M, Cruciani M, Mengoli C, et al. Effect of Helicobacter pylori eradication on platelet count in idiopathic thrombocytopenic purpura: a systematic review and meta-analysis. J Antimicrob Chemother. 2007;60:237-46. [ Links ]
39. Takahashi T, Yujiri T, Shinohara K, et al. Molecular mimicry by Helicobacter pylori CagA protein may be involved in the pathogenesis of H. pylori-associated chronic idiopathic thrombocytopenic purpura. Br J Haematol. 2004;124:91-6. [ Links ]
40. Pérez-Pérez GI, Bhat N, Gaensbauer J, et al. Country-specific constancy by age in cagA+ proportion of Helicobacter pylori infections. Int J Cancer. 1997;72:453-6. [ Links ]
41. Asahi A, Nishimoto T, Okazaki Y, et al. Helicobacter pylori eradication shifts monocyte Fcgamma receptor balance toward inhibitory FcgammaRIIB in immune thrombocytopenic purpura patients. J Clin Invest. 2008;118:2939-49. [ Links ]
42. Yamanishi S, Iizumi T, Watanabe E, et al. Implications for induction of autoimmunity via activation of B-1 cells by Helicobacter pylori urease. Infect Immun. 2006;74:248-56. [ Links ]
43. Lombard M, Chua E, OToole P. Regulation of intestinal non-haem iron absorption. Gut. 1997;40:435-9. [ Links ]
44. Conrad ME, Umbreit JN, Moore EG. Iron absorption and transport. Am J Med Sci. 1999;318:213-29. [ Links ]
45. Rathbone BJ, Johnson AW, Wyatt JI, et al. Ascorbic acid: a factor concentrated in human gastric juice. Clin Sci (Lond). 1989;76:237-41. [ Links ]
46. Capurso G, Lahner E, Marcheggiano A, et al. Involvement of the corporal mucosa and related changes in gastric acid secretion characterize patients with iron deficiency anaemia associated with Helicobacter pylori infection. Aliment Pharmacol Ther. 2001;15:1753-61. [ Links ]
47. Annibale B, Capurso G, Lahner E, et al. Concomitant alterations in intragastric pH and ascorbic acid concentration in patients with Helicobacter pylori gastritis and associated iron deficiency anaemia. Gut. 2003;52:496-501. [ Links ]
48. Baysoy G, Ertem D, Ademoğlu E, et al. Gastric histopathology, iron status and iron deficiency anemia in children with Helicobacter pylori infection. J Pediatr Gastroenterol Nutr. 2004;38:146-51. [ Links ]
49. Muhsen K, Cohen D. Helicobacter pylori infection and iron stores: a systematic review and meta-analysis. Helicobacter. 2008;13:323-40. [ Links ]
50. Zhang ZW, Patchett SE, Perrett D, et al. The relation between gastric vitamin C concentrations, mucosal histology, and CagA seropositivity in the human stomach. Gut. 1998;43:322-6. [ Links ]
51. Sarker SA, Davidsson L, Mahmud H, et al. Helicobacter pylori infection, iron absorption, and gastric acid secretion in Bangladeshi children. Am J Clin Nutr. 2004;80:149-53. [ Links ]
52. Otto BR, Verweij-van Vught AM, MacLaren DM. Transferrins and heme-compounds as iron sources for pathogenic bacteria. Crit Rev Microbiol. 1992;18:217-33. [ Links ]
53. Milman N, Rosenstock S, Andersen L, et al. Serum ferritin, hemoglobin, and Helicobacter pylori infection: a seroepidemiologic survey comprising 2794 Danish adults. Gastroenterology. 1998;115:268-74. [ Links ]
54. Barabino A, Dufour C, Marino CE, et al. Unexplained refractory iron-deficiency anemia associated with Helicobacter pylori gastric infection in children: further clinical evidence. J Pediatr Gastroenterol Nutr. 1999;28:116-9. [ Links ]
55. Mahalanabis D, Islam MA, Shaikh S, et al. Haematological response to iron supplementation is reduced in children with asymptomatic Helicobacter pylori infection. Br J Nutr. 2005;94:969-75. [ Links ]
56. Jeon BH, Oh YJ, Lee NG, et al. Polymorphism of the Helicobacter pylori feoB gene in Korea: a possible relation with iron-deficiency anemia? Helicobacter. 2004;9:330-4. [ Links ]
57. Choe YH, Oh YJ, Lee NG, et al. Lactoferrin sequestration and its contribution to iron-deficiency anemia in Helicobacter pylori-infected gastric mucosa. J Gastroenterol Hepatol. 2003;18:980-5. [ Links ]
58. Husson MO, Legrand D, Spik G, et al. Iron acquisition by Helicobacter pylori: importance of human lactoferrin. Infect Immun. 1993;61:2694-7. [ Links ]
59. Dhaenens L, Szczebara F, Husson MO. Identification, characterization, and immunogenicity of the lactoferrin-binding protein from Helicobacter pylori. Infect Immun. 1997;65:514-8. [ Links ]
60. DuBois S, Kearney DJ. Iron-deficiency anemia and Helicobacter pylori infection: a review of the evidence. Am J Gastroenterol. 2005;100:453-9. [ Links ]
61. Yip R, Limburg PJ, Ahlquist DA, et al. Pervasive occult gastrointestinal bleeding in an Alaska native population with prevalent iron deficiency. Role of Helicobacter pylori gastritis. JAMA. 1997;277:1135-9. [ Links ]
62. Chan FK, Chung SC, Suen BY, et al. Preventing recurrent upper gastrointestinal bleeding in patients with Helicobacter pylori infection who are taking low-dose aspirin or naproxen. N Engl J Med. 2001;344:967-73. [ Links ]
63. Krause A, Neitz S, Mägert HJ, et al. LEAP-1, a novel highly disulfide-bonded human peptide, exhibits antimicrobial activity. FEBS Lett. 2000;480:147-50. [ Links ]
64. Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science. 2004;306:2090-3. [ Links ]
65. Nemeth E, Valore EV, Territo M, et al. Hepcidin, a putative mediator of anemia of inflammation, is a type II acute-phase protein. Blood. 2003;101:2461-3. [ Links ]
66. Lee SY, Song EY, Yun YM, et al. Serum prohepcidin levels in Helicobacter pylori infected patients with iron deficiency anemia. Korean J Intern Med. 2010;25:195-200. [ Links ]
67. Beutler E. Hepcidin mimetics from microorganisms? A possible explanation for the effect of Helicobacter pylori on iron homeostasis. Blood Cells Mol Dis. 2007;38:54-5. [ Links ]
68. Ozkasap S, Yarali N, Isik P, et al. The role of prohepcidin in anemia due to helicobacter pylori infection. Pediatr Hematol Oncol. 2013;30:425-31. [ Links ]
69. Azab SF, Esh AM. Serum hepcidin levels in Helicobacter pylori-infected children with iron-deficiency anemia: a case-control study. Ann Hematol. 2013;92:1477-83. [ Links ]
70. Hutchinson C, Geissler CA, Powell JJ, et al. Proton pump inhibitors suppress absorption of dietary non-haem iron in hereditary haemochromatosis. Gut. 2007;56:1291-5. [ Links ]
71. McColl KE. Effect of proton pump inhibitors on vitamins and iron. Am J Gastroenterol. 2009;104(Suppl 2):S5-9. [ Links ]
72. Annibale B, Capurso G, Delle Fave G. Consequences of Helicobacter pylori infection on the absorption of micronutrients. Dig Liver Dis. 2002;34(Suppl 2):S72-7. [ Links ]
73. Baik HW, Russell RM. Vitamin B12 deficiency in the elderly. Annu Rev Nutr. 1999;19:357-77. [ Links ]
74. Ito T, Jensen RT. Association of long-term proton pump inhibitor therapy with bone fractures and effects on absorption of calcium, vitamin B12, iron, and magnesium. Curr Gastroenterol Rep. 2010;12:448-57. [ Links ]
75. Carmel R. Malabsorption of food cobalamin. Baillieres Clin Haematol. 1995;8:639-55. [ Links ]
76. Stopeck A. Links between Helicobacter pylori infection, cobalamin deficiency, and pernicious anemia. Arch Intern Med. 2000;160:1229-30. [ Links ]
77. Serin E, Gümürdülü Y, Ozer B, et al. Impact of Helicobacter pylori on the development of vitamin B12 deficiency in the absence of gastric atrophy. Helicobacter. 2002;7:337-41. [ Links ]
78. Kaptan K, Beyan C, Ural AU, et al. Helicobacter pylori-is it a novel causative agent in Vitamin B12 deficiency? Arch Intern Med. 2000;160:1349-53. [ Links ]
79. Ozer B, Serin E, Gumurdulu Y, et al. Helicobacter pylori eradication lowers serum homocysteine level in patients without gastric atrophy. World J Gastroenterol. 2005;11:2764-7. [ Links ]
80. Marino MC, de Oliveira CA, Rocha AM, et al. Long-term effect of Helicobacter pylori eradication on plasma homocysteine in elderly patients with cobalamin deficiency. Gut. 2007;56:469-74. [ Links ]
81. Cohen H, Weinstein WM, Carmel R. Heterogeneity of gastric histology and function in food cobalamin malabsorption: absence of atrophic gastritis and achlorhydria in some patients with severe malabsorption. Gut. 2000;47:638-45. [ Links ]











 texto en
texto en