Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.4 Bogotá Oct./Dec. 2013
Derivaciones biliopancreáticas guiadas por ultrasonido endoscópico: descripción de caso y revisión de la literatura
Elías Alfonso Forero Piñeros, MD. (1), Doménico Galasso, MD. (2), Erwan Bories, MD. (3), Marc Giovannini, MD. (4)
(1) Jefe, Servicio de Endoscopia Digestiva y Gastroenterología, Hospital Central de la Policía. Bogotá, Colombia.
(2) Gastroenterólogo, Unidad Operativa de Endoscopia Digestiva Quirúrgica, Policlínico Agostino Gemelli, Universidad de Roma. Roma, Italia.
(3) Gastroenterólogo, Instituto Paoli Calmette. Marsella, Francia.
(4) Jefe, Servicio de Endoscopia Terapéutica, Instituto Paoli Calmette. Marsella, Francia.
Fecha recibido: 25-10-12 Fecha aceptado: 27-08-13
Resumen
En este trabajo se presenta el primer caso reportado de hepatogastrostomía guiada por ultrasonido endoscópico, realizada en un paciente con antecedente de cirugía bariátrica (banda gástrica), y se revisan la evolución clínica y de la técnica, así como los accesorios utilizados. Se complementa este caso clínico con una revisión detallada y actualizada de la literatura médica referente a las derivaciones biliopancreáticas guiadas por ultrasonido endoscópico, las cuales son procedimientos en rápido desarrollo e incrementan el armamentarium terapéutico para los pacientes que requieren derivaciones biliares o pancreáticas, y en quienes ha fallado la derivación por colangiopancreatografía retrógrada endoscópica (CPRE) o no es posible realizarla; también lo es para quienes no son candidatos a la alternativa de la derivación biliar percutánea o la rechazan.
Entre los mencionados procedimientos se incluyen la hepatogastrostomía guiada por ultrasonido endoscópico, el rendezvous biliopancreático guiado por ultrasonido endoscópico, la coledocoduodenostomía guiada por ultrasonido endoscópico, la colecistogastrostomía guiada por ultrasonido endoscópico y la pancreatogastrostomía guiada por ultrasonido endoscópico. Se hará, además, una descripción técnica de cada uno de estos procedimientos y de los accesorios requeridos.
Finalmente, se plantea el manejo de los pacientes, guiados por los pioneros de mayor experiencia en estas técnicas en el mundo; procedimientos que ya tienen un lugar reconocido dentro del armamentarium terapéutico de los pacientes que ameritan tal tipo de derivaciones.
Palabras clave
Ultrasonido endoscópico, hepaticogastrostomía, coledocoduodenostomía, rendezvous, pancreatogastrostomía.
CASO CLÍNICO
Hepatogastrostomía guiada por ultrasonido endoscópico en un paciente tratado previamente con banda gástrica
La historia clínica del paciente observado revelaba obesidad (índice de masa corporal 37,9; altura 1,78 m, peso 120 kg, en el momento de la hospitalización), síndrome de apnea obstructiva del sueño, diabetes no insulinodependiente y antecedentes de cirugía bariátrica (banda gástrica por laparoscopia) en 2006. Se asoció tabaquismo activo severo (20 cigarrillos al día durante 35 años), estenosis de la carótida interna derecha del 30%, asma y bronconeumopatía obstructiva crónica moderada.
Tras la aparición inicial de astenia, náuseas y diarrea, asociadas a pérdida de peso de 6 kg, colestasis anictérica y prueba de aumento de la función hepática y oncomarcadores (CA 19-9; 8,816 U/l; CEA 11,3 ng/ml; alfa-fetoproteína 5,4 g/l), un hombre de 53 años de edad fue sometido a exámenes adicionales (tabla 1), incluyendo una imagen de resonancia magnética (el 7 de mayo de 2012), que muestra una masa nodular de 35 mm a la altura del hilio hepático, lo cual llevó a determinar la existencia de una dilatación de los conductos biliares intrahepáticos.
El paciente es remitido al Instituto Paoli Calmette, para investigaciones posteriores, incluyendo evaluación por ultrasonografía endoscópica (USE) y aspiración de la masa con aguja fina (PAAF).
Una tomografía axial computarizada (TAC), realizada en el mencionado hospital el 31 de mayo de 2012, detectó que la lesión parecía extenderse a la rama izquierda de la vena porta, la hepática izquierda y los conductos biliares posterolaterales. También se detectaron linfadenopatías hiliares, celiacas e inter-cava-aórticas asociadas.
Una punción citológica guiada por USE de los trombos neoplásicos en la rama izquierda de la vena porta, realizada el 12 de junio de 2012, con aguja calibre 25 G (EchoTip, Cook Ireland Ltd., Limerick, Irlanda), suministró un diagnóstico de colangiocarcinoma (CK7 y Muc1 intensamente positiva y CK20 moderadamente positiva en la inmunohistoquímica).
El paciente ha sido tratado por quimioterapia neoadyuvante, pero, debido a la aparición de ictericia (bilirrubina total 420 mmol/l, valor normal 5,0-17,0 mmol/l), fue sometido el 26 de junio de 2012 a una colangiopancreatografía retrógrada endoscópica (CPRE) y se le puso un stent metálico autoexpandible descubierto (RX Wall Flex biliar descubierto, Boston Scientific, Galway, Irlanda) de 10 cm de largo, para drenar el lóbulo hepático derecho. El drenaje del lóbulo izquierdo resultó un desafío técnico durante la sesión de CPRE, y fracasó. El 28 de junio de 2012 se le realizó, entonces, un drenaje percutáneo externo, con un dren de 8,5 Fr (Cook Ireland Ltd., Limerick, Irlanda).
Se hicieron tres intentos (el 28 de junio, el 3 de julio y el 19 de julio de 2012), con el fin de ponerle un stent biliar por vía percutánea para drenar el lóbulo hepático izquierdo en el conducto biliar común, a través del tumor. Los tres intentos fracasaron, y se dejó en su lugar un drenaje percutáneo externo de 8,5 Fr (Cook Ireland Ltd, Limerick, Irlanda), el cual drena 600 cm3/día de bilis clara.
Una TAC practicada el 2 de julio de 2012 detectó un aumento ulterior en el volumen del tumor, de hasta 40 mm de tamaño, pero los conductos biliares estaban menos dilatados y el stent metálico y el drenaje biliar externo se hallaban correctamente en su lugar. La linfadenopatía era estable, pero apareció una ascitis de pequeño volumen.
Como falló el tercer intento para instalar percutáneamente un stent metálico biliar izquierdo y el drenaje externo estaba drenando 300-600 cm3/día de bilis clara, se le propuso al paciente una gastrostomía hepática guiada por USE (HGS) como una solución definitiva, y la cual él aceptó.
Una revisión de las imágenes de las TAC mostró una posible ventana para hepatogastrostomía guiada por ecoendoscopia HGS a la altura del cardias. El drenaje biliar externo se cerró el 22 de julio de 2012, y el 25 de julio se llevó a cabo, con éxito, la HGS.
Procedimiento
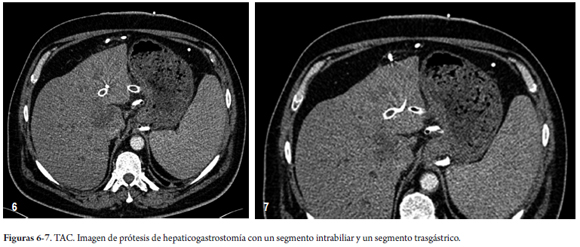
Al hacer el examen del lóbulo hepático izquierdo por USE, utilizando un ecoendoscopio lineal terapéutico (EG-3870 UTK, Pentax Corporation, Tokio, Japón) y un procesador de ultrasonido (HI VISION Avius, Hitachi Medical Corporation, Tokio, Japón), se detectó dilatación de los conductos biliares intrahepáticos izquierdos y el drenaje biliar externo. El paciente ya estaba recibiendo terapia de antibióticos (vancomicina y amikacina), debido a los cultivos de sangre positivos, y no estuvo febril durante las 12 horas anteriores al momento del procedimiento.
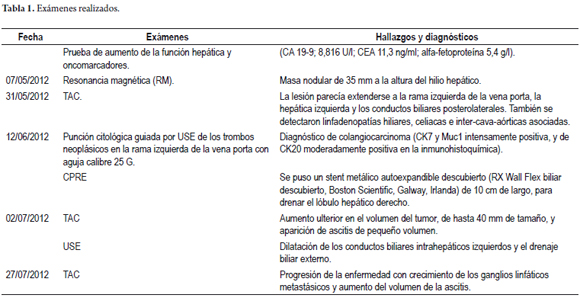
El conducto de drenaje de la bilis hepática en el segmento III fue puncionado transgástricamente, a la altura del cardias, justo por encima de la banda gástrica, utilizando una aguja FNA estándar calibre 19 (EchoTip, Cook Ireland Ltd., Limerick, Irlanda) bajo la guía endosonográfica. Una vez inyectado el medio de contraste y realizada la colangiografía hepática izquierda, se introdujo una guía de 450 cm de largo y 0,035 pulgadas (Straight Tip Jagwire, Boston Scientific, Alajuela, Costa Rica), en el conducto biliar hepático izquierdo.
Se avanzó, entonces, un cistótomo de 6 Fr (Cook Ireland Ltd., Limerick, Irlanda) a lo largo del alambre guía, con el fin de generar una fístula biliogástrica, a través dela cual se pudiera insertar un stent metálico. El modo endocut se utilizó para conseguir tal objetivo.
Una vez la punta del cistótomo estuvo dentro de la vía biliar, el alambre guía se reemplazó con uno más rígido, de 0,035 pulgadas y 460 cm de largo (Snap-Tip, MTW Endoskopie, Wesel, Alemania), y se introdujo exitosamente un stent metálico medio cubierto de 10 cm (GIOBOR Niti-S Biliary Covered stent Half Covered-Type, Tae Woong Medical, Gyeonggi-do, Corea del Sur), a través de la fístula generada.
Este tipo particular de stent metálico autoexpandible tiene tres marcadores radiopacos: uno en el centro y uno en cada extremo, que permiten el posicionamiento preciso tanto de la parte cubierta como de la no cubierta del stent.
La parte no cubierta del stent se puso completamente dentro del conducto biliar, y la parte cubierta, a través de la fístula, para evitar cualquier complicación conocida (fuga biliar, absceso hepático, migración del stent, etc.).
Seguimiento
No se presentaron complicaciones durante el procedimiento ni a lo largo de las siguientes dos semanas.
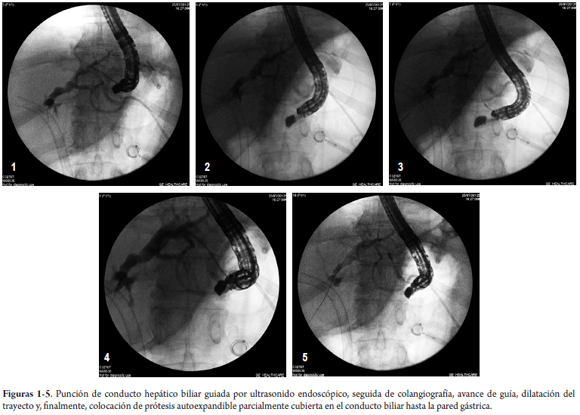
Una TAC realizada el 27 de julio de 2012 mostró una progresión de la enfermedad, con crecimiento de los ganglios linfáticos metastásicos y aumento del volumen de la ascitis. Tanto el stent metálico endobiliar como el stent metálico transgástrico seguían en su lugar. Entonces el drenaje percutáneo externo, que se mantuvo cerrado durante todo el periodo, fue retirado y el paciente fue remitido a los oncólogos para quimioterapia (gentamicina y cisplatin). Las figuras 1-5, 6-7 y 8-9 muestran los pasos principales durante el procedimiento y la imagen del TAC posterior.
INTRODUCCIÓN
El drenaje biliar ecoendoscópico es una opción para tratar la ictericia obstructiva cuando el drenaje por CPRE falla, lo cual ha sido posible gracias al desarrollo de los ecoendoscopios y de sus accesorios, y lo convierten en una alternativa adicional al drenaje biliar percutáneo y a la cirugía.
Aunque la CPRE es aún hoy el tratamiento estándar de oro para el drenaje de la vía biliar, no es infalible; por ejemplo, para derivar con éxito a pacientes con cáncer de páncreas solo alcanza una efectividad del 80%-85%, lo cual deja un grupo importante de pacientes con requerimientos de tratamientos alternativos. La canulación de la papila mayor falla entre el 3% y el 12% de los casos, incluso cuando se utilizan para llevarla a cabo las alternativas del precorte y la infundibulotomía (1).
Algunas de las limitaciones del drenaje biliar percutáneo incluyen el hecho de requerir que los conductos biliares intrahepáticos estén dilatados; además, tiene una tasa de complicaciones del 25%-30%, y que incluyen, entre otras: colangitis, fuga biliar, formación de fístula, bilioma, peritonitis, empiema, sangrado peritoneal y oclusión del stent. La cirugía derivativa biliar tiene una morbilidad del 17%-50% y una mortalidad del 2%-5%, y en algunas series, de hasta el 10%-15% (2).
Aunque Wiersema describió la colangiopancreatografía guiada por ultrasonido endoscópico en 1996 (3), solo durante los últimos diez años estas técnicas de derivación ecoendoscópica se han desarrollado en centros de referencia, por grupos expertos en CPRE.
Actualmente existe una guía general para la ejecución segura de la mayoría de tales procedimientos. Se han propuesto diferentes nombres para agruparlos: por ejemplo, colangiopancreatografía endosonográfica, o el más general: derivaciones biliares guiadas por ultrasonido endoscópico; incluyen, principalmente, el rendezvous biliar o pancreático ecoguiado, la hepatogastrostomía ecoguiada y la coledocoduodenostomía ecoguiada. Otros procedimientos ecoguiados de menor utilización en la actualidad son la pancreatogastrostomía ecoguiada y la colecistoduodenostomía ecoguiada (4-8).
Los procedimientos ecoguiados pueden ser de primera elección en casos de imposibilidad de CPRE, y de segunda línea cuando la CPRE falla. Algunas de las causas de no resolución de la obstrucción biliar o pancreática por CPRE incluyen el divertículo peripapilar, las variaciones anatómicas de la unión biliopancreática, el crecimiento tumoral dentro de un stent derivativo, la compresión digestiva por un tumor, la obstrucción del tracto de salida gástrico y la anatomía digestiva alterada quirúrgicamente (por ejemplo, en el bypass gástrico o en la reconstrucción en Y de Roux).
En algunos pacientes con anatomía digestiva alterada es posible la desobstrucción mediante el acceso a la vía biliar, facilitado por enteros copia de doble balón; más aún, recientemente se han publicado casos aislados de resolución de la obstrucción de la vía biliar en pacientes operados, mediante la combinación de rendezvous ecoguiado con enteroscopia de doble balón. Ejemplo de ello es colocar mediante esta combinación un stent metálico autoexpandible en una anastomosis hepático-yeyunal (9,10).
Si bien se ha tendido a considerar que estos procedimientos ecoguiados son indicados, en especial, para pacientes con patología maligna, también existen varios reportes de su utilización para resolver obstrucciones biliopancreáticas en pacientes con patología benigna (por ejemplo, coledocolitiasis, pancreatolitiasis, estenosis benignas o fístulas biliares), con similar éxito clínico.
En general, para los pacientes con patología benigna se tiende a buscar que solo se haga el rendezvous ecoguiado. Los expertos generalmente evitan la coledocoduodenostomía o la hepatogastrostomía en pacientes con patología benigna o con patología maligna potencialmente resecable, incluso si el intento de rendezvous inicial fallaba. Adicionalmente, ya se reportó una mayor incidencia de eventos adversos cuando dichos procedimientos se realizan en pacientes con patología benigna que cuando se hacen en pacientes con patología maligna (11).
El enfoque utilizado por expertos de servicios de gran volumen de CPRE, quienes a menudo llevan a cabo también estos procedimientos ecoguiados, es el siguiente:
En todos los pacientes con papila accesible al duodenoscopio y CPRE fallida, después de intento de precorte o de infundibulotomía, se intenta rendezvous. Si se logra hacerlo, se completa el procedimiento como una CPRE normal. Si no es posible completar el rendezvous, se remite a derivación percutánea o quirúrgica; en los casos cuando estas dos alternativas son imposibles o no son aceptadas por el paciente se procede a la derivación biliodigestiva (colédoco duodenostomía o hepatogastrostomía), y se descarta para ellas a los pacientes con patología benigna o con patología maligna potencialmente resecable.
En los pacientes sin posibilidad de acceso a la papila con el duodenoscopio, según la disponibilidad y la experiencia, se hace procedimiento biliar mediante enteroscopia de balones; si esto no es posible o no se dispone del equipo, se remite a derivación percutánea o quirúrgica; en los casos en las que estas alternativas son imposibles o no son aceptadas por el paciente, se procede a la hepatogastrostomía, con las mismas consideraciones de malignidad comentadas. En algunos pacientes se pueden realizar procedimientos combinados de rendezvous ecoendoscópico con enteroscopia de balones.
En algunos pacientes seleccionados es posible combinar procedimientos derivativos guiados por ultrasonido endoscópico con procedimientos derivativos anterógrados usuales (dilatación con balones o colocación de prótesis biliares en estenosis, etc.), realizados a través del trayecto de la derivación ecoguiada. Por ejemplo, poner una prótesis autoexpandible en el ducto hepático común, que resuelve una obstrucción en dicha zona, al resolver el gradiente de presión, disminuye la posibilidad de fuga persistente o de fístula en el sitio de punción de la hepatogastrostomía.
MATERIALES Y EQUIPOS REQUERIDOS
1. Ecoendoscopio lineal de canal terapéutico (> 3,2 mm), que permite el avance de prótesis de 8,5 Fr o > 3,7 mm que permite el paso de accesorios de hasta 10 Fr de diámetro.
2. Agujas para punción de ultrasonido endoscópico: usualmente, de 19 G, que permiten el paso en su interior de guías de 0,035 (pues las de 22 G o 23 G solo permiten el paso de guías de 0,018, si bien ocasionalmente se las puede requerir para punciones desde el duodeno, donde se requiere una mayor flexibilidad de la aguja). Recientemente se han desarrollado las agujas access (Wilson Cook) para facilitar la punción y el paso de la guía, la cual tiene la parte cortante dentro del estilete, que se retira antes de pasar la guía, y así se previene que la guía se pele, o se corte y algún segmento de esta quede accidentalmente suelto como cuerpo extraño dentro de la vía biliar, lo cual, además, impediría completar el procedimiento derivativo.
3. Accesorios para dilatar el trayecto después de la punción: el más utilizado es el cistótomo de 6 Fr (Endoflex Company).
4. Stents biliares. Pueden ser plásticos o metálicos autoexpandibles (self expandible metal stent [SEMS, por sus siglas en inglés]). Aunque con pequeñas variaciones, según el tipo de derivación, durante los últimos años se ha tendido a utilizar cada vez más los stents metálicos autoexpandibles, por las siguientes razones:
La expansión máxima del SEMS efectivamente sella el tracto de punción/dilatación, lo cual puede, en teoría, prevenir la fuga biliar.
Sus diámetros mayores proveen una mejor permeabilidad a largo plazo, lo cual puede disminuir la necesidad de revisiones del stent.
La disfunción del stent por crecimiento interno del tumor o por coagulación es más fácil de manejar en los stents autoexpandibles que en los plásticos: en los primeros se pone un nuevo SEMS en el interior del ocluido; mientras, cambiar un stent plástico transmural ocluido suele requerir un reemplazo sobre guía, pues la remoción libre tiene el riesgo de disrupción del tracto, con el subsiguiente riesgo de paso de la guía en el posterior intento de paso al peritoneo, lo cual implica, prácticamente, la obligación de repetir desde el principio todo el proceso derivativo ecoguiado.
Estas ventajas de los SEMS deben sopesarse con el hecho de que su inserción es un poco más difícil que en la inserción por CPRE, y que se debe poner cuidadosa atención a los detalles de la adecuada colocación, para prevenir el riesgo de acortamiento anterior, con la subsiguiente peritonitis biliar. En los primeros intentos publicados de este procedimiento se reportó la creación de una fístula con un stent plástico, y cuando maduraba se intentaba pasar un SEMS; actualmente, ya no suele hacerse esto.
Para prevenir tanto la migración como las fugas biliares, se puede poner internamente un stent autoexpandible no cubierto, que evita la migración, y en su interior, al paso por la pared digestiva, un stent totalmente cubierto, para prevenir la fuga.
Recientemente Giovannini y Bories diseñaron un stent autoexpandible metálico para las hepatogastrostomías, que es mitad no cubierto (la mitad que queda en el parénquima hepático y da fijación) y mitad cubierto (la mitad que atraviesa la pared gástrica y evita la fuga biliar) (1). Según se ha demostrado, utilizar stents totalmente cubiertos sin otro soporte adicional aumenta la probabilidad de migración y de complicaciones, aunque en pequeñas series (migración del 25%, en comparación con el 7% de migración promedio reportada) (12). También en tiempos recientes, se reportó una migración fatal de un stent hacia el peritoneo (13). Los stents totalmente cubiertos, además, no previenen del todo la obstrucción por crecimiento interno del tumor.
A continuación se describe cada uno de los procedimientos de derivación biliopancreática guiados por ultrasonido endoscópico, de uso y desarrollo en la actualidad.
RENDEZVOUS ECOGUIADO
Consiste en avanzar una guía a través de la papila, mediante una punción guiada por ultrasonido endoscópico lineal de algún conducto biliar o pancreático. Una vez la guía se encuentra en el duodeno, se cambia de equipo por un duodenoscopio, se atrapa la guía con un asa o una pinza y se lleva a cabo la CPRE de la manera convencional.
Los pasos de un rendezvous ecoguiado biliar son los siguientes:
Previamente, administrar antibióticos profilácticos y descartar contraindicaciones.
Se punciona el sistema biliar hepático izquierdo (segmento III) con una aguja 19 G bajo visión endosonográfica lineal desde el cardias (menos común desde el esófago distal, caso en el que se punciona el segmento hepático II).
Se pasa una guía hidrofílica de 0,035 pulgadas (Tracer Metro de Cook, o Jagwire de Boston) en el árbol biliar, hasta que salga por la papila al duodeno.
Se retira suavemente el ecoendoscopio, dejando la guía en posición.
Se inserta un duodenoscopio paralelo a la guía hasta la tercera porción del duodeno.
Se captura la guía con un asa de polipectomía y se la pasa a través del canal de trabajo del duodenoscopio; sobre la guía se montan los accesorios necesarios para completar el procedimiento de derivación de la vía biliar (esfinterotomía, extracción de cálculos, dilatación, colocación de stent, etc.).
Una variante del rendezvous es hacerlo puncionando el colédoco distal desde la segunda porción del duodeno con el equipo rectificado (lo que tiende a dirigir la punción hacia la papila), y pasando una guía angulada, la cual se dirige hasta que salga por la papila; el resto del procedimiento se lleva a cabo de la forma ya descrita. Si no se logra puncionando desde la segunda porción del duodeno, se intenta desde bulbo o antro, aunque con menores posibilidades de éxito (14,15).
La otra variante es el rendezvous del conducto pancreático, que casi siempre ha sido reportado por punción del wirsung desde el estómago, con paso de guía que se recupera en la segunda porción duodenal, y luego se completa el procedimiento de la manera convencional. Este abordaje tiene como aspecto positivo que, teóricamente, tiene menos complicaciones que los otros drenajes ecoguiados; además, permite la instrumentación tradicional de la CPRE. En caso de que no pueda completarse, por no poderse superar con la guía, o la estenosis o la papila, queda la opción de proceder a la coledocoduodenostomía o a la hepatogastrostomía (16). Lo negativo del abordaje es que falla en el 20% de los intentos, incluso en manos experimentadas.
En las revisiones más grandes de reportes de este procedimiento, que incluyen a 45 pacientes (16), se reporta: punción desde el duodeno en 18 de ellos; desde el estómago, en 17, y desde el esófago, en uno. El éxito técnico se logró en estos 36/45 (80%); se presentaron complicaciones en 2/45 (4%), que correspondieron a pneumoperitoneo y fuga biliar, sin mortalidad. La resolución de la obstrucción mediante stent transpapilar se logró en 32 de los 45 pacientes en quienes se intentó (71%).
Otra publicación (9) mostró que el rendezvous biliar fue exitoso en el 75% de los pacientes en quienes se intentó, y se logró resolver el 86% de las obstrucciones; mientras, el rendezvous pancreático fue exitoso en solo el 56% de los casos. Para algunos autores esta técnica es el método preferido de salvamento cuando falla la canulación biliar tradicional (17,18).
En una comparación de este rendezvous con punción desde la segunda porción del duodeno con la técnica de precorte, se encontró que fue efectiva para lograr canulación en el 98,3% de los casos, mientras que el precorte solo lo fue en el 90,3% (P = 0,03) (14).
En otra serie de 40 rendezvous biliares se realizó el acceso por vía transduodenal o antral en 31 (77,5%), y en los otros 9, por vía transgástrica intrahepática (22,5%) (15). En esta serie se reportaron complicaciones en 5 pacientes (13%), que incluían pancreatitis leve a moderada, dolor abdominal y pneumoperitoneo, sin mortalidad.
COLEDOCODUODENOSTOMÍA ECOGUIADA
Consiste en crear una fístula o neopapila que comunique el colédoco con el duodeno, para permitir el drenaje biliar. Los pasos de su realización son los siguientes:
- Previamente, administrar antibióticos profilácticos y descartar contraindicaciones.
- Puncionar transduodenalmente el conducto biliar bajo guía endosonográfica con aguja de 19 G (si es posible), o de 22 G. Se busca el eje largo del ducto biliar extrapancreático con el equipo en posición larga (no acortada); en dicha posición el ecoendoscopio se debe ajustar para dirigir la punción hacia el hilio hepático; luego de lograr la punción, se aspira bilis para comprobar la localización (y para descomprimir la vía biliar), y luego se inyecta medio de contraste en el ducto biliar, para realizar colangiografía.
- Insertar una guía de 0,035 pulgadas de 450 cm de longitud (Metro o Jagwire).
- Dilatar la fístula coledocoduodenal con un catéter de dilatación biliar de Soehendra de 4-9 Fr, o con un cistótomo de 6 Fr. En algunos reportes, para dilatar se ha utilizado el precorte de aguja montado sobre la guía; sin embargo, ha demostrado que dicha estrategia incrementa las complicaciones. Algunos autores recomiendan no utilizar cauterio o bisturí de aguja para lograr el acceso, pues en caso de un drenaje fallido puede haber un alto riesgo inmediato de perforación luminal, de lesión de vena porta y de fuga ductal. El uso de Needle Knife para dilatar la fístula para las derivaciones biliares es el único predictor comprobado estadísticamente como factor de riesgo de eventos adversos posprocedimiento, y se lo debe evitar mientras sea posible; mucho más, si la dirección de corte es tangencial a la pared (11,12,19).
- Insertar un stent biliar (plástico Tanembaumde 7-10 Fr, o metálico autoexpandible cubierto) y posicionarlo a través de la coledocoduodenostomía, con su extremo proximal en el conducto biliar extrahepático. La porción del stent por fuera de la pared duodenal debe ser de por lo menos 15-20 mm de longitud, para prevenir su desalojo.
Algunas de las ventajas de este procedimiento son: la imagen del colédoco es más fácil de ver con el ecoendoscopio lineal que los ductos biliares intrahepáticos, y ello, eventualmente, facilitaría la punción y disminuiría los riesgos; sin embargo, en la actualidad muchos autores expertos no están de acuerdo, y la controversia al respecto se mantiene.
Otra ventaja mencionada es que la posición retroperitoneal del colédoco lo hace un sitio atractivo de acceso en pacientes con ascitis. Este procedimiento es útil para pacientes con obstrucciones biliares distales, y no sirve para las obstrucciones hiliares. Como la derivación generalmente es lejos del tumor, tiene menos posibilidad de obstrucción de la prótesis por crecimiento interno del tumor.
Entre las limitaciones del procedimiento se encuentran: requiere que se vea bien el colédoco, lo cual no siempre es posible; es irrealizable en pacientes con alteración quirúrgica gástrica o duodenal (gastrectomía, bypass, etc.); a veces, por la posición del equipo, no se puede lograr la punción con una aguja 19 G, por lo cual, eventualmente, requiere el uso de agujas más delgadas, que, a su vez, permiten el paso de guías más delgadas, con las cuales es más difícil hacer la instrumentación y el avance del stent; debido a ello, a veces requieren recambio adicional por guías más gruesas y firmes. Por otro lado, se debe evitar al máximo su realización en pacientes con patología benigna o maligna potencialmente resecable.
Una variante del procedimiento es puncionar desde el antro gástrico (coledocoantrostomía), lo que podría ser útil en pacientes con infiltración neoplásica del bulbo duodenal (20).
La coledocoduodenostomía fue inicialmente reportada por Giovannini. En 13 estudios con 33 pacientes mostró una tasa de éxito técnico global reportada del 92%-95%, con éxito clínico en todos los pacientes, y complicaciones globales en el 19%, que incluyen, en orden de frecuencia, pneumoperitoneo y peritonitis biliar focal. Se ha reportado una permeabilidad promedio del stent de 152 días (11).Pequeñas series que han comparado este procedimiento con la alternativa del drenaje percutáneo han encontrado que ambos tienen una tasa similar de éxito, sin diferencias en las complicaciones, los costos o la calidad de vida (21,22).
Otra complicación posible es la migración del stent; para prevenirla se ha propuesto dilatar temprano con balón los stents SEMS, o ponerles en su interior un stent plástico en doble cola de cerdo. Las complicaciones se pueden dividir, a su vez, en tempranas (menores a 30 días), como el pneumoperitoneo y la fuga, que se tratan con antibióticos, nada vía oral (NVO) y, ocasionalmente, cirugía; o tardías (mayores a 30 días; algunos autores dicen mayor a 2 semanas), cuando la fístula ya es madura, y que incluyen, adicionalmente, la migración o la oclusión del stent.
La migración requiere repetir el drenaje biliar; la oclusión requiere, en el caso de los SEMS, insertar un nuevo stent; en el caso de los stents plásticos, el recambio sobre guía, que, como se mencionó, tiene mayor riesgo de pérdida del acceso y paso de la guía al peritoneo. Este recambio sobre guía implica pasar un catéter de vía biliar con guía por medio del stent plástico ocluido, y sobre la guía, usando un asa de polipectomía, remover el stent ocluido a través del canal del duodenoscopio y cambiarlo por otro nuevo, dejando en todo momento la guía en su lugar.
La migración del stent al peritoneo requiere cirugía de urgencia; ya se mencionó una migración fatal de stent al peritoneo. Se debe individualizar el tratamiento por seguir, de acuerdo con la clínica del paciente y la técnica utilizada.
Entre las variantes propuestas de este procedimiento está la coledocoantrostomía, de la que ya se han reportado seis casos; todos ellos, con éxito técnico. También se ha propuesto la utilización del stent axios (Lumena), el cual es un stent metálico autoexpandible diseñado para facilitar el drenaje de los pseudoquistes pancreáticos, como paliativo en algunos pacientes individualizados, pero aún no hay reportes de su utilización en las coledocoduodenostomías.
Otras variaciones publicadas consisten en coledocoduodenostomías con stents metálicos autoexpandibles totalmente cubiertos, que cuando la fístula estaba madura (después de una a cuatro semanas de implantados) se retiraron transitoriamente, para permitir el ingreso en la fístula de un endoscopio convencional (de 8,8 mm de diámetro, con canal operatorio de 2,8 mm), y por medio de él, realizar terapia fotodinámica de un tumor sangrante en el conducto biliar común en un paciente, y en otro, hacer coagulación con argón plasma de un tumor mucinoso papilar intraductal biliar, que incluso se pudo repetir en varias oportunidades (23). También se han podido realizar coledocoduodenostomías en pacientes que tienen in situ stents metálicos autoexpandibles duodenales no cubiertos, a través de los orificios laterales de estas (24,25).
HEPATOGASTROSTOMÍA ECOGUIADA
Consiste en crear una fístula entre los conductos biliares intrahepáticos izquierdos y la pared gástrica. Los pasos para su realización son los siguientes:
Previamente, administrar antibióticos profilácticos (iniciados de tres a cinco días antes) y descartar contraindicaciones.
Utilizando un ecoendoscopio lineal, se visualiza el conducto hepático izquierdo dilatado del segmento III.
Teniendo la punta del ecoendoscopio con el balón inflado, posicionado en la parte media o superior de la curvatura menor del estómago, y bajo guía combinada fluoroscópica y ecoendoscópica, se punciona transgástricamente la vía biliar con una aguja 19 G. Se puede aspirar para comprobar la obtención de bilis y descomprimir el sistema, y se inyecta medio de contraste, para realizar la colangiografía hasta el sitio de obstrucción. La punción se debe realizar desde el cuerpo gástrico superior, con la aguja dirigida hacia el hilio hepático.
Se pasa guía de 0,020 pulgadas (terumo), y sobre esta guía se cambia la aguja introduciendo una vaina diatérmica de 6,5 Fr (set Cysto-gastro de Endoflex) o un cistótomo de 6 Fr (Endoflex), utilizando corriente de corte, para aumentar el diámetro del canal entre el estómago y el conducto hepático izquierdo.
A través de este accesorio se cambia la guía terumo 0,020 por una 0,035 (Metro o Jagwire), se retira el cistótomo y sobre la guía se pasa un stent metálico autoexpandible no cubierto (rango de 8-10 cm), y dentro de este, atravesando la pared gástrica, un stent metálico autoexpandible totalmente cubierto corto (6 cm), para prevenir la formación de fuga biliar. Algunas alternativas para prevenir la fuga incluyen poner un dren nasobiliar de 6-7 Fr y dejarlo 48 horas bajo aspiración continua, o bien, utilizar el stent metálico autoexpandible diseñado por Giovannini y Bories, el cual tiene la mitad no cubierta y la otra mitad, que atraviesa la pared gástrica, cubierta, y el cual actualmente está en evaluación. También se puede dilatar con balón tempranamente o poner un stent plástico doble cola de cerdo en el interior del metálico, para prevenir la migración (26).
Este procedimiento, reportado inicialmente por Burmester (27) en 2003, utiliza los mismos principios del drenaje de pseudoquistes pancreáticos guiado por ultrasonido endoscópico. Las ventajas teóricas adicionales de este procedimiento sobre el drenaje transhepático percutáneo incluyen que la punción del árbol biliar se hace con guía ecográfica en tiempo real, utilizando la información del doppler color, lo que limita la posibilidad de injuria vascular; además, la ausencia de ascitis en el campo de intervención disminuye la posibilidad de complicaciones, y al no necesitarse drenaje externo mejora la calidad de vida de los pacientes.
Shah, Kahaleh, Giovannini y Bories, quienes tienen las mayores casuísticas tanto de este procedimiento como de la coledocoduodenostomía, consideran que la aproximación extrahepática (coledocoduodenostomía) es más difícil y tiene muchas más posibilidades de complicaciones que la aproximación intrahepática (hepatogastrostomía) (28) y la comunicación personal.
La hepatogastrostomía puede, adicionalmente, facilitar el acceso repetido del ducto biliar, sin necesidad de repetir la punción; también facilita el acceso y la resolución de obstrucciones biliares en pacientes con stent metálico autoexpandible duodenal, quienes experimentan recurrencia de la obstrucción biliar. En la hepatogastrostomía, en comparación con otras derivaciones ecoguiadas, el ecoendoscopio está más recto, lo cual favorece la transmisión de la fuerza de empuje para la inserción del stent; es más fácil penetrar un conducto intrahepático pequeño rodeado de hígado que la pared fibrótica del colédoco.
Entre otras ventajas reportadas de este procedimiento se incluyen que se puede utilizar en pacientes con obstrucción biliar del hilio, o distales, si bien requiere tener dilatado el árbol biliar intrahepático izquierdo. Otra ventaja es que tiene menos posibilidad de lesionar la vía biliar y, por lo tanto, menos posibilidad de fugas.
Como limitaciones de esta técnica se han reportado las siguientes:
- La pared gástrica no está perfectamente opuesta al lóbulo hepático izquierdo, y permite cierto desplazamiento entre el sitio de punción de la pared gástrica y el ducto biliar intrahepático, lo que puede producir falla en el procedimiento.
- Cuando la aproximación se hace transesofágica, existe el riesgo teórico de mediastinitis.
- En pacientes con cirrosis hepática se dificulta un poco la punción.
- Existe, al igual que en la coledocoduodenostomía, el riesgo de lesionar la vena porta.
- Requiere el uso de stents de pequeño calibre o metálicos autoexpandibles con aditamento de liberación de pequeño diámetro (19).
- No se recomienda en pacientes con abundante ascitis y gran coagulopatía.
- No es útil para drenar la vía biliar derecha obstruida.
La hepatogastrostomía ecoguiada fue inicialmente reportada por Burmester (27) en 2003. Hasta ahora, en más de 13 publicaciones, las series reportan más de 120 casos de derivaciones biliares ecoguiadas, con ligeras diferencias en cuanto a los accesorios y los stents utilizados, y muestran que el éxito técnico es cercano al 98%; mientras, existen complicaciones de entre el 14%-36% (el doble de la CPRE), y entre las cuales las más comunes son: pneumoperitoneo, coleperitoneo, infección y disfunción del stent, migración tardía del stent, íleo (probablemente, secundario al uso de morfina durante la anestesia), colangitis y bilioma, con una muerte por peritonitis en uno de los primeros pacientes en quienes se utilizó la técnica.
Esta gran serie incluía 51 hepatogastrostomías, reportó éxito técnico en 49 de ellas y éxito clínico, en 46; 42 se hicieron de la manera típica transgástrica y 9 se realizaron por acceso variante (5 transyeyunales en pacientes con gastrectomía total, y 4 transesofágicas en pacientes en quienes el ducto seleccionado para punción era alto, en el segmento II, y de acceso por encima del cardias). En esta serie solo se reportaron complicaciones en el 20% de las hepatogastrostomías.
En otra serie de pacientes de una sola institución (16), de 28 procedimientos se reportó éxito técnico en 27 (96%), y en ellos se resolvió la ictericia en 26 (96%). Se reportaron complicaciones tempranas en el 14% de los casos.
En una serie de su institución, Giovannini reportó 5 casos de complicaciones de 36 hepatogastrostomías: 3 migraciones del stent, un absceso hepático y un coleperitoneo (este último, mortal). Todas las complicaciones fueron manejadas conservadoramente, excepto el paciente del coleperitoneo (al inicio de la técnica, por posible contracción del stent).
La mayoría de los centros que practican tanto la hepatogastrostomía como la coledocoduodenostomía ecoguiadas muestran una notable predilección por la primera; en algunos sitios, incluso, en una proporción de 8 a 1. Un reporte de duración de la permeabilidad promedio de los stents de la hepatogastrostomía informa 132 días promedio, con seguimientos de hasta 184 días (11,29,30).
Entre las variaciones descritas reportadas para el procedimiento, aparte del acceso transyeyunal o transesofágico, se reporta un tratamiento fotodinámico de una estenosis biliar maligna, en la que se introdujo un endoscopio a través de la fístula creada por la hepatogastrostomía (23).
Cabe mencionar que la hepatogastrostomía sirve para manejar estenosis hiliares como distales; también se ha descrito su realización en pacientes con múltiples prótesis obstruidas que no se pueden volver a tratar por CPRE, y que tampoco son candidatos al drenaje percutáneo o los rechazan.
También se ha descrito la colocación de un stent en una anastomosis hepaticoyeyunal, a través de una hepatogastrostomía (10). En pacientes con patología maligna no curable, que requieren derivaciones hepáticas definitivas, son mejores las derivaciones internas, como la hepatogastrostomía que la derivación percutánea definitiva, en cuanto a manejo y calidad de vida (31).
COLECISTODUODENOSTOMÍA ECOGUIADA
Consiste en la derivación interna de la vesícula biliar, en casos de colecistitis aguda, de pacientes que no son candidatos quirúrgicos. Los pasos de su realización son los siguientes:
- Se visualiza la vesícula desde el bulbo duodenal o desde el antro gástrico, con el ecoendoscopio en posición larga.
- Bajo guía endosonográfica, se inserta en la vesícula una aguja de precorte o un cistótomo, o una aguja de ultrasonido de 19 G.
- Se remueve el estilete, se aspira bilis para descomprimir y se inyecta medio de contraste en la vesícula, para colecistografía.
- Se pasa guía 0,035 (Metro o Jagwire).
- Se dilata el trayecto con dilatadores biliares de Soehendra o con balón dilatador.
- Se pone un stent plástico de 5-10 Fr o un stent metálico autoexpandible en el trayecto.
Se ha reportado una serie de 14 pacientes (19), con éxito técnico y clínico del 100%, sin eventos adversos serios; hubo complicaciones en el 7% (un pneumoperitoneo que se resolvió con manejo conservador). Si bien es muy poca la experiencia al respecto, se reportan como limitaciones que la movilidad de la vesícula hace que ocasionalmente sea difícil la colocación del stent, y el hecho de que los accesorios utilizados y potencialmente útiles son de poco diámetro. En esta técnica, muy claramente, faltan más estudios.
PANCREATOGASTROSTOMÍA ECOGUIADA
Consiste en crear una fístula entre el conducto pancreático principal y la pared gástrica. Los pasos para su realización son los siguientes:
- Previamente, administrar antibióticos profilácticos (iniciados de tres a cinco días antes) y descartar contraindicaciones.
- Utilizando un ecoendoscopio lineal, se visualiza el conducto pancreático principal (que debe estar dilatado).
- Teniendo la punta del ecoendoscopio con el balón inflado, y bajo guía combinada fluoroscópica y ecoendoscópica, se punciona transgástricamente la vía pancreática con una aguja 19 G; se puede aspirar para comprobar la obtención de jugo pancreático y descomprimir el sistema, y se inyecta medio de contraste, para realizar la pancreatografía hasta el sitio de obstrucción. Aunque teóricamente es posible puncionar desde el duodeno, sería más difícil; cabe anotar que todos los procedimientos publicados han sido con punción transgástrica.
- Se pasa guía de 0,020 pulgadas (terumo), y sobre esta guía se cambia la aguja por una vaina diatérmica de 6,5 Fr (set Cysto-gastro de Endoflex) o por un cistótomo de 6 Fr (Endoflex), y la cual se introduce utilizando corriente de corte, para aumentar el diámetro del canal entre el estómago y el conducto pancreático principal.
- A través de este accesorio se cambia la guía terumo 0,020 por una guía 0,035 (Metro o Jagwire), se retira el cistótomo y sobre la guía se pasa un stent plástico de 7 Fr.
- En caso de poder avanzar la guía a través de la estenosis y de la papila, se puede cambiar el equipo por un duodenoscopio, y se completa el procedimiento de CPRE de la manera convencional.
La serie más grande conocida en la literatura reporta 25 pancreatografías guiadas por ultrasonido endoscópico, con 10 pancreatogastrostomías, y el 100% de éxito técnico (9). Si bien no hay datos abundantes, se reporta que las derivaciones pancreáticas son más difíciles y tienen menos éxito técnico y clínico (mejoría del dolor, en este caso) que las derivaciones biliares ecoguiadas. Se ha reportado como su principal complicación la pancreatitis, incluso con reportes de pancreatitis severas. Sin duda, también faltan más estudios en la materia.
DISCUSIÓN
El desarrollo de los procedimientos derivativos biliares y pancreáticos ecoguiados ha abierto una nueva posibilidad para los pacientes, en muchos casos, con notorias ventajas en cuanto a su calidad de vida y al evitar costos y cirugías. Sin embargo, aún se mantienen altas tasas de morbilidad, las cuales imponen que su realización actualmente sea practicada por equipos experimentados, que conozcan muy bien el uso de las agujas, los accesorios, las guías, los dilatadores y los stents, así como de las sutiles variaciones de las posiciones de los ecoendoscopios, de su orientación y de las técnicas de anclajes de los stents, para incrementar el éxito y disminuir las complicaciones. A su vez, aún faltan desarrollos en los accesorios utilizados.
Todas las variantes de derivación biliar se deben considerar complementarias, así como todas las vías de acceso (endoscópica, endosonográfica percutánea y quirúrgica). Es muy útil para los endoscopistas expertos en CPRE y en procedimientos endosonográficos derivativos conocer también la técnica para realizar la derivación percutánea, pues aumenta al máximo la posibilidad de resolverle el problema al paciente cuando falló o no fue posible la CPRE (32).
Hay que tener mucho cuidado con las sutilezas técnicas; la mayoría de las complicaciones serias fueron por drenaje biliar inadecuado, después de puncionar un sistema ductal de alta presión, o bien, como resultando en fuga peritoneal o en colangitis, o de un drenaje pancreático inadecuado que degeneró en pancreatitis o en la formación de pseudoquistes.
Los stents plásticos causan colangitis, debido a la migración o a la obstrucción temprana; el acortamiento de los stents metálicos autoexpandibles lleva a peritonitis biliar o a bilioma; este último caso requiere drenaje percutáneo o repetir la derivación ecoguiada. Las únicas dos muertes reportadas por tales derivaciones tuvieron relación con peritonitis severa por acortamiento o por migración peritoneal de los stents. Otras complicaciones reportadas son el hematoma hepático subcapsular o la perforación.
La mayoría de las complicaciones se manifiestan como dolor abdominal transitorio, con o sin pneumoperitoneo, que responden a medidas conservadoras. Los expertos recomiendan, ante la posibilidad de elección, la hepatogastrostomía sobre la coledocoduodenostomía, por su mayor facilidad y su menor posibilidad de complicaciones (33,34).
Las más grandes series reportadas muestran que los procedimientos ecoguiados descritos terminan siendo requeridos en, aproximadamente, el 3,5% de los casos que inicialmente son derivados a CPRE. En una serie de 2566 pacientes, 95 requirieron tratamientos ecoguiados, y solo 3 pacientes fueron enviados a derivación percutánea. El éxito final del tratamiento guiado por USE es del 86% para los procedimientos biliares, y del 75% para los pancreáticos (9). El tiempo promedio reportado de dichos procedimientos fue de 97 minutos (rango de 36-210).
Hacen falta más estudios y series más grandes, con seguimientos a más largo plazo, que, además, definan específicamente el papel de cada uno de tales procedimientos en los pacientes con patologías malignas o benignas (35-37).
CONCLUSIONES
Los drenajes biliopancreáticos ecoguiados son una nueva e importante alternativa para resolver la obstrucción de estos sistemas ductales, cuando la CPRE falla o es irrealizable.
Si bien faltan estudios que aclaren sus indicaciones, así como el desarrollo de más accesorios que aumenten su eficacia y disminuyan la morbimortalidad, en general actualmente se acepta que para pacientes con obstrucción biliar o pancreática y CPRE fallida se puede intentar un rendezvous ecoguiado; si este falla en superar la papila con la guía, pero se logra superar el nivel de estenosis, se puede intentar un tratamiento directo de dicha estenosis a través de la fístula creada por la hepatogastrostomía, o, en su defecto, por la coledocoduodenostomía; si eso no es posible, se puede plantear la derivación definitiva con stents (sobre todo, metálicos autoexpandibles), por medio de hepatogastrostomía, o, en su defecto, de coledocoduodenostomía, pero siempre, ojalá, en pacientes con patología maligna irresecable, en quienes dichos procedimientos muestran las mayores ventajas, comparados con la derivación percutánea definitiva o a la cirugía (2).
REFERENCIAS
1. Giovannini M, Bories E. EUS-Guided Biliary Drainage. Gastroenterol Res Pract. 2012;2012:348719. [ Links ]
2. Savides TJ, Varadarajulu S, Palazzo L, et al. Working Group document: evaluation of EUS-Guided hepaticogastrostomy. Gastrointest Endosc. 2009;69:S3-7. [ Links ]
3. Wiersema MJ, Sandusky D, Carr R, et al. Endosonography-guided cholangiopancreatography. Gastrointest Endosc 1996;43:102-6. [ Links ]
4. Artifon EL, Ferreira F, Sakai P, et al. Endoscopic ultrasound-guided biliary drainage. Korean J Radiol. 2012;13:S74-82. [ Links ]
5. Tarantino I, Barresi L, Triana M, et al. Endoscopic ultrasound guided biliary drainage. World J Gastrointest Endosc. 2012;4:306-11. [ Links ]
6. Attasaranya S, Netinasunton N, Jongboonyanuparp T, et al. The spectrum of endoscopic ultrasound intervention in biliary diseases: A single Centers experience in 31 cases. Gastroenterol Res Pract. 2012;2012:680753. [ Links ]
7. Chavalitdhramrong D, Draganov P. Endoscopic ultrasound-guided biliary drainage. World J Gastroenterol. 2012;18:491-7. [ Links ]
8. Artifon EL, Ferreira F, Pinhata J, et al. EUS-guided biliary drainage: a review article. JOP 2012;13:7-17. [ Links ]
9. Shah JN, Marson F, Weilert F, et al. Single-operator, single sesión EUS-guided anterograde cholangiopancreatography in failed ERCP or inaccesible papilla. Gastrointest Endosc. 2012;75:56-64. [ Links ]
10. Artifon EL, Safatle-Ribeiro AV, Ferreira FC, et al. EUS-guided anterograde transhepatic placement of a self-expandable metal stent in hepático-jejunal anastomosis. JOP. 2011;12:610-3. [ Links ]
11. Park DH, Jang JW, Lee SS, et al. EUS-guided biliary drainage with transluminal stenting after failed ERCP: predictors of adverse events and long-term results. Gastrointest Endosc. 2011;74:1276-84. [ Links ]
12. Kim TH, Hun Kim S, Lee SO, et al. Endoscopic ultrasound-guided biliary drainage with placement of a fully covered metal stent for malignant biliary obstruction. World J Gastroenterol. 2012;18:2526-32. [ Links ]
13. Martins FP, Rossini LG, Ferrari AP, et al. Migration of a covered metallic stent following endoscopic ultrasound-guided hepaticogastrostomy: fatal complication. Endoscopy. 2010;42(Suppl 2):E126-7. [ Links ]
14. Dhir V, Bhandari S, Bapat M, et al. Comparison of EUS-guided rendezvous and precut papillotomy techniques for biliary access. Gastrointest Endosc. 2012;75:354-9. [ Links ]
15. Iwashita T, Lee JG, Shinoura S, et al. Endoscopic ultrasound-guided rendezvous for biliary access after failed cannulation. Endoscopy. 2012;44:60-5. [ Links ]
16. Yamao K, Hara K, Bhatia V, et al. EUS-guided biliary drainage. Gut Liver. 2010;(Suppl 1):S67-75. [ Links ]
17. Iwashita T, Lee J. Endoscopic ultrasonography-guided biliary drainage: rendezvous technique. Gastrointest Endosc Clin N Am. 2012;22:249-58. [ Links ]
18. Yoon WJ, Brugge WR. EUS-guided biliary rendezvous: EUS to the rescue. Gastrointest Endosc. 2012;75:360-1. [ Links ]
19. Itoi T, Sofuni A, Itokawa F, et al. Endoscopic ultrasonography-guided biliary drainage. J Hepatobiliary Pancreat Sci. 2010;17:611-6. [ Links ]
20. Artifon EL, Okawa L, Takada J, et al. EUS-guided choledochoantrostomy: an alternative for biliary drainage in unresectable pancreatic cáncer with duodenal invasión. Gastrointest Endosc. 2011;73:1317-20. [ Links ]
21. Artifon EL et al. Biliary drainage in patients with unresectable malignant obstruction where ERCP fails: endoscopic ultrasonography-guided choledochoduodenostomy versus percutaneous drainage. J Clin Gastroenterol. 2012;46:768-74. [ Links ]
22. Yamao K, Hara K, Mizuno N, et al. Endoscopic ultrasound-guided Choledochoduodenostomy for malignant lower biliary tract obstruction. Gastrointest Endosc Clin N Am. 2012;22:259-69. [ Links ]
23. Eum J, Park do H, Ryu CH, et al. EUS-guided biliary drainage with a fully covered metal stent as a novel route for natural orifice transluminal endoscopic biliary interventions: a pilot study. Gastrointest Endosc. 2010;72:1279-84. [ Links ]
24. Khashab MA, Fujii LL, Baron TH, et al. EUS-guided biliary drainage for patients with malignant biliary obstruction with an indwelling duodenal stent. Gastrointest Endosc. 2012;76:209-13. [ Links ]
25. Ramirez-Luna MA, Téllez-Ávila FI, Giovannini M, et al. Endoscopic ultrasound-guided biliodigestive drainage is a good alternative in patients with unresectable cáncer. Endoscopy. 2011;43:826-30. [ Links ]
26. Perez-Miranda M, de la Serna C, Vila J, et al. Endosonography-guided cholangiopancreatography as a salvage drainage procedure for obstructed biliary and pancreatic ducts. World J Gastrointest Endosc. 2010;2:212-22. [ Links ]
27. Burmester E, Niehaus J, Leineweber T, et al. EUS-cholangio-drainage of the bile duct: report of 4 cases. Gastrointest Endosc. 2003;57:246-51. [ Links ]
28. Kahaleh M, Hernandez AJ, Tokar J, et al. Interventional EUS-guided cholangiography: evaluation of a technique in evolution. Gastrointest Endosc. 2006;64:52-9. [ Links ]
29. Park DH, Song TJ, Eum J, et al. EUS-guided hepaticogastrostomy with a fully covered metal stent as the biliary diversión technique for an occluded biliary metal stent after a failed ERCP. Gastrointest Endosc. 2010;71:413-9. [ Links ]
30. Park DH. Endoscopic ultrasonography-guided hepaticogastrostomy. Gastrointest Endosc Clin N Am. 2012;22:271-80. [ Links ]
31. Sharaiha RZ, Kalloo AN, Khashab MA. EUS-guided hepatoesophagostomy for transesophageal biliary drainage. Gastrointest Endosc. 2012;76:227-8. [ Links ]
32. Giovannini M, Moutardier V, Pesenti C, et al. Endoscopic ultrasound-guided bilioduodenal anastomosis: a new technique for biliary drainage. Endoscopy. 2001;33:898-900. [ Links ]
33. Yamao K, Bhatia V, Mizuno N, et al. EUS-guided choledochoduodenostomy for palliative biliary drainage in patients with malignant biliary obstruction: results of longterm follow-up. Endoscopy. 2008;40:340-2. [ Links ]
34. Bories E, Pesenti C, Caillol F, et al. Transgastric endoscopic ultrasonography-guided biliary drainage: results of a pilot study. Endoscopy. 2007;39:287-91. [ Links ]
35. Lee KH, Lee JK. Interventional endoscopic ultrasonography: present and future. Clin Endosc. 2011;44:6-12. [ Links ]
36. Katanuma A, Maguchi H, Osanai M, et al. Endoscopic ultrasound-guided biliary drainage performed for refractory bile duct stenosis due to chronic pancreatitis: a case report. Dig Endosc. 2012;24(Suppl 1):34-7. [ Links ]
37. Artifon EL, Pinhata Otoch J, Yábar A, et al. Endoscopy ultrasonography-guided biliary drainage in the surgical-endoscopy era. Rev Gastroenterol Peru. 2011;31:365-75. [ Links ]











 text in
text in