Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957
Rev Col Gastroenterol vol.28 no.4 Bogotá oct./dic. 2013
Hepatopatología para gastroenterólogos y hepatólogos. Tercera parte: patología de la enfermedad hepática necroinflamatoria crónica
Rocío del Pilar López Panqueva, MD. (1)
(1) Patóloga. Jefe sección Anatomía Patológica, Hospital Universitario Fundación Santa Fe de Bogotá. Profesora, Facultad de Medicina, Universidad de Los Andes. Bogotá, Colombia. Mail: rocio.lopez@fsfb.org.co rolopez@uniandes.edu.co
Fecha recibido: 30-09-13 Fecha aceptado: 15-10-13
Resumen
En la interpretación de una biopsia hepática, las enfermedades necroinflamatorias hepáticas están entre las patologías halladas más a menudo, y en el estudio histopatológico es habitual enfrentarse a varias preguntas al respecto: ¿Qué es? ¿Qué tan grave es la enfermedad? ¿Qué es lo que el clínico espera? Se buscará en este artículo dar respuesta a tales preguntas.
Palabras clave
Hígado, biopsia, enfermedad necroinflamatoria, Hepatitis C (HVC), Hepatitis B (HVB), Hepatitis autoinmune (HAI).
INTRODUCCIÓN
Como ya se ha visto, las enfermedades necroinflamatorias corresponden a un "patrón", que puede ser agudo o crónico, y en el cual se halla inflamación y evidencia de muerte celular (apoptosis o necrosis), con múltiples etiologías probables, las más comunes de las cuales son las hepatitis virales, la hepatitis autoinmune y las hepatitis inducidas por medicamentos.
Gran parte de la utilidad de la biopsia hepática radica en que se establezca la diferencia entre enfermedad hepática crónica y una hepatitis aguda vs. hepatitis crónica. Este artículo se centrará en la hepatitis crónica, la cual se define, desde el punto de vista morfológico, por la presencia de inflamación portal e injuria hepatocitaria manifestada por hepatitis de interfase o por la actividad inflamatoria lobulillar; su sello característico es la fibrosis, inicialmente observada como expansión fibrosa portal hasta la cirrosis establecida. Existe la tendencia a dar el nombre de hepatitis crónica a cualquier biopsia con inflamación portal; cabe recordar que esta consideración implica un riesgo importante de progresión y genera un manejo y un seguimiento muy diferentes entre sí para los pacientes.
En la práctica de la hepatopatología, cuando se encuentra inflamación portal se debe diferenciar entre las condiciones que característicamente lo presentan, como la hepatitis C, la hepatitis B y la hepatitis autoinmune, pero también deben incluirse las enfermedades colestásicas crónicas, las hepatitis toxicomedicamentosas y algunas enfermedades metabólicas, como la hemocromatosis, la enfermedad de Wilson y la deficiencia de alfa-1-antitripsina, entre otras, pues todas ellas pueden dar un patrón de injuria que se asemeja al de la hepatitis crónica. Por lo tanto, es indispensable la correlación clínico-patológica: de lo contrario, sería permitido para el patólogo establecer un diagnóstico netamente descriptivo de los hallazgos morfológicos observados, como, por ejemplo, "inflamación portal con actividad lobular y de interfase".
En las hepatitis crónicas el diagnóstico clínico ya suele estar determinado por la historia clínica, los antecedentes y los estudios serológicos virales o de autoanticuerpos, previos a la decisión de hacer una biopsia. Por ende, uno de los principales objetivos que llevan a un clínico a realizar la biopsia es aclarar con la mayor certeza posible el grado de actividad necroinflamatoria, así como estadificarla por la presencia o no de fibrosis.
Existen muchos sistemas para la graduación y la estadificación de una biopsia hepática; algunos son más complejos que otros, y a través de los tiempos han tenido varias modificaciones.
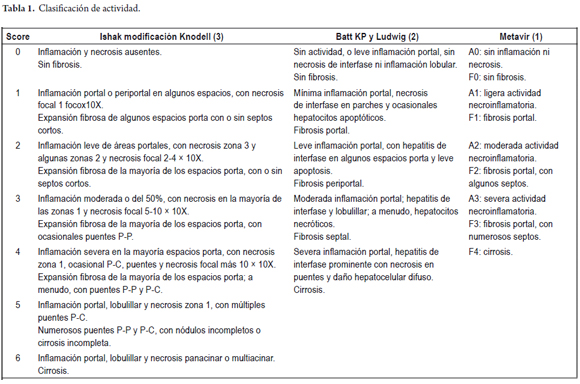
En la tabla 1 se hace una comparación de tres de los principales sistemas utilizados tanto en la graduación de la actividad como en la estadificación de las hepatitis crónicas: el original, de Knodell, modificado posteriormente por el de Ishak; el de Batts y Ludwig, que en 1995 popularizaron su sistema en base a pictogramas, y el sistema europeo de Metavir (1-3).
Algunos sistemas no incluyen el grado ni el estadio 0, que en algunas circunstancias pueden ser observados: por ejemplo, en hepatitis autoinmunes postratamiento, en algunas formas de hepatitis B (portadores inactivos) o en el 5% de los casos de hepatitis C donde solo se observa inflamación portal sin actividad necroinflamatoria ni de interfase.
En los mencionados sistemas la inflamación portal, aún en ausencia de actividad de interfase, se tiene en cuenta para la graduación, y es uno de los motivos por los que en algunos sistemas se tiende a aumentar cuantitativa y cualitativamente el grado de actividad inflamatoria comparado con otros.
Se recomienda utilizar sistemas numéricos solo cuando se hagan estudios de investigación y cuando, a su vez, estos sean analizados por patólogos expertos. En la práctica diaria es más útil, y, definitivamente, práctico, utilizar los métodos semicuantitativos para la graduación de la actividad inflamatoria nominándola como mínima, leve, moderada o severa.
La biopsia sigue siendo el patrón de oro al enfrentar una hepatitis crónica; sin embargo, es importante tener en cuenta que los datos clínicos o patológicos interpretados aisladamente pueden llevar a un diagnóstico errado entre el 15% y el 50% de los casos; en el 10%-15% una biopsia puede aportar datos adicionales fundamentales en el diagnóstico, y hasta en el 18%-20% de los casos puede cambiar un manejo (4).
Pese a lo anterior, ampliamente reportado en la literatura, no se puede desconocer que nuevas técnicas, tanto serológicas como de estudios imaginológicos, han empezado a reemplazar el papel de la biopsia hepática en algunas circunstancias, y, muy probablemente, las indicaciones de esta quedarán aún más limitadas en el futuro cercano (5).
Ante tal panorama, la principal indicación de la biopsia es cuando el clínico piensa que su resultado va a modificar el diagnóstico, el tratamiento o el pronóstico de un paciente. Sea cual sea el sistema que se utilice, este debe ser conocido por el clínico, quien, finalmente, va a interpretar el resultado de un estudio patológico; por tanto, la interacción patólogo-gastroenterólogo-hepatólogo es vital para hablar el mismo idioma.
¿CUÁL ES LA BIOPSIA IDEAL PARA PODER REALIZAR UNA ADECUADA INTERPRETACIÓN PATOLÓGICA?
Se sabe que la biopsia hepática es un procedimiento invasivo, costoso y no exento de complicaciones (en pocos casos, mayores). El 30% de los pacientes así tratados experimentan dolor, en el 0,3% de los casos pueden presentarse complicaciones severas, como sangrado, y en menos del 0,01%, la muerte. Igualmente, pueden existir errores por poca representatividad de la lesión, o del parénquima; en especial, por la heterogeneidad de la gran mayoría de las patologías hepáticas y la variación interobservador e intraobservador (6-8).
En el diagnóstico de las enfermedades necroinflamatorias no se recomiendan las biopsias percutáneas por punción con aguja fina (BACAF o ACF); tampoco, biopsias abiertas superficiales o subcapsulares. Las biopsias ideales para el patólogo, y, por eso mismo, para el paciente, son las biopsias trucut, con agujas calibres 14-19, biopsias transyugulares, o biopsias en cuña laparoscópicas o abiertas; preferiblemente, deben ser enviadas a estudio histopatológico 2 biopsias con representación tanto del hígado derecho como del izquierdo, con fragmentos de 2 cm de longitud y entre 1-2 mm de diámetro, que contengan al menos 11 espacios porta. Una biopsia con tales características es considerada óptima, pues corresponde, aproximadamente, a valorar entre 1/50 000-1/63 000 de parénquima hepático (9,10).
Este artículo se centrará en los cambios morfológicos observados en las principales formas de hepatitis crónica.
HEPATITIS VIRAL C (HVC)
Es bien sabido que luego de la infección aguda hasta el 85% de los casos evoluciona a una hepatitis crónica; de estos, el 27% lo hace, además, a cirrosis, y el 25% desarrollan hepatocarcinoma; esta última, por su parte, es en la actualidad la principal causa de muerte por enfermedad hepática y una de las principales indicaciones de trasplante hepático.
Desde el punto de vista netamente morfológico, las fases iniciales de la enfermedad crónica no están bien documentadas en la literatura, por su presentación subclínica; así, cuando hay manifestaciones clínicas, usualmente con elevación de las aminotransferasas, la HVC ya se encuentra bien establecida; sin embargo, no existe una buena correlación entre los niveles de AST/ALT y los hallazgos histopatológicos (11).
Yano demostró que el 30% de los pacientes que en una biopsia inicial no tenían fibrosis la desarrollaban 13 años después, al 43% de quienes la tenían de leve a moderada les tomaba 17 años desarrollarla, y al 100% de quienes tenían fibrosis con puentes o nódulos regenerativos incompletos les ocurría lo mismo a lo largo de los siguientes 10 años (12). Esta es una de las razones por las cuales ante una evidencia serológica de HVC con sospecha clínica de enfermedad crónica la biopsia hepática podría ser de utilidad, pues tiene un valor tanto pronóstico como predictivo, al proporcionar parámetros para evaluar la posibilidad de iniciar o suspender una terapia (13,14).
Hay cambios morfológicos característicos, pero no patognomónicos, de la HVC, y que ayudan en su diferenciación de otras formas de enfermedad necroinflamatoria hepática crónica, pues comparten el patrón necroinflamatorio antes descrito.
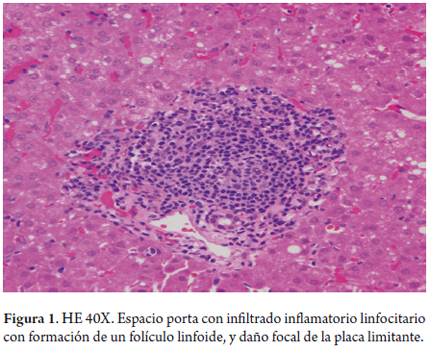
Se enumerarán a continuación los observados más a menudo. Hay infiltrado inflamatorio portal, predominantemente linfocitario, con formación de agregados linfoides, así como folículos linfoides con centros germinales bien formados (figura 1), hasta en el 50% de los casos (15).
En 1969 Poulsen y Christofferson, aún sin saber que se trataba de la HVC, describieron el daño ductal no destructivo, o colangitis linfocítica, donde observaron la permeación intraepitelial de linfocitos, que en ocasiones oscurece o hace difícil identificar el ducto; tal fenómeno es conocido como lesión de Poulsen (16) y la mayoría de los estudios la describen hasta en la tercera parte de los casos; algunos grupos, como el de Bach et al., la han reportado en el 91% de las biopsias de HVC. Dicho cambio hace necesario establecer un diagnóstico diferencial con enfermedades colestásicas crónicas, como la cirrosis biliar primaria, o con enfermedades colestásicas ductopénicas (15).
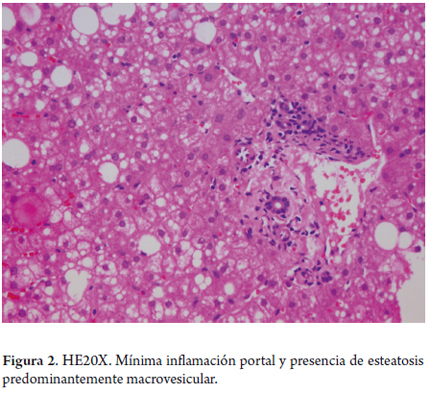
La esteatosis usualmente macrovesicular observada, sobre todo, en HVC genotipo 3, está directamente relacionada con el virus y se la ha visto en el 70% de los casos; no tiene distribución zonal específica y suele ser de ligera intensidad; en los otros genotipos su relación no es clara, pero también es menos común (figura 2). Es importante determinar su coexistencia con esteatohepatitis, la cual puede verse en cerca del 10% de los casos (17).
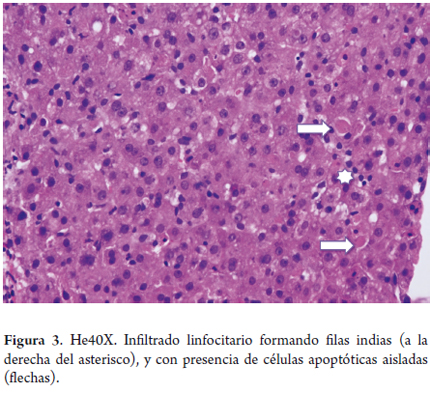
La hialina de Mallory, o cuerpos de Mallory, generalmente se hallan presentes en la enfermedad más avanzada, lo cual refleja cambios colestásicos asociados, de localización periportal y reportados en el 18% de los casos. Puede, además, existir hepatitis lobulillar, con aumento del infiltrado linfocitario sinusoidal, e hiperplasia de células de Kupffer; los linfocitos sinusoidales se disponen característicamente en hileras formando verdaderas filas indias. Tal hallazgo es observado en más del 80% de los casos de HVC crónica; según la severidad de la actividad necroinflamatoria, es posible encontrar hepatocitos apoptóticos aislados (figura 3) o necrosis confluente. La fibrosis es progresiva e inicia en las zonas portales (15,18).
El diagnóstico diferencial, desde el punto de vista morfológico, incluye otras formas de hepatitis virales; principalmente, hepatitis B, hepatitis autoinmune, enfermedad de Wilson, hepatitis inducidas por drogas, enfermedades colestásicas crónicas y deficiencia de alfa 1 antitripsina, entre otras (19).
HEPATITIS VIRAL B (HVB)
Solo el 10% de los pacientes con infección aguda por HVB progresan a la cronicidad. La prevalencia ha disminuido por el uso de vacunas recombinantes, aun cuando en Asia y África sigue siendo alta.
En el estudio histopatológico se encuentra inflamación portal y periportal, que si bien es común a cualquier tipo de hepatitis viral, varía en su magnitud, según factores tanto del virus como del huésped. Es también predominantemente linfocitaria, con algunos plasmocitos y macrófagos, importante actividad de interfase y asociada a daño hepatocelular, y se observan hepatocitos apoptóticos; especialmente, en la zona periportal. La fibrosis, por su parte, inicia en la zona portal y no constituye un prerrequisito para desarrollar hepatocarcinoma.
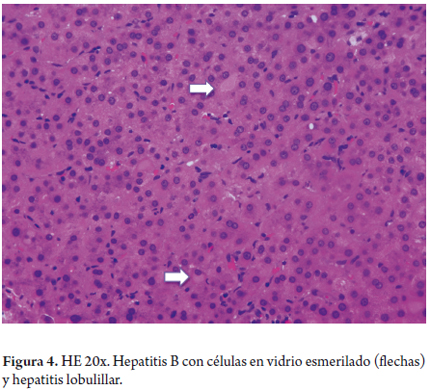
El hallazgo histológico más característico, observado en el 50%-75% de los casos, es la presencia de hepatocitos en vidrio esmerilado, o ground glass, y que reflejan la presencia de antígeno de superficie (HBsAg), el cual se mezcla con el retículo endoplasmático del citoplasma de los hepatocitos y da una imagen finamente granular, un poco clara, con halo periférico, que en ocasiones desplaza el núcleo a la periferia (figura 4). Tal como ya se describió, estudios de histoquímica (Victoria blue, Orceina, Aldehído fuschina, Shikata) pueden ser de utilidad para identificar las células en vidrio esmerilado.
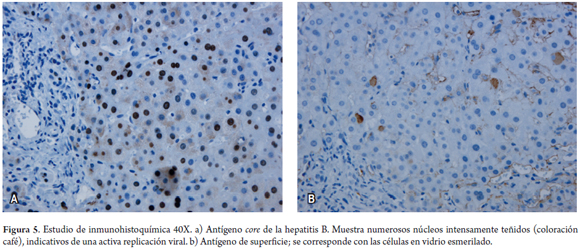
Los núcleos en arena, o sanded, son inclusiones rosadas, pálidas y granulares que contienen antígeno core (HBcAg), lo cual, a su vez, indica replicación activa del virus. Cuando dicho hallazgo es masivo puede sugerir un estado de inmunosupresión. También se utilizan pruebas de inmunohistoquímica, como el antígeno de superficie (HBsAg), a la altura tanto de la membrana como citoplasmática, y el HBcAg, de localización nuclear (figura 5) (20).
Algunos cambios histopatológicos ayudan en la categorización de las diferentes fases de la infección por HVB. En la fase de tolerancia inmune, observada en pacientes con infección perinatal, no suele hallarse daño hepático, o este es mínimo. Durante la fase de aclaramiento inmune hay evidencia de infección crónica con daño hepático progresivo; en esta fase se observa inflamación portal de variable intensidad, actividad de interfase, hepatitis lobulillar y presencia de células en vidrio esmerilado. Cuando hay portadores inactivos puede existir inflamación portal y lobulillar de ligera intensidad, con presencia de hepatocitos en vidrio esmerilado, a veces prominentes, sin mayor daño hepatocitario. En fases de reactivación de la infección nuevamente se observa tanto actividad necroinflamatoria portal y lobulillar como hepatocitos en vidrio esmerilado (21-23).
El diagnóstico diferencial morfológico incluye hepatitis por virus A, C, CMV, Epstein Barr, adenovirus y fiebre amarilla; también se incluyen hepatitis autoinmune y hepatitis por drogas. La correlación con la historia clínica y las serologías es indispensable (19).
HEPATITIS AUTOINMUNE (HAI)
Clínicamente está muy bien caracterizada, y la biopsia hepática juega un papel de importancia tanto en el diagnóstico de las formas agudas y crónicas como en el manejo.
La HAI es una enfermedad rápidamente progresiva si no es tratada, y aun cuando los hallazgos morfológicos no son patognomónicos pueden ayudar cuando el diagnóstico clínico no se halla del todo establecido. Tres tipos de HAI se han descrito con base en los títulos de autoanticuerpos (ANA, ASMA o anti-LKM); sin embargo, desde el punto de vista morfológico, todos ellos son similares (24,25).
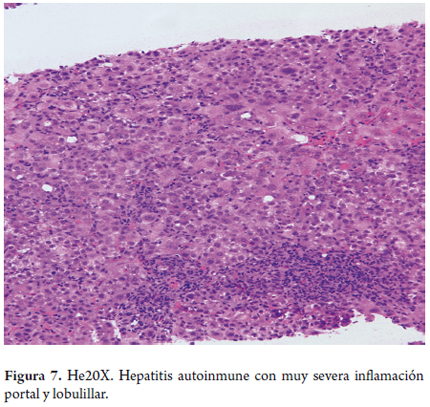
Típicamente, el paciente de HAI muestra una enfermedad necroinflamatoria, con infiltrados portales y periportales irregularmente distribuidos, necrosis piecemeal o hepatitis de interfase usualmente de considerable magnitud. En la mayoría de los casos hay un incremento importante del número de células plasmáticas, o plasmocitos, acompañados de linfocitos y algunos eosinófilos.
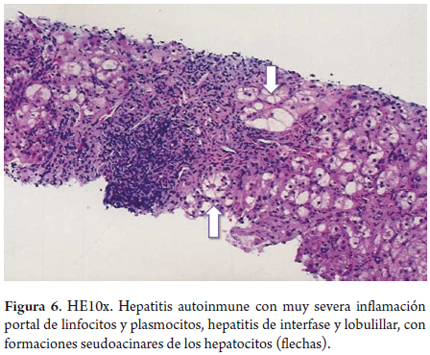
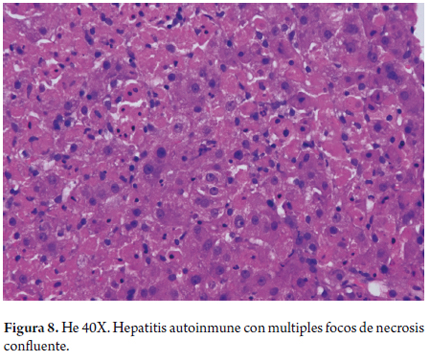
El compromiso lobulillar es marcado; típicamente, afecta la zona 1, con formación seudoacinar de los hepatocitos (figuras 6 y 7). En ocasiones se puede observar transformación gigantocelular hepatocitaria (15). Es raro el compromiso necroinflamatorio de la zona 3, pero se lo ha descrito con el término "necrosis centrolobulillar piecemeal"; sobre todo, en formas agudas (26). La necrosis hepatocitaria con presencia de cuerpos acidofílicos puede verse con células aisladas o en forma de necrosis confluente (figura 8), la cual se traducirá inicialmente en colapso de la trama reticular y posterior fibrosis en puentes; su inicio siempre es en la zona 1 (15,27).
No hay cambios a la altura de los ductos biliares, y si dichos cambios aparecen se debe hacer diagnóstico diferencial con desórdenes colestásicos crónicos, como la cirrosis biliar primaria, donde se encuentran infiltrados portales con linfocitos y plasmocitos, pero, además, es característica la lesión ductal, que en ocasiones forma granulomas con pérdida de ductos, y acompañado de evidencia de enfermedad colestásica crónica en la biopsia, y en la clínica, de elevación de la fosfatasa alcalina y anticuerpos antimitocondria (AMA) positivos.
También se deben descartar una colangitis esclerosante primaria, síndromes de sobreposición o HVC; si hay formación de folículos linfoides con predominio de infiltrado linfocitario sobre el plasmocitario, se debe considerar HVC en el diagnóstico diferencial, y cuando existen numerosos eosinófilos es importante diferenciarla de cuadros de hepatitis toxicomedicamentosa que semejan HAI (19).
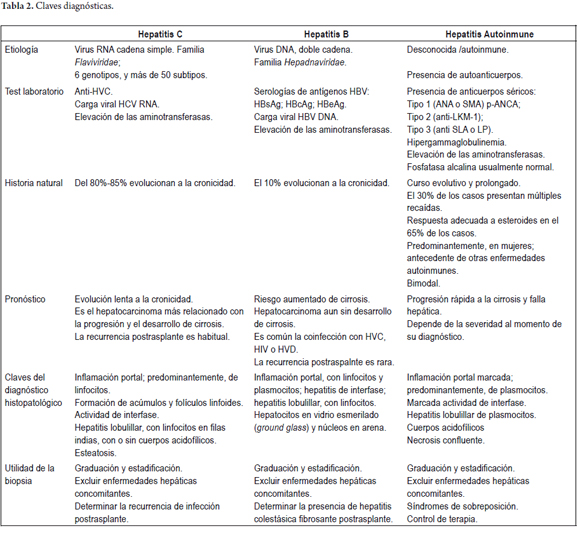
En la tabla 2 se hace un resumen de las características clínicas e histopatológicas más importantes de las tres entidades más representativas de este patrón de daño hepático.
IMITADORES DE HEPATITIS CRÓNICA DE TIPO NECROINFLAMATORIO
Muchas son las entidades que semejan morfológicamente un compromiso hepático crónico por enfermedad necroinflamatoria. A continuación se enumerarán algunas, adicionales a las ya descritas.
En la esteatohepatitis puede existir inflamación portal linfocitaria importante; así pues, encontrar balonización y fibrosis subsinusoidal, con un compromiso predominantemente de la zona 3, ayudará en el diagnóstico diferencial; especialmente, en casos de HVC.
La infiltración por procesos linfoproliferativos, como el linfoma, puede mostrar infiltrados portales muy prominentes; sin embargo, la apariencia monótona del infiltrado, o bien la atipia celular y las pruebas de inmunofenotipo, ayudará en el diagnóstico.
Las hepatitis agudas también pueden presentar infiltrados portales prominentes, pero la marcada balonización con hepatitis lobulillar y la pérdida de la trama reticular, junto con la historia clínica, son clave en el diagnóstico.
Los síndromes obstructivos biliares presentan infiltrados portales, pero en ellos suelen predominar las células de tipo polimorfonuclear neutrófilo, con reacción proliferativa colangiolar y colangitis aguda, y asociadas a cambios colestásicos pericentrales; estos síndromes orientan el diagnóstico, con el apoyo de la historia clínica y de las imágenes diagnósticas.
En la enfermedad celiaca se pueden hallar también infiltrados inflamatorios portales; predominantemente, de linfocitos. Los antecedentes clínicos, las serologías negativas y la presencia de anti-tTG son claves diagnósticas.
En la enfermedad de Wilson hay, así mismo, inflamación portal y esteatosis, usualmente acompañadas de balonización y de núcleos glicogenados; encontrar depósitos de cobre, serologías virales negativas, evidencia clínica de colestasis y la disminución de la ceruloplasmina ayudarán en la interpretación morfológica de los hallazgos.
La deficiencia de Alfa1-antitripsina mostrará también inflamación portal, e incluso, actividad de interfase. El hallazgo de las inclusiones intracitoplasmáticas (PAS) diastasa positivas, a escala periportal o periseptal cuando ya existe fibrosis, será la clave diagnóstica.
En la hemocromatosis hay, igualmente, infiltrados portales linfocitarios. Los depósitos de hierro intrahepatocitarios en los endotelios, en el tejido conectivo portal o en el epitelio ductal, con serologías y autoanticuerpos negativos, darán la pauta en el diagnóstico diferencial.
Las hepatitis reactivas a menudo muestran infiltrados portales considerados no específicos; en tal caso no hay actividad de interfase ni necrosis, es mínima la actividad lobulillar inflamatoria y, definitivamente, no hay fibrosis; encontrar macrófagos portales y sinusoidales llenos de material PAS diastasa positivos puede sugerir un proceso reactivo de reciente data; por ejemplo, secundario a colelitiasis, a colecistitis o a infección intestinal.
REFERENCIAS
1. Goodman ZD. Grading and staging systems for inflammation and fibrosis in chronic liver diseases. J Hepatol. 2007;47:598-607. [ Links ]
2. Batts KP, Ludwig J. Chronic hepatitis. An update on terminology and reporting. Am J Surg Pathol. 1995;19:1409-17. [ Links ]
3. Ishak K, Baptista A, Bianchi L, et al. Histological grading and staging of chronic hepatitis. J Hepatol. 1995;22:696-9. [ Links ]
4. Bravo AA, Sheth SG, Chopra S. Liver biopsy. N Engl J Med. 2001;344:495-500. [ Links ]
5. Castera L. Noninvasive methods to assess liver disease in patients with hepatitis B or C. Gastroenterology. 2012;142:1293-302. [ Links ]
6. Regev A, Berho M, Jeffers LJ, et al. Sampling error and intraobserver variation in liver biopsy in patients with chronic HCV infection. Am J Gastroenterol. 2002;97:2614-8. [ Links ]
7. Bedossa P, Dargère D, Paradis V. Sampling variability of liver fibrosis in chronic hepatitis C. Hepatology. 2003;38:1449-57. [ Links ]
8. Ratziu V, Charlotte F, Heurtier A, et al. For the LIDO Study Group. Sampling variability of liver biopsy in nonalcoholic fatty liver disease. Gastroenterology. 2005;128:1898-906. [ Links ]
9. Colloredo G, Guido M, Sonzogni A, et al. Impact of liver biopsy size on histological evaluation of chronic viral hepatitis: the smaller the sample, the milder the disease. J Hepatol. 2003;39:239-44. [ Links ]
10. Rockey Don, Caldwell S, Goodman Z, et al. Liver biopsy. Hepatology. 2009;19:1017-44. [ Links ]
11. Gil Parada F, López Panqueva R. Guías de diagnóstico y tratamiento de hepatitis viral C. Diagnóstico. Rev Colomb Gastroenterol. 2012;(Suplemento 27):15-20. [ Links ]
12. Yano M, Kumada H, Kage M, et al. The long-term pathological evolution of chronic hepatitis C. Hepathology. 1996;23:1334-40. [ Links ]
13. Gebo KA, Herlong HF, Torbenson MS, et al. Role of liver biopsy in management of chronic hepatitis C: A systematic review. Hepatology. 2002;36:S161-72. [ Links ]
14. Ghany MG, Strader DB, Thomas DL, et al. Diagnosis, management and treatment of hepatitis C: An update. Hepatology. 2009;49:1335-52. [ Links ]
15. Bach N, Thung SN, Schaffner F. The histological features of chronic hepatitis C and autoimmune chronic hepatitis: A comparative analysis. Hepatology. 1992;15:572-7. [ Links ]
16. Poulsen H Christofferson P. Abnormal bile duct epitheliumin liver biopsies with histological signs of viral hepatitis. Acta Pathol Microbiol Scand. 1969;76:383-90. [ Links ]
17. Asselah T, Rubbia-Brandt L, Marcellin P, et al. Steatosis in chronic hepatitis C: Why does it really matter? Gut. 2006;55:123-30. [ Links ]
18. Lefkowich JH, Schiff ERE, Davis GL, et al. Pathological diagnosis of chronic hepatitis C: A multicenter comparative study with chronic hepatitis B. Gastroenterology. 1993;104:595-603. [ Links ]
19. Lamps L, Kom G, Wang H. Diagnostic pathology: hepatobiliary and pancreatic. 1st ed. Salt Lake, Utah: Amirsys Publishing; 2011. [ Links ]
20. López Panqueva RP. Hepatopatología para gastroenterólogos y hepatólogos. Rev Colomb Gastroenterol. 2013;28:166-7. [ Links ]
21. Dienstang JL. Hepatitis B infection. N Engl J Med. 2008;259:1486-500. [ Links ]
22. Mani H, Kleiner DE. Liver biopsy findingsin chronic hepatitis B. Hepatology 2009;49(5 Suppl):61-71. [ Links ]
23. Elgouhari HM, Abu-Rajab Tamimi TI, Carey WD. Hepatitis B virus infection: Understanding its epidemiology, course and diagnosis. Cleve Clin J Med. 2008;75:881-9. [ Links ]
24. Álvarez F, Berg PA, Bianchi FB, et al. International Autoinmmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatology. 1999;31:929-38. [ Links ]
25. Hennes EM, Zeniya M, Czaja AJ et al. Simplified criteria for diagnosis of autoimmune hepatitis. Hepatology. 2008;48:169-76. [ Links ]
26. Misdraji J, Thiim M, Graeme-Cook FM. Autoimmune hepatitis with centrilobular necrosis. Am J Surg Pathol. 2004;28:471-8. [ Links ]
27. Burgart LJ, Batts KP, Ludwig J, et al. Recent-onset autoimmune hepatitis. Biopsy finding clinical correlations. Am J Surg Pathol. 1995;19:699-708. [ Links ]











 texto en
texto en