Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957
Rev Col Gastroenterol vol.28 supl.1 Bogotá set. 2013
Diagnóstico imagenológico
Imaging diagnosis
Octavio Germán Muñoz Maya, MD. (1), Juan Guillermo Trujillo, MD. (2)
(1) Médico internista hepátologo. Grupo de Trasplante Hepático del Hospital Pablo Tobón Uribe, Universidad de Antioquia, Medellín, Colombia. Correo electrónico: octavio.g.munoz@gmail.com.
(2) Radiólogo intervencionista, Clínica Reina Sofía, Bogotá, Colombia.
Fecha recibido: 29-09-13 Fecha aceptado: 16-10-13
Resumen
El diagnóstico del CHC por imágenes ha cobrado cada vez más relevancia, debido no solo a la escasez de síntomas y signos en los pacientes con este tumor, sino al conocimiento cada vez mayor del comportamiento biológico tumoral en estos medios diagnósticos. Esto ha llevado a las diferentes técnicas por imágenes a convertirse en el pilar fundamental del algoritmo diagnóstico en CHC.
Palabras clave
Fase arterial, fase venosa, fase tardía, medios de contraste, informe radiológico.
Abstract
Imaging diagnosis of HCC has become increasingly important, not only because of the scarcity of symptoms and signs in patients with this tumor, but also because of the growth of knowledge about the biological behavior of these tumors. This has led to various imaging techniques becoming mainstays of the diagnostic algorithm for HCC.
Keywords
Arterial phase, Venous phase, Late phase, Contrast media, Radiological reports.
IMPORTANCIA DE LAS IMÁGENES EN EL DIAGNÓSTICO DE HEPATOCARCINOMA
La incidencia de carcinoma hepatocelular (CHC) sigue aumentando y representa la sexta neoplasia más frecuente y la tercera causa de muerte por cáncer en el mundo. En más del 90% de los casos, el CHC se presenta en hígados cirróticos, y en este grupo de pacientes es la principal causa de muerte, independiente de la etiología del daño hepático crónico (1).
Establecer el diagnóstico de CHC es un proceso único, dado que, a diferencia de otras neoplasias, la biopsia no es estrictamente necesaria y en la mayoría de los casos la especificidad de los criterios de imagen son suficientes (2). El curso clínico del CHC generalmente es asintomático y enmascarado por los síntomas de la cirrosis hepática. Por este motivo, muchas veces el diagnóstico es tardío, y esto ensombrece el pronóstico. La tasa de supervivencia de los pacientes con hepatocarcinoma no resecable es del 29% al año y del 8% a tres años (3).
A pesar del progreso en el manejo de los pacientes con CHC, el pronóstico depende principalmente del diagnóstico temprano y la detección de lesiones pequeñas. En esto radica la importancia de las imágenes, tanto en el tamizaje de las poblaciones de riesgo, como en la confirmación del diagnóstico con el uso de pruebas dinámicas. Adicionalmente, las imágenes permiten informar el tamaño y el número de lesiones, la localización anatómica y la relación con las estructuras vasculares, con lo cual se define la mejor terapia posible (4).
En este artículo se revisan los desarrollos recientes en las técnicas de imagen para detectar y caracterizar el CHC.
FISIOPATOLOGÍA DE LA EVOLUCIÓN DE LOS NÓDULOS HEPÁTICOS EN EL PACIENTE CIRRÓTICO Y SU REPRESENTACIÓN EN LAS IMÁGENES
Los hepatocitos malignos resultan de mutaciones acumulativas en las células maduras o en las células madre. Inicialmente, estas células forman focos de hepatocitos displásicos, los cuales evolucionan a la displasia de alto grado y tienen un riesgo del 30% a cinco años de convertirse en focos de CHC. Generalmente, los nódulos displásicos y el hepatocarcinoma temprano son pequeños, menores de 2 cm, y todavía no muestran un aumento marcado en la vasculatura arterial. Posteriormente, sigue una fase de neoangiogénesis, en la que se aumenta la circulación derivada de la arteria hepática, secundario a factores angiogénicos como el factor de crecimiento del endotelio vascular (VEGF), el tumor crece y pierde progresivamente el grado de diferenciación (5,6).
El diagnóstico por imágenes del CHC se basa en los cambios secuenciales del flujo sanguíneo intranodular durante la hepatocarcinogénesis. Los nódulos regenerativos tienen un flujo sanguíneo igual al resto del parénquima hepático, los nódulos displásicos tienen un flujo sanguíneo variable y el hepatocarcinoma está perfundido por un flujo arterial anormal predominante (7).
En las imágenes dinámicas, esto se traduce en la captación del contraste por parte del tumor en la fase arterial y posteriormente se evidencia el patrón de lavado de la lesión en la fase venosa y las fases tardías cuando hay mayor captación del medio por el resto del parénquima irrigado por sangre venosa portal y la lesión ya ha perdido el realce del contraste adquirido en la fase arterial.
En un 10 a 20% de los casos de CHC, las lesiones son hipovasculares y no tienen el comportamiento anteriormente descrito en las imágenes contrastadas; estas lesiones generalmente son pequeñas, el tumor se caracteriza por la falta de arterialización y su diagnóstico es histológico (8).
COMPORTAMIENTO DEL CHC EN AS IMÁGENES DISPONIBLES: ECOGRAFÍA, TOMOGRAFÍA AXIAL COMPUTARIZADA (TAC) Y RESONANCIA NUCLEAR MAGNÉTICA (RNM)
El CHC puede presentarse como una masa única, como nódulos múltiples o con un patrón difuso infiltrativo. El ultrasonido es el método inicial de evaluación en la enfermedad hepática; sin embargo, este método es operador dependiente y, en términos generales, el comportamiento de las lesiones es muy variable. Los nódulos pequeños son hipoecoicos y los de mayor tamaño, hiperecoicos, por la presencia de hemorragia, fibrosis o infiltración grasa. Las calcificaciones son muy inusuales y la mayor vascularización se detecta con el uso de medios de contraste específicos (9), los cuales no están disponibles en Colombia, por su elevado costo. Una revisión sistemática que evaluó el desempeño de la ecografía demostró una sensibilidad del 60% y una especificidad del 97% (10).
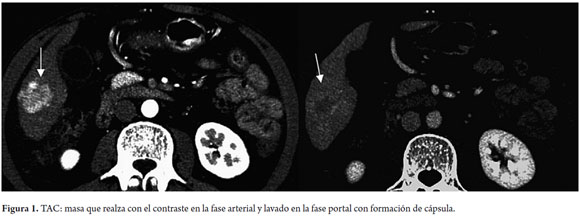
La TAC demuestra una lesión hipervascular en la fase arterial, con un lavado leve en la fase venosa portal y más evidente en la fase tardía (figura 1).
También, se hacen evidentes otras características, como el realce periférico que sugiere la presencia de una cápsula fibrosa y arquitectura interna en mosaico; además, permite evaluar las estructuras vasculares y descartar trombosis portal. La sensibilidad se estima en el 68% y la especificidad, en el 93%. El PET-TC solo tiene una sensibilidad del 50% y su uso se ha limitado al control postratamiento (11).
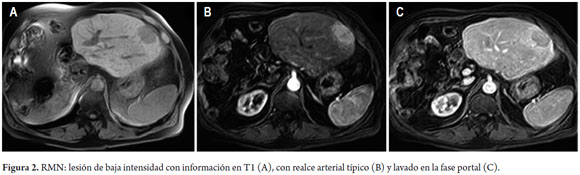
La resonancia magnética tiene mejor desempeño diagnóstico, especialmente para lesiones menores de 2 cm; generalmente, los tumores pequeños son isointensos con información en T1 y las lesiones más grandes son de alta intensidad por el contenido de lípidos, glicógeno o cobre. En información en T2 las lesiones se ven de alta intensidad y las secuencias posgadolinio muestran el realce en la fase arterial y el lavado en las fases tardías; estas características tienen una sensibilidad del 89% y una especificidad del 96% (4) (figura 2).
Existen tres grupos de medios de contraste en resonancia magnética en el mercado: 1. los contrastes extracelulares de bajo peso molecular, como el gadopentate de dimeglumine; 2. las partículas supermagnéticas de óxido de hierro, y 3. el contraste hepatobiliar, como la diglumina de gadobenate o ácido gadoexético (12). Las partículas de óxido de hierro son captadas por las células de Kupffer, lo cual produce una disminución de señal en las secuencias con información en T1 y T2. La mayoría de los tumores no tienen estas células y por esto se presenta una disminución en la intensidad de señal del parénquima hepático y un aumento en el brillo de la lesión tumoral (13). Los medios hepatobiliares son captados por los hepatocitos y luego eliminados por el sistema biliar a los 20 minutos. Se produce un aumento en la intensidad de señal del parénquima hepático normal con un contraste hígado-lesión, teniendo en cuenta que los tumores no contienen hepatocitos. Estos medios han demostrado ser los más adecuados, en especial el ácido gadoacético, que tiene el mayor índice de captación por los hepatocitos (14).
Es importante anotar que en el hígado cirrótico existen nódulos regenerativos que deben plantearse como diagnóstico diferencial. Estos nódulos son micronodulares, macronodulares y mixtos. La suplencia vascular de estos nódulos está dada principalmente por la vena porta y no por la arteria hepática, lo que lleva a un realce tardío.
ALGORITMO DE DIAGNÓSTICO Y SEGUIMIENTO
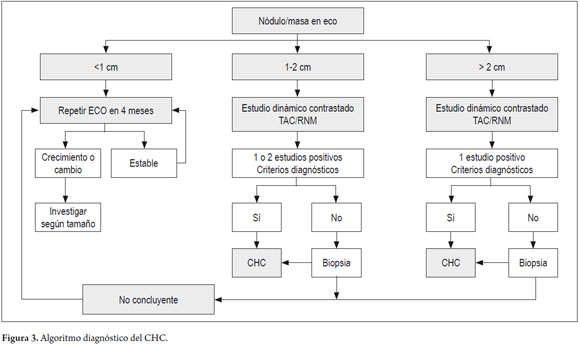
Una característica común de todas las guías de las sociedades científicas es que la interpretación de las imágenes para el diagnóstico de CHC se debe realizar en el contexto del riesgo del paciente; así, la aplicación del siguiente algoritmo es posible únicamente en los pacientes con cirrosis hepática o infección crónica por el virus de la hepatitis B.
Para lesiones menores de 1 cm no se requieren estudios adicionales inmediatos y el plan es hacer seguimiento cada tres meses con el mismo método con que se encontró el nódulo inicial. En las lesiones mayores de 1 cm, con características radiológicas típicas de CHC en un estudio dinámico, ya sea TAC o RNM contrastadas, el diagnóstico está confirmado. Cuando una lesión no tiene características típicas en un estudio dinámico, se puede optar por dos alternativas: se puede realizar biopsia de la lesión o aplicar un segundo estudio dinámico diferente al inicial (15).
Las lesiones que no son típicas y las pequeñas entre 1-2 cm se convierten en un reto diagnóstico, y en estos casos se prefiere tener dos estudios dinámicos antes de decidir la realización de la biopsia hepática (16) (figura 3).
INFORME DE LAS IMÁGENES
El informe radiológico es un elemento de comunicación entre el médico solicitante y el radiólogo, sin olvidar que es un documento médico-legal. Por esto, el informe debe incluir los siguientes aspectos:
1. Datos demográficos y clínicos del paciente.
2. Descripción detallada del tipo de examen y su técnica.
3. Descripción de los hallazgos:
- Localización de la lesión en los segmentos.
- Diámetro de las lesiones en dos ejes.
- Ecogenicidad, atenuación o señal de intensidad de la lesión durante las diferentes fases del estudio.
- Presencia de cápsula o pseudocápsula.
- Trombosis vascular benigna o maligna.
- Compromiso de la vía biliar.
- Comportamiento dinámico de las lesiones en las secuencias pre- y poscontraste.
- Comparación con estudios previos, si es posible.
4. La conclusión debe ser corta y el radiólogo debe reflejar la interpretación que él les da a los hallazgos positivos y negativos del estudio, y si es posible, formular el diagnóstico (17).
IMÁGENES EN EL SEGUIMIENTO DE LAS TERAPIAS: RECIST
Los criterios de respuesta a la evaluación de tumores sólidos (RECIST, por sus siglas del inglés) es un sistema que define si el paciente con cáncer mejoró, permanece estable o está en progresión de la enfermedad después del tratamiento (18). Los criterios usados actualmente son los del RECIST 1.1, reformado en el 2009 (19). La respuesta completa hace referencia a la desaparición del realce arterial en las lesiones, la respuesta parcial representa una disminución de al menos un 30% en la suma de las lesiones en el estado basal, la progresión de la enfermedad implica un aumento del 20% en el diámetro de las lesiones iniciales y la enfermedad estable es aquella en que los cambios no cumplen los criterios anteriores (17).
Actualmente, existe controversia por la evaluación de la mejoría de los pacientes basados en lesiones medibles, teniendo en cuenta que muchas lesiones no tienen un comportamiento real con el tratamiento, ya sea por la presencia de edema o de tejido necrótico. Se están valorando estudios de angiogénesis u otros métodos como el PET-TC que pueden demostrar mejor la actividad metabólica de la lesión.
HEPATOCARCINOMA EN HÍGADO CIRRÓTICO
Las características del CHC sobre hígado no cirrótico son diferentes. El tumor se presenta más avanzado al momento del diagnóstico, dado que estos pacientes no están en programas de seguimiento y, por lo general, el diagnóstico se realiza en el estudio de dolor abdominal o alteración bioquímica hepática derivadas del crecimiento tumoral. Sin embargo, el pronóstico es mejor y los pacientes pueden ser sometidos a tratamientos quirúrgicos más agresivos por tener mejor reserva hepática. Las lesiones, en la mayoría de los casos, corresponden a tumores únicos de gran tamaño y ocasionalmente pueden tener áreas necróticas; el diagnóstico en este tipo de casos exige la confirmación histológica, y los diagnósticos diferenciales, desde el punto de vista radiológico, son amplios (20).
Un caso especial corresponde al hepatocarcinoma de variedad fibrolamelar, un tipo de tumor que se presenta en pacientes adultos jóvenes, sin preferencia de género y usualmente como una masa única, bien definida, lobulada; frecuentemente presenta una cicatriz central. En la RNM y la TAC, la lesión es heterogénea, con calcificaciones, y en las imágenes contrastadas tardías se manifiesta la cicatriz fibrosa y los septos reteniendo el medio de contraste (21).
REFERENCIAS
1. Ayuso C, Rimola J, Forner A. Imaging techniques in hepatocellular carcinoma: diagnosis, extension and evaluation of therapeutic response. Gastroenterol Hepatol. 2010;33:721-6. [ Links ]
2. Russo MW, Wald C. Radiological diagnosis of hepatocellular carcinoma. Clin Liver Dis. 2012;1:190-3. [ Links ]
3. Llovet JM, Bustamante J, Castells A, et al. Natural history of untreated nonsurgical hepatocellular carcinoma: rationale for the design and evaluation of therapeutic trials. Hepatology. 1999;29:62-7. [ Links ]
4. Anis M, Irshad A. Imaging of hepatocellular carcinoma: practical guide to differential diagnosis. Clin Liver Dis. 2011;15:335-52. [ Links ]
5. Borzio M, Fargion S, Borzio F, et al. Impact of large regenerative, low grade and high grade dysplastic nodules in hepatocellular carcinoma development. J Hepatol. 2003;39:208-14. [ Links ]
6. Kojiro M, Roskams T . Early hepatocellular carcinoma and dysplastic nodules. Sem Liver Dis. 2005;25:133-42. [ Links ]
7. Kudo M. Multistep human hepatocarcinogenesis: correlation of imaging with pathology. J Gastroenterol. 2009;44(Suppl 19):112-8. [ Links ]
8. Hanna RF, Aguirre DA, Kased N, et al. Cirrhosis-associated hepatocellular nodules: correlation of histopathologic and MR imaging features. Radiographics. 2008;28:747-69. [ Links ]
9. Harvey CJ, Albrecht T. Ultrasound of focal liver lesions. Eur Radiol. 2001;11:1578-93. [ Links ]
10. Colli A, Fraquelli M, Casazza G, et al. Accuracy of ultrasonography, spiral CT, magnetic resonance and alph-fetoprotein in diagnosing hepatocellular carcinoma: a systemic review. Am J Gastroenterol. 2006;101:513-23. [ Links ]
11. Mitsuzaki K, Yamashita Y, Ogata I, et al. Multiple-phase helical CT of the liver for detecting small hepatomas in patients with liver cirrhosis: contrast-injection protocol and optimal timing. Am J Roentgenol. 1996;167:753-7. [ Links ]
12. Kim SH, Choi BI, Lee JY, et al. Diagnostic accuracy of multi/single detector row CT and contrast enhanced MRI in the detection of hepatocellular carcinomas meeting the Milan criteria before liver transplantation. Inter virology. 2008;51(Suppl 1):52-60. [ Links ]
13. Yoo HJ, Lee JM, Lee JY, et al. Additional value of SPIO-enhanced MR imaging for the noninvasive imaging diagnosis of hepatocellular carcinoma in cirrhotic liver. Invest Radiol. 2009;44:800-7. [ Links ]
14. Lee JM, Choi BI. Hepatocellular nodules in liver cirrhosis: MR evaluation. Abdom Imaging. 2011;36:282-9. [ Links ]
15. European Association for the Study of the Liver; European Organisation for Research and Treatment of Cancer. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol. 2012;56:908-43. [ Links ]
16. Bruix J, Sherman M, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma: an update. Hepatology. 2011;53:1020-2. [ Links ]
17. Lee JM, Trevisani F, Vilgrain V, et al. Imaging diagnosis and staging of hepatocellular carcinoma. Liver Transpl. 2011;17(Suppl 2):34-43. [ Links ]
18. Romero J, Pinzón B. Nuevo enfoque en la evaluación de pacientes oncológicos. Rev Col Radiol. 2006;17:1949-54. [ Links ]
19. Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45:228-47. [ Links ]
20. Winston CB, Schwartz LH, Fong Y, et al. Hepatocellular carcinoma: MR imaging findings in cirrhotic livers and noncirrhotic livers. Radiology. 1999;210:75-9. [ Links ]
21. Brancatelli G, Federle MP, Grazioli L, et al. Hepatocellular carcinoma in noncirrhotic liver: CT, clinical, and pathologic findings in 39 U.S. residents. Radiology. 2002;222:89-94. [ Links ]