Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957
Rev Col Gastroenterol vol.28 supl.1 Bogotá set. 2013
Tratamiento intervencionista
Interventional treatment
Juan Manuel Pérez MD. (1), Oscar Alfredo Beltrán Galvis MD. (2)
(1) Radiología. Fundación Cardioinfantil-Instituto de Cardiología, Bogotá, Colombia.
(2) Grupo de Hepatología y Trasplante Hepático. Fundación Cardioinfantil-Instituto de Cardiología, Bogotá, Colombia.
Fecha recibido: 06-10-13 Fecha aceptado: 16-10-13
Resumen
Con el advenimiento de la terapia intervencionista se dio campo a una modalidad más de tratamiento que podría brindar la oportunidad a aquellos pacientes que por diferentes motivos no podían ser llevados a tratamientos quirúrgicos. De esta forma, las terapias locorregionales (ablación percutánea y quimioembolización) se han constituido en un apoyo como terapias curativas y paliativas en pacientes sin otra opción. Sin embargo, las terapias locorregionales deben estar enmarcadas en la estratificación clínica del CHC, que nos permite estimar la expectativa de vida, el mejor tratamiento para su estadio y un balance de riesgos y beneficios del tratamiento escogido.
Palabras clave
Terapias locorregionales, ablación percutánea, quimioembolización.
Abstract
The advent of interventional therapy has given a wider field to a form of treatment that could provide an opportunity to those patients who, for various reasons, cannot undergo surgical treatments. Thus, local and regional therapies such as percutaneous ablation and chemoembolization have become supporting curative and palliative therapies for patients with no other choice. However, local and regional therapies should be framed within the clinical stratification of HCC which allows us to estimate the life expectancy and the best treatment for the patients stage and the balance of risks and benefits of the treatment chosen.
Keywords
Local and regional therapies, Percutaneous ablation, Chemoembolization.
El carcinoma hepatocelular (CHC) es diagnosticado en estadios tempranos en los países desarrollados, en un 30-40% de los pacientes, cuando es posible un tratamiento curativo, con una sobrevida a cinco años de, aproximadamente, el 50-75%. La curación en cánceres avanzados es de 0-10%, y mundialmente se reconoce que el 70% de los CHC son diagnosticados en fases tardías. El CHC comprende entre el 75 y 90% de todos canceres del hígado, y entre el 70 y 80% de los casos se presentan en pacientes con cirrosis (1,2).
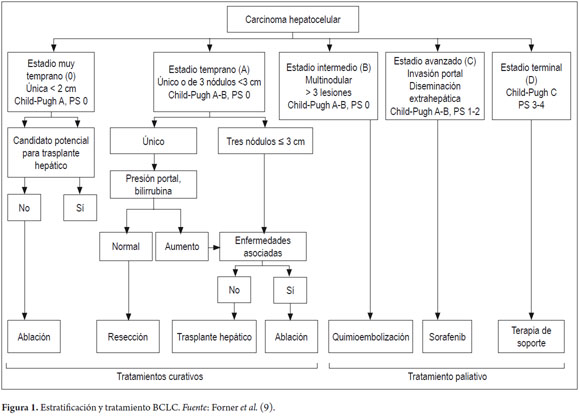
Existen varios sistemas de estratificación para estimar la expectativa de vida de los pacientes con CHC (3), pero, de acuerdo con las guías de la Asociación Estadounidense para el Estudio de las Enfermedades Hepáticas (AASLD) y la Asociación Europea para el Estudio de las Enfermedades Hepáticas (EASL), únicamente el sistema Barcelona Clinic Liver Cancer (BCLC), que une el estadio con el tratamiento y ha sido validada externamente, tiene amplia aceptación en la comunidad científica internacional y nacional (4-8).
Las terapias locorregionales (ablación percutánea y quimioembolización) deben estar enmarcadas dentro de la estratificación clínica del CHC, que nos permite estimar la expectativa de vida, el mejor tratamiento para su estadio y un balance de riesgos y beneficios del tratamiento escogido (figura 1).
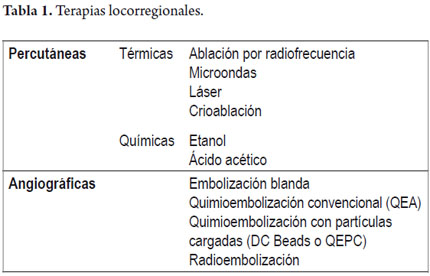
Las terapias locorregionales se pueden clasificar en percutáneas, angiográficas o combinadas. Las terapias percutáneas a su vez se dividen en térmicas y químicas. Dentro de las térmicas se encuentran la ablación por radiofrecuencia (ARF), microondas y crioablación; en el grupo de las químicas está la inyección con etanol o con ácido acético. Por el otro lado, se encuentran la terapias angiográficas o endovasculares, dentro de las cuales se encuentra la embolización blanda, quimioembolización convencional (QEA), quimioembolización con partículas cargadas (o DC Beads) y radioembolización (RE) (tabla 1).
TERAPIA LOCORREGIONAL PERCUTÁNEA
Definición
Esta terapia consiste en la inyección de sustancias en el tumor (etanol, ácido acético) o en cambios de temperatura intralesional (radiofrecuencia, ARF, láser, crioterapia, microondas). Las más ampliamente usadas y disponibles en nuestro medio son la ARF y la inyección percutánea de etanol (IPE) (8).
- Radiofrecuencia: corriente alterna de alta frecuencia que genera calor al agitar los iones adyacentes al extremo no aislado de la punta de la aguja, lo cual va a producir una necrosis de coagulación.
- Inyección de etanol: técnica más antigua en la cual se produce una deshidratación del citoplasma y desnaturalización de las proteínas, lo cual lleva a una necrosis de coagulación. Por otro lado, su acción directa sobre el endotelio vascular causa agregación plaquetaria y trombosis.
Indicaciones
- La ablación por radiofrecuencia (ARF) es la primera línea de tratamiento con intención curativa en pacientes con CHC muy temprano (< 2 cm), BCLC O, que no son candidatos para trasplante hepático o resección quirúrgica, con tasas de sobrevida a cinco años del 50 a 75%.
- En tumores < 2 cm, ambas técnicas (ARF e IPE) logran completa respuesta en el 90-100% de los casos; recientemente se ha postulado que la ARF podría ser considerada como una alternativa competitiva a la resección quirúrgica en todos los pacientes con hepatocarcinoma muy temprano, pero se requieren estudios clínicos controlados y aleatorizados (8).
- La ARF se recomienda como principal terapia locorregional en tumores únicos menores de 5 cm o hasta tres tumores menores de 3 cm, BCLC A, sin opción de trasplante hepático, teniendo en cuenta que a mayor tamaño, la tasa de recurrencia puede alcanzar hasta el 50%. En tumores > 2 cm, la tasa de necrosis completa, así como la sobrevida a tres años, es mucho mejor con la ARF, que con IPE, con menor número de sesiones y menor tasa de recaída (9,10).
- La inyección con etanol se recomienda en casos en que la ARF no sea técnicamente factible (10-15%), como en aquellos tumores localizados cerca de la vesícula biliar, vía biliar central o cuando están en contigüidad con otros órganos, como riñón, colon o cámara gástrica; sin embargo, en estos casos se debe intentar realizar una hidrodisección con dextrosa para separar el órgano y emplear la ARF, antes que emplear el etanol.
Limitaciones
- Una de las principales limitantes de la ablación es el efecto de sifonaje, que ocurre en aquellos casos en que el tumor está adyacente a estructuras vasculares de más de 3 mm. Consiste en la pérdida de calor en el tumor, porque el flujo sanguíneo constante dentro del vaso refrigera la zona adyacente e impide que la temperatura alcance el punto ideal de más de 50°C y, por lo tanto, pueden quedar células tumorales viables. En los casos en los cuales el tumor está localizado en el domo, se aumenta el riesgo de lesión del diafragma; por lo tanto, se prefiere realizar la ablación por laparoscopia, laparotomía abierta o empleando otro método, como la inyección con etanol.
- El riesgo de diseminación del tumor a través de la punción (seeding) es del 1% y usualmente aparece de manera tardía en los controles de seguimiento. Los factores de riesgo asociados son: diámetro de la aguja, número de punciones, aproximación perpendicular, biopsias previas, patrón histológico pobremente diferenciado, niveles de AFP y localización subcapsular de la lesión. En la actualidad, los sistemas de ablación por radiofrecuencia cuentan con mecanismos de cauterización del trayecto de entrada, con el fin de evitar siembras tumorales, y en lo posible se debe evitar punción directa de la lesión (11).
- La recurrencia después del tratamiento es tan alta como con la resección quirúrgica, y puede alcanzar el 80% a cinco años (12). Aunque la evidencia no es sólida, por la heterogeneidad de los estudios, un metaanálisis reciente sugiere que la sobrevivida global y la sobrevida libre de recurrencia fue mejor cuando se combina ARF más quimioembolización en tumores mayores de 3 cm (13).
- La sobrevida a largo plazo con ARF es todavía limitada. Estudios con número de pacientes pequeños informan tasas de sobrevida del 80-100% a un año, 63-98% a dos años, 45-67% a tres años, 74% a cuatro años, 41-60% a cinco años y 27-60% a diez años (14). Recientes estudios muestran tasas de sobrevida y recurrencia muy comparables a la resección en tumores en estadio temprano o muy temprano, sugiriendo la ARF, algunas guías como la Europea de CHC, como una alternativa, a la resección, en estadios muy tempranos BCLC 0. (14,15).
Pacientes candidatos para ablación por radiofrecuencia (ARF)
Los potenciales candidatos para ablación por radiofrecuencia son:
- En general, se consideran para ablación por radiofrecuencia aquellas lesiones periféricas menores de 5 cm o hasta tres lesiones con diámetros menores de 3 cm, en pacientes CHILD A o B, sin opción de tratamiento quirúrgico, o aquellos pacientes que son pobres candidatos quirúrgicos por múltiples comorbilidades
- Pacientes con diagnóstico de hepatocarcinoma como puente al trasplante, cuando el tiempo estimado en lista de espera es mayor a seis meses, para control local del tumor.
- Pacientes con buena reserva funcional hepática CHILD A, y tumores menores de 2 cm, como una alternativa al trasplante o resección quirúrgica.
- Recurrencia local de CHC, después de hepatectomía parcial.
Complicaciones
La ablación por radiofrecuencia es un procedimiento muy seguro con tasas de complicaciones que oscilan entre el 0,5 y el 7%. La más frecuente es la hemorragia, que se estima menor del 1% (16). El riesgo está directamente relacionado con la localización y el tamaño del tumor. Se puede presentar absceso posradiofrecuencia, perforación intestinal o diseminación (menos del 1%), neumotórax o derrame pleural. El riesgo de estas complicaciones es menor cuando se compara con la resección quirúrgica abierta (hasta 22%). La mortalidad de este procedimiento es del 0,5% (17).
Evaluación de respuesta
La eficacia de las terapias locorregionales es evaluada por TAC o RM dinámica contrastada, un mes después del procedimiento; luego, imágenes cada tres a seis meses durante dos años, y luego anualmente.
La ausencia de captación del contraste dentro de tumor refleja necrosis tumoral, mientras que la persistencia de este refleja enfermedad persistente. La recurrencia del tumor, en el área tratada o en otra parte, es definida por la reaparición del realce vascular durante la fase arterial.
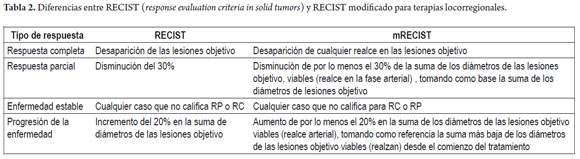
Se han planteado varias alternativas para evaluar la respuesta tumoral en hepatocarcinoma (RECIST, response evaluation criteria in solid tumors, EASL o RECIST modificado), pero hay tendencia a preferir el RECIST modificado, dado que en este no solo se toma en cuenta el diámetro de la lesión, sino el área viable identificado como la zona de realce dentro del tumor en la fase arterial (18) (tabla 2).
Recomendaciones mRECIST
- En derrame pleural y ascitis se requiere confirmación de la naturaleza neoplásica para definir progresión de la enfermedad. PD.
- Los ganglios de la portahepatis son considerados malignos si tienen más de 2 cm en el eje corto.
- Una nueva lesión puede ser clasificada como CHC si tiene diámetro mayor de por lo menos 1 cm, con comportamiento radiológico típico; es decir, realce en la fase arterial con lavado del medio en la fase portal o tardía. Una lesión con patrón radiológico atípico puede ser diagnosticada como CHC si hay crecimiento de más de 1 cm en el intervalo entre los estudios radiológicos (18).
- El uso de α-fetoproteína (AFP) no se ha evaluado en el seguimiento de pacientes con CHC.
TÉCNICAS ANGIOGRÁFICAS
A pesar de existir varias técnicas angiográficas, como la embolización blanda, la radioembolización y la quimioembolización, solo esta última ha mostrado de manera sólida un beneficio en la sobrevida de los pacientes con CHC.
QUIMIOEMBOLIZACIÓN ARTERIAL (QEA)
Su principio se basa en el aporte vascular arterial que tiene el hepatocarcinoma; el procedimiento consiste en avanzar un catéter-microcatéter dentro de la arteria hepática lo más selectivo posible y liberar el agente de quicioembolización (doxorubicina, mitomicina o cisplatino), mezclado con agente oleoso (lipiodol), el cual es retenido selectivamente por el tumor, magnificando la exposición de las células tumorales a la quimioterapia selectiva. Posteriormente, se ocluye la arteria hepática con material de embolización, tal como micropartículas de alcohol polivinilico, microesferas, espirales o esponja absorbible, con el propósito de inducir necrosis sobre el tumor y evitar lavado del agente de quimioterapia, para así permitir un mayor tiempo de exposición.
Recientemente, se ha propuesto el uso de microesferas cargadas con doxorubicina (QEA-PC); técnicamente es similar a la QEA, con la diferencia de que una vez liberadas las esferas dentro del tumor no hay necesidad de realizar oclusión vascular, ya que dichas esferas van a ocluir el vaso. El resultado de este procedimiento es la liberación controlada de la doxorubicina en un periodo de una semana, aumentando la concentración local y disminuyendo la toxicidad sistémica (19).
No hay suficiente evidencia que favorezca la selección de un agente quimioterapéutico, tipo agente embolizante, el uso o no de agente embolizante o de lipiodol, pero el más utilizado hasta el momento es la doxorubicina (50-75 mg/m2 máximo 150 mg), mezclada con lipiodol (5-20 mg) y oclusión con microesferas.
Se recomienda administrar antibióticos EV de amplio espectro, antieméticos, dexametasona y antihistamínicos, antes del procedimiento. Después del procedimiento, se recomienda agresiva hidratación, control del dolor y en general salida después de 48 horas, posterior a adecuada ingesta. En un metaanálisis se encontró un promedio de hospitalización de cinco días por síndrome posquimioembolización (fiebre, dolor y leucocitosis). No hay evidencia sólida, pero nosotros recomendamos antibióticos por cinco días, particularmente en pacientes con esfinterotomía previa o anastomosis bilioentéricas (20,21).
Indicaciones
1. Es la terapia de primera línea para el CHC intermedio, según BCLC, es decir, pacientes asintomáticos con tumores multinodulares sin invasión vascular o diseminación extrahepática.
2. Tratamiento del CHC no resecable en pacientes no candidatos para ARF.
3. En pacientes en lista de espera para trasplante hepático, para reducir la tasa de progresión de la enfermedad y salida de la lista (dropout), cuando se espera que permanezcan más de seis meses esperando el trasplante.
Selección de candidatos para QEA
El beneficio del QEA depende de la combinación de factores relacionados con el tumor y de la gravedad de la disfunción hepática previa.
1. Son candidatos los pacientes con CHC con lesiones no resecables, lesiones solitarias (< 8-10 cm) o multinodulares (> 3), sin invasión vascular o diseminación extrahepática, con función hepática conservada (CHILD A o B 7 sin ascitis), con buen estado funcional EF O.
2. Los pacientes con CHC y trombosis de la porta, tradicionalmente se han excluido de la QEA, pero recientemente, pacientes con CHC, con trombosis portal sin compromiso de la vena porta principal, toleran mejor el procedimiento. Pacientes con trombosis portal de la rama principal deben ser considerados para otras alternativas, como radioembolización, no disponible en nuestro medio actualmente (22).
3. Son contraindicaciones absolutas para el QEA, además de la trombosis de la vena porta principal, la encefalopatía, la obstrucción biliar y la cirrosis Child C. Son contraindicaciones relativas para el QEA: bilirrubina mayor de 2, ast > 100, tumor que comprometa > 50% del hígado, insuficiencia cardiaca o renal, ascitis, sangrado reciente de várices esofágicas, trombocitopenia significativa, TIPS (derivación portosistémica intrahepática), obstrucción biliar o papila incompetente por stent biliar o cirugía previa.
4. En pacientes con enfermedad hepática más avanzada (CHILD B, enfermedad bilobar o recurrente), o en pacientes con falla cardiaca leve a moderada, es una mejor opción la quimioembolización con partículas cargadas, por menor toxicidad sistémica (19).
Eficacia
- Para los pacientes con CHC, estadio intermedio sin ningún tratamiento, la sobrevida esperada a los tres años es del 7 al 17%, mientras que con quimioembolización convencional alcanza 26 al 29% (22).
- La quimioembolización (QEA) logra una respuesta parcial en el 15-55% de los pacientes (23). Una importante limitación de la QEA es la alta tasa de recurrencia del tumor, que logra una respuesta sostenida mayor de seis meses en únicamente el 28-35% de quienes recibieron QEA tradicional, y en los no respondedores, ningún beneficio se logra en la sobrevida, comparativamente con el soporte estándar (24).
- Pese a ausencia de estudios fase 3, comparando QEA-PC (quimioembolización con partículas cargadas) frente a QEA convencional, QEA-PC genera más consistencia y reproducibilidad de la técnica en los diferentes protocolos que la QEA convencional; una reciente publicación mostró una sobrevida promedio de 48 meses (19).
- La mortalidad es menor del 2% cuando se realiza una selección adecuada de los candidatos para QEA.
- La evidencia actual sugiere que un ciclo de QEA no es suficiente para definir un efectivo tratamiento en pacientes con CHC estadio intermedio (25). Los criterios para definir suspensión de la QEA son:
- No lograr la respuesta planteada, según mRECIST, en las lesiones objetivo, después de por lo menos dos tratamientos.
- Deterioro clínico o funcional. Se debe suspender, en caso de progresión clínica a un estado funcional > 2 o evolución sostenida de la descompensación hepática.
- El beneficio de repetidos ciclos de QEA debe ser evaluado contra el riesgo de falla hepática. Se recomienda un nuevo ciclo de tratamiento, ocho semanas después del tratamiento inicial, después de confirmar que las enzimas hepáticas han regresado a su valor normal. En los casos de progresión de la enfermedad, se debe suspender la quimioembolización y pasar a quimioterapia sistémica con sorafenib.
- Hipotéticamente, la administración del sorafenid podría regular los factores angiogénicos inducidos por el QEA y mejorar los resultados de la quimioembolización. Estudios no controlados son promisorios, pero faltan estudios aleatorizados (24).
- Se recomienda TAC o RM con contraste seis semanas después del procedimiento; luego, cada tres a seis meses, por dos años, y luego anualmente.
Complicaciones
El más frecuente evento adverso pos-QEA es el síndrome postembolización (60-80%). Se caracteriza por dolor en el hipocondrio derecho, náuseas, moderado grado de íleo, fatiga, fiebre y elevación transitoria de AST, ALT y bilirrubinas. Los síntomas son autolimitados (tres a cuatro días). Probablemente es secundario a la necrosis del tumor, aunque otros sugieren daño isquémico en tejido hepático no tumoral(26).
El riesgo de descompensación hepática es reversible, generalmente (20%) e irreversible 3% en un estudio (3%). Factores de riesgo para falla hepática irreversible fueron: bilirrubina > 4 mg, INR prolongado, albúmina < 2 g/l, creatinina > 2 mg/dl, ascitis marcada, encefalopatía o MELD > 20 (23). Otras complicaciones (2%) pueden ser: abscesos hepáticos (2%), colecistitis aguda y lesión de la vía biliar (bilomas subcapsulares, estenosis focales del hepático común o del colédoco), úlceras gastroduodenales, disfunción renal, embolización pulmonar o cerebral por el lipiodol, o neumonía intersticial.
Abreviaturas
AASLD: Asociación Estadounidense para el Estudio de las Enfermedades del Hígado
ARF: ablación por radiofrecuencia
BCLC: Barcelona Clinic Liver Cancer
CHC: carcinoma hepatocelular
ESLD: Asociacion Europea para el Estudio de las Enfermedades Hepáticas
IPE: inyección percutánea de etanol
QEA: quimioembolización arterial
QEA-PC: quimioembolización arterial con partículas cargadas
REFERENCIAS
1. Okuda H. Hepatocellular carcinoma development in cirrhosis. Best Pract Res Clin Gastroenterol. 2005;21:161-73. [ Links ]
2. Llovet JM, Bruix J. Novel advancements in the management of hepatocellular carcinoma. J Hepatol. 2008;48(Supp1):S20-37. [ Links ]
3. Forner ARM, Rodríguez de Lope C, Bruix J. Current strategy for staging and treatment: the BCLC update and future prospects. Semin Liver Dis. 2010;30:61-74. [ Links ]
4. Cillo U, Vitale A, Grigoletto F, et al. Prospective validation of the Barcelona clinic liver cancer staging system. J Hepatol. 2006;44:723-31. [ Links ]
5. Grieco A, Pompili M, Caminiti G, et al. Prognostic factors for survival in patients with early-intermediate hepatocellular carcinoma undergoing non-surgical therapy: comparison of Okuda, CLIP, and BCLC staging systems in a single Italian centre. Gut. 2005;54:411-8. [ Links ]
6. Marrero JA, Fontana RJ, Barrat A, et al. Prognosis of hepatocellular carcinoma: comparison of 7 staging systems in an American cohort. Hepatology. 2005;41:707-16. [ Links ]
7. Bruix J. Sherman M. Managment of hepatocellular carcinoma: an update. Hepatology. 2011;53:1020-2. [ Links ]
8. Forner A, Llovet J, Bruix J. Hepatocellular carcinoma. Lancet. 2012;379:1245-55. [ Links ]
9. European Association for the Study of the liver, European Organization for Research and treatment of Cancer. EASL-EORTC clinical practice guidelines: managment of Hepatocellular carcinoma. J Hepatol. 2012;56:908-43. [ Links ]
10. Pleguezuelo M, Germani G, Marelli L, et al. Evidence-based diagnosis and loco regional therapy for hepatocellular carcinoma. Expert Rev Gastroenterol Hepatol. 2008;2:761-84. [ Links ]
11. Gervais D, Goldberg N, Society of International Radiology position statement on percutaneous radiofrequency ablation for the treatment of liver tumors. J Vasc Interv Radiol. 2009;20:S342-S7. [ Links ]
12. Harrison LE, Kner B, Baramiour P, et al. Locoregional recurrences are frequent after radiofrequency ablation for hepatocellular carcinoma. J Am Coll Surg. 2003;197:759-64. [ Links ]
13. Ni JY, Liu SS, Xu LF, et al. Meta-analysis of radiofrequency ablation in combination with transarterial quemoembolization for hepatocellular carcinoma. World j Gastroenterol. 2013;19:3872-82. [ Links ]
14. Lin SM. Ultrasonograhy. Guided radiofrequency ablation in hepatocellular carcinoma. current status and future perspectives. Jmu. 2013;21:9-15. [ Links ]
15. Pompili M, Saviano A, Mattaeis N, et al. Long-term effectiveness of resection and radiofrequency for single hepatocelular carcinoma <3 cms. Result of a multicenter Italian Survey. J Hepatol. 2013;59:89-97. [ Links ]
16. De Baére T, Risse O, Kuoch V, et al. Adverse events during radiofrequency treatment of 582 hepatic tumors. Am J Roentgenol. 2003;181:695-700. [ Links ]
17. Kasugay H, Osaki Y, Oka H, et al. Severe complications of radiofrequency ablation therapy for Hepatocellular carcinoma: An analysis of 3891 ablations in 2,614 patients. Oncology. 2007;72(Suppl 1):72-5. [ Links ]
18. Lencioni R, Llovet JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 2010;30:52-60. [ Links ]
19. Burrel M, Reig M, Forner A, et al. Survival of patients with hepatocellular carcinoma treated by QEA using Drugs Eluting Beads. Implications for clinical practice and trial design. J Hepatol. 2012;56:1330-5. [ Links ]
20. Brown DB, Geschwind JF, Soulen MC, et al. Society of Interventional Radiology position statement on chemoembolization of Hepatic malignancies. J Vasc Interv Radiol. 2006;17:217-23. [ Links ]
21. Plentz RR, Lankisch TO, Basturk M, et al. Prospective analysis of German patients with hepatocellular carcinoma undergoing transcatheter arterial chemoembolization with or without prophylactic antibiotic therapy. J Gastroenterol Hepatol. 2005;20:1134-6. [ Links ]
22. Scwarz RE, Abou-Alfa GK, Geschwind JF, et al.Nonoperative therapies for combined modality treatment of hepatocellular carcinoma. HBP (Oxford). 2010;12:313-20. [ Links ]
23. Meza-Junco J, Montano-Loza A, Liu D, et al. Locoregional radiological treatment for Hepatocelular carcinoma: Which, when and how? Cancer Treat Rev. 2012:38:54-62. [ Links ]
24. Lencioni R. Loco-regional treatment of hepatocellular carcinoma by transcatheter arterial chemoembolizacion. Therapy in liver disease. Elsevier Doyma. 2013;311-316 [ Links ]
25. Raoul JL, Sangro B, Forner A, et al. Evolving strategies for the management of intermediate-stage hepatocellular carcinoma. Available evidence and expert opinion on the use of transarterial chemoembolization. Cancer Treat Rev. 2011;37:212-20. [ Links ]
26. Curley S, Stuart K, et al. Non surgical therapies for localized hepatocelular carcinoma: transarterial embolizacion, radiotherapy and radioembolizacion. Sep 6 2013. [ Links ]