Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.28 supl.1 Bogotá Sept. 2013
Hepatocarcinoma (CHC) y trasplante hepático
Hepatocellular carcinoma (HCC) and liver transplantation
Rafael Claudino Botero MD. FACP. (1)
(1) Fundación Cardioinfantil, Departamento de Medicina Interna, Servicio de Gastroenterología y Hepatología, Bogotá, Colombia.
Fecha recibido: 30-09-13 Fecha aceptado: 16-10-13
Resumen
El trasplante hepático constituye hoy en día la mejor modalidad terapéutica para el hepatocarcinoma, ya que permite no solamente erradicar la lesión tumoral, sino, también, el hígado cirrótico con potencial de nuevos tumores y, de esta forma, mejorar la sobrevida y obtener mejores posibilidades de curación a corto y largo plazos. En esta revisión se pretende dar una visión actualizada del manejo del hepatocarcinoma en el paciente cirrótico, desde que se identifica la lesión inicial, los criterios de enlistamiento y exclusión, el seguimiento y alternativas terapéuticas en la lista de espera, la importancia del estudio del explante en el manejo futuro y, finalmente, el pronóstico a largo plazo y las terapias coadyuvantes en casos de recurrencia postrasplante.
Palabras clave
Selección de pacientes, lista de espera, MELD.
Abstract
Today liver transplantation has become the best therapeutic modality for HCC because it allows not only eradication of the tumor, but also removes cirrhotic liver with its potential for new tumors. In this way liver transplantation improves survival and chances of a cure in both the short and long term. This review aims to provide an update on management of hepatocellular carcinoma in cirrhotic patients from initial identification of the lesion, through inclusion and exclusion criteria, and including monitoring and therapeutic alternatives for patients on the waiting list for donor organs. It includes an overview of the importance of studying the explant for future management as well as long-term prognosis and adjunct therapies in cases of post-transplant recurrence.
Keywords
Patient selection, waiting list, MELD.
GENERALIADES
En la década de los años ochenta, cuando el trasplante hepático dejó de ser un procedimiento experimental para convertirse en un procedimiento efectivo y aceptado en el mundo, el hepatocarcinoma se convirtió en una de las más frecuentes indicaciones para el procedimiento, y los primeros estudios de seguimiento mostraron unas tasas de recurrencia en el injerto del 65-75% asociadas con el rápido crecimiento tumoral inducido por la inmunosupresión y con la falta de criterios adecuados de selección para el trasplante.(1,2).
En 1985, Itwasuki et al., en la Universidad de Pittsburgh en los Estados Unidos (1), mostraron la experiencia obtenida en los centros de Colorado y Pittsburgh en pacientes cirróticos con CHC, en la que observaron por primera vez que un grupo de pacientes con tumores incidentales no presentaron recurrencia (mediana de seguimiento de 16 meses), en comparación con aquellos previamente identificados, en quienes se observó recurrencia en el 74% de los casos (mediana de tiempo para la recurrencia de ocho meses). Adicionalmente, en 1990, el grupo de Oltohff et al., en la Universidad de California en los Angeles (UCLA), describieron su experiencia en 16 pacientes trasplantados por CHC, de los cuales 12 sobrevivieron los primeros tres meses, 8 (67%) tuvieron recurrencia entre dos meses y dos años postrasplante (3). Estos y otros estudios que reportaron altísimas tasas de recurrencia llevaron a que disminuyera el interés en trasplantar pacientes en estas circunstancias y se implementara un proceso de moratoria a trasplantar pacientes por fuera de estudios clínicos (4).
En 1996, Mazaferro et al., en Milán, Italia, publicaron un importante estudio que demostraba por primera vez que cuando se seleccionaban los pacientes con CHC para trasplante teniendo en cuenta unos criterios que hoy conocemos como los criterios de Milán, basados en el tamaño y el número de las lesiones en pacientes sin compromiso vascular ni metastásico, la sobrevida actuarial a cuatro años era del 75%, similar a las indicaciones sin malignidad para el procedimiento (5). Estos excelentes resultados fueron confirmados por otros centros de trasplante en el mundo y se convirtieron rápidamente en los estándares aceptados para la selección de pacientes (6,7).
En los Estados Unidos, Yoo et al. (8) analizaron la base de datos de la red de trasplantes y procuramiento de órganos (OPTN), en la cual se estudiaron 34.327 pacientes trasplantados entre 1987 y 2001; se encontró que la sobrevida para los pacientes trasplantados por CHC era mucho peor que la obtenida con otras indicaciones (sobrevida a un año del 77% frente a 86,7%, p < 0,001; a cinco años del 48,3% frente a 74,7%, p < 0,001) y el CHC era un fuerte predictor de peor sobrevida a uno y cinco años postrasplante (razón de riesgo [HR] 1,6 y 2,02, respectivamente). Sin embargo, los investigadores observaron que con el tiempo ocurría una mejoría sustancial en la sobrevida de los pacientes con CHC, sin que lo mismo ocurriera en aquellos trasplantados por indicaciones no malignas.
La sobrevida a los cinco años aumentó del 25,3% en el periodo de 1987 a 1991, a 61,6% entre 1996 y 2001, estableciendo así el hecho de que la mejoría en la sobrevida era consecuencia de la mejor selección de los pacientes para trasplante.
Ante la gran mejoría de los resultados obtenidos con el trasplante en pacientes con CHC, muchos investigadores encontraron que el sistema utilizado para asignar órganos para trasplante en los Estados Unidos discriminaba en contra de los pacientes con CHC, debido a que se basaban en la gravedad de la enfermedad según los criterios de Child-Turcotte-Pugh y el tiempo en la lista de espera que no correlacionaba con la mortalidad (9).
En 1998, la administración de los servicios y recursos de salud, perteneciente al departamento de salud y recursos humanos en los Estados Unidos, hizo un llamado proponiendo la búsqueda de un nuevo sistema más justo para la asignación de órganos (10). De esta manera, en 1992 los investigadores en la Clínica Mayo propusieron implementar el sistema MELD diseñado por ellos para predecir la mortalidad después de la inserción de la derivación transyugular intrahepática (TIPS), para asignar los órganos; desde entonces viene siendo el sistema utilizado en la mayoría de los centros en el mundo (11,12). En corto tiempo el nuevo sistema mostró que había disminuido el número de pacientes enlistados y aumentado el número de trasplantes; además, pudo demostrarse de forma retrospectiva una relación lineal entre el puntaje MELD y la mortalidad en la lista de trasplante (13).
Posteriormente, ante el gran aumento de pacientes trasplantados con CHC, llevó a que se introdujeran sistemas para evitar que los pacientes con CHC progresaran a estados más avanzados antes de poderse trasplantar y, por ende, ser excluidos de la lista de trasplante. Para ello, se propuso un sistema que igualara el riesgo de progresión a estadios por arriba del 2 (sistema TNM modificado) para pacientes con CHC, con el riesgo de muerte en la lista de trasplantes para pacientes sin CHC. Según este sistema, a los pacientes con estadio 1 se les asignó un puntaje MELD de 29 que equivalía a un riesgo de progresión en tres meses a estadios más avanzados del 30% y una adición del 10% al puntaje cada tres meses.
Esta modificación generó en muy corto tiempo que el número de pacientes trasplantados con CHC aumentara del 7% antes del MELD, al 22% un año después, y que el 87% de los pacientes con CHC se trasplantaran dentro de los primeros tres meses de enlistarse (14,15). Para evitar disparidades y aumento de la mortalidad de los pacientes sin CHC en la lista de trasplante, en el 2003 se propuso una modificación consistente en asignarle 20 puntos a los pacientes en estadio 1, y 24 puntos a aquellos con estadio 2, con la cual se redujo el número de pacientes trasplantados con CHC del 22% al 14%, aunque no cambió el tiempo de espera en la lista ni la frecuencia de exclusión de esta (16).
Posteriores estudios que analizan la presencia del CHC en los explantes demostraron que en el 31% de los pacientes trasplantados en estadio 1 no se encontró el CHC en el explante, comparado con el 9% en aquellos con estadio 2 (17). Por esta razón, se decidió excluir de este sistema a los pacientes estadio 1 y establecer el sistema actual que les asigna 22 puntos a los pacientes con un aumento trimestral del 10%.
El impacto de estos nuevos sistemas ha sido validado en estudios retrospectivos en los Estados Unidos. Duffy et al., de UCLA, estudiaron los resultados de trasplante para CHC en 467 pacientes, de 1984 a 2006; demostraron que la sobrevida libre de recurrencia era significativamente mejor en pacientes dentro de los criterios de Milán que en aquellos por fuera de ellos (74 frente a 72%, respectivamente; p < 0,01) (18). De forma llamativa, los pacientes trasplantados posterior a la introducción del sistema MELD tuvieron una sobrevida a cinco años del 74% frente al 47% de aquellos trasplantados antes del MELD (p = 0,001). Posterior a 1997, la sobrevida a los cinco años mejoró hasta el 76% para los pacientes trasplantados con CHC y la rata de recurrencia bajó del 52,9% (1987-1992) y 48,2% (1992-1997), al 11,4% (1997-2002) (19); ello demuestra nuevamente que el sistema MELD disminuía el tiempo promedio en la lista de espera para los pacientes con CHC.
En centros de trasplante en los que el tiempo de espera en la lista es mayor de seis meses, es aceptable realizar tratamientos ablativos y en centros especiales de trasplante de donante vivo relacionado (LDLT), teniendo en cuenta el doble riesgo para el paciente y el donante.
SELECCIÓN D PACIENTES
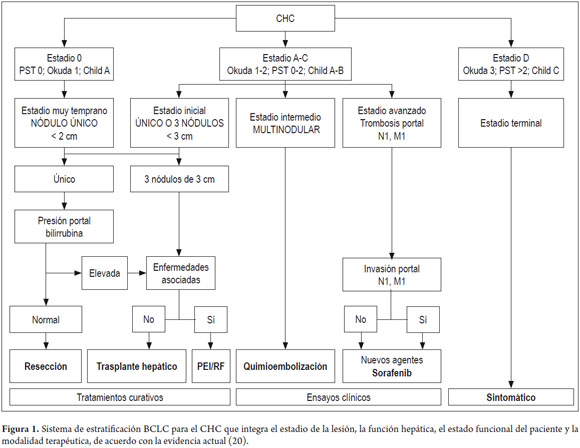
Gracias a la implementación en el mundo del ultrasonido y los niveles de AFP cada seis meses en los pacientes cirróticos, el número de pacientes con CHC en estadios tempranos ha aumentado significativamente, así mismo el número de ellos referidos para trasplante hepático. Sin embargo, en el estudio original de Mazaferro et al. (5), solo el 20% de los pacientes estaban dentro de los criterios de Milán y eran candidatos a trasplante. En la actualidad, la mayoría de los grupos de trasplante en el mundo y en Colombia seleccionan pacientes con CHC basados en los criterios de Milán y el sistema de la clínica de hígado de la Universidad de Barcelona (BCLC) (evidencia 2a; recomendación 1b), ya que es un sistema validado en el mundo y que en forma práctica integra el estadio del CHC con la gravedad de la enfermedad hepática, el estado funcional del paciente y el tratamiento más eficaz (20) (figura 1).
A pesar de la optimización de los sistemas de asignación de órganos, existe una tremenda desproporción entre el número de pacientes enlistados y el número fijo de donantes cadavéricos, que ha llevado a que un número significativo de pacientes progresen a estadios avanzados y tengan que ser excluidos de la lista de trasplantes, con deterioro de la sobrevida de los pacientes enlistados con CHC (21).
Algunos estudios practicados por Llovet et al. han mostrado una frecuencia de salida de la lista en los primeros seis meses del 25%, o por Pelletier et al., que al estudiar la base de datos OPTN, demostraron un riesgo del 12% a un año y del 20% a tres años de ser excluidos de la lista (22,23). Ante este doloroso hecho, muchos grupos de trasplante han decidido utilizar modalidades terapéuticas ablativas, como la quimoembolización (TACE), la ablación por radiofrecuencia (RFA) y la inyección percutánea de etanol (PEI), cuyas técnicas específicas se describen en detalle en otros artículos de estas guías.
Maddala et al., utilizando RFA pretrasplante en la Clínica Mayo, encontraron una posibilidad de egreso de la lista del 15% a los seis meses y del 25% a un año (24). Mazaferro et al. trataron 60 tumores en 50 pacientes con RFA pretrasplante; observaron que en un periodo de 9,5 meses de seguimiento no hubo pacientes excluidos de la lista por recurrencia tumoral, y las sobrevidas a uno y tres años fueron del 95 y 83%, respectivamente (25).
A pesar de que las terapias ablativas pretrasplante como el TACE tienen un claro papel de puente hacia el trasplante, su beneficio oncológico postrasplante todavía no está claro. Yao et al. demostraron un efecto beneficioso de estas terapias en la recurrencia postrasplante libre de tumor en pacientes con CHC, en estadios T2 y T3, los cuales tuvieron una sobrevida libre de tumor a cinco años del 93%, comparados con los que no recibieron tratamientos ablativos pretrasplante (26).
Bharat et al. evaluaron en forma retrospectiva a 100 pacientes con CHC que fueron trasplantados y de los cuales 46 recibieron terapias ablativas pretrasplante. De estos últimos, el 82,5% sobrevivieron cinco años frente al 51% que no recibieron terapia pretrasplante (p = 0,01). Al estratificarlos, dependiendo del estadio tumoral, el beneficio se observó en aquellos con tumores T2-T4. Pacientes con estadio T1 tuvieron excelentes resultados con o sin tratamiento pretrasplante. De estos pacientes, 16 tuvieron 100% necrosis tumoral en el explante; de los 16, 11 tenían estadios T2 y T3 y experimentaron mejor sobrevida que aquellos con tumores T1, de acuerdo con las imágenes pretrasplante (27).
Otra adición interesante a estas terapias es la posibilidad de reducir el estadio del tumor (downstaging) con el propósito de incluirlos dentro de los criterios de Milán y poderlos trasplantar. La mayoría de los estudios proceden de la universidad de California en San Francisco (UCSF), donde Yao et al. han propuesto un nuevo sistema de asignación por fuera de los criterios de Milán, denominado criterios UCSF. Este sistema propone expandir el tamaño tumoral a 6,5 cm cuando existe un solo tumor, o hasta tres tumores, el mayor ≤ 4,5 cm y un diámetro tumoral total ≤ 8 y sin invasión vascular ni metástasis. Estos resultados se derivan de las características tumorales en el explante, donde los investigadores demostraron que las imágenes pretrasplante reducían erróneamente el tamaño de las lesiones (ünderstaging) cuando se comparaban con las del explante, y esto no necesariamente afectaba los resultados. De los 168 pacientes estudiados inicialmente, la sobrevida libre de tumor a los cinco años fue del 94% para los 30 pacientes que llenaban los criterios UCSF, pero excedían los de Milán (p = 0,05) (28).
Adicionalmente, estos criterios fueron evaluados en una serie de 467 pacientes trasplantados en UCLA, en la cual 173 pacientes estaban dentro de los criterios de Milán, 185 estaban fuera de ellos, pero dentro de los criterios UCSF, y 109 fuera de estos últimos criterios. Todo esto basado en imágenes pretrasplante. La sobrevida a cinco años fue del 79% para aquellos dentro de los criterios de Milán, frente al 64% para aquellos por fuera de estos, pero dentro de los de UCSF (P = 0,61). Basados en la patología del explante, la sobrevida de los que llenaron los criterios de Milán frente a aquellos que llenaban solamente los de UCSF fue de 86% frente a 81% a los cinco años, respectivamente (18).
Majno et al., del Hospital Pau Brousse en París, fueron los primeros en aplicar el criterio de downstaging para facilitar el trasplante, el cual ha sido aceptado por otros centros (29). Sin embargo, debe quedar claro que esta modalidad no constituye un estándar de cuidado, y por dicha razón debería limitarse a centros que tengan la posibilidad de realizar estudios clínicos que la evalúen a largo plazo (evidencia 2D; recomendación 2B).
En un estudio de la Universidad de Washington en San Luis, Missuri, en 202 pacientes con CHC evaluados para trasplante, 76 tenían tumores estadio III/IV, pero sin otras contraindicaciones para el trasplante. Estos pacientes recibieron un promedio de dos sesiones de TACE y 18 pacientes (23,7%) lograron reducción del estadio, suficiente para ser enlistados para trasplante dentro de los criterios de Milán. De estos, 17 (22,4%) recibieron un injerto cadavérico en promedio 5,8 +- 3,5 meses después del primer TACE. La sobrevida actuarial a cinco años de los pacientes con estadio 2 que recibieron quimoembolización y luego trasplante fue del 66%, comparada con 93,8% en pacientes estadio 3/4 que fueron downstaged y luego recibieron trasplante (p = 0,03) (29).
Estos resultados sugieren que dicha estrategia permite la selección de pacientes con un buen pronóstico a largo plazo y han sido reproducidos en UCSF utilizando TACE en pacientes por fuera de los criterios de Milán, pero dentro de los de UCSF con un mínimo periodo de observación de tres meses siguiendo la terapia tumoral. Se observó disminución del estadio en 43 de 61 pacientes (70,5%), y fallas terapéuticas en 18 (29,5%). De los 35 trasplantados, 13 tuvieron necrosis tumoral completa, 17 llenaron criterios estadio 2, y 5 estaban por fuera de este. La sobrevida promedio a dos y cuatro años postrasplante fue del 96,2% y 92,1%, respectivamente. No se observaron recurrencias en un tiempo promedio de seguimiento de 25 meses (29).
RESECCIÓN FRENTE A TRASPLANTE
Desde el punto de vista teórico, existe consenso en que el trasplante es la mejor modalidad de tratamiento para pacientes cirróticos con CHC dentro de los criterios de Milán y que no sean candidatos a resección, con una mortalidad perioperatoria y a un año del 3% y ≤ 10%, respectivamente (evidencia 2A;recomendación 1A); sin embargo, en la práctica existen muchas restricciones para realizarlo, como la carencia de órganos, tiempo en la lista de espera con riesgo de progresión y exclusión de la lista, estadio de la enfermedad, efectos adversos de la inmunosupresión y altos costos. Por esta razón, y ante la posibilidad de resecar la lesión para evitar progresión y con una mortalidad perioperatoria de 2-3% en cirróticos, muchos centros en el mundo ofrecen cirugía de resección anatómica a los pacientes con lesiones tempranas, estadio 1 dentro de los criterios de Milán, pacientes sin cirrosis o con función hepática preservada (bilirrubina normal con presión de cuña hepática ≤ 10 mmHg o recuento plaquetario ≥ 100.000) y aquellos con enfermedades sistémicas asociadas, que contraindican el trasplante, reservan este último para pacientes dentro de los criterios de Milán, pero con hipertensión portal significativa y bilirrubinas por arriba de 1,0 mg/dL (evidencia A; recomendación B).
Uno de los mayores problemas para seleccionar la modalidad quirúrgica es la falta de estudios clínicos adecuados, ya que es muy difícil realizar estudios aleatorizados y controlados en estos pacientes, y la mayoría de los estudios disponibles son retrospectivos con sus problemas inherentes o con intención de tratamiento (ITT).
Algunos estudios de esta última naturaleza han mostrado resultados como el de Facciuto et al., al estudiar a 179 pacientes con cirrosis que fueron llevados a resección o trasplante. Se excluyeron aquellos con cirrosis CTP estadio C, CHC incidental e invasión macrovascular, y quedaron 157 para el análisis. De estos, 51 pacientes fueron resecados y 106 fueron enlistados para trasplante, de los cuales 84 fueron trasplantados. La sobrevida promedio desde el momento de la resección o el enlistamiento fue similar en ambos grupos: sobrevida del 88% y 61% a uno y cuatro años para el grupo resecado frente a 92 y 62% para el trasplantado (p = 0,64). El tiempo promedio de espera en la lista de trasplante fue de siete meses; fue necesario excluir de la lista a 21 pacientes por progresión de la enfermedad.
Como se esperaba, la sobrevida fue peor en ambos grupos por fuera de los criterios de Milán (30). El grupo de Llovet et al., en 1999, realizó un estudio ITT en 164 pacientes, de los cuales 77 fueron resecados y 87 trasplantados. De los resecados, 74 fueron CTP A. La sobrevida a uno, tres y cinco años fue del 85, 62 y 51% para la resección y 84, 69 y 69% para los trasplantados, respectivamente. Al excluir del análisis a los pacientes con hipertensión portal significativa (presión de cuna hepática > 10 mm), la sobrevida a los cinco años posresección aumentó al 74%, lo cual indica que cuando se hace una selección adecuada, la resección provee una sobrevida similar a la del trasplante (22). Una de las desventajas de la resección es que la rata de recurrencia es muy alta y del 19, 67 y 83%, comparada con la del trasplante, que es del 4, 18 y 20%, a uno, cinco y diez años, respectivamente. Sin embargo, esta alta rata de recurrencia no disminuyó la sobrevida comparada con el trasplante, lo cual indica el efecto benéfico de las terapias ablativas en la sobrevida de los resecados y la letalidad de la recurrencia postrasplante.
Otra modalidad utilizada en el mundo es la resección seguida por trasplante (salvage transplantation), que es cada día más difícil de realizar por la carencia de donantes y las restricciones del MELD. Algunos centros han mostrado resultados alentadores si se llevan a trasplante solamente aquellos pacientes dentro de los criterios de Milán.
Adam et al. observaron una alta mortalidad intraoperatoria en pacientes trasplantados por recurrencia posresección, una sobrevida menor (41 frente a 61%; p = 0,03) y alta tasa de recurrencia. Fueron elegibles para trasplante 98 pacientes resecados, con recurrencia tumoral en 69 (70%), y solamente 17 pacientes (25%) de estos tuvieron recurrencia con posibilidad de trasplante (31).
Un estudio por Belghiti et al. no mostró peor sobrevida o mortalidad temprana para aquellos que fueron trasplantados posresección, comparados con los que fueron trasplantados como terapia inicial (32).
Un estudio con modelo de Markov evaluando el beneficio frente a daño inducido por el trasplante después de la resección mostró que la modalidad de trasplante inicial ofrece una mejor sobrevida a los cinco años (33). Otros estudios en Bologna y París han mostrado que la sobrevida a cinco años no difiere entre los dos grupos, pero los estudios fueron retrospectivos y con posibilidades de sesgo de selección (34). Se han encontrado algunos factores que predicen recurrencia por fuera de los criterios de Milán, incluyendo cirrosis, nódulos satélites, mala diferenciación, diámetro tumoral > 3 cm e invasión vascular.
Recientemente, en un estudio retrospectivo publicado en Hepatology en abril del 2013 y realizado en Milán y Nueva York con 132 pacientes, por Roayaie et al., pudieron demostrarse sobrevidas del 70% a cinco años en pacientes cirróticos con estadios tempranos dentro de los criterios de Milán tratados con resección. Sin embargo, aun en este grupo tan temprano y bien seleccionado se encontró una tasa de recurrencia tumoral a cinco años del 70%, con un tiempo promedio para la recurrencia de 31,6 meses (35,36).
EVALUACION DEL EXPLANTE
Aunque las imágenes diagnósticas tienen una sensibilidad y especificidad excelente en el diagnóstico del CHC, no es raro que al analizar el explante se demuestre que la lesión había sido clasificada erróneamente en un estadio más o menos avanzado que el observado en patología; este punto es esencial por sus implicaciones pronósticas. La invasión micro- o macrovascular y pobre diferenciación implican alta recurrencia postrasplante y necesidad de seguimiento frecuente y regímenes de inmunosupresión minimizados o especiales (inhibidores de mTOR). Así mismo, se han determinado subclases tumorales en las muestras de tumores, incluyendo la subclase Wnt, una clase proliferativa (con dos subclases: S1-TGF-β y S2-EpCAM positivo) y una clase con inflamación, que pueden identificarse en diferentes áreas del tumor en el 95% de los casos. De la misma forma, el perfil genético del tejido hepático adyacente al tumor puede definir dos subgrupos con buen y mal pronóstico. Se requieren estudios adicionales para evaluar la aplicabilidad de estos hallazgos (37).
PRONOSTICO A LARO PLAZO Y TERAPIAS COAYUVANTES
Como ya se dijo, el pronóstico es excelente con sobrevida a cinco años del 80-90% para pacientes resecados o trasplantados, y 70% con ablación (36); depende claramente de la selección adecuada de los pacientes. Los datos de sobrevida a diez años son escasos y requieren seguimiento utilizando el análisis ITT.
Para prevenir la recurrencia se han utilizado múltiples agentes, como la quimioterapia sistémica, tamoxifeno, inmunoterapia, terapia antiandrogénica y diferentes yerbas, cuyo uso no se ha demostrado ni se recomienda en la actualidad (evidencia 1-2A; recomendación 1A/B).
Los avances en biología molecular han identificado múltiples señales características del CHC que podrían ser el blanco perfecto para medicamentos y productos biológicos que los bloquean, como el factor de crecimiento vascular (VEGF) que regula la angiogénesis, y se puede bloquear con bevacizumab o con inhibidores de la quinasa de la tirosina, como sorafenib, sunitinib, brivanib, linifabib, vatalinib, cediranib; el factor de crecimiento del epidermo (EGF), con el cetuximab, el erlotinib, el gefitinib o el lapatinib, y otros que se encuentran en investigación (37).
Teniendo en cuenta las múltiples modalidades terapéuticas existentes, se aconseja presentar estos pacientes a una junta de decisiones conformada por cirujanos de trasplante, hepatólogos, oncólogos, radiólogos intervencionistas, patólogos y enfermeras de trasplante.
Para este artículo se han escogido el sistema del National Cancer Institute y el peso de la recomendación según el sistema GRADE para mostrar la evidencia de las recomendaciones basado en las guías de práctica clínica de EASL-EORTC.
RECOMENDACIONES FINALES
BCLC 0-A (CHC temprano)
1. Trasplante hepático en pacientes no quirúrgicos dentro de los criterios de Milán.
2. Resección anatómica o RFA en pacientes no cirróticos o cirróticos con función hepática preservada dentro de los criterios de Milán.
3. En centros donde el tiempo de espera en la lista es mayor a seis meses se acepta la terapia coadyuvante con RFA como un puente para trasplante (evidencia 2D; recomendación 2B) o el LDLT (evidencia 2A; recomendación 2B).
4. La extensión de los criterios de Milán a tumores de mayor tamaño (criterios UCSF) no es un procedimiento estándar y no se recomienda (evidencia 2B; recomendación 2B).
BCLC B y C (CHC intermedio y avanzado)
1. No candidatos a trasplante.
2. Aunque la disminución del estadio (downstaging) con terapias ablativas en pacientes por fuera de los criterios de Milán parece prometedora, aún no se considera un estándar de cuidado y solo se recomienda en centros con posibilidades de realizar estudios clínicos adecuados (evidencia 2D; recomendación 2C.)
3. No existe evidencia del efecto beneficioso de la quimioterapia, radioterapia o sorafenib, y otros biológicos en el manejo del CHC recurrente postrasplante.
REFERENCIAS
1. Iwatsuki S, Gordon RD, Shaw BW Jr, et al. Role of liver transplantation in cancer therapy. Ann Surg. 1985;202:401-7. [ Links ]
2. OGrady JG, Polson RJ, Rolles K, et al. Liver transplantation for malignant disease. Results in 93 consecutive patients. Ann Surg. 1988;207:373-9. [ Links ]
3. Olthoff KM, Millis JM, Rosove MH, et al. Is liver transplantation justified for the treatment of hepatic malignancies? Arch Surg. 1990;125:1261-6. [ Links ]
4. Onaca N, Davis GL, Jennings LW, et al. Improved results of transplantation for hepatocellular carcinoma: a report from the International Registry of Hepatic Tumors in Liver Transplantation. Liver Transpl. 2009;15:574-80. [ Links ]
5. Mazzaferro V, Regalia E, Doci R, et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med. 1996;334:693-9. [ Links ]
6. Shetty K, Timmins K, Brensinger C, et al. Liver transplantation for hepatocellular carcinoma validation of present selection criteria in predicting outcome. Liver Transpl. 2004;10:911-8. [ Links ]
7. Llovet JM, Bruix J, Fuster J, et al. Liver transplantation for small hepatocellular carcinoma: the tumor-node-metastasis classifica- tion does not have prognostic power. Hepatology. 1998;27:1572-7. [ Links ]
8. Yoo HY, Patt CH, Geschwind JF, et al. The outcome of liver transplantation in patients with hepatocellular carcinoma in the United States between 1988 and 2001: 5-year survival has im- proved significantly with time. J Clin Oncol. 2003;21:4329-35. [ Links ]
9. Freeman RB Jr, Edwards EB. Liver transplant waiting time does not correlate with waiting list mortality: implications for liver alloca- tion policy. Liver Transpl. 2000;6:543-52. [ Links ]
10. Organ Procurement and Transplantation Network. Organ procure- ment and transplantation network. Health Resources and Services Administration, HHS. Final rule. Fed Regist .1999;64:56650-61. [ Links ]
11. Wiesner RH, McDiarmid SV, Kamath PS, et al. MELD and PELD: application of survival models to liver allocation. Liver Transpl. 2001;7:567-80. [ Links ]
12. Wiesner R, Edwards E, Freeman R, et al. United Network for Organ Sharing Liver Disease Severity Score Committee. Model for end-stage liver disease (MELD) and allocation of donor livers. Gastroenterology. 2003;124:91-6. [ Links ]
13. Olthoff KM, Brown RS Jr, Delmonico FL, et al. Summary report of a national conference: Evolving concepts in liver allocation in the MELD and PELD era. Liver Transpl. 2004;10(Suppl 2):A6-A22. [ Links ]
14. Sharma P, Balan V, Hernández JL, et al. Liver transplantation for hepatocellular carcinoma: the MELD impact. Liver Transpl. 2004;10:36-41. [ Links ]
15. Freeman RB, Wiesner RH, Edwards E, et al. United Network for Organ Sharing Organ Procurement and Transplantation Network Liver and Transplantation Committee. Results of the first year of the new liver allocation plan. Liver Transpl. 2004;10:7-15. [ Links ]
16. Sharma P, Harper AM, Hernández JL, et al. Reduced priority MELD score for hepatocellular carcinoma does not adversely impact candidate survival awaiting liver transplantation. Am J Transplant. 2006;6:1957-62. [ Links ]
17. Wiesner RH, Freeman RB, Mulligan DC. Liver transplantation for hepatocellular cancer: the impact of the MELD allocation policy. Gastroenterology. 2004;127(5, Suppl 1):S261-7. [ Links ]
18. Duffy JP, Vardanian A, Benjamin E, et al. Liver transplantation criteria for hepatocellular carcinoma should be expanded: a 22- year experience with 467 patients at UCLA. Ann Surg. 2007;246:502-9. [ Links ]
19. Onaca N, Klintmalm GB. Liver transplantation for hepatocellular carcinoma: the Baylor experience. J Hepatobiliary Pancreat Sci. 2010;17:559-66. [ Links ]
20. Llovet JM. Updated treatmant approach to hepatocelular carcinoma. J Gastroenterol. 2005;40:225-35. [ Links ]
21. Sarasin FP, Majno PE, Llovet JM, et al. Living donor liver transplantation for early hepatocellular carci- noma: a life-expectancy and cost-effectiveness perspective. Hepatology. 2001;33:1073-9. [ Links ]
22. Llovet JM, Fuster J, Bruix J. Intention-to-treat analysis of surgical treatment for early hepatocellular carcinoma: resection versus transplantation. Hepatology. 1999;30:1434-40. [ Links ]
23. Pelletier SJ, Fu S, Thyagarajan V, et al. An intention-to-treat analysis of liver transplantation for hepatocellular carcinoma using organ procurement transplant network data. Liver Transpl. 2009;15:859-68. [ Links ]
24. Maddala YK, Stadheim L, Andrews JC, et al. Drop-out rates of patients with hepatocellular cancer listed for liver transplantation: outcome with chemoembolization. Liver Transpl. 2004;10:449-55. [ Links ]
25. Mazzaferro V, Battiston C, Perrone S, et al. Radiofrequency ablation of small hepatocellular carcinoma in cirrhotic patients awaiting liver transplantation: a prospective study. Ann Surg. 2004;240:900-9. [ Links ]
26. Yao FY, Kinkhabwala M, LaBerge JM, et al. The impact of pre- operative loco-regional therapy on outcome after liver transplan- tation for hepatocellular carcinoma. Am J Transplant. 2005;5:795-804. [ Links ]
27. Bharat A, Brown DB, Crippin JS, et al. Pre-liver transplantation locoregional adjuvant therapy for hepatocellular carcinoma as a strategy to improve longterm survival. J Am Coll Surg. 2006;203:411-20. [ Links ]
28. Yao FY, Ferrell L, Bass NM, et al. Liver transplantation for hepato- cellular carcinoma: expansion of the tumor size limits does not adversely impact survival. Hepatology. 2001;33:1394-403. [ Links ]
29. Majno PE, Adam R, Bismuth H, et al. Influence of preoperative transarterial lipiodol chemoembolization on resection and trans- plantation for hepatocellular carcinoma in patients with cirrhosis. Ann Surg. 1997;226:688-701. [ Links ]
30. Facciuto ME, Rochon C, Pandey M, et al. Surgical dilemma: liver resection or liver transplantation for hepatocellular carcinoma and cirrhosis. Intention-to-treat analysis in patients within and out- with Milan criteria. HPB (Oxford). 2009;11:398-404. [ Links ]
31. Adam R, Azoulay D, Castaing D, et al. Liver resection as a bridge to transplantation for hepatocellular carcinoma on cirrhosis: a rea- sonable strategy? Ann Surg. 2003;238:508-18. [ Links ]
32. Belghiti J, Cortes A, Abdalla EK, et al. Resection prior to liver transplantation for hepatocellular carcinoma. Ann Surg. 2003;238:885-92. [ Links ]
33. Cucchetti A, Vitale A, Gaudio MD, et al. Harm and benefits of primary liver resection and salvage transplantation for hepatocellular carcinoma. Am J Transplant. 2010;10:619-27. [ Links ]
34. Fuks D, Dokmak S, Paradis V, et al. Benefit of initial resection of hepatocellular carcinoma followed by transplantation in case of recurrence: an intention-to-treat analysis. Hepatology. 2012;55:132-40. [ Links ]
35. Roayaie S, Obeidat K, Sposito C, et al. Resection of hepatocellular cencers 2 cm: results from two west- ern centers. Hepatology. 2013;57:1426-35. [ Links ]
36. Earl TM, Chapman WC. Hepatocellular Carcinoma: Resection versus Tansplantation. Semin Liv Dis. 2013;33:282-93. [ Links ]
37. European Association for the Study of the Liver; European Organisation for Research and Treatment of Cancer. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol. 2012;56:908-43. [ Links ]