Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.29 no.1 Bogotá Jan./Mar. 2014
Farmacocinética, eficacia y seguridad de la formulación de mesalazina MMX en el tratamiento de la colitis ulcerosa
Joaquín Hinojosa, MD (1), Víctor Navas, MD (2), Cristina Saro, MD (3)
(1) Departamento de Enfermedades Digestivas, Hospital de Manises (Valencia), España.
(2) Departamento Médico, Shire Pharmaceuticals Ibérica (Madrid), España.
(3) Hospital de Cabueñes. Aparato Digestivo (Asturias), España.
Fecha recibido: 17-10-13 Fecha aceptado: 19-12-13
Resumen
La mesalazina-MMX® es una formulación gastrorresistente de 5 ASA con tecnología Multi-Matrix para lograr la administración retardada y prolongada de alta dosis de mesalazina por todo el colon. En los ensayos clínicos se ha demostrado la eficacia clínica y endoscópica, para inducir remisión. Con dosis de 2,4-4,8 g/día (2-4 comprimidos en dosis única diaria) se consigue una remisión clínica y endoscópica del 29,2% al 41,2% tras 8 semanas de tratamiento, frente al placebo (12,9% y el 22,2%, respectivamente). Esta formulación ha demostrado eficacia similar al tratamiento tópico en la inducción de remisión en colitis izquierda (remisión clínica del 60% tras 8 semanas con mesalazina-MMX frente al 50% con tratamiento tópico). Aunque las tasas de remisión en el tratamiento de inducción son similares a las obtenidas con mesalazina convencional, los ensayos con mesalazina-MMX utilizan criterios más rigurosos (mejoría endoscópica). El 88,9% de los pacientes tratados con 2,4 g/día en dosis única no recidivaron tras 12 meses. El perfil de seguridad es similar al de las mesalazinas estándar. La formulación MMX es un tratamiento prometedor para pacientes con CU, por los datos de eficacia y la comodidad posológica que puede mejorar el cumplimiento terapéutico.
Palabras clave
Colitis ulcerosa, mesalazina, inducción de la remisión, cumplimiento del tratamiento, endoscopia digestiva.
INTRODUCCIÓN
La colitis ulcerosa (CU) es una enfermedad inflamatoria crónica del colon y el recto. Se caracteriza por una inflamación superficial difusa de la mucosa del colon, que suele comenzar por encima del margen anal y extenderse en sentido proximal de forma continua (1, 2). Las lesiones se localizan con mayor frecuencia en el recto, el colon sigmoide y el colon izquierdo, aunque también puede verse afectada la totalidad del colon (3). No se conoce la etiología subyacente, aunque se han implicado factores tanto genéticos como ambientales (3).
La forma de presentación más frecuente (60%-80% de los casos nuevos) es proctitis, proctosigmoiditis o colitis izquierda (1). Los síntomas clásicos comprenden rectorragia y diarrea, a menudo acompañadas de otros síntomas como dolor abdominal o tenesmo (2). La evolución de la CU se caracteriza por remisiones y recidivas. En un período de un año, el 50% de los pacientes con CU presentan recidivas (1). Además, la actividad de la enfermedad persiste durante mucho tiempo en los pacientes con CU extensa, y esta evolución prolongada es un factor de riesgo de padecer cáncer de colon (1), (aumento del riesgo 0,5%-1% por año en la CU de duración superior a 8-10 años) (2). Esto explica la importancia crucial del tratamiento de mantenimiento una vez alcanzada la remisión de la enfermedad.
La incidencia de CU oscila entre 0,5-24,5 casos por 100 000 individuos al año en todo el mundo (1). Aunque esta incidencia es mayor en países desarrollados de Europa y América del Norte, (2-12 nuevos diagnósticos por 100 000 sujetos al año) (2, 3), estudios recientes indican un aumento progresivo, paralelo a la industrialización, en Europa oriental, Latinoamérica y Asia (1). Se calcula que la prevalencia es de 70-200 casos por 100.000 en Estados Unidos (2). Hay entre 250 000-500 000 personas con CU, y se calcula que la asistencia de estos pacientes asciende a los 192 millones de dólares estadounidenses al año en hospitalización y 138 millones de dólares al año en medicación (4).
Siguiendo las guías de práctica clínica (5), el tratamiento farmacológico de elección de primera línea para el brote de CU leve-moderada, y el mantenimiento de la remisión de la enfermedad es mesalazina (ácido 5-aminosalicílico, 5-ASA) o sus derivados, utilizados generalmente como profármacos (1). Estos tratamientos se administran por vía oral o tópica, o en combinación, y su eficacia está claramente demostrada (2, 6, 7).
Dado que la enfermedad afecta solo al intestino grueso, y teniendo en cuenta el efecto local, se han desarrollado formulaciones para administración rectal, junto con diferentes preparados orales diseñados para evitar la absorción gástrica e ileal y lograr así que el fármaco alcance el colon en mayores cantidades (8-10). En el tratamiento a largo plazo, las presentaciones rectales o las dosis múltiples de las formulaciones orales pueden plantear dificultades para el cumplimiento. Estas circunstancias y la influencia de otros factores (edad del paciente, nivel socioeconómico, etc.) (11) pueden tener consecuencias negativas para el control de la enfermedad (14).
FARMACOCINÉTICA DE MESALAZINA-MMX
Existe una formulación oral de mesalazina basada en la tecnología multimatriz (MMX®, marca registrada de Cosmo Technologies Ltd., Wicklow, Irlanda y MMX Multi Matrix System®, marca registrada de Cosmo S.p.A., Milán, Italia), para lograr una liberación retardada y prolongada del fármaco, lo que permite la administración de una dosis elevada una vez al día (2-4 comprimidos, 1,2 g/comprimido) (3).
La mesalazina-MMX fue autorizada para el tratamiento de la remisión de la CU por la Food and Drug Administration (FDA) de Estados Unidos en enero de 2007 con el nombre de Lialda® (marca registrada de Giuliani International Ltd., Dublín, Irlanda). En la mayoría de los países europeos se comercializa con el nombre de Mezavant® (1) (marca registrada de Giuliani International Ltd., Dublín, Irlanda) y está indicado para inducir la remisión de la CU y en el tratamiento de mantenimiento. La Agencia Española de Medicamentos y Productos Sanitarios española (AEMPS) declaró este producto como una innovación galénica de interés terapéutico en febrero de 2009 (12).
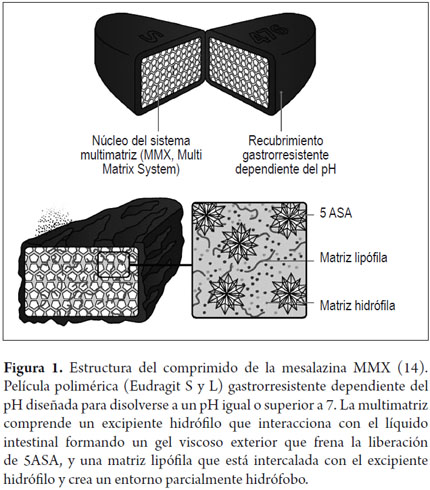
La mesalazina-MMX se presenta en un comprimido con cubierta gastrorresistente con una película que contiene dos polímeros (Eudagrit S y L). En el interior hay un sistema matricial polimérico doble que contiene el micropartículas del fármaco inmersas en la matriz lipófila que entremezclada con la matriz hidrófila retrasa y prolonga la disolución.
La película se desintegra solo a pH ≥7, que habitualmente se encuentra en el íleon terminal (13) (figura 1). A medida que se desintegra el recubrimiento, la matriz hidrófila interacciona con el contenido digestivo, absorbe agua y se hincha, formando una masa gelatinosa-viscosa. Así se retrasa la difusión del fármaco contenido en el núcleo hasta el espacio luminal del colon. La matriz lipófila retrasa la penetración del líquido intestinal en el núcleo del comprimido, lo que prolonga la liberación del fármaco (1). De esta forma, y en comparación con otros preparados orales, la mesalazina se libera de forma lenta y gradual, y se distribuye uniformemente por todo el colon (3, 4).
La hipótesis de esta liberación del medicamento en todo el colon está respaldada por diferentes estudios in vitro e in vivo. Tenjarla y cols. (14) utilizaron un modelo in vitro del aparato digestivo que simula las condiciones fisiológicas del tubo digestivo humano en ayunas y tras la ingesta de alimentos. La liberación del fármaco anterior al colon (en el estómago y el intestino delgado simulados) fue inferior al 1%, mientras que en el colon simulado alcanzó el 78,0% en condiciones posprandiales y el 68,5% en ayunas. Se liberaron cantidades considerables del fármaco durante un período de 8-18 horas (49,6 mg/h en condiciones posprandiales y 40,7 mg/h en ayunas). En estudios de tránsito y liberación de 5-ASA en el aparato digestivo en voluntarios sanos empleando técnicas gammagráficas, Brunner y cols. (15) observaron que la erosión del comprimido comenzaba tras permanecer 6,9±1,1h en el colon ascendente o transverso y que el marcador radiactivo se extendía homogéneamente por todo el colon hasta su porción distal. La absorción media fue del 19,9% en el intestino delgado y el íleon, y del 80,1% en el colon. Las concentraciones máximas de 5-ASA en sangre se registraron después de 8-12 horas, coincidiendo con el tránsito a través del colon transverso y descendente. En otro estudio utilizando también técnicas gammagráficas en voluntarios sanos, Brunner y cols. (16) evaluaron el tránsito gastrointestinal y el lugar de liberación de 5-ASA con formulaciones en gránulos y comprimidos (Salofalk®). Con ambas formulaciones el tiempo hasta alcanzar la válvula ileocecal fue más corto, y las concentraciones máximas de 5-ASA en sangre se registraron transcurridas entre 3-4 horas, coincidiendo con el paso del fármaco por esta región; es decir, mucho antes que en el estudio de mesalazina-MMX. Se ha comparado la mesalazina-MMX con la formulación Asacol® de liberación retardada dependiente del pH, utilizando el marcado radiactivo. Se demostró que la desintegración del comprimido, medida por el marcador, comenzaba después de un promedio de 4,75 horas con mesalazina-MMX y de 6,16 horas con Asacol®. Sin embargo, la desintegración completa se registró transcurridas 17,37 y 7,27 horas, respectivamente (17-19). Estos resultados indican que la mesalazina-MMX libera 5-ASA de forma retardada a lo largo del colon, mientras que el preparado de liberación lenta dependiente del pH libera el fármaco principalmente en el colon ascendente.
Los estudios farmacocinéticos realizados en voluntarios sanos con dosis múltiples de mesalazina-MMX de 2,4 y 4,8 g administradas con comida indican que la absorción total de la dosis administrada se sitúa en torno al 24% (20); es decir, la formulación ejerce un efecto básicamente local.
EFICACIA Y SEGURIDAD EN LA INDUCCIÓN DE LA REMISIÓN
Se han realizado varios ensayos clínicos para evaluar la eficacia y la seguridad de mesalazina-MMX (tabla 1).
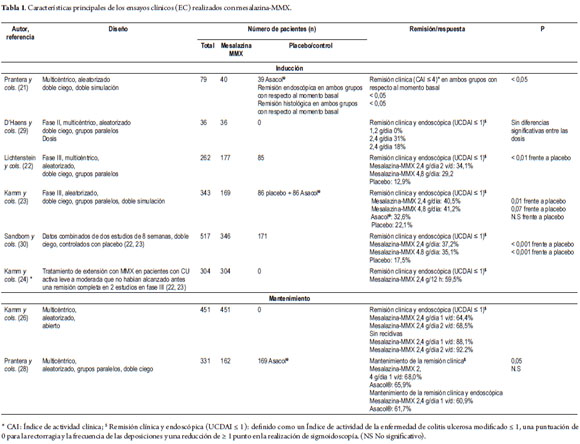
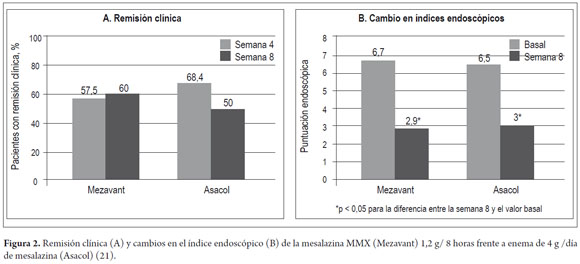
Prantera y cols. (21) publicaron los resultados de un estudio aleatorizado, doble ciego, con doble simulación, realizado en 79 pacientes con CU izquierda de actividad leve-moderada (índice de actividad clínica, CAI≥6), en el que se comparó mesalazina-MMX 1,2 g tres veces al día (más un enema de placebo) con un enema que de 4 g de 5-ASA (más un comprimido de placebo), durante 8 semanas. Se excluyeron pacientes con proctitis (<15 cm de extensión). El criterio de valoración principal fue la remisión clínica (puntuación CAI ≤4) a las 4 semanas. El porcentaje de remisión clínica fue similar con ambos tratamientos: 57,5% frente a 68,4% después de cuatro semanas y 60,0% versus 50,0% después de 8 semanas, con mesalazina-MMX en comparación con el enema de 5-ASA, respectivamente (figura 2). Ambos tratamientos disminuyeron significativamente la puntuación CAI tras cuatro semanas (-4,3 y -3,9 puntos) y 8 semanas (-5,7 y -4,9 puntos) (tabla 1). A las 8 semanas se observó remisión endoscópica en el 45,0% de los pacientes tratados con mesalazina-MMX, frente al 36,8% de los tratados con los enemas. Ambos grupos mostraron mejorías estadísticamente significativas en el índice endoscópico (IE ≤2) (figura 2). En este estudio, la tasa de remisión histológica fue del 15,0% en el grupo tratado con mesalazina-MMX, frente al 8% en el grupo de tratamiento con los enemas. El cumplimiento terapéutico fue del 97,0% y del 87,5%, respectivamente. La mesalazina-MMX fue bien tolerada. No se produjeron acontecimientos adversos graves ni inesperados. Se registró al menos un acontecimiento adverso en el 15,0% de los pacientes tratados con mesalazina-MMX y en el 28,0% de los tratados con enemas. Hubo un solo caso de suspensión del tratamiento debido a acontecimientos adversos, concretamente en el grupo tratado con enemas.
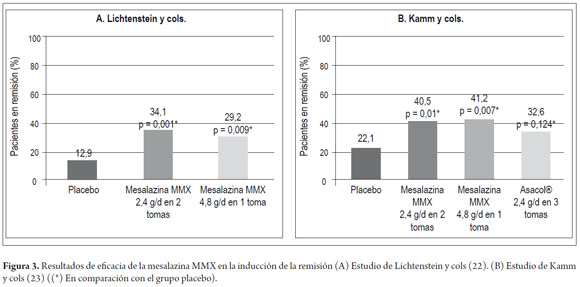
Se han publicado dos estudios en fase III de mesalazina-MMX, multicéntricos, aleatorizados, de grupos paralelos, doble ciego, con doble simulación, con una duración de 8 semanas, en los que se evaluó la remisión clínica y endoscópica. En el primero (22), controlado con placebo y de grupos paralelos, se incluyeron 280 pacientes con CU leve-moderada tratados con mesalazina-MMX 2,4 g/día administrados bien 1,2 g dos veces al día (n=93) o 4,8 g/día en una dosis única (n=94), o bien con placebo (n=93), durante 8 semanas. El objetivo principal fue el porcentaje de pacientes con remisión clínica y endoscópica. Para definirlo se utilizó un estricto índice: una puntuación UC-DAI modificada ≤1, con una puntuación de 0 para la rectorragia y la frecuencia de las deposiciones, y al menos una reducción de 1 punto con respecto al valor basal en la puntuación de sigmoidoscopia. Los pacientes con cualquier grado de friabilidad de la mucosa recibieron una puntuación sigmoidoscópica ≥2, por lo que se consideró que no habían alcanzado el criterio de valoración principal. La remisión se alcanzó con una frecuencia significativamente mayor (p <0,01) en los pacientes tratados con mesalazina-MMX 1,2 g dos veces al día o 4,8 g/día en dosis única diaria que en el grupo de placebo (tabla 1, figura 3). Ambas dosis de mesalazina-MMX fueron, en general, bien toleradas, sin que se observaran diferencias clínicamente significativas en la seguridad en comparación con el placebo. Se produjeron 223 acontecimientos adversos en 129 pacientes; la mayoría de ellos de intensidad leve-moderada. Solo 7 pacientes experimentaron un total de 8 acontecimientos adversos graves.
El otro estudio (23), con doble simulación y controlado con placebo y con producto activo como comparador (mesalazina de liberación retardada sin tecnología MMX: Asacol®), incluyó 343 pacientes con CU leve-moderada. Las dosis de mesalazina-MMX estudiadas fueron 2,4 g/día (n=86) o 4,8 g/día ambas en dosis única (n=85), mientras que Asacol® se administró en tres dosis diarias de 0,8 g (2,4 g/día), n=86. Se utilizó un grupo control con placebo (n=86). El tratamiento se mantuvo 8 semanas. Igual que en el estudio anterior, el objetivo principal fue evaluar la remisión clínica y endoscópica. El 22,1% de los pacientes con placebo alcanzaron la remisión frente a los porcentajes significativamente mayores obtenido con mesalazina-MMX 2,4 g/día (40,5%; OR 2,4; p=0,01) y 4,8 g/día (41,2%; OR 2,5; p=0,007) (figura 3). Todos los tratamientos activos fueron bien tolerados, sin que se observaran diferencias entre grupos. Un total de 72 pacientes experimentaron 115 acontecimientos adversos durante el estudio y 5 sufrieron un total de 8 acontecimientos adversos graves. Solo cuatro pacientes abandonaron el estudio debido a acontecimientos adversos (dos de ellos del grupo de placebo, uno del grupo de 2,4 g y 1 del grupo de Asacol®) (23).
En un análisis agrupado de los dos estudios en fase III, los acontecimientos adversos graves fueron más frecuentes con placebo (6,1%) que con 2,4 g o 4,8g de mesalazina-MMX (1,1% y 2,2%, respectivamente) (3). En ambos, los acontecimientos adversos más frecuentes observados con el principio activo fueron cefalea y flatulencia (3).
A pesar de la eficacia del tratamiento (tabla 1), debe destacarse que muchos pacientes con CU no alcanzan la remisión tras 8 semanas de tratamiento con mesalazina y a menudo reciben corticosteroides o inmunodepresores. Kamm y cols. (24) realizaron un estudio de extensión multicéntrico y abierto, al que incorporaron a los pacientes de los dos ensayos en fase III antes mencionados que no habían alcanzado la remisión tras 8 semanas de tratamiento con mesalazina-MMX 2,4 g o 4,8 g/día, Asacol® 2,4 g/día o placebo. Todos recibieron el mismo tratamiento, 2,4 g/12 horas, durante otras 8 semanas, a modo de extensión. El objetivo principal fue la remisión clínica y endoscópica, definida de la misma forma que en los estudios originales. El 59,5% de los 304 pacientes con CU leve-moderada incluidos en el estudio alcanzaron la remisión completa después del período de tratamiento adicional, este porcentaje no difirió en función del tratamiento anterior (formulaciones de mesalazina o placebo). La mesalazina-MMX fue bien tolerada, observándose 156 acontecimientos adversos en 72/312 pacientes (23,1%) (60 acontecimientos adversos relacionados con el tratamiento en 27/312 pacientes [8,7%]; 9 acontecimientos adversos graves, uno considerado como relacionado con el tratamiento [pancreatitis]).
Sandborn y cols. (25) presentaron los resultados de la fase de extensión aguda del estudio evaluando el tiempo hasta la desaparición de los síntomas, definido como: primer día sin hemorragia rectal y con normalización de la frecuencia de las deposiciones. Alcanzaron la remisión de los síntomas 181/ 304 pacientes incluidos en la población de eficacia de la fase de extensión. La mediana del tiempo hasta la resolución de los síntomas fue de 15 días.
Por lo tanto, los ensayos clínicos que tuvieron un importante rigor metodológico y que incluyeron criterios de valoración tanto clínicos como endoscópicos, confirman la eficacia y seguridad de mesalazina-MMX durante 8 semanas como tratamiento para la inducción de la remisión en los brotes de la CU. Los datos del estudio de extensión abierto indican que el tratamiento continuo puede ser útil para inducir la respuesta en los pacientes que no alcanzan la remisión en el periodo de tratamiento inicial.
EFICACIA Y SEGURIDAD EN EL TRATAMIENTO DE MANTENIMIENTO
El tratamiento de mantenimiento con mesalazina-MMX en la colitis leve-moderada se ha investigado en un ensayo multicéntrico, aleatorizado y abierto, en él participaron 459 pacientes con remisión estrictamente definida, según criterios clínicos y endoscópicos (como se ha descrito), después de haber presentado una exacerbación leve-moderada de la CU (30). Todos ellos procedían de uno de los dos estudios aleatorizados de tratamiento agudo durante 8 semanas (n=246), o del estudio de extensión de 8 semanas adicionales con mesalazina-MMX 4,8 g/día (n=213). Los pacientes fueron aleatorizados para recibir tratamiento de mantenimiento durante 12 meses con mesalazina-MMX 2,4 g/día en dosis única (dos comprimidos de 1,2 g) o en dos tomas (un comprimido de 1,2 g dos veces al día). El criterio de valoración principal fue la seguridad y la tolerabilidad, evaluadas a partir de los acontecimientos adversos y del tiempo hasta la retirada.
El tratamiento fue en general bien tolerado. Un total de 174 de los 459 pacientes (37,9%) presentaron 384 acontecimientos adversos, la mayoría de los cuales fueron de intensidad leve-moderada. Se produjeron 22 acontecimientos adversos graves (10 con la dosis única diaria y 12 con las dos dosis diarias) en 18 pacientes (3,9%). La mayoría de estos acontecimientos consistieron en problemas digestivos (9 pacientes). 76 acontecimientos adversos en 47 pacientes (10,2%) se consideraron relacionados con el tratamiento, sin diferencias importantes entre los grupos. Se produjo la suspensión del tratamiento por acontecimientos adversos en 21 pacientes (11 [4,9%] tratados con una dosis diaria y 10 [4,3%] con dos dosis diarias); no se observaron diferencias entre los grupos en cuanto al tiempo hasta la suspensión del tratamiento. A pesar del período de tratamiento prolongado, el cumplimiento fue muy bueno: un total de 442 pacientes (96,3%) consumieron el 80% o más de la medicación prescrita, sin diferencias significativas entre las dos pautas posológicas (30).
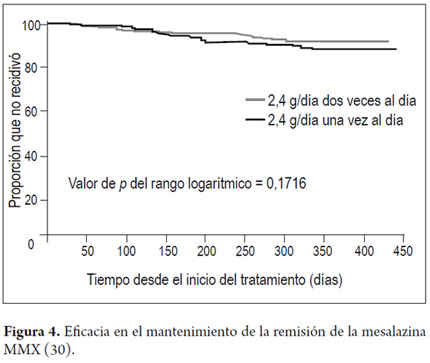
La eficacia del tratamiento de mantenimiento, que fue un criterio de valoración secundario de este ensayo, también resultó muy positiva (población para el análisis de la eficacia, n=451) (30). Después de 12 meses, el 64,4% de los pacientes tratados con una dosis diaria (2,4 g/día) y el 68,5% con dos dosis diarias (1,2 g/12h) presentaron remisión clínica y endoscópica. A su vez, el 88,9% y el 93,2% de los sujetos de cada uno de estos grupos no se habían retirado debido a recidiva, lo que se definió como la ausencia de necesidad de aumentar la dosis de mesalazina-MMX o de administrar otros tratamientos, incluida la cirugía (figura 4). Hanauer y cols. (31) llevaron a cabo un análisis conjunto de los datos relativos a la inducción y el mantenimiento de la remisión en los pacientes de los dos ensayos en fase III aleatorizados y controlados con placebo y del mencionado estudio de mantenimiento tratados con mesalazina-MMX en dosis de 2,4 g o 4,8 g diarios (excluidos los pacientes tratados con placebo o con una formulación sin MMX en los estudios aleatorizados y controlados con placebo en fase III). La recidiva durante el mantenimiento se definió igualmente como la necesidad de medicación alternativa o intervención quirúrgica debido a una exacerbación de la CU. En conjunto, el 63,6% (220/346) de los pacientes alcanzaron la remisión después de 8 o 16 semanas de tratamiento. De estos 220 pacientes, 218 se incorporaron al tratamiento de mantenimiento durante 12 meses, y al término del estudio no se habían retirado debido a recidiva el 89,9% de ellos (196/218). En conjunto, el 56,6% de los pacientes con CU leve-moderada (196/346) que comenzaron un tratamiento con mesalazina-MMX alcanzaron la remisión completa (tanto clínica como endoscópica) sin necesidad de medicación adicional, remisión que se mantuvo durante 12 meses sin exacerbaciones que precisaran tratamiento alternativo. El perfil de acontecimientos adversos con todas las dosis utilizadas fue similar al observado en los grupos de placebo de los estudios originales.
Hay pocos datos comparativos directos de mesalazina-MMX con otras formulaciones de 5-ASA en referencia al tratamiento de mantenimiento. Prantera y cols. (32) han publicado un estudio multicéntrico, aleatorizado, doble ciego, de grupos paralelos, en 331 pacientes con CU izquierda en tratamiento de mantenimiento durante 12 meses con mesalazina-MMX 2,4 g/día en una dosis única, o Asacol® 2,4 g/día en dos tomas. Todos los pacientes llevaban en remisión durante al menos un mes antes del ensayo y habían sufrido ≤1 recidiva en el año previo. La evaluación de la eficacia se basó en el mantenimiento de la remisión clínica, y de la remisión clínica y endoscópica. Los pacientes recibieron diarios para que anotasen los síntomas específicos de la enfermedad, basándose en los dos primeros apartados de la escala UC-DAI (frecuencia de las deposiciones y rectorragia). Los dos tratamientos se toleraron de forma similar, y no hubo diferencias significativas en lo que respecta a la remisión clínica (68,0% con mesalazina-MMX frente al 65,9% con Asacol®) o a la remisión clínica y endoscópica (60,9% frente al 61,7%). El mantenimiento de la remisión también se evaluó a partir de los diarios de los pacientes, tomando como criterio un empeoramiento de la frecuencia de las deposiciones y el aumento de la rectorragia (puntuación ≥2, con una puntuación ≥1 para la rectorragia, durante un mínimo de 2 semanas). Después de 12 meses se registró remisión en el 62,2% de los pacientes tratados con mesalazina-MMX, en comparación con el 51,5% de los tratados con Asacol® (p=0,053).
Por tanto, aunque no existen datos claros que apoyen la superioridad de una formulación de 5-ASA con respecto a otra, la mesalazina-MMX representa un avance importante en el tratamiento de la CU con 5 ASA. El conjunto de datos existente indica que el uso de estos comprimidos de gran concentración, con liberación prolongada en todo el colon (incluida la porción distal) permite un tratamiento más cómodo, con menos comprimidos y dosis única diaria, lo que favorece su cumplimiento terapéutico, tanto en la remisión de la fase aguda como en el mantenimiento.
CONCLUSIÓN
La mesalazina-MMX es una formulación gastrorresistente, de liberación retardada y prolongada de 5-ASA, que permite la distribución homogénea del fármaco por todo el colon, gracias a su recubrimiento gastrorresistente y la doble matriz. Ensayos clínicos de sólido diseño metodológico con evaluación tanto clínica como endoscópica han demostrado la eficacia y la seguridad de la mesalazina-MMX para lograr la remisión en pacientes con CU leve-moderada. Uno de los estudios señaló que su eficacia puede ser similar a la del tratamiento tópico para la inducción de la remisión en la colitis izquierda. Su papel en el tratamiento de la proctitis no ha sido definido. Además, los datos obtenidos han demostrado un perfil aceptable de seguridad y eficacia como tratamiento de mantenimiento para la prevención de nuevas exacerbaciones de la enfermedad. Los datos de eficacia, y su administración única diaria, tanto en el tratamiento para remisión como en el de mantenimiento, hacen de la mesalazina-MMX una opción farmacológica prometedora en la colitis ulcerosa.
REFERENCIAS
1. Schreiber S, Kamm MA, Lichtenstein GR. Mesalamine with MMX technology for the treatment of ulcerative colitis. Expert Rev Gastroenterol Hepatol. 2008;2(3):299-314. [ Links ]
2. Hu MY, Peppercorn MA. MMX mesalamine: a novel high-dose, once-daily 5-aminosalicylate formulation for the treatment of ulcerative colitis. Expert Opin Pharmacother. 2008;9(6):1049-58. [ Links ]
3. McCormack, P.L., D.M. Robinson, C.M. Perry. Delayed-release Multi Matrix System (MMX) mesalazine: in ulcerative colitis. Drugs. 2007;67(17):2635-42. [ Links ]
4. Kale-Pradhan, P.B., R.S. Pradhan, S.M. Wilhelm. Multi-Matrix System Mesalamine: To Use or Not To Use. Ann Pharmacother. 2008;42(2):265-269. [ Links ]
5. Dignass, A., Lindsay J.O., Sturm A., Windsor A., Colombel J.F. Allez M. et al. Second European evidence-based Consensus on the diagnosis and management of ulcerative colitis: Current management. J Crohns Colitis. 2012;6(10):991-1030. [ Links ]
6. Marshall, J.K., M. Thabane, A.H. Steinhart, J.R. Newman, A. Anand, E.J. Irvine.Rectal 5-aminosalicylic acid for induction of remission in ulcerative colitis. Cochrane Database Syst Rev. 2010(1):CD004115. [ Links ]
7. Sutherland, L.J.K. Macdonald.Oral 5-aminosalicylic acid for induction of remission in ulcerative colitis. Cochrane Database Syst Rev. 2006(2):CD000543. [ Links ]
8. Desreumaux, P.S. Ghosh.Review article: mode of action and delivery of 5-aminosalicylic acid - new evidence. Aliment Pharmacol Ther. 2006;24 Suppl1: 2-9. [ Links ]
9. Ng, S.C.M.A. Kamm.Review article: new drug formulations, chemical entities and therapeutic approaches for the management of ulcerative colitis. Aliment Pharmacol Ther. 2008;28(7):815-29. [ Links ]
10. Sandborn, W.J.Oral 5-ASA therapy in ulcerative colitis: what are the implications of the new formulations? J Clin Gastroenterol. 2008;42(4):338-44. [ Links ]
11. Shale, M.J.S.A. Riley.Studies of compliance with delayed-release mesalazine therapy in patients with inflammatory bowel disease. Aliment Pharmacol Ther. 2003;18(2):191-8. [ Links ]
12. Declaración de innovacion galénica de interés terapéutico, Agencia Española de Medicamentos y Productos Sanitarios, Editor. 2009: (Archivado por Shire Pharmaceuticals Ibérica). [ Links ]
13. Baker, D.E.MMX mesalamine. Rev Gastroenterol Disord. 2006;6(3):146-52. [ Links ]
14. Tenjarla, S., V. Romasanta, E. Zeijdner, R. Villa, L. Moro.Release of 5-aminosalicylate from an MMX mesalamine tablet during transit through a simulated gastrointestinal tract system. Adv Ther. 2007;24(4):826-40. [ Links ]
15. Brunner, M., R. Assandri, K. Kletter, M. Tschurlovits, M.E. Corrado, R. Villa, et al. Gastrointestinal transit and 5-ASA release from a new mesalazine extended-release formulation. Aliment Pharmacol Ther. 2003;17(3):395-402. [ Links ]
16. Brunner, M., R. Greinwald, K. Kletter, H. Kvaternik, M.E. Corrado, H.G. Eichler, et al. Gastrointestinal transit and release of 5-aminosalicylic acid from 153Sm-labelled mesalazine pellets vs. tablets in male healthy volunteers. Aliment Pharmacol Ther. 2003;17(9):1163-9. [ Links ]
17. Wray, H., R. Joseph, M. Palmen, D. Pierce. MMXTM Mesalamine and delayed-release mesalamine: A pharmacokinetic and scintigraphic comparison. in Canadian Digestive Diseases Week. 2009. Banff, Alberta, Canada. [ Links ]
18. Wray, H., R. Joseph, M. Palmen, D. Pierce.Combined pharmacokinetic and scintigraphic analyses for the comparison of 5-ASA release profiles from MMX mesalamine and another delayed-release mesalamine formulation. Inflammatory Bowel Diseases. 2008;14(S3):S19-S20 (Abstract P-0030). [ Links ]
19. Wray, H, R. Joseph, M. Palmen, D. Pierce.A pharmacokinetic and scintigraphic comparison of MMXTM mesalamine and delayed-release mesalamine. Am J Gastroenterol. 2008;103(s1): S433-S434 (abstract). [ Links ]
20. Prospecto: Informacion para el usuario. 2008 [consultada: 2011]; Disponible en: https://sinaem4.agemed.es/consaem/especialidad.do?metodo=verFichaWordPdf&codigo=70144&formato=pdf&formulario=PROSPECTOS. [ Links ]
21. Prantera, C., A. Viscido, L. Biancone, A. Francavilla, L. Giglio, M. Campieri.A new oral delivery system for 5-ASA: preliminary clinical findings for MMx. Inflamm Bowel Dis. 2005;11(5):421-7. [ Links ]
22. Lichtenstein, G.R., M.A. Kamm, P. Boddu, N. Gubergrits, A. Lyne, T. Butler, et al. Effect of once- or twice-daily MMX mesalamine (SPD476) for the induction of remission of mild to moderately active ulcerative colitis. Clin Gastroenterol Hepatol. 2007;5(1):95-102. [ Links ]
23. Kamm, M.A., W.J. Sandborn, M. Gassull, S. Schreiber, L. Jackowski, T. Butler, et al. Once-daily, high-concentration MMX mesalamine in active ulcerative colitis. Gastroenterology. 2007;132(1):66-75;quiz 432-3. [ Links ]
24. Kamm, M.A., G.R. Lichtenstein, W.J. Sandborn, S. Schreiber, K. Lees, K. Barrett, et al. Effect of extended MMX mesalamine therapy for acute, mild-to-moderate ulcerative colitis. Inflamm Bowel Dis. 2009;15(1):1-8. [ Links ]
25. Sandborn, W., M. Kamm, G. Lichtenstein, M. Sumner, R. Joseph. MMX mesalamine therapy for the induction of remission beyond 8 weeks: how long before symptoms resolution?. Am J Gastroenterol. 2008;103(s1):S435 (abstract). [ Links ]
26. Kamm, M.A., G.R. Lichtenstein, W.J. Sandborn, S. Schreiber, K. Lees, K. Barrett, et al. Randomised trial of once- or twice-daily MMX mesalazine for maintenance of remission in ulcerative colitis. Gut. 2008;57(7):893-902. [ Links ]
27. Hanauer, S.B., G.R. Lichtenstein, M.A. Kamm, W.J. Sandborn, K. Lees, K. Barrett, et al. MMX Mesalamine for Induction and Maintenance Therapy in Mild-to-Moderate Ulcerative Colitis. Gastroenterol Hepatol. 2009;5(7):494-500. [ Links ]
28. Prantera, C., A. Kohn, M. Campieri, R. Caprilli, M. Cottone, F. Pallone, et al. Clinical trial: ulcerative colitis maintenance treatment with 5-ASA: a 1-year, randomized multicentre study comparing MMX with Asacol. Aliment Pharmacol Ther. 2009;30(9): 908-18. [ Links ]
29. D'Haens, G., D. Hommes, L. Engels, F. Baert, L. Van Der Waaij, P. Connor, et al. Once daily MMX mesalazine for the treatment of mild-to-moderate ulcerative colitis: a phase II, dose-ranging study. Alimentary Pharmacology & Therapeutics. 2006;24(7): 1087-1097. [ Links ]
30. Sandborn, W.J., M.A. Kamm, G.R. Lichtenstein, A. Lyne, T. Butler, R.E. Joseph.MMX Multi Matrix System® mesalazine for the induction of remission in patients with mild-to-moderate ulcerative colitis: a combined analysis of two randomized, double-blind, placebo-controlled trials. Alimentary Pharmacology & Therapeutics. 2007;26(2):205-215. [ Links ]











 text in
text in