Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.29 no.1 Bogotá Jan./Mar. 2014
Tumor GIST grande en estómago: hallazgo incidental posterior a laparotomía. Presentación de un caso y revisión de la literatura
Mauricio Melo Peñaloza, MD (1), Dolly Williamson (2), Lady Vargas (2)
(1) Internista Gastroenterólogo Universidad Nacional. Coordinador Medicina del Adulto, Facultad de Medicina de la Universidad Cooperativa de Villavicencio. Villavicencio, Colombia.
(2) Estudiante Medicina del adulto, Facultad de Medicina de la Universidad Cooperativa de Villavicencio. Villavicencio, Colombia.
Fecha recibido: 30-04-13 Fecha aceptado: 19-12-13
Resumen
Los tumores del estroma gastrointestinal (GIST) son las neoplasias mesenquimales más frecuentes del tubo digestivo. La frecuencia de GIST en países desarrollados se estima entre 6,5 a 14,5 casos por millón anualmente. La mayoría de ellos se originan en estómago (50% a 70%). La sintomatología de los pacientes varía desde síntomas abdominales inespecíficos hasta la presencia de dolor abdominal con o sin masa palpable. Una parte de estos pacientes son diagnosticados de forma incidental al ser sometidos a endoscopia de tamizaje o para diagnóstico de sangrado digestivo alto. Presentamos un caso de GIST que se presentó como sangrado digestivo alto luego de laparotomía por colecistectomía.
Palabras clave
GIST, tumor estromal gastrointestinal, sangrado digestivo, hallazgo incidental.
INTRODUCCIÓN
Se entiende como tumores GIST a las neoplasias provenientes del estroma mesenquimal gastrointestinal. Su origen parece ser una célula totipotencial, que también da origen a las células intersticiales de Cajal (célula marcapaso gastrointestinal del plexo de Auerbach, que mediante la función neural autonómica que les corresponde activan la función muscular lisa) y su diferenciación es hacia grupos celulares que no expresan marcadores de musculo liso como la desmina y las actinas. Del total de las neoplasias gástricas, representan del 1% al 2%, aproximadamente 30% de estas lesiones pueden tener potencial maligno (2, 6, 33, 35).
Este término se utilizó por vez primera en 1983 por Mazur y Clark, lo emplearon para designar tumores no epiteliales del tubo digestivo, que carecían de rasgos ultra estructurales de músculo liso junto con el hallazgo no esperado de marcadores neurales, detectados por técnicas de inmunohistoquímica que están muy relacionados con la célula intersticial de Cajal. Propusieron el término de tumor estromal' modificado posteriormente a tumores del estroma gastrointestinal (3, 4, 5, 18, 19, 20, 27).
En 1998, Hirota y cols describieron que para el desarrollo normal de la célula intersticial de Cajal era necesaria la presencia del protooncogén c-KIT, un receptor tirosina-cinasa III. El genoma humano contiene aproximadamente 90 receptores tirosina-cinasa (TK) y 43 genes asociados a ellas, cuyos productos regulan la proliferación celular, la supervivencia, la diferenciación, la función y la motilidad. El gen c-Kit está localizado en el cromosoma 4 y codifica para un receptor transmembranal de TK tipo III llamado también KIT (antígeno CD 117), expresado por las células intersticiales de Cajal (CIC). Más del 90% de los GIST y las CIC expresan el receptor KIT(c-kit).
Para su identificación histológica se utiliza el concepto morfológico y la tinción con inmunohistoquímica. En relación a lo primero, macroscópicamente son estructuras que van de unos pocos milímetros hasta varios centímetros (hay tumores de 30 cm o más); son lesiones difusas, encapsuladas o multinodulares, fibrosos al corte con áreas de hemorragia, degeneración quística y necrosis central. Habitualmente son tumores intramurales, usualmente comprometen la submucosa y la muscular propia. Microscópicamente pueden ser tipo células fusiformes en 70% de los casos, epitelioides en un 20%, y el resto es del tipo mixto. Un pequeño porcentaje, menor a 5%, tiene un marcado polimorfismo nuclear (12, 34).
Para la determinación inmunohistoquímica se utilizan varios anticuerpos tanto mono como policlonales que son capaces de detectar el epítopo CD117 localizado en dominio externo de la oncoproteína; el más usado es el pAb A4502 (DakoCytomation) (9-12).
Los tumores GIST más comunes son gástricos (60%-70%), le siguen los del intestino delgado (20%-25%) y colon (5%). Aproximadamente 20 por ciento de estos tumores son asintomáticos, pequeño y descubiertos de manera incidental. Se presentan más frecuentemente entre los 50 y 80 años de edad y no hay diferencia entre hombres y mujeres en cuanto a la incidencia (1, 14).
CASO CLÍNICO
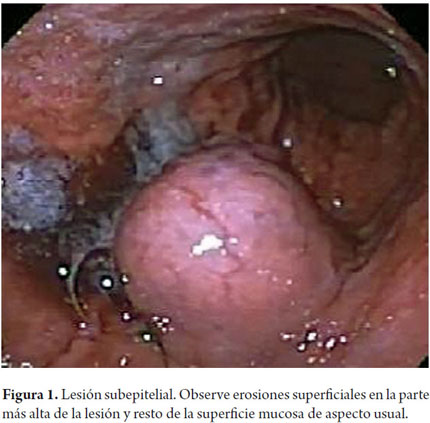
Mujer de 57 años de edad quien ingresó al servicio de urgencias del hospital departamental de Villavicencio, Meta, el día 16 de octubre del 2012. Presentó antecedente de colecistectomía, realizada el 6 de octubre del 2012 y cuadro clínico de nauseas, distensión abdominal, fiebre, edema, calor, rubor y secreción purulenta a nivel de la herida quirúrgica. Fue valorada por cirugía general, donde se determinó el uso de antibióticos. Al segundo día se trasladó a sala de cirugía, donde se realizó laparotomía a drenaje de hemoperitoneo abscedado. El día siguiente la paciente presentó vómito en pozos de café; al tercer día de hospitalización, la paciente presentó deposiciones diarreicas, melénicas y dolor en el hemiabdomen superior, motivo por el cual se le ordenó endoscopia. Durante el examen se observó en la mucosa fundo corporal, en el tercio proximal, a 6 cm de la unión y en la pared posterior, una masa de aspecto subepitelial de 6 cm de diámetro compatible con GIST. El hallazgo presentaba áreas erosionadas en su superficie y estigmas de sangrado reciente no activo (figura 1).
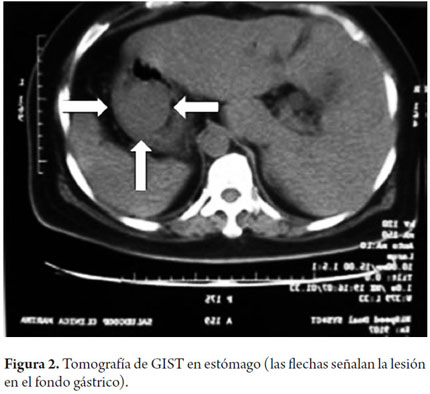
Se practicó TAC de abdomen que mostró la lesión en la ubicación descrita por la endoscopia (figura 2). La paciente fue llevada a cirugía. Se encontró masa tumoral en la parte posterior, hacia el fundus. Se realizó resección de la lesión con márgenes amplios y se envió el material a patología.
El espécimen estudiado en patología mostró como hallazgos macroscópicos: superficie lisa brillante, pardo clara que pesó 42g; midió 8x4x2 cm. La superficie externa dejaba ver la trama vascular; al corte, de color blanquecino con áreas hemorrágicas, sobre uno de sus bordes contenido friable de color pardo oscuro.
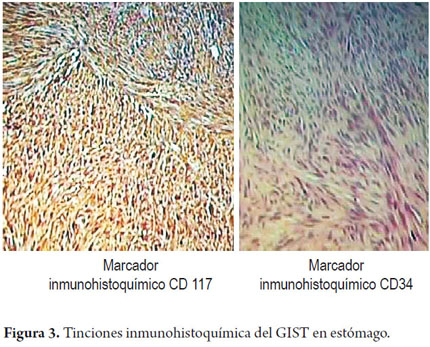
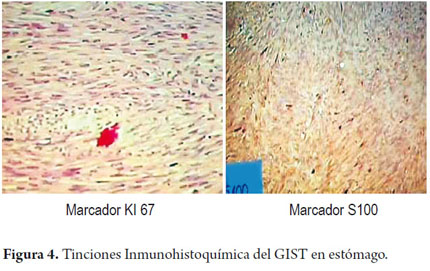
Los hallazgos microscópicos mostraron: en los cortes 1 a 3; 4 áreas con contenido friable, conteo mitótico 1 por 50 campos de alto poder, epiplón, fragmento de 12x5x1 cm con áreas congestivas libres de tumor. Los estudios imunohistoquímicos mostraron positividad en la población tumoral con el CD117, S100, CD34 focal con la actina de musculo liso. El índice de proliferación celular fue elevado, con el k167 en 1%.No hubo descripción clara de los bordes de la lesión (figura 3 y 4).
Se le dio alta a la paciente y se inició tratamiento con imatinib 400 mg/día VO. Tres meses después se realizó ecoendoscopia de control; muestra a nivel del cardias, lesión hipoecoica, homogénea, de 12,6x6,9 mm de diámetro mayor, dependiente de la cuarta ecocapa (muscular propia), compatible con (GIST). Actualmente la paciente está bajo seguimiento y en tratamiento con imatinib 400 mg/día, muestra respuesta favorable al tratamiento. En abril 05 de 2013 se solicitó nueva ecoendoscopia con biopsia de la lesión fúndica.
DISCUSIÓN
El comportamiento biológico de estos tumores es usualmente poco predecible, se dificulta catalogarlos. El recuento mitótico y el tamaño tumoral son los principales factores morfológicos pronósticos relacionados con la progresión de la enfermedad, por lo cual se recomienda hablar de grupo pronostico o de riesgo en lugar de lesión benigna o maligna.
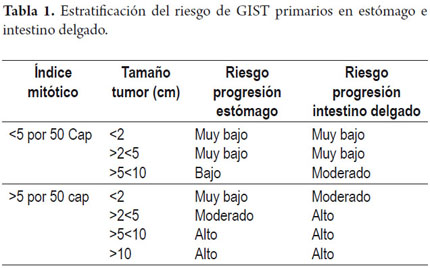
En nuestro caso se consideró la clasificación Fletcher 2002 (15, 16, 23, 29, 36), que fue modificada en 2006, basada en estudios de Miettienen y Lasota (40). Esta clasificación se divide en dos categorías de acuerdo al índice mitótico, y siete de acuerdo al tamaño del tumor. Dependiendo de estos factores se estima el riesgo de progresión de los tumores GIST de estómago. A mayor número de mitosis y a mayor tamaño del tumor el riesgo progresión del tumor es mayor (tabla 1).
En nuestro caso el conteo mitótico correspondió a 1 en 50 campos de alto poder y un tamaño de 8x4x2 cm, que lo ubica en riesgo de progresión bajo.
También se ha propuesto el uso de positividad Ki67 para determinar el curso probable de un caso en particular; ya que más del 10% de núcleos positivos para esta tinción son indicadores de desarrollo de metástasis. En el caso que nos ocupa, el índice Ki67 fue del 1% (23, 24, 29).
Las lesiones sub epiteliales son un hallazgo relativamente frecuente en la endoscopia alta, con una incidencia estimada del 0,3%; incluyen lipomas, estructuras vasculares, quistes, remanentes pancreáticos y estructuras extramurales. Una de cada cinco lesiones subepiteliales es neoplasia (como es el caso de los GIST). El diagnóstico con biopsia es bajo (17%), aun si estas son pinzas de gran capacidad. El procedimiento de elección para el diagnóstico de los tumores submucosos es el ultrasonido endoscópico, ya que puede diferenciar entre lesiones propias de la pared gastrointestinal o compresiones extrínsecas, además puede determinar la capa de origen, tamaño y presencia de adenopatías con una sensibilidad entre el 64% y 80% (28, 38).
La ulceración de la mucosa es de ocurrencia común en los GIST gástricos. Sobreviene tanto en casos benignos como malignos, aunque la ulceración no tiene un valor predictivo sí puede estar relacionada con el tamaño del tumor. En nuestro caso clínico, la manifestación que obligó a la evaluación endoscópica fue el sangrado y la presencia de erosiones superficiales múltiples en un tumor de 8 cm de diámetro; por tal motivo se presentó asociación entre el tamaño y el sangrado (23, 24).
El tratamiento de estas neoplasias en la actualidad continúa siendo quirúrgico y consiste idealmente en la resección completa, respetar su seudocápsula y evitar la ruptura del tumor, con márgenes microscópicos de la resección libres del tumor. Se ha descrito la importancia de establecer si el margen quirúrgico es negativo o positivo para lesión tumoral, puesto que este dato en asociación con el tamaño y presencia o no de sangrado puede ayudar a establecer el pronóstico del GIST y su respuesta al imatinib (7, 22, 27, 39). En nuestro caso el tamaño fue alrededor de 8 cm y presento sangrado, sin embargo en patología no quedo claramente establecido el resultado de los bordes de sección.
En general la supervivencia en cinco años oscila entre 28% y 35% para los tumores parcialmente resecados. En el caso de tumores GIST localmente avanzados se indica la terapia neoadyuvante con inhibidores de tirosina-cinasa debido a la posibilidad de invasión a estructuras vecinas. Una vez se obtiene la máxima respuesta de la enfermedad (de 6 a 12 meses) se reevalúa al paciente para determinar nuevamente la posibilidad de resección quirúrgica (22, 30, 37, 41).
El uso del imatinib fármaco compite con el ATP en la fijación del dominio de la tirosina-cinasa e inhibe la activación y fosforilación del mismo, así retrasando el crecimiento tumoral.
La primera descripción de un tratamiento con imatinib (2001) se refiere a una mujer con un tumor metastásico recidivante en progresión a pesar de cirugía y tratamiento quimioterápico. En los dos primeros meses de tratamiento hubo una reducción tumoral del 50% y a los 18 meses era del 78%; a las 4 semanas en una tomografía de emisión de positrones (PET) se observó una disminución de la captación de glucosa significativa. El desarrollo de imatinib en relación al tratamiento de estos tumores, a partir de este caso, es de las más rápidas en la historia de los tratamientos en oncológica.
La duración del tratamiento aún se desconoce; en algunos artículos se recomienda que debe ser de por vida (17, 21). Los principales efectos adversos encontrados con el uso del imatinib son: edema periorbitario (74%), nauseas (52%), diarrea (45%), mialgia y dolor reumático (40%), cefalea (26%); sin embargo, solo el 7% de las veces los efectos adversos interrumpieron el tratamiento (31).
En un estudio sobre 106 casos se estableció que el uso de imatinib es exitoso cuando el GIST es completamente resecado. Sin embargo está por demostrarse su utilidad en GIST de alto riesgo (8, 13, 25, 26, 30, 32). La guía de práctica clínica de la National Comprehensive Cáncer Network (NCCN) sugiere luego de la cirugía el uso de imatinib durante al menos 36 meses en pacientes de GIST de alto riesgo. Es decir, tumor de >5 cm de tamaño e índice mitótico alto (>5 mitosis/50 campos) (41).
CONCLUSIONES
1. Se presentó un caso de GIST de estómago, localización que es la más frecuente.
2. La paciente presento sintomatología luego de un postoperatorio complicado de colecistectomía.
3. El síntoma dominante de este caso de GIST fue el sangrado, lo que se ha asociado a mayor tamaño del tumor y menor respuesta terapéutica.
4. Los márgenes no están reportados en la patología, por lo que el caso requerirá seguimiento con el objeto de establecer una evolución hacia la diseminación de la neoplasia, como se ha descrito en la literatura para resecciones parciales con márgenes positivos.
5. Se administró Mesilato de Imatinib, medicamento que ha demostrado utilidad en enfermedad metastásica, lo que podría eventualmente mejorar el pronóstico a largo plazo de este caso, ya que por patología, clasificación fletcher y presencia de sangrado presenta riesgo intermedio.
6. En el seguimiento por eco endoscopia se encontró una segunda lesión más pequeña lo podría representar evolución metastásica a corto plazo.
REFERENCIAS
1. Eisenberg BL, Pipas JM. Gastrointestinal stromal tumor--background, pathology, treatment. Hematol Oncol Clin North Am. 2012;26(6):1239-59. [ Links ]
2. Gómez M. Paciente con lesión gástrica subepitelial. Rev Col Gastroenterol. 2010;25 (4)371-378. [ Links ]
3. Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol. 1983;7(6):507-19. [ Links ]
4. Hirota S, Isozaki K, Moriyama Y, Hashimoto K, Nishida T, Ishiguro S, et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 1998;279(5350):577-80. [ Links ]
5. Romero A, Mesa O, Melo M, Chinchilla S. Tumor del estroma gastrointestinal gástrico con metástasis inusual al cráneo. Rev Col Gastroenterol. 2011; 26: 311-315. [ Links ]
6. Barreda BF, Liu BH, Sánchez L, Landeo A, Sánchez Rodríguez Z. Survival factors in 152 patients with gastrointestinal stromal tumors. Rev Gastroenterol Peru. 2010;30(4):305-23. [ Links ]
7. Toro J, Vasquez l, Madrid J. Tumores del estroma gastrointestinal (GIST): papel del cirujano en la era de la medicina molecular.Abr,26-2010,Facultad de Medicina Universidad de Antioquia iatreia@medicina.udea.edu.co [ Links ]
8. Krause DS, Van Etten RA. Tyrosine kinases as targets for cancer therapy. N Engl J Med. 2005;353(2):172-87. [ Links ]
9. Hewavisenthi SDS, De Silva M. Gastrointestinal stromal tumours (GIST) revisited. Journal of Diagnostic Pathology [Internet]. 21 de abril de 2011 [citado 26 de febrero de 2014];3(1). Recuperado a partir de: http://www.sljol.info/index.php/JDP/article/view/2988. [ Links ]
10. Fresno M, Determinación inmunohistoquímica del CD 117 /c-kit en el GIST, Oncología, 2004; 27 (4):242-245. [ Links ]
11. Bohórquez P, Neveu R. Tumores del estroma gastrointestinal (GIST), un particular tipo de neoplasia. Rev Méd Chile. 2008;136:921-929. [ Links ]
12. Corless CL, Fletcher JA, Heinrich MC. Biology of gastrointestinal stromal tumors. J Clin Oncol. 15 de septiembre de 2004;22(18):3813-25. [ Links ]
13. Vargas C, Cardona A, Carranza H, Otero J, Reveiz L, Ospina E, et al. Tumores del estroma Gastrointestinal, experiencia en dos instituciones hospitalarias de Bogotá D.C. Colombia. Rev Col Gastroenterol. 2008;23(3)213-223. [ Links ]
14. Oliveros R, Quintero A, Sánchez R, Mesa J. Tumores estromales gastrointestinales (GIST) en el Instituto Nacional de Cancerología, Bogotá D.C., Colombia 2000-2008. Rev Col Cancerol 2011;15(4):202-211. [ Links ]
15. Gómez G, Lombo M, Peñaloza F. Tumores estromales gástricos (GIST) malignos. Presentación de dos casos. Rev Col Gastroenterol. 2004;19(2):137-142. [ Links ]
16. Fletcher CDM, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol. 2002;33(5):459-65. [ Links ]
17. Buchdunger E, O'Reilly T, Wood J. Pharmacology of imatinib (STI571). Eur J Cancer. 2002;38 Suppl 5:S28-36. [ Links ]
18. Saund MS, Demetri GD, Ashley SW. Gastrointestinal stromal tumors (GISTs). Curr Opin Gastroenterol. 2004;20(2):89-94. [ Links ]
19. Miettinen M, Lasota J. Gastrointestinal stromal tumors (GISTs): definition, occurrence, pathology, differential diagnosis and molecular genetics. Pol J Pathol. 2003;54(1):3-24. [ Links ]
20. Kindblom LG, Remotti HE, Aldenborg F, Meis-Kindblom JM. Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol. 1998;152(5):1259-69. [ Links ]
21. Joensuu H, Roberts PJ, Sarlomo-Rikala M, Andersson LC, Tervahartiala P, Tuveson D, et al. Effect of the tyrosine kinase inhibitor STI571 in a patient with a metastatic gastrointestinal stromal tumor. N Engl J Med. 2001;344(14):1052-6. [ Links ]
22. McCarter MD, Antonescu CR, Ballman KV, Maki RG, Pisters PWT, Demetri GD, et al. Microscopically positive margins for primary gastrointestinal stromal tumors: analysis of risk factors and tumor recurrence. J Am Coll Surg. 2012;215(1):53-59. [ Links ]
23. DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg. 2000;231(1):51-8. [ Links ]
24. Miettinen M, El-Rifai W, H L Sobin L, Lasota J. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Hum Pathol. 2002;33(5):478-83. [ Links ]
25. Blair SL, Al-Refaie WB, Wang-Rodriguez J, Behling C, Ali M-W, Moossa AR. Gastrointestinal stromal tumors express ras oncogene: a potential role for diagnosis and treatment. Arch Surg. 2005;140(6):543-548. [ Links ]
26. Gutierrez JC, De Oliveira LOP, Perez EA, Rocha-Lima C, Livingstone AS, Koniaris LG. Optimizing diagnosis, staging, and management of gastrointestinal stromal tumors. J Am Coll Surg. 2007;205(3):479-491. [ Links ]
27. Jeong IH, Kim JH, Lee SR, Kim JH, Hwang JC, Shin SJ, et al. Minimally invasive treatment of gastric gastrointestinal stromal tumors: laparoscopic and endoscopic approach. Surg Laparosc Endosc Percutan Tech. 2012;22(3):244-50. [ Links ]
28. Kim MN, Kang SJ, Kim SG, Im JP, Kim JS, Jung HC, et al. Prediction of risk of malignancy of gastrointestinal stromal tumors by endoscopic ultrasonography. Gut Liver. 2013;7(6):642-7. [ Links ]
29. Eizaguirre Zarza B, Burgos Bretones JJ. Tumores GIST. Revisión de la literatura. Revista Española de Patología. 2006;39(4):209-18. [ Links ]
30. Joensuu H, Fletcher C, Dimitrijevic S, Silberman S, Roberts P, Demetri G. Management of malignant gastrointestinal stromal tumours. Lancet Oncol. 2002;3(11):655-64. [ Links ]
31. Poveda A, Artigas V, Casado A, Cervera J, García Del Muro X, Antonio López-Guerrero J, et al. Clinical practice guidelines in gastrointestinal stromal tumours (GEIS): update 2008. Cir Esp. 2008;84 Suppl 1:1-21. [ Links ]
32. Pennacchioli E, Colombo C, Berselli M, Gronchi A. Update on management of GIST and postsurgical use of imatinib. Open Access Surgery. 2010;2010:63-71. [ Links ]
33. Moraila FA. Tumores del estroma gastrointestinal, definición, generalidades y epidemiología. Cirujano General. 2008;30(Suplemento 1):5-10. [ Links ]
34. Koh JS, Trent J, Chen L, El-Naggar A, Hunt K, Pollock R, et al. Gastrointestinal stromal tumors: overview of pathologic features, molecular biology, and therapy with imatinib mesylate. Histol Histopathol. 2004;19(2):565-74. [ Links ]
35. Muñoz C, Sabah S, Navarro A, Planzer M, Silva C, Santander R. Tumores del estroma gastrointestinal (GIST): Revisión de la literatura. Gastr Latinoam. 2006; 17(1): 43-51. [ Links ]
36. Soto G. S, del Pozo L. M, Kuschel H. C, Schultz H. E, Banse E. C. Tumores estromales del tubo digestivo (GIST): A propósito de un caso clínico. Cuadernos de Cirugía. 2003;17(1):37-42. [ Links ]
37. Acín-Gándara D, Pereira-Pérez F, Castaño-Pascual Á, Durán-Poveda M, Antequera-Pérez A, Miliani-Molina C. Tumores estromales gastrointestinales: diagnóstico y tratamiento. Cir Cir. 2012;80:44-51. [ Links ]
38. Cañadas R, Galiano M, Gil Enfoque epidemiológico, clínico y endoscópico. En Oliveros R, ed. Temas Escogidos en gastroenterología. GIST 2013. Asociación Colombiana de gastroenterología, 2013, cap 1 pág 19-34. [ Links ]
39. Andrade R, Panqueva R, Palau M. Diagnóstico patológico y metodologías accesorias. En Oliveros R, ed. Temas Escogidos en gastroenterología. GIST 2013. Asociación Colombiana de gastroenterología. 2013,cap 2, pg 37-60. [ Links ]
40. Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med. 2006;130(10):1466-78. [ Links ]
41. Von Mehren M, Benjamin RS, Bui MM, Casper ES, Conrad EU 3rd, DeLaney TF, et al. Soft tissue sarcoma, version 2.2012: featured updates to the NCCN guidelines. J Natl Compr Canc Netw. 2012;10(8):951-60. [ Links ]











 text in
text in