Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.29 no.1 Bogotá Jan./Mar. 2014
Enfermedad hepática grasa. Aspectos patológicos
Rocío del Pilar López Panqueva, MD. (1)
(1) Médica Patóloga, Hospital Universitario. Fundación Santa Fe de Bogotá. Universidad de Los Andes. Bogotá, Colombia.
Fecha recibido: 11-02-14 Fecha aceptado: 21-02-14
Resumen
En el hígado humano normal aproximadamente un 5% de su masa está compuesta por lípidos. Cuando tenemos aumento del depósito de grasa el término más utilizado es el de hígado graso o esteatosis e incluye el hígado graso no alcohólico (HGNA) y el hígado graso de etiología alcohólica (HGA), siendo aún la biopsia hepática considerada como el patrón de oro para determinar la severidad del daño hepático en cualquiera de estas entidades.
Palabras clave
Esteatosis, esteatohepatitis, esteatohepatitis no alcohólica, EHNA, esteatohepatitis alcohólica, EHA, biopsia hepática.
INTRODUCCIÓN
Numerosos estudios del siglo XX mostraron la asociación bien documentada entre esteatosis, cirrosis, obesidad, diabetes y alcohol; pero solo hasta 1980 Ludwig et al, publicaron un estudio de la Mayo Clinic donde se establecía la naturaleza no-alcohólica de cambios hepáticos de esteatosis y esteatohepatitis acuñando el término NASH ("Non-alcoholic steatohepatitis" [en español, EHNA]) (1, 2).
Desde esas primeras publicaciones hasta la actualidad, el hígado graso se ha convertido en una enfermedad hepática cada vez más común, especialmente por el incremento en la prevalencia del síndrome metabólico (obesidad, hipertensión arterial, dislipidemia, microalbuminuria y diabetes mellitus tipo II) en la población general, siendo en la actualidad el Hígado graso No Alcohólico (HGNA) una de las patologías más prevalentes a nivel mundial.
Estas entidades se acompaña de un espectro de cambios patológicos que van desde una simple esteatosis o esteatosis acompañada de inflamación con o sin fibrosis importante o esteatohepatitis, evolucionando a una hepatopatía crónica avanzada que evoluciona hasta cirrosis, insuficiencia hepática y aumento del riesgo de Hepatocarcinoma (HCC). Aproximadamente un 30% de los pacientes que tienen como único hallazgo inicial esteatosis progresan a cirrosis, de estos, 10% desarrollarán HCC y del 30% al 40% desarrollan falla hepática o mueren a consecuencia de su enfermedad de base en un periodo de 10 años (3).
En pacientes con factores de riesgo para HGNA, especialmente obesidad y diabetes tipo 2 se ha observado la presencia de esteatosis en un 50%-70%, de los cuales un 20%-30% evolucionan a esteatohepatitis y entre 2%-3% a cirrosis. Igualmente, se ha reportado la ocurrencia de cirrosis entre 5%-15%, con una mortalidad general que oscila entre el 12%-36% y mortalidad relacionada con enfermedad hepática de un 2%-7%, significativamente mayor que en la población general. Estos cambios morfológicos pueden ser idénticos tanto en la etiología alcohólica como no alcohólica (2, 4, 5).
No existen aún métodos diagnósticos clínicos, de laboratorio o de imágenes, que puedan establecer con toda certeza la diferencia entre esteatosis simple y esteatohepatitis, así como determinar el grado de actividad inflamatoria, la fibrosis y evaluar la existencia o no de otros procesos patológicos coexistentes, es ahí donde el rol de la biopsia hepática toma su importancia en esta entidad.
DEFINICIÓN
La enfermedad hepática grasa se ha dividido tradicionalmente en alcohólica y no alcohólica, con apariencia tanto macro como microscópica muy similar; sin embargo, la clínica y su fisiopatología son diferentes.
Se define HGNA como la acumulación de grasa hepática que excede en más de 5%-10% su peso, siendo indispensable descartar el consumo importante de alcohol (menos de 20 g/día para mujeres y menos de 40 g/día para los hombres). Esto se correlaciona directamente con la presencia de vacuolas grasas en el citoplasma de los hepatocitos.
Representa un espectro de cambios desde el rango de la esteatosis como único hallazgo la cual puede tener muy leve o ninguna inflamación, entidad conocida como hígado graso no alcohólico (HGNA); su evolución es benigna y el riesgo de cronicidad con progresión a cirrosis es de menos del 5% de los casos. La esteatohepatitis (EHNA) esteatosis e inflamación de variable intensidad, acompañada siempre de lesión hepatocelular (balonización y/o fibrosis pericelular), con progresión a enfermedad crónica y cirrosis en un 21%-28%, e insuficiencia hepática y hepatocarcinoma, con una mortalidad asociada de un 12% (6, 7).
Más de la mitad de los pacientes con cirrosis criptogénica han tenido anteriormente diagnóstico de EHNA o cambios histológicos que sugieren HGNA y hasta el 13% de ellos están asociados a Hepatocarcinoma (3).
FACTORES DE RIESGO
Muchas condiciones están asociadas con el fenotipo histológico del HGNA, pero la gran mayoría de los pacientes vistos en la práctica clínica tienen síndrome metabólico, siendo la resistencia a la insulina (RI) el sello más importante del síndrome metabólico; en efecto, el vínculo común de todas las etiologías asociadas con el HGNA. El síndrome metabólico está presente en el 22%-30% de la población e incrementa el riesgo de morbilidad y mortalidad cardiovascular, así como la progresión a fibrosis en la esteatohepatitis no alcohólica (EHNA). el 90% de los pacientes con EHNA tienen síndrome metabólico. Entre el 70%-80% de las personas con un índice de masa corporal >30 Kg/m2 tiene esteatosis hepática (8-10).
Existen otras muchas causas de hígado graso consideradas como secundarias, el tamaño de la vacuola puede ayudar a la búsqueda del factor etiológico; por ejemplo, la vacuola grande se observa en la pérdida rápida de peso y la malnutrición y se asocia a Hepatitis C, enfermedades metabólicas genéticas como la enfermedad de Wilson, tirosinemia y Abetalipoproteinemia, otras condiciones como lipodistrofia congénita o la adquirida por infección con VIH, grandes resecciones intestinales, gastroplastia y bypass yeyunoileal. La esteatosis de vacuola pequeña en el síndrome de Reye, el hígado agudo graso del embarazo, síndrome de HELLP, errores del metabolismo como deficiencia de Lecitina Colesterol Acil Transferasa, enfermedad de Wolman y la enfermedad por depósito de ésteres de colesterol (10, 11).
La esteatosis hepática y esteatohepatitis también se han relacionado con medicamentos. Por ejemplo, el 1%-3% de los pacientes con uso prolongado de Amiodarona la presentan. El maleato de perhexilina (Pexid) y el dietilaminoetoxihexestrol (Coralgil), muy usados en Europa y Japón, la desarrollan; así mismo bloqueadores de los canales del calcio como nifedipina. El tamoxifeno, isoniacida, estrógenos, glucocorticoides, dietilestilbestrol y los esteroides muestran una cuestionable asociación etiológica, pero está demostrada la exacerbación del EHNA con su uso, especialmente en pacientes con factores de riesgo. El Metrotrexato también es bien conocido como causante de esteatosis, fibrosis y eventualmente cirrosis, igualmente se sugiere que su uso aumenta la esteatosis (12-14). Posteriormente ampliaremos los hallazgos observados en el parénquima hepático y secundarios a toxicidad medicamentosa.
Los factores predictores de la gravedad y mayor probabilidad de progresión son la edad mayor de 45 años, relación AST/ALT mayor de 1,0, obesidad, diabetes mellitus tipo 2, hipoalbuminemia, hipertensión arterial y la presencia de fibrosis hepática (15).
¿CUÁL ES EL PAPEL DE LA BIOPSIA HEPÁTICA?
La enfermedad hepática grasa ha sido identificada como la etiología más frecuente en pacientes con elevación no explicada de las aminotransferasas, la biopsia hepática puede además revelar en cerca del 30% de los casos otra patología acompañante. Por lo cual la biopsia hepática sigue siendo el estándar o patrón de oro para confirmar el diagnóstico de EHGNA, su espectro clinicopatológico, y en muchos casos, le permite al clínico establecer un tratamiento adecuado. Biopsias repetidas son usadas en la evaluación o monitoreo de la respuesta al tratamiento, muy especialmente en el contexto de estudios de investigación o en el uso de nuevas terapeúticas.
Cuándo hacerla continúa siendo una pregunta que conlleva mucha controversia. Especialmente por considerarse una prueba invasiva, costosa, con morbilidad y potenciales riesgos vitales. Por lo tanto, esta debe ser totalmente individualizada y tener en cuenta especialmente los factores de riesgo que establecen progresión, las imágenes diagnósticas; por lo que el objetivo primordial de la biopsia debe ser establecer un diagnóstico de esteatohepatitis (HGNA versus EHNA), así como determinar el grado de actividad inflamatoria, el estadio o fibrosis y finalmente evaluar procesos coexistentes o, cuando existe, una probable etiología dual; en la hepatopatía ahcohólica estas últimas se encuentran hasta en el 20% de los casos (16, 17).
HALLAZGOS HISTOPATOLÓGICOS
Nos centraremos en los cambios morfológicos necesarios para establecer este diagnóstico y recordemos que tanto en la etiología alcohólica como no alcohólica los criterios histológicos de su compromiso hepático pueden ser indistinguibles. El diagnóstico de HGNA está basado en 2 criterios importantes, el primero es establecer la presencia de hígado graso o de esteatohepatitis y la segunda determinar la naturaleza no alcohólica de la enfermedad.
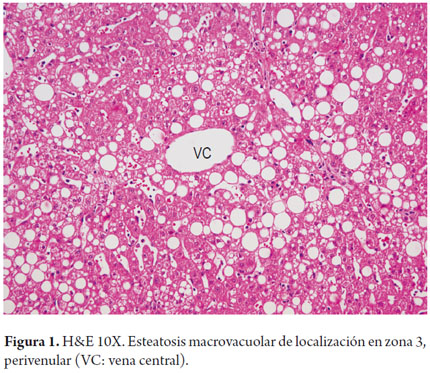
El espectro morfológico, la severidad y extensión de cada uno de los criterios a evaluar varían caso a caso. En fases tempranas las alteraciones se concentran en la zona 3 o región centrolobulillar, según progrese se extiende por el acino, destruye la arquitectura normal hasta llegar a la cirrosis.
Los principales hallazgos están dados por esteatosis, inflamación, lesión hepatocelular y fibrosis (17, 18).
Esteatosis o cambio graso
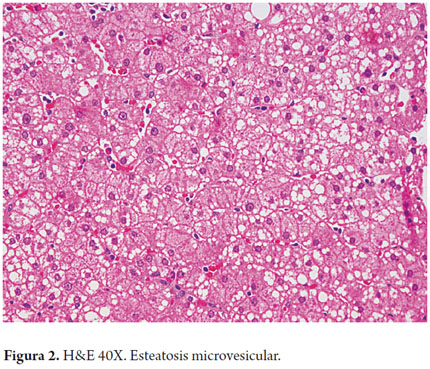
Está presente hasta en el 90%-100% de los casos. Predominantemente es macrovesicular o una combinación de vacuola pequeña y grande (micro y macrovesicular), localizada predominantemente en la zona 3 (figura 1 y 2). Un límite de más del 5% es usado como punto de corte para definir una esteatosis significante; grados menores se consideran dentro de los límites de la normalidad histológica. En algunas ocasiones la grasa prácticamente desaparece o es mínima su cantidad, por ejemplo cuando existe fibrosis significante o en estadio de cirrosis, o cuando un paciente alcohólico ha dejado de beber (12). La esteatosis sola no es un patrón específico y puede tener algún grado leve de inflamación.
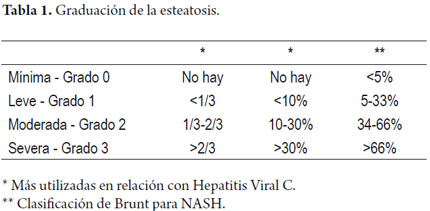
La severidad de la esteatosis se gradúa teniendo en cuenta la cantidad de hepatocitos comprometidos por las vacuolas grasas; para lo cual existen varias clasificaciones tanto cualitativas como cuantitativas, algunas más utilizadas cuando la esteatosis acompaña a entidades como la hepatitis viral C. Se hace una comparación de los criterios en la tabla 1 (4, 13, 19-21).
Inflamación
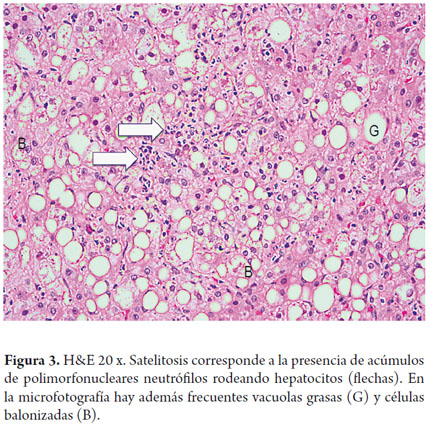
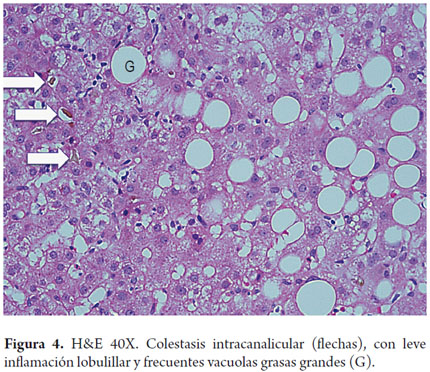
El polimorfonuclear neutrófilo es la célula que característicamente está presente; usualmente se dispone en pequeños cúmulos o en los sinusoides. El hallazgo de leucocitos polimorfonucleares neutrófilos rodeando hepatocitos balonizados constituye la llamada satelitosis (figura 3). La inflamación lobulillar o acinar usualmente es leve, con infiltrado mixto (de linfocitos y polimorfonucleares neutrófilos), es considerada una de las claves diagnósticas de la esteatohepatitis (18, 19). El infiltrado acinar, la inflamación portal de linfocitos e histiocitos es frecuentemente observada pero es de ligera intensidad, es mayor cuando se acompaña de actividad necroinflamatoria sobreimpuesta a otras entidades como la hepatitis viral C, o a colestasis en la hepatitis alcohólica aguda (figura 4) (20, 21).
Lesión hepatocelular
Es requisito indispensable para el diagnóstico de esteatohepatitis. De no existir evidencia de lesión hepatocelular la esteatosis con o sin inflamación no son criterios diagnósticos en forma aislada.
La lesión ocurre de dos formas: balonización hepatocelular y/o fibrosis pericelular o subsinusoidal.
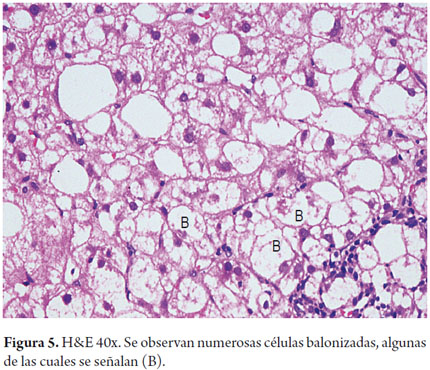
La balonización se caracteriza por edema y rarefacción del citoplasma, son células agrandadas, de apariencia clara, con material residual granular intracitoplasmático; localizados en la zona 3, en etapas avanzadas de la enfermedad están adyacentes a los septos fibrosos (figura 5). Al igual que en otras formas de hepatitis se puede observar necrosis hepatocelular aislada, cuerpos acidofílicos o apoptóticos (18, 19).
Fibrosis
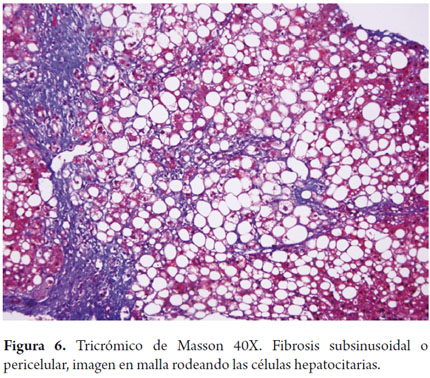
La fibrosis distintiva de las esteatohepatitis es la fibrosis pericelular, subsinusoidal o en "chickenwire" es el patrón dado por el depósito de colágeno en el espacio de Disse inicia en la zona 3 y posteriormente puede extenderse hacia el espacio porta; ocurre en las fases iniciales del compromiso hepático (figura 6).
Adicionalmente, la fibrosis también se desarrolla alrededor de las vénulas hepáticas terminales, esta fibrosis perivenular o fleboesclerosis eventualmente termina siendo obliterante de la luz venular. En estadios más avanzados la combinación de estos hallazgos progresa a zonas cicatriciales que reemplazan la zona 3 constituyendo la necrosis hialina esclerosante.
En la endoflebitis existe permeación por células inflamatorias a la pared de las vénulas hepáticas terminales y sublobulares o intercaladas, al obliterar la luz con proliferación subintimal se constituyen las lesiones venooclusivas. La fibrosis portal y periportal es inusual en fases iniciales, puede existir también evidencia de enfermedad venooclusiva en venas portales.
En estadios avanzados de la enfermedad la fibrosis en puentes se extiende desde las áreas perivenulares hacia los tractos portales, característicamente la cirrosis es micronodular pero el patrón mixto macro y micronodular o macronodular también se puede observar, especialmente en aquellos casos en los que el estímulo inicial es reitirado, por ejemplo la ingesta masiva de alcohol (22, 23).
Otros hallazgos
Las megamitocondrias o mitocondrias gigantes pueden observarse tanto en EHNA como EHA; son pequeños cuerpos eosinofílicos que miden entre 3 y 10 micras, negativas con las coloraciones de PAS, son indicativas de un gran estrés oxidativo de los hepatocitos.
Los núcleos glicogenados más observados en pacientes diabéticos y en los niños con EHNA.
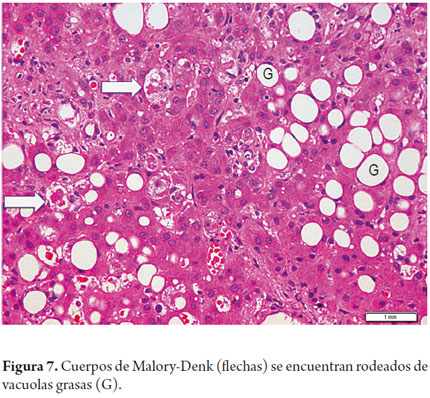
Los cuerpos de Mallory o Mallory-Denk aparecen en células balonizadas más abundantes en zona 3, no bien desarrollados o inconspicuos en el EHNA, prominentes y bien formados en la hepatopatía alcohólica (figura 7).
Para el diagnóstico de la esteatohepatitis no alcohólica tomamos en cuenta las recomendaciones dadas por la "American Association for the Study of Liver Diseases" en la conferencia NASH, realizada en Atlanta, GA, en Septiembre del 2002 (11).
Cambios indispensables para el diagnóstico: esteatosis localizada en zona 3, inflamación lobular y lesión hepatocelular de tipo balonización.
Cambios usualmente presentes pero no necesarios para el diagnóstico: fibrosis subsinusoidal o pericelular en zona 3, lipogranulomas, núcleos glicogenados en zona 1, cuerpos acidofílicos y presencia de células de Kupffer hipertróficas con material PAS diastasa positivo.
Cambios que pueden presentarse pero no necesarios para el diagnóstico: cuerpos de Mallory, depósitos de hierro en hepatocitos o en células sinusoidales, usualmente en escasa cantidad, y más relacionados con hepatopatía alcohólica y megamitocondrias.
Hallazgos inusuales más considerados como parte del cuadro morfológico de otras entidades son: esteatosis de tipo microvesicular, esteatosis macrovesicular menor del 30% de distribución no zonal, inflamación portal o acinar prominente, presencia de un infiltrado inflamatorio rico en plasmocitos o eosinófilos, granulomas epitelioides, fibrosis portal o periportal en ausencia de fibrosis pericelular, colestasis crónica con proliferación ductular y depósitos de cobre o colestasis aguda con formación de tapones biliares. Hallazgos como fibrosis perivenular, lesiones vasculares de tipo venooclusivo, fleboesclerosis o esclerosis hialina. Depósitos de hierro intrahepatocitarios con gradiente de la zona 1 hacia la 3 (22-25).
CONDICIONES ESPECIALES
Esteatohepatitis en niños
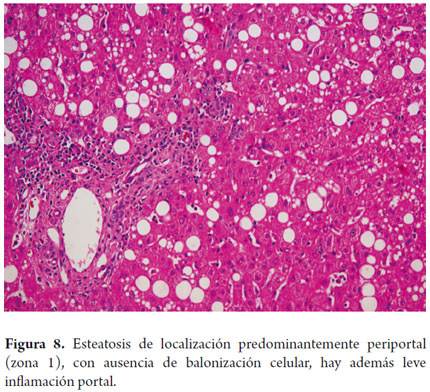
Para algunos autores las diferencias morfológicas observadas sugieren que se trate de una enfermedad diferente. Aproximadamente en el 17% de la población pediátrica; más observado en niñas blancas, se conocen la esteatohepatitis Tipo 1 con cambios muy semejantes a los observados en la población adulta. El Tipo 2 tiene características un poco diferentes, ocurre en el 51% de los casos de niños de edad mayor o adolescentes, especialmente, hombres, hispanos, asiáticos y nativos americanos y más relacionado con niños obesos; la localización de los cambios morfológicos ocurren en la zona 1 con mayor inflamación de linfocitos y fibrosis portal, con ausencia de cambio balonizante (figura 8). En el restante 32% puede observarse un patrón mixto con sobreposición de los dos patrones descritos (25, 26).
Etiología alcohólica
Como se ha referido, en su cuadro histopatológico pueden ser indistinguibles; sin embargo, usualmente hay mayor actividad inflamatoria y enumeraremos algunos de los hallazgos que pueden ayudarnos a sugerir esta etiología.
La presencia de necrosis hialina esclerosante que es una combinación de cuerpos de Mallory o Mallory-Denk bien formados, en gran cantidad, fibrosis perivenular con depósito de colágeno de Tipo III y necrosis de hepatocitos localizados en la zona 3; enfermedad venooclusiva, la llamada degeneración espumosa alcohólica que corresponde a esteatosis microvacuolar en la zona 3 y colestasis.
Se han propuesto modelos no invasivos, para lograr diferenciar entre la hepatopatía alcohólica y EHNA utilizando el índice ANI que valora el volumen corpuscular medio, relación AST/ALT, el índice de masa corporal y el sexo; cuando este índice es mayor a 0 apoya la etiología alcohólica, sin embargo aún no han sido validados, por lo cual la biopsia hepática sigue siendo utilizada en el diagnóstico (16, 27).
GRADUACIÓN Y ESTADIFICACIÓN
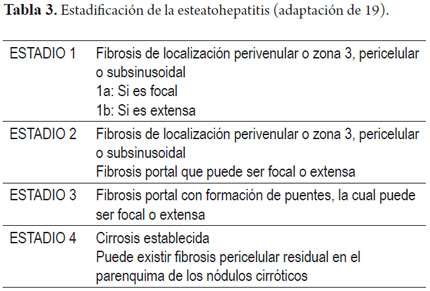
Como en la mayoría de las enfermedades hepáticas es importante determinar el grado de actividad inflamatoria determinada por la inflamación y la magnitud de la lesión hepatocelular y el estadio definido como la extensión y extensión de la fibrosis y cambios arquitecturales para definir el pronóstico y determinar una adecuada terapéutica. Varios grupos han trabajado; realizando esquemas de graduación y estatificación. La más usada es la clasificación semicuantitativa modificada de Brunt; sin importar cuál es el sistema utilizado lo recomendable es realizar siempre una clasificación de hallazgos morfológicos observados adecuada y lo más objetiva posible (18, 19, 22, 23, 25, 28). Las tablas 2 y 3 hacen un resumen de los criterios a tener en cuenta.
REFERENCIAS
1. Ludwig J, Viggiano TR, McGill DB, Oh BJ. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc. 1980;55(7):434-8. [ Links ]
2. Levene AP, Goldin RD. The epidemiology, pathogenesis and histopathology of fatty liver disease. Histopathology. 2012;61(2):141-52. [ Links ]
3. Shimada M, Hashimoto E, Taniai M, Hasegawa K, Okuda H, Hayashi N, et al. Hepatocellular carcinoma in patients with non-alcoholic steatohepatitis. J Hepatol. 2002;37(1):154-60. [ Links ]
4. Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003;37(5):1202-19. [ Links ]
5. Kakar Sanjay. Medical Liver Disease: Problem Diagnoses for Practicing Pathologists. Short Course # 14. XXVI International Congress of the International Academy of Pathology. Montreal, Quebec, Canada. September 20, 2006. [ Links ]
6. Browning JD, Szczepaniak LS, Dobbins R, Nuremberg P, Horton JD, Cohen JC, et al. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology. 2004;40(6):1387-95. [ Links ]
7. Adams LA, Lymp JF, St Sauver J, Sanderson SO, Lindor KD, Feldstein A, et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology. julio de 2005;129(1):113-21. [ Links ]
8. Marrero JA, Fontana RJ, Su GL, Conjeevaram HS, Emick DM, Lok AS. NAFLD may be a common underlying liver disease in patients with hepatocellular carcinoma in the United States. Hepatology. 2002;36(6):1349-54. [ Links ]
9. Chitturi S, Abeygunasekera S, Farrell GC, Holmes-Walker J, Hui JM, Fung C, et al. NASH and insulin resistance: Insulin hypersecretion and specific association with the insulin resistance syndrome. Hepatology. 2002;35(2):373-9. [ Links ]
10. Marchesini G, Bugianesi E, Forlani G, Cerrelli F, Lenzi M, Manini R, et al. Nonalcoholic fatty liver, steatohepatitis, and the metabolic syndrome. Hepatology. 2003;37(4):917-23. [ Links ]
11. Chalasani N, Younossi Z, Lavine JE, Diehl AM, Brunt EM, Cusi K, et al. The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology. 2012;55(6):2005-23. [ Links ]
12. Stravitz RT, Sanyal AJ. Drug-induced steatohepatitis. Clin Liver Dis. 2003;7(2):435-51. [ Links ]
13. Hübscher SG. Histological assessment of non-alcoholic fatty liver disease. Histopathology. 2006;49(5):450-65. [ Links ]
14. Patel V, Sanyal AJ. Drug-induced steatohepatitis. Clin Liver Dis. 2013;17(4):533-546, vii. [ Links ]
15. Idrovo CV, Gozalo GL. Enfermedad hepática grasa no alcohólica: NAFLD. Rev Col Gastroenterol. 2004;19(1):44-9. [ Links ]
16. O'Shea RS, Dasarathy S, McCullough AJ. Alcoholic liver disease. Am J Gastroenterol. 2010;105(1):14-32; quiz 33. [ Links ]
17. Burt AD, Mutton A, Day CP. Diagnosis and interpretation of steatosis and steatohepatitis. Semin Diagn Pathol. 1998 [ Links ]
18. Brunt EM. Histopathology of non-alcoholic fatty liver disease. Clin Liver Dis. 2009;13(4):533-44. [ Links ]
19. Brunt EM, Tiniakos DG. Histopathology of nonalcoholic fatty liver disease. World J Gastroenterol. 2010;16(42):5286-96. [ Links ]
20. Castéra L, Hézode C, Roudot-Thoraval F, Bastie A, Zafrani E-S, Pawlotsky J-M, et al. Worsening of steatosis is an independent factor of fibrosis progression in untreated patients with chronic hepatitis C and paired liver biopsies. Gut. 2003;52(2):288-92. [ Links ]
21. Fartoux L, Chazouillères O, Wendum D, Poupon R, Serfaty L. Impact of steatosis on progression of fibrosis in patients with mild hepatitis C. Hepatology. 2005;41(1):82-7. [ Links ]
22. Brunt EM, Janney CG, Di Bisceglie AM, Neuschwander-Tetri BA, Bacon BR. Nonalcoholic steatohepatitis: a proposal for grading and staging the histological lesions. Am J Gastroenterol. 1999;94(9):2467-74. [ Links ]
23. Bedossa P, Poitou C, Veyrie N, Bouillot J-L, Basdevant A, Paradis V, et al. Histopathological algorithm and scoring system for evaluation of liver lesions in morbidly obese patients. Hepatology. 2012;56(5):1751-9. [ Links ]
24. Rafiq N, Younossi ZM. Nonalcoholic fatty liver disease: a practical approach to evaluation and management. Clin Liver Dis. 2009;13(2):249-66. [ Links ]
25. Loomba R, Sirlin CB, Schwimmer JB, Lavine JE. Advances in pediatric nonalcoholic fatty liver disease. Hepatology. 2009;50(4):1282-93. [ Links ]
26. Hsu E, Murray K. Is nonalcoholic fatty liver disease in children the same disease as in adults? Clin Liver Dis. 2012;16(3):587-98. [ Links ]
27. Schwartz JM, Reinus JF. Prevalence and natural history of alcoholic liver disease. Clin Liver Dis. 2012;16(4):659-66. [ Links ]
28. Pagadala MR, McCullough AJ. The relevance of liver histology to predicting clinically meaningful outcomes in nonalcoholic steatohepatitis. Clin Liver Dis. 2012;16(3):487-504. [ Links ]











 text in
text in