Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.29 no.2 Bogotá Apr./June 2014
Enfoque del paciente con dispepsia y dispepsia funcional: actualización
William Otero R. MD. (1), Martín Gómez Zuleta MD. (2), Lina Otero P. MD. (3)
(1) Profesor de Medicina, Unidad de Gastroenterología, Universidad Nacional de Colombia. Gastroenterólogo, Clínica Fundadores. Bogotá, Colombia.
(2) Profesor de Medicina, Unidad de Gastroenterología, Universidad Nacional de Colombia. Gastroenterólogo, Hospital El Tunal. Bogotá, Colombia.
(3) Fellow de Gastroenterología, Universidad Nacional de Colombia. Bogotá, Colombia.
Fecha recibido: 24-06-13 Fecha aceptado: 08-05-14
Resumen
La dispepsia (DP) describe el dolor o malestar en el abdomen superior. Puede ser dispepsia no investigada o dispepsia funcional (DF), cuando después de realizar pruebas diagnósticas, como la endoscopia digestiva alta (EDA) y ocasionalmente ecografía abdominal superior, no se encuentran alteraciones orgánicas que la expliquen. No obstante, hallazgos recientes controvierten la clasificación de la DF en DP tipo dolor y DP posprandial, pese a su amplia difusión. Se discute el enfoque del paciente con DP y la fisiopatología y el tratamiento farmacológico de la DF.
Palabras clave
Dispepsia, dispepsia funcional, Helicobacter, procinéticos, antisecretores.
INTRODUCCIÓN
El término dispepsia proviene de las palabras griegas dys (malo) y pepsis (digestión). La dispepsia (DP) se refiere al dolor o malestar crónico o recurrente, localizado en la parte central del abdomen superior (epigastrio). De manera incorrecta, con frecuencia, es reemplazada por las denominaciones "gastritis crónica" o "enfermedad acidopéptica".
Cuando un paciente se presenta con DP y no se le ha estudiado la causa, se denomina dispepsia no investigada (DPNI); cuando ha sido sometido a exámenes, específicamente endoscopia digestiva alta (EDA) y ocasionalmente, además, ecografía abdominal superior, se puede clasificar como funcional o idiopática (DF), cuando no se encuentran alteraciones que expliquen los síntomas, o dispepsia secundaria u orgánica, cuando es debida a diversas enfermedades orgánicas gastrointestinales (ulceras pépticas o tumores), sistémicas o metabólicas (1) (tabla 1). Después de las investigaciones pertinentes, la DF explica más del 70% de los casos de dispepsia no investigada (2). En el pasado, este tipo de dispepsia se denominaba dispepsia no ulcerosa, denominación que es incorrecta ya que además de las úlceras pépticas, hay otras entidades que también producen el cuadro clínico.
El patrón de los síntomas por sí solo, no permite diferenciar entre una enfermedad orgánica o funcional, por lo cual es necesario realizar investigaciones para excluir una enfermedad orgánica.
EPIDEMIOLOGÍA
Aproximadamente del 15-40% de la población, tiene síntomas dispépticos crónicos o recurrentes no investigados, de los cuales, aproximadamente, la tercera parte tendrán dispepsia secundaria u orgánica (4). En algunos países se ha encontrado que la incidencia anual es aproximadamente del 1% y se calcula que una de cada dos personas consultará en algún momento de su vida por síntomas dispépticos. Representa el 5% de la consulta en medicina general y aproximadamente del 20 al 30% de la consulta en gastroenterología (2,5,6). Además de su alta prevalencia, es importante porque disminuye notablemente la calidad de vida de los individuos que la padecen (2,5,6).
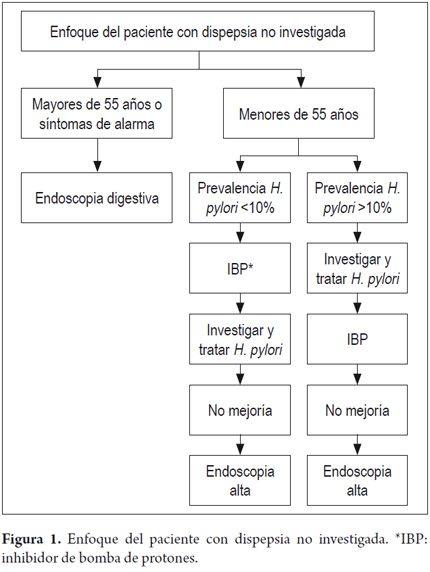
El enfoque diagnóstico de la DP, depende de la preocupación o sospecha de que exista una entidad seria, así como de la relación costo/efectividad (4). La indicación de realizar endoscopia digestiva inmediata es la presencia de síntomas y/o signos de alarma (tabla 2) y edad mayor a 50-55, que es la edad prevalente de aparición de cáncer gástrico (CG) en países desarrollados (5-7).
El enfoque en los países desarrollados es diferente al que se hace en países en vía de desarrollo; esta diferencia se basa, fundamentalmente, en la prevalencia e incidencia del CG, el cual es aproximadamente 4-5 veces más frecuente en países como Colombia, Venezuela, Costa Rica, entre otros, en comparación con Estados Unidos (3). La Asociación Americana de Gastroenterología y el Colegio Americano de Gastroenterología, recomiendan el algoritmo de la figura 1.
En Colombia, en un estudio prospectivo realizado en pacientes con DPNI, que fueron sometidos a EDA, se encontró CG en el 9% de los pacientes, siendo esta patología la segunda causa de enfermedad orgánica (3). De manera característica, el CG se hizo más frecuente a partir de los 30 años edad, por lo cual la recomendación es que la EDA se realice a todos los pacientes con dispepsia no investigada, mayores de 30 años, y en los menores de esa edad si tiene síntomas de alarma. Es posible que la alta prevalencia de CG en esta investigación se deba a que muchos de los pacientes fueron evaluados en un hospital de referencia. Sin embargo, se considera que esta recomendación es justificable por la alta prevalencia de CG en Colombia que, según estadísticas recientes, está entre las más altas del mundo con 17,4 a 48,2 casos por 100 000 habitantes (8) y además por el bajo costo de la EDA (40-100 dólares).
Cuando en la endoscopia digestiva y en la ecografía hepatobiliar (cuando está indicada) no se encuentra patología orgánica, el diagnóstico será DF, cuyos criterios para el diagnóstico se muestran en las tablas 3 y 4. Desde el consenso de ROMA III, la DF se ha dividido en dos categorías: i) DF tipo dolor y II) DF con molestias posprandiales.
La amplia aceptación que estos criterios han tenido, con la respectiva subdivisión en las dos categorías (dolor y distrés posprandial), ha sido confirmadas en estudios realizados en varias partes del mundo (9). Recientemente, Vakil y sus colaboradores encontraron que en pacientes con DF existe una superposición de estos dos suptipos en el 66% de los pacientes; y las categorías puras de síndrome de distrés posprandial y síndrome de dolor epigástrico, en el 10 y 24% respectivamente, por lo cual, los autores consideran que la subdivisión en estas dos categorías es cuestionable y sugieren que se necesita una nueva clasificación de la DF (10). Además, con frecuencia los pacientes con enfermedad por reflujo gastroesofágico tienen síntomas que los clasificarían como portadores de DF (10).
FISIOPATOLOGÍA
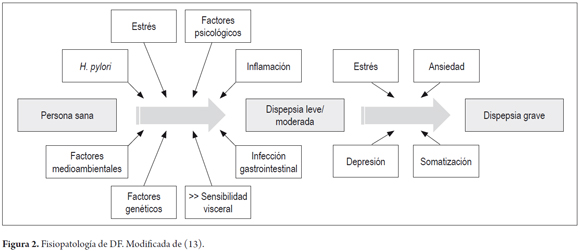
No se conocen con exactitud, los mecanismos responsables de la DF, es decir, si no hay enfermedad orgánica, ¿por qué ocurren los síntomas? Diversos estudios clínicos han demostrado las siguientes anormalidades (11-15): i) alteración de la acomodación gástrica; ii) vaciamiento gástrico retardado; iii) hipersensibilidad gástrica; iv) hipersensibilidad duodenal al ácido y a los lípidos; v) inflamación de bajo grado; vi) estrés y factores sicosociales, trauma, predisposición genética, infección viral previa, etc.; e vii) infección por H. pylori (16), así como la precipitación por gastroenteritis infecciosa. Al respecto, en un reciente metanálisis se encontró que el riesgo de desarrollar DF está significativamente aumentado después de estas infecciones (OR:1,97; IC 95%; 1,51-2,56) (17). Estos hallazgos han hecho suponer que la inflamación y alteraciones inmunológicas pueden ser importantes. Estudios de epidemiología genética han identificado además polimorfismos de la proteína G, subunidad del gene B3 (GNB3), que tienen influencia sobre la activación de las células inmunológicas (12). Un modelo de la participación de los diferentes factores desde el individuo sano hasta el cuadro de DF severa, se muestra en la figura 2 (13).
EVALUACIÓN DEL PACIENTE CON DISPEPSIA Y TRATAMIENTO DE LA DF
La evaluación de los pacientes con DF incluye una cuidadosa historia clínica, haciendo énfasis en los síntomas de alarma, los cuales pueden sugerir la presencia de un tumor o una enfermedad orgánica complicada. Contrario a lo considerado en el consenso de Roma III, la pirosis y/o regurgitación, que exclusivamente significaban enfermedad por reflujo gastroesofágico (ERGE), en la actualidad hay nuevos datos que indican que estos síntomas con frecuencia ocurren en DF, incluso después de haber corroborado la ERGE con los exámenes actualmente disponibles (10). Si los síntomas dispépticos consisten en dolor abdominal superior que se alivia con la defecación o, como se mencionó, se asocia con un cambio en la frecuencia o forma de las heces en ausencia de síntomas de alarma, lo más probable es que se trate de síndrome de intestino irritable (1). Si el síntoma que predomina es el dolor superior que se empeora con los alimentos, puede indicar pancreatitis crónica o enfermedad de la vesícula biliar. Si hay esteatorrea se refuerza la probabilidad de pancreatitis crónica con malabsorción. Si el dolor superior se alivia con los alimentos o antiácidos, el cuadro sugiere una úlcera péptica. Los síntomas de alarma de la tabla 1, sugieren la presencia de dispepsia orgánica o secundaria.
En los pacientes con DP se siguen cuatro enfoques: i) endoscopia inmediata cuando hay signos/síntomas de alarma, la edad es mayor de 50 años o en una edad menor, dependiendo de las características epidemiológicas del CG; ii) tratamiento empírico con antisecretores; iii) investigación de H. pylori y tratamiento si es positivo; o iv) investigación de H. pylori y endoscopia alta si es positivo (4). La EDA estaría indicada en los escenarios 3 y 4 si no hay mejoría.
TRATAMIENTO DE LA DISPEPSIA FUNCIONAL
Con base en los mecanismos fisiopatológicos implicados (6,7,18,19), los medicamentos actualmente recomendados para el manejo de esta entidad son los siguientes:
1. Antidepresivos tricíclicos: dirigidos a bloquear la hipersensibilidad visceral, con un NNT 2 (IC 95%; 1,5-5) o de 5 (IC 95%; 3-250) (20).
2. Inhibidores de la secreción de ácido: el uso de anti-H2 o inhibidores de bomba de protones (IBP) están dirigidos a controlar la hipersensibilidad. El NNT para anti-H2 es 8 (IC 95%; 5-24) y para los IBP es 9 (IC 95%; 6-19); con estos últimos responde el 34% de los pacientes, frente al 25% con placebo (21). Los IBP pueden considerarse como el medicamento de elección para los pacientes que, además de la DP, tienen síntomas de ERGE o los que tengan dolor tipo ardor o quemante en el epigastrio. La recomendación es administrarlos por lo menos durante cuatro semanas (19).
3. Erradicación de H. pylori: este tratamiento no mejora en la mayoría de los pacientes. El NNT es de 14 (IC 95%; 10-29), pero este pequeño beneficio es estadísticamente significativo y en estudios a largo plazo, ha demostrado que es costoeficaz (18,19). La ganancia terapéutica por encima de placebo es 6-14% (22). Con la erradicación de H. pylori se obtienen otros beneficios, tales como eliminación de la gastritis y disminución o eliminación del riesgo de CG, si al momento de la erradicación no existen alteraciones histológicas avanzadas como la atrofia o la metaplasia intestinal (23). También se disminuye el riesgo de úlceras pépticas futuras (24).
4. Procinéticos: la utilización de estos medicamentos tiene como objetivo corregir las alteraciones de motilidad gástrica. Las moléculas de este grupo que estimulan el músculo liso son las de elección para el tratamiento de la gastroparesia. Globalmente, los procinéticos tienen un NNT de 5 (IC 95%; 3-11). Dentro de esta categoría se encuentran cisaprida (ya retirado del mercado, por efectos adversos cardiovasculares) y metoclopramida, la cual produce serios efectos adversos neurológicos, por lo cual no es una buena alternativa, siendo reemplazada por domperidona, un antagonista de los receptores D2, que no cruza la barrera hematoencefálica (19).
El mosaprida, un agonista de los receptores 5HT4 y antagonista 5HT3, no fue mejor que un placebo en un estudio europeo grande (25). Itopride es un nuevo medicamento que combina el efecto anti D2 con inhibición de la colinesterasa, con lo cual aumenta los niveles de acetilcolina, produciendo mejoría en el vaciamiento gástrico (19). Un metanálisis reciente, encontró beneficio en la sensación global de bienestar, en la llenura posprandial, así como en la llenura precoz (26).
Levosulpirida, isómero L del sulpirida, tiene un doble mecanismo para corregir las alteraciones de la motilidad. Es un antagonista del receptor D2 de la dopamina en el músculo liso gastrointestinal superior, con lo cual se disminuye la actividad de la dopamina, una sustancia inhibidora, y de esta manera predomina la acción de la acetilcolina, lo cual se traduce en un aumento de las contracciones gástricas (27). Su otro mecanismo es como agonista de los receptores 5HT4 de la serotonina, los cuales al ser activados, aumentan la liberación de la acetilcolina y de esta manera se aumentará la actividad motora intestinal superior (26) y también el de la vesícula biliar. Además, tiene efecto antiemético (28). En un estudio español, levosulpirida tuvo eficacia similar a cisaprida en el control de los síntomas de la DF (29).
De los resultados de eficacia de los diferentes medicamentos recomendados en el actualidad para DF, previamente comentados, parecería que el tratamiento menos eficaz sería la erradicación de H. pylori, (NNT 14 IC 95%; 10-20) (16), sin embargo, la calidad de los estudios que evalúan los distintos tratamientos es baja para procinéticos, muy baja para antidepresivos, moderada para anti H2 y de muy buena calidad para H. pylori (18), por lo cual la aparentemente menor eficacia de la erradicación de H. pylori, tiene relación directa con la excelente calidad de los estudios.
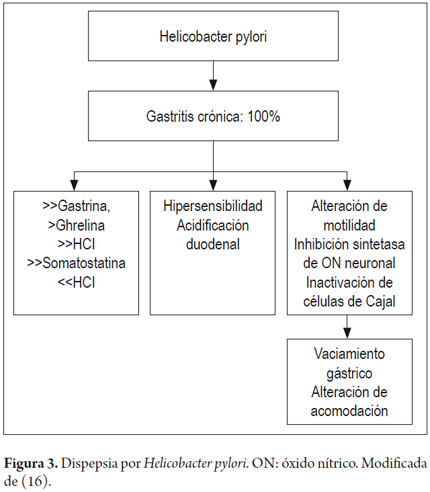
La importancia del rigor y la calidad de los ensayos clínicos controlados, tienen impacto en los resultados. Los estudios de pobre calidad pueden sobreestimar la magnitud del efecto y cuando tienen puntajes de dos puntos o menos en la escala de Jadad producen efectos favorables de 35% superiores que los ensayos clínicos con tres o más puntos (30). Aunque la erradicación de H. pylori sólo mejoraría los síntomas en 5 a 10% (1 de cada 14) (16), los diferentes estudios han demostrado que eliminar la infección es costoeficaz a largo plazo (16,31) y además que la erradicación a largo plazo tiene beneficios adicionales como disminuir o evitar el riesgo de CG (23), además de prevenir las úlceras pépticas (32), así como el sangrado por las mismas (33); por lo tanto, es justificable la premisa de muchos expertos "el único Helicobacter bueno es el que está muerto". Los pacientes que mejoran de la dispepsia al erradicar H. pylori no tendrían entonces dispepsia funcional sino "dispepsia por H. pylori, la cual sería una dispepsia orgánica. Los mecanismos teóricos implicados en la generación de DP se muestran en la figura 3 (16). Se ignoran los factores responsables de DF entre todos los infectados, así como el número de los casos que presentan este cuadro clínico, aunque el 100% de ellos presenten gastritis crónica (24). La erradicación de la infección se debe verificar por métodos no invasivos como el test respiratorio de urea o antígenos fecales después de cuatro semanas de terminar el tratamiento con antibióticos (23).
Ningún tratamiento es eficaz en todos los pacientes, por lo tanto, las diferentes estrategias pueden utilizarse de manera secuencial o combinada, por ejemplo, en pacientes con síntomas de ERGE y dispepsia, cuyos síntomas de reflujo mejoren con IBP pero persistan los síntomas dispépticos, se les podría incluir un procinético o un antidepresivo tricíclico (34).
OTROS TRATAMIENTOS
No hay evidencias sobre la utilidad de recomendar dietas especiales para evitar la DF (35). Terapias sicológicas e hipnoterapia, necesitan especialistas expertos dedicados a este tipo de enfoque y, al parecer, se carece de los mismos (35). Acotiamida en un nuevo medicamento que aumenta la liberación de acetilcolina, inhibe la colinesterasa y adicionalmente puede aumentar la acomodación gástrica (36); y parece que su eficacia está restringida a la DF tipo distrés posprandial y no a la DF tipo dolor (37).
REFERENCIAS
1. Tack J, Talley NJ, Camilleri M, Holtmann G, Hu P, Malagelada J-R, et al. Functional gastroduodenal disorders. Gastroenterology. 2006;130(5):1466-79. [ Links ]
2. Halder SLS, Talley NJ. Functional Dyspepsia: A New Rome III Paradigm. Curr Treat Options Gastroenterol. 2007;10(4):259-72. [ Links ]
3. Pineda LF, Otero W, Gómez M, Arbeláez V. Enfermedad estructural y valor predictivo de la Historia Clínica en pacientes con dispepsia no investigada. Rev Col Gastroenterol 2004;19:13-25. [ Links ]
4. Graham DY, Rugge M. Clinical practice: diagnosis and evaluation of dyspepsia. J Clin Gastroenterol. 2010;44(3):167-72. [ Links ]
5. Talley NJ, Vakil NB, Moayyedi P. American gastroenterological association technical review on the evaluation of dyspepsia. Gastroenterology. 2005;129(5):1756-80. [ Links ]
6. Talley NJ, Vakil N, Practice Parameters Committee of the American College of Gastroenterology. Guidelines for the management of dyspepsia. Am J Gastroenterol. 2005;100(10):2324-37. [ Links ]
7. Gisbert JP, Calvet X, Ferrándiz J, Mascort J, Alonso-Coello P, Marzo M, et al. [Clinical practice guideline on the management of patients with dyspepsia. Update 2012]. Atencion Primaria Soc Esp Med Fam Comunitaria. 2012;44(12):727.e1-727.e38. [ Links ]
8. Globocan 2012 - Home [Internet]. [citado 29 de mayo de 2014]. Recuperado a partir de: http://globocan.iarc.fr/Default.aspx [ Links ]
9. Tack J, Talley NJ. Functional dyspepsia--symptoms, definitions and validity of the Rome III criteria. Nat Rev Gastroenterol Hepatol. 2013;10(3):134-41. [ Links ]
10. Vakil N, Halling K, Ohlsson L, Wernersson B. Symptom overlap between postprandial distress and epigastric pain syndromes of the Rome III dyspepsia classification. Am J Gastroenterol. 2013;108(5):767-74. [ Links ]
11. Lee K-J, Kindt S, Tack J. Pathophysiology of functional dyspepsia. Best Pract Res Clin Gastroenterol. 2004;18(4):707-16. [ Links ]
12. Holtmann G, Siffert W, Haag S, Mueller N, Langkafel M, Senf W, et al. G-protein beta 3 subunit 825 CC genotype is associated with unexplained (functional) dyspepsia. Gastroenterology. 2004;126(4):971-9. [ Links ]
13. Lacy BE. Functional dyspepsia and gastroparesis: one disease or two? Am J Gastroenterol. 2012;107(11):1615-20. [ Links ]
14. Miwa H. Why dyspepsia can occur without organic disease: pathogenesis and management of functional dyspepsia. J Gastroenterol. 2012;47(8):862-71. [ Links ]
15. Vanheel H, Farré R. Changes in gastrointestinal tract function and structure in functional dyspepsia. Nat Rev Gastroenterol Hepatol. 2013;10(3):142-9. [ Links ]
16. Suzuki H, Moayyedi P. Helicobacter pylori infection in functional dyspepsia. Nat Rev Gastroenterol Hepatol. 2013;10(3):168-74. [ Links ]
17. Pike BL, Porter CK, Sorrell TJ, Riddle MS. Acute gastroenteritis and the risk of functional dyspepsia: a systematic review and meta-analysis. Am J Gastroenterol. 2013;108(10):1558-1563; quiz 1564. [ Links ]
18. Moayyedi P. Dyspepsia. Curr Opin Gastroenterol. 2012;28(6):602-7. [ Links ]
19. Oustamanolakis P, Tack J. Dyspepsia: organic versus functional. J Clin Gastroenterol. 2012;46(3):175-90. [ Links ]
20. Wu JC, Cheong PK, Chan Y, Lai LH, Ching J, Chan A, et al. A Randomized, Double-Blind, Placebo-Controlled Trial of Low Dose Imipramine for Treatment of Refractory Functional Dyspepsia (FD). Gastroenterology. 2011;140(5):S-50. [ Links ]
21. Moayyedi P, Shelly S, Deeks JJ, Delaney B, Innes M, Forman D. WITHDRAWN: Pharmacological interventions for non-ulcer dyspepsia. Cochrane Database Syst Rev. 2011;(2):CD001960. [ Links ]
22. Lacy BE, Talley NJ, Locke GR 3rd, Bouras EP, DiBaise JK, El-Serag HB, et al. Review article: current treatment options and management of functional dyspepsia. Aliment Pharmacol Ther. 2012;36(1):3-15. [ Links ]
23. Malfertheiner P, Megraud F, O'Morain CA, Atherton J, Axon ATR, Bazzoli F, et al. Management of Helicobacter pylori infection--the Maastricht IV/ Florence Consensus Report. Gut. 2012;61(5):646-64. [ Links ]
24. Otero W. , Trespalacios AA, Otero E. Helicobacter pylori: Tratamiento actual. Un importante reto en gastroenterología. Rev Col Gastroenterol 2009:24:279-292. [ Links ]
25. Hallerbäck BI, Bommelaer G, Bredberg E, Campbell M, Hellblom M, Lauritsen K, et al. Dose finding study of mosapride in functional dyspepsia: a placebo-controlled, randomized study. Aliment Pharmacol Ther. 2002;16(5):959-67. [ Links ]
26. Huang X, Lv B, Zhang S, Fan Y-H, Meng L-N. Itopride therapy for functional dyspepsia: a meta-analysis. World J Gastroenterol WJG. 2012;18(48):7371-7. [ Links ]
27. Serra J. [Levosulpiride in the management of functional dyspepsia and delayed gastric emptying]. Gastroenterol Hepatol. 2010;33(8):586-90. [ Links ]
28. Corazza GR, Tonini M. Levosulpiride for dispepsia and emesis: A review of its pharmacology, efficacy and tolerability. Clin Drug Invest 2000;12:151-62. [ Links ]
29. Mearin F, Rodrigo L, Pérez-Mota A, Balboa A, Jiménez I, Sebastián JJ, et al. Levosulpiride and cisapride in the treatment of dysmotility-like functional dyspepsia: a randomized, double-masked trial. Clin Gastroenterol Hepatol Off Clin Pract J Am Gastroenterol Assoc. 2004;2(4):301-8. [ Links ]
30. Moher D, Pham B, Jones A, Cook DJ, Jadad AR, Moher M, et al. Does quality of reports of randomised trials affect estimates of intervention efficacy reported in meta-analyses? Lancet. 1998;352(9128):609-13. [ Links ]
31. Sonnenberg A. Cost-benefit analysis of testing for Helicobacter pylori in dyspeptic subjects. Am J Gastroenterol. 1996;91(9):1773-7. [ Links ]
32. Ford AC, Delaney BC, Forman D, Moayyedi P. Eradication therapy in Helicobacter pylori positive peptic ulcer disease: systematic review and economic analysis. Am J Gastroenterol. 2004;99(9):1833-55. [ Links ]
33. Sánchez-Delgado J, Gené E, Suárez D, García-Iglesias P, Brullet E, Gallach M, et al. Has H. pylori prevalence in bleeding peptic ulcer been underestimated? A meta-regression. Am J Gastroenterol. 2011;106(3):398-405. [ Links ]
34. Quigley EMM, Lacy BE. Overlap of functional dyspepsia and GERD--diagnostic and treatment implications. Nat Rev Gastroenterol Hepatol. 2013;10(3):175-86. [ Links ]
35. Camilleri M, Stanghellini V. Current management strategies and emerging treatments for functional dyspepsia. Nat Rev Gastroenterol Hepatol. 2013;10(3):187-94. [ Links ]
36. Tack J, Masclee A, Heading R, Berstad A, Piessevaux H, Popiela T, et al. A dose-ranging, placebo-controlled, pilot trial of Acotiamide in patients with functional dyspepsia. Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc. 2009;21(3):272-80. [ Links ]
37. Tack J, Janssen P. Acotiamide (Z-338, YM443), a new drug for the treatment of functional dyspepsia. Expert Opin Investig Drugs. 2011;20(5):701-12. [ Links ]











 text in
text in