Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.29 no.2 Bogotá Apr./June 2014
Probióticos para el tratamiento específico del dolor en el síndrome del intestino irritable. Una revisión
María Ortiz Lucas Lic. (1), Aurelio Tobías (2), Pablo Saz Peiró MD. (3), Juan José Sebastián MD. (4)
(1) Licenciada en Bioquímica, Profesora universitaria, Facultad de Ciencias de la Salud, Universidad San Jorge. Zaragoza, España.
(2) Investigador, Instituto de Diagnóstico Ambiental y Estudios del Agua (IDAEA), CSIC. Barcelona, España.
(3) Profesor universitario, Facultad de Medicina, Universidad de Zaragoza. Zaragoza, España.
(4) Profesor universitario, Facultad de Medicina, Jefe del Servicio de Digestivo, Hospital Royo Villanova. Zaragoza, España.
Correspondencia: mariaortizlucas@gmail.com; aurelio.tobias@gmail.com; pablosaz@unizar.es; jjsebastian@salud.aragon.es
Fecha recibido: 04-10-13 Fecha aceptado: 08-15-14
Resumen
El dolor abdominal es uno de los síntomas peor tolerados por los pacientes con síndrome del intestino irritable (SII). Estudios realizados los últimos años sugieren que existe una disbiosis intestinal en estos pacientes, que podría ser responsable, al menos en parte, de los síntomas. La revisión de la literatura apunta hacia que los probióticos podrían ser una terapia efectiva en el alivio del dolor en el SII, y se acepta que sus efectos son específicos de cuerdo a la cepa empleada. En este artículo se revisa el efecto que cada cepa, o mezcla de probióticos, tiene en el alivio del dolor abdominal, según los ensayos clínicos publicados, y se discuten los posibles mecanismos de acción. Se proponen nuevas perspectivas de investigación para poder dilucidar el mecanismo de acción de los probióticos en el alivio del dolor abdominal en estos pacientes.
Palabras clave
Probióticos, síndrome del intestino irritable, dolor abdominal, mecanismo de acción.
SÍNDROME DEL INTESTINO IRRITABLE Y MICROBIOTA
El síndrome del intestino irritable (SII) es el trastorno funcional digestivo más prevalente. El diagnóstico de SII se establece según criterios clínicos consensuados (criterios de Roma), que han ido variando en el transcurso de los años. El último consenso (Roma III, 2006) ratifica que los pacientes con SII deben presentar: "dolor o disconfort abdominal recurrente, al menos 3 veces al mes, durante los últimos 3 meses, asociado con 2 o más de los siguientes elementos: mejora con la defecación, comienzo asociado con un cambio en la frecuencia de las heces, comienzo asociado con un cambio en la forma (apariencia) de las heces" (1). En los últimos años hay una evidencia creciente que sugiere la presencia de una disbiosis intestinal en estos pacientes, aunque no haya una alteración uniforme en la composición de la microbiota, en el conjunto de pacientes con SII, ni en los distintos subtipos de SII. Incluso hay autores que sugieren distintos subtipos de pacientes, de acuerdo a su perfil microbiano (2-4).
MECANISMO DE ACCIÓN DE LOS PROBIÓTICOS
Los probióticos se definen como microorganismos vivos que confieren un beneficio a la salud del huésped, cuando se los administra en cantidades adecuadas (5). Tienen diferentes efectos en su huésped. La modulación de la microbiota intestinal inducida por los probióticos se atribuye a su capacidad de colonizar, de forma transitoria, el tracto gastrointestinal, y a la liberación de elementos antimicrobianos. Los probióticos compiten con otros patógenos, impidiendo su replicación y atenuando su virulencia. También influyen en la función de la barrera intestinal, al adherirse a las células intestinales y manteniendo la integridad y resistencia de la barrera epitelial, consiguiendo, de esta forma, prevenir la unión y los efectos de los patógenos entéricos. Los efectos antiinflamatorios de los probióticos se han atribuido al reclutamiento de células inmunes y a la activación de la respuesta inmune, mediante la alteración en la liberación de citocinas y quimiocinas. Finalmente, los probióticos podrían tener un papel en la reducción de la hipersensibilidad visceral. Además de estos efectos locales, los probióticos también tienen una acción sistémica produciendo un aumento de la protección inmune (6,7).
En el caso particular del SII, se postula que los probióticos podrían actuar modificando la microbiota intestinal, mediante el aumento de la cantidad de bacterias beneficiosas en el tracto gastrointestinal y la disminución del sobrecrecimiento bacteriano en el intestino, mejorando la función barrera del intestino, al aumentar la permeabilidad intestinal, invirtiendo el desequilibrio entre las citocinas pro- y antiinflamatorias, produciendo con ello, un retardo en el tránsito intestinal y modificando la hipersensibilidad visceral (8,9).
Se han estudiado los efectos de la ingesta de probióticos en la microbiota de los pacientes con SII. Los estudios llegan a distintas conclusiones: algunos autores no pudieron demostrar un cambio en la microbiota intestinal de los pacientes, tras la ingesta de probióticos (10-12), mientras que otros encontraron una estabilización de la microbiota (13-15). Estos últimos consideraron que la estabilización de la microbiota es un efecto positivo, ya que se ha encontrado una microbiota inestable en los pacientes con SII, en comparación con la de sujetos sanos (16,17). En un estudio publicado recientemente se evidenció un cambio en la microbiota de los pacientes tratados con probióticos (18).
Los mecanismos de acción de los probióticos dependen del probiótico en sí mismo, y la evidencia científica indica que es específica de la especie e incluso de la cepa de probiótico. Además, los efectos en el huésped son múltiples (6). Con relación al SII, el dolor abdominal es uno de los síntomas peor tolerados por estos pacientes, incidiendo de forma negativa en su calidad de vida (19). La revisión de la literatura sugiere que los probióticos podrían ser una terapia efectiva en el tratamiento del dolor de algunos pacientes con SII (20-22); sin embargo, ¿qué especies o cepas, en particular, de probiótico son las responsables del alivio del dolor en los pacientes con SII?
EFECTO ANTINOCICEPTIVO DE LOS PROBIÓTICOS
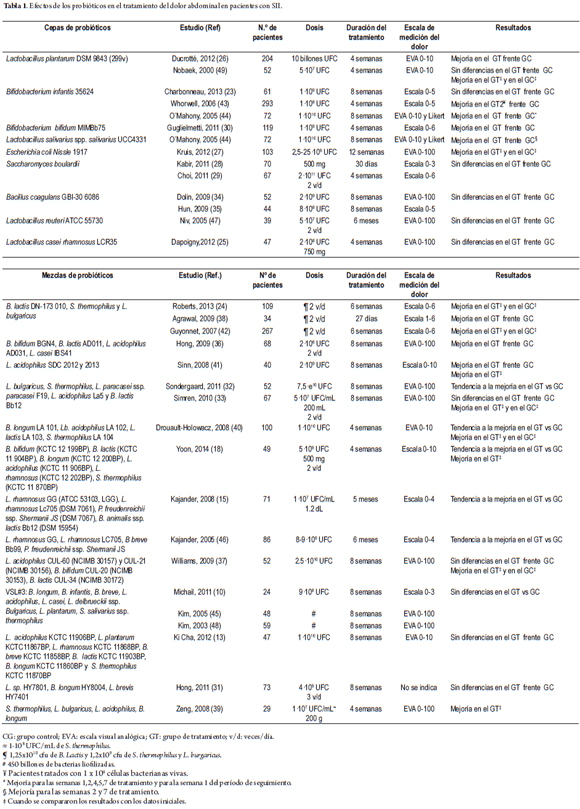
La tabla 1 muestra un resumen de los resultados de ensayos clínicos, aleatorios, sobre el efecto de los probióticos en el alivio del dolor abdominal en pacientes adultos con SII, considerando la composición de la cepa de probiótico o la mezcla de probióticos en cada uno de los estudios (10,13,15,18,23-49). Únicamente en 2 estudios, el efecto de los probióticos en el alivio del dolor abdominal fue considerado como variable principal del estudio (41,43).
ESPECIES DE PROBIÓTICOS
En dos estudios (26,49) se midió el efecto de la cepa Lactobacillus plantarum DSM 9843 (299v) en el alivio del dolor abdominal. Ducrotté y sus colaboradores (26) encontraron una mejoría, mientras que Nobaek y su equipo (49) hallaron una mejoría con respecto al inicio del tratamiento en ambos grupos de pacientes (probióticos y placebo), pero no al comparar los dos grupos entre sí. Otras mezclas de probióticos, que también contenían L. plantarum, no produjeron ninguna mejoría al comparar entre los grupos (10,13,45,48). En animales sanos se encontró un efecto antiinflamatorio y una reducción de la percepción del dolor intestinal, tras la administración de esta especie (50). Este efecto antinociceptivo no se encontró cuando se provocó un estímulo doloroso a nivel gástrico (51). Al evaluar esta especie de probiótico (cepa NCIMB8826) y una mutante de la misma deficiente en D-alanina , se encontró que el efecto regulador de los probióticos en la precepción del dolor visceral, a nivel del colon, podría estar relacionado con el grado de D-alaninación del ácido lipoteicoico, un componente de la pared celular bacteriana. Se ha propuesto que las citocinas antiinflamatorias también podrían estar involucradas en la disminución de la percepción visceral del dolor (50,52). Sin embargo, el mecanismo de acción antinociceptivo parece que es específico de la cepa de probiótico, pero también del órgano diana (51).
Dos estudios (43,44) encontraron un efecto positivo de la cepa Bifidobacterium infantis 35624 en el tratamiento del dolor abdominal, que Charbonneau y colaboradores (23) no pudieron confirmar. Además, Whorwell y sus investigadores (43) hallaron que este efecto era significativo en el caso de los pacientes con predominio de estreñimiento. Al administrar la mezcla de probióticos VSL#3 que contiene, entre otras, esta especie, no se encontró ninguna mejoría en el alivio del dolor abdominal (10,45,48). En ratas sanas, en ratas con perfil de ansiedad y en ratas con perfil de hipersensibilidad del colon posinflamatoria (53,54) se encontró un efecto antinociceptivo visceral de la cepa B. infantis 35624. El efecto positivo en el alivio del dolor abdominal que se encontró en el estudio de O'Mahony y su equipo (44) se acompañó de una modulación de la respuesta inmune, restableciendo la relación IL-10/IL-12 en el grupo de los probióticos; sin embargo, no se aportaron datos de correlaciones para proporcionar una relación más directa entre estos dos factores. Duncker y colaboradores (50) sugieren que podría existir una relación entre los niveles de citocinas y la capacidad nociceptiva del sistema nervioso, lo que permitiría explicar estos resultados de O´Mahonny y su equipo.
Se demostró un efecto positivo de la cepa Bifidobacterium bifidum MIMBb75 en el tratamiento del dolor abdominal en un estudio (30). Tres estudios más emplearon otras cepas de B. bifidum como parte de una mezcla de probióticos (18,36,37). Los pacientes que se trataron con la mezcla de probióticos que contenían la cepa B. bifidum BGN4 (36) también mostraron una mejoría del dolor abdominal y los que se trataron con la mezcla que contenía la cepa B. bifidum (KCTC 12 199BP) (18) tuvieron una tendencia a la mejoría (p=0,07), con respecto al grupo control (además, el grupo tratado con probióticos tuvo una mejoría significativa con respecto al inicio del tratamiento, que no se observó en el grupo control). El tratamiento con la mezcla de probióticos que contenía la cepa B. bifidum CUL-20 (NCIMB 30153) (37) no difirió del placebo; sin embargo, tanto el grupo de los probióticos como el grupo placebo mostraron una mejoría, cuando se compararon los datos antes y después del estudio en cada uno de los grupos, de forma individual.
La cepa Lactobacillus salivarius ssp. salivarius UCC4331 (44) mejoró el dolor abdominal a las semanas 2 y 7 de tratamiento, pero no al finalizar las 8 semanas del mismo. Al estudiar la cepa Escherichia coli Nissle 1917 (27) se mostró una mejoría del dolor abdominal, cuando se comparaban los resultados al inicio del tratamiento, tanto en el grupo con tratamiento como en el grupo placebo, y se halló un aumento del umbral de sensibilidad visceral, al administrar esta cepa a ratas con hiperalgesia visceral posinflamatoria, pero no al administrarlo a ratas sanas (55).
Otros ensayos clínicos estudiaron la acción de otras cepas individuales de probióticos sin obtener diferencias significativas en el alivio del dolor abdominal. Estas cepas son Saccharomyces boulardii (28,29), Bacillus coagulans GBI-30 6086 (34), Lactobacillus reuteri ATCC 55730 (47) y Lactobacillus casei rhamnosus LCR35 (25). En ratas sanas, la cepa Lactobacillus rhamnosus JB-1[1] redujo la hipersensibilidad visceral en la distensión colorrectal (56) y gástrica (52), y observó que este efecto repercute a nivel medular sobre los ganglios de la raíz dorsal, al evitar su hiperexcitabilidad frente a un estímulo doloroso (57).
MEZCLAS DE PROBIÓTICOS
Si se consideran las mezclas de probióticos, Agrawal y colaboradores (38) hallaron un efecto positivo en el alivio del dolor abdominal para la mezcla de Bifidobacterium lactis DN-173 010, Streptococcus thermophilus, y Lactobacillus bulgaricus. Además, encontraron una correlación entre la distensión abdominal y el tiempo de tránsito colónico y orofecal, cuando los pacientes se trataron con esta mezcla. Sin embargo, los autores no proporcionaron datos de la correlación del dolor abdominal con el tiempo de tránsito. Podría ser posible que la mejoría en la distensión observada en estos pacientes pudiera, al menos en parte, aliviar su dolor abdominal. Para esa misma mezcla de probióticos, otros dos estudios (24,42) encontraron una mejoría en ambos grupos, cuando se comparaban los resultados con los datos al inicio del estudio.
Las siguientes mezclas de probióticos mostraron un efecto significativo en el alivio del dolor en los pacientes con SII:
1. B. bifidum BGN4, B. lactis AD011, Lactobacillus acidophilus AD031, y Lactobacillus casei IBS41(36).
2. L. acidophilus SDC 2012 y 2013(54). En estudios animales, Rousseaux y su equipo (58) mostraron una reducción del dolor visceral, cuando se inducían los receptores opioides y cannabinoides en las células epiteliales de ratas, tras la administración de L. acidophilus NCFM.
En un estudio (32) que evaluaba la mezcla de L. bulgaricus, S. thermophilus, Lactobacillus paracasei ssp. paracasei F19, L. acidophilus La5 y B. lactis Bb12 se halló una tendencia hacia el alivio del dolor abdominal. Los autores no proporcionaron datos sobre el valor de p. En otro estudio (33), con la misma mezcla de probióticos, no se encontraron diferencias entre los grupos, pero sí una mejoría, tanto en el grupo de tratamiento, como en el grupo placebo, con respecto al inicio del tratamiento, tanto para el alivio del dolor intestinal, como para la frecuencia de presentación de ese dolor.
Las siguientes mezclas de probióticos mostraron una tendencia a mejorar el dolor abdominal en los pacientes con SII:
1. Bifidobacterium longum LA 101, L. acidophilus LA 102, L. lactis LA 103 y S. thermophilus LA 104 (p=0,054) (40). Se encontró, además, una mejoría, tanto en el grupo de tratamiento, como en el grupo placebo, con respecto al inicio del tratamiento para todos los pacientes, así como en cada uno de los subgrupos de pacientes con SII. En el subgrupo de pacientes con un patrón alternante se halló una mejoría significativa entre ambos grupos en el alivio del dolor abdominal.
2. B. bifidum KCTC 12 199BP, B. lactis KCTC 11 904BP, B. longum KCTC 12 200BP, L. acidophilus KCTC 11 906BP, L. rhamnosus KCTC 12 202BP y S. thermophilus KCTC 11 870BP (p=0,07) (18).
3. L. rhamnosus GG (ATCC 53103, LGG), L. rhamnosus Lc705 (DSM 7061), Propionibacterium freudenreichii ssp. shermanii JS (DSM 7067) y B. animalis ssp. lactis Bb12 (DSM 15954) (p=0,052) (15).
4. Lactobacillus rhamnosus GG, L. rhamnosus LC705, Bifidobacterium breve Bb99 y P. freudenreichii ssp. shermanii JS (p=0,110) (46).
Las siguientes mezclas de probióticos no mostraron un efecto significativo en el alivio del dolor en los pacientes con SII (ver tabla 1):
1. L. acidophilus CUL-60 (NCIMB 30157) y CUL-21 (NCIMB 30156), B. bifidum CUL-20 (NCIMB 30153) y B. lactis CUL-34 (NCIMB 30172) (37). En este estudio se encontró una mejoría con respecto al inicio del tratamiento en el grupo tratado con el probiótico y en el grupo control, tanto en el alivio del dolor abdominal, como en el número de días con dolor.
2. VSL#3 (B. longum, B. infantis, B. breve, L. acidophilus, L. casei, L. delbrueckii ssp. Bulgaricus, L. plantarum, S. salivarius ssp. thermophilus) (10,45,48). Sin embargo, Dai y colaboradores (59) hallaron una disminución de la hipersensibilidad visceral, al administrar esta mezcla de probióticos en un modelo de ratas que simulan un perfil de SII, con predominio de diarrea. Estos autores además sugieren que el efecto antinociceptivo del VSL#3 podría estar mediado, al menos en parte, por la potenciación de la síntesis de óxido nítrico. En este mismo estudio se halló una disminución de la permeabilidad paracelular y el aumento de proteínas de unión estrecha de membrana, tras la administración del probiótico. Los autores no hallaron una relación entre la inhibición de la síntesis de óxido nítrico y los cambios observados en la permeabilidad intestinal, con lo que postulan que ambos factores no estarían correlacionados. Distrutti y su equipo (60) también hallaron un efecto antinociceptivo tras la administración de VSL#3 en ratas con hipersensibilidad visceral y alodinia, que además repercutió en una reversión en la expresión de genes que median el dolor y la inflamación. Además, parece ser que este efecto no se debe a un cambio en el estado de consciencia, ni a la modificación del tono rectocolónico.
3. L. acidophilus KCTC 11906BP, L. plantarum KCTC11867BP, L. rhamnosus KCTC 11868BP, B. breve KCTC 11858BP, B. lactis KCTC 11903BP, B. longum KCTC 11860BP y S. thermophilus KCTC 11870BP (13).
4. Lactobacillus sp. HY7801, B. longum HY8004 y L. brevis HY7401 (31).
Zeng y colaboradores (39) encontraron que la mezcla de probióticos que contenía L. bulgaricus, L. acidophilus y B. longum mejoraba el dolor abdominal en los pacientes del grupo de los probióticos, mientras que no se encontró una mejoría en el grupo placebo, cuando se comparaban los datos de antes y después del estudio, en cada uno de los grupos de forma individual. Sin embargo, el estudio no proporcionó datos comparando los 2 grupos. Además, sugieren que el descenso en la permeabilidad del intestino delgado, encontrada después de la ingesta de la mezcla de probióticos, podría, al menos parcialmente, contribuir a aliviar los síntomas del SII (incluyendo el dolor). Sin embargo, no proporcionaron datos de un análisis de correlación, ni mostraron una diferencia significativa entre los grupos de probióticos y placebo.
Otros estudios en animales mostraron un efecto antinociceptivo de distintas cepas de probióticos. Se encontró una modulación de la hipersensibilidad visceral de la cepa Lactobacillus paracasei NCC2461 en ratones, con hipersensibilidad inducida por antibióticos (61) (en este estudio el probiótico también normalizó los niveles de sustancia P), y en ratas, según dos modelos de hipersensibilidad inducida por estrés (62). En este último estudio, además, se observó la normalización de la permeabilidad intestinal en las ratas sometidas a separación materna, tras la administración del probiótico. Estos efectos fueron específicos de la cepa de probiótico empleada, ya que no se encontró ningún efecto tras la administración de B. lactis NCC362 ni de Lactobacillus johnsonii NCC533. Otra cepa de B. lactis –la cepa CNCM I-2494– junto con Lactococcus lactis CNCM I-1631, L. bulgaricus y S. thermophilus (63) sí redujo la hipersensibilidad visceral en ratas sometidas a estrés. Además, se demostró que este efecto era dosisdependiente. Los autores de este estudio encontraron una normalización de la permeabilidad paracelular, sugiriendo que podría ser uno de los factores que explicara ese efecto antinociceptivo.
Ait-Belgnaoui y su equipo (64) hallaron un efecto antinociceptivo tras la administración del probiótico Lactobacillus farciminis CIP 103136 en ratas sometidas a estrés, y un aumento de la permeabilidad paracelular colónica; ambos factores posiblemente influenciados por la estimulación de la liberación de óxido nítrico por el probiótico. El probiótico actuaría a nivel de la modulación de la permeabilidad intestinal, evitando la fosforilación de la cadena ligera de la miosina –y la contracción del citoesqueleto de las células epiteliales, con la consiguiente apertura de las uniones estrechas–, lo que podría deberse a la presencia de óxido nítrico. Sin embargo, como ya se ha comentó, otros autores (59) no han encontrado una relación entre el aumento de la permeabilidad paracelular y la inhibición de la síntesis de óxido nítrico, tras la administración de la mezcla de probióticos VSL#3. En otro estudio posterior (65), en el que se administró la cepa Lactobacillus farciminis CIP 103136 a ratas sometidas a estrés, se observó la disminución de la hipersensibilidad visceral, mediante el procesamiento nociceptivo visceral a niveles espinales y supraespinales, al hallar una disminución de la sobreexpresión de la proteína Fos en estos niveles.
NUEVAS PERSPECTIVAS PARA EL ESTUDIO DEL EFECTO DE LOS PROBIÓTICOS EN EL ALIVIO DEL DOLOR ABDOMINAL
Hoy en día se acepta que existe una vía de comunicación bidireccional entre el sistema nervioso central y el tracto gastrointestinal, y se postula que el SII es una entidad multifactorial, donde existe una disregulación del eje cerebro-intestinal (66). Para poder conocer el mecanismo de acción de los probióticos en el alivio del dolor abdominal sería necesario poder dilucidar el efecto de los probióticos con efectos antinociceptivos en la regulación de este eje. Tal y como se muestra en esta revisión, se ha avanzado mucho en los últimos 10 años en esta dirección.
Las futuras investigaciones podrían dirigirse al estudio del efecto de la ingesta de ciertos probióticos en la regulación de diferentes sustancias, y de las células que han demostrado tener una correlación con el dolor abdominal, tal y como los mastocitos (67), las fibras nerviosas del receptor vanilloide potencial transitorio 1 (68), la serotonina (69), el factor neutrófico derivado del cerebro (70) y la permeabilidad intestinal (71), así como las proteínas de unión estrecha (72,73) y de adhesión celular (74).
Con relación a la permeabilidad intestinal, se halló una correlación entre el dolor abdominal y la disminución de las proteínas de unión estrecha JAM-A (72) y ocludina (73), en los pacientes con SII. En animales el tratamiento con probióticos produjo una disminución de la hipersensibilidad visceral, acompañada del restablecimiento de los niveles de estas proteínas de unión estrecha (59,63). Entonces, surge la pregunta: ¿podría ser este uno de los factores que permitiera explicar el mecanismo de acción del efecto antinociceptivo de los probióticos?
Otras posibles líneas de investigación podrían dirigirse a estudiar la relación entre los efectos encontrados en los pacientes con SII, tras la administración de probióticos y el dolor abdominal. Entre estos efectos se encontrarían la disminución de la permeabilidad del intestino delgado (39) y la normalización de la respuesta inmune (44). Finalmente, la cronicidad de este síntoma hace necesario estudiar el efecto de los probióticos en la modulación del dolor abdominal, en relación a mecanismos neurales centrales y a factores psicológicos (66), y ya se están dando los primeros pasos en esa dirección (57,65).
En conclusión, hay una serie de cepas de probióticos (L. plantarum DSM 9843 (299v), B. infantis 35624 y B. bifidum MIMBb75) y mezcla de probióticos (B. lactis DN-173 010, S. thermophilus y L. bulgaricus; B. bifidum BGN4, B. lactis AD011, L. acidophilus AD031 y L. casei IBS41; y L. acidophilus SDC 2012 y 2013) que han demostrado un aparente efecto antinociceptivo y que parecen mejorar el dolor abdominal en ciertos subgrupos de pacientes con SII. Tal vez, en un futuro no muy lejano, se puedan desarrollar fórmulas magistrales con estas cepas, para tratar este síntoma tan acuciante en algunos pacientes con dicho trastorno funcional.
REFERENCIAS
1. Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC. Functional bowel disorders. Gastroenterology. 2006;130(5):1480-91. [ Links ]
2. Carroll IM, Ringel-Kulka T, Siddle JP, Ringel Y. Alterations in composition and diversity of the intestinal microbiota in patients with diarrhea-predominant irritable bowel syndrome. Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc. 2012;24(6):521-530, e248. [ Links ]
3. Chassard C, Dapoigny M, Scott KP, Crouzet L, Del'homme C, Marquet P, et al. Functional dysbiosis within the gut microbiota of patients with constipated-irritable bowel syndrome. Aliment Pharmacol Ther. 2012;35(7):828-38. [ Links ]
4. Jeffery IB, O'Toole PW, öhman L, Claesson MJ, Deane J, Quigley EMM, et al. An irritable bowel syndrome subtype defined by species-specific alterations in faecal microbiota. Gut. 2012;61(7):997-1006. [ Links ]
5. 2012 Probiotics_NEW FINAL_sp - 2012 Probiotics_NEW FINAL_sp.pdf [Internet]. [citado 12 de junio de 2014]. Recuperado a partir de: http://www.worldgastroenterology.org/assets/export/userfiles/2012%20Probiotics_NEW%20FINAL_sp.pdf [ Links ]
6. Rowland I, Capurso L, Collins K, Cummings J, Delzenne N, Goulet O, et al. Current level of consensus on probiotic science--report of an expert meeting--London, 23 November 2009. Gut Microbes. 2010;1(6):436-9. [ Links ]
7. Ng SC, Hart AL, Kamm MA, Stagg AJ, Knight SC. Mechanisms of action of probiotics: recent advances. Inflamm Bowel Dis. 2009;15(2):300-10. [ Links ]
8. Dai C, Zheng C-Q, Jiang M, Ma X-Y, Jiang L-J. Probiotics and irritable bowel syndrome. World J Gastroenterol WJG. 2013;19(36):5973-80. [ Links ]
9. Barbara G, Zecchi L, Barbaro R, Cremon C, Bellacosa L, Marcellini M, et al. Mucosal permeability and immune activation as potential therapeutic targets of probiotics in irritable bowel syndrome. J Clin Gastroenterol. 2012;46 Suppl:S52-55. [ Links ]
10. Michail S, Kenche H. Gut microbiota is not modified by Randomized, Double-blind, Placebo-controlled Trial of VSL#3 in Diarrhea-predominant Irritable Bowel Syndrome. Probiotics Antimicrob Proteins. 2011;3(1):1-7. [ Links ]
11. Kajander K, Krogius-Kurikka L, Rinttilä T, Karjalainen H, Palva A, Korpela R. Effects of multispecies probiotic supplementation on intestinal microbiota in irritable bowel syndrome. Aliment Pharmacol Ther. 2007;26(3):463-73. [ Links ]
12. Charbonneau D, Gibb RD, Quigley EMM. Fecal excretion of Bifidobacterium infantis 35624 and changes in fecal microbiota after eight weeks of oral supplementation with encapsulated probiotic. Gut Microbes. 2013;4(3):201-11. [ Links ]
13. Ki Cha B, Mun Jung S, Hwan Choi C, Song I-D, Woong Lee H, Joon Kim H, et al. The effect of a multispecies probiotic mixture on the symptoms and fecal microbiota in diarrhea-dominant irritable bowel syndrome: a randomized, double-blind, placebo-controlled trial. J Clin Gastroenterol. 2012;46(3):220-7. [ Links ]
14. Lyra A, Krogius-Kurikka L, Nikkilä J, Malinen E, Kajander K, Kurikka K, et al. Effect of a multispecies probiotic supplement on quantity of irritable bowel syndrome-related intestinal microbial phylotypes. BMC Gastroenterol. 2010;10:110. [ Links ]
15. Kajander K, Myllyluoma E, Rajilić-Stojanović M, Kyrönpalo S, Rasmussen M, Järvenpää S, et al. Clinical trial: multispecies probiotic supplementation alleviates the symptoms of irritable bowel syndrome and stabilizes intestinal microbiota. Aliment Pharmacol Ther. 2008;27(1):48-57. [ Links ]
16. Maukonen J, Satokari R, Mättö J, Söderlund H, Mattila-Sandholm T, Saarela M. Prevalence and temporal stability of selected clostridial groups in irritable bowel syndrome in relation to predominant faecal bacteria. J Med Microbiol. 2006;55(Pt 5):625-33. [ Links ]
17. Mättö J, Maunuksela L, Kajander K, Palva A, Korpela R, Kassinen A, et al. Composition and temporal stability of gastrointestinal microbiota in irritable bowel syndrome--a longitudinal study in IBS and control subjects. FEMS Immunol Med Microbiol. 2005;43(2):213-22. [ Links ]
18. Yoon JS, Sohn W, Lee OY, Lee SP, Lee KN, Jun DW, et al. Effect of multispecies probiotics on irritable bowel syndrome: a randomized, double-blind, placebo-controlled trial. J Gastroenterol Hepatol. 2014;29(1):52-9. [ Links ]
19. Spiegel B, Strickland A, Naliboff BD, Mayer EA, Chang L. Predictors of patient-assessed illness severity in irritable bowel syndrome. Am J Gastroenterol. 2008;103(10):2536-43. [ Links ]
20. Moayyedi P, Ford AC, Talley NJ, Cremonini F, Foxx-Orenstein AE, Brandt LJ, et al. The efficacy of probiotics in the treatment of irritable bowel syndrome: a systematic review. Gut. 2010;59(3):325-32. [ Links ]
21. Hoveyda N, Heneghan C, Mahtani KR, Perera R, Roberts N, Glasziou P. A systematic review and meta-analysis: probiotics in the treatment of irritable bowel syndrome. BMC Gastroenterol. 2009;9:15. [ Links ]
22. McFarland LV, Dublin S. Meta-analysis of probiotics for the treatment of irritable bowel syndrome. World J Gastroenterol WJG. 2008;14(17):2650-61. [ Links ]
23. Charbonneau D, Gibb RD, Quigley EMM. Fecal excretion of Bifidobacterium infantis 35624 and changes in fecal microbiota after eight weeks of oral supplementation with encapsulated probiotic. Gut Microbes. 2013;4(3):201-11. [ Links ]
24. Roberts LM, McCahon D, Holder R, Wilson S, Hobbs FDR. A randomised controlled trial of a probiotic «functional food» in the management of irritable bowel syndrome. BMC Gastroenterol. 2013;13:45. [ Links ]
25. Dapoigny M, Piche T, Ducrotte P, Lunaud B, Cardot J-M, Bernalier-Donadille A. Efficacy and safety profile of LCR35 complete freeze-dried culture in irritable bowel syndrome: a randomized, double-blind study. World J Gastroenterol WJG. 2012;18(17):2067-75. [ Links ]
26. Ducrotté P, Sawant P, Jayanthi V. Clinical trial: Lactobacillus plantarum 299v (DSM 9843) improves symptoms of irritable bowel syndrome. World J Gastroenterol WJG. 2012;18(30):4012-8. [ Links ]
27. Kruis W, Chrubasik S, Boehm S, Stange C, Schulze J. A double-blind placebo-controlled trial to study therapeutic effects of probiotic Escherichia coli Nissle 1917 in subgroups of patients with irritable bowel syndrome. Int J Colorectal Dis. 2012;27(4):467-74. [ Links ]
28. Kabir MA, Ishaque SM, Ali MS, Mahmuduzzaman M, Hasan M. Role of Saccharomyces boulardii in diarrhea predominant irritable bowel syndrome. Mymensingh Med J MMJ. 2011;20(3):397-401. [ Links ]
29. Choi CH, Jo SY, Park HJ, Chang SK, Byeon J-S, Myung S-J. A randomized, double-blind, placebo-controlled multicenter trial of saccharomyces boulardii in irritable bowel syndrome: effect on quality of life. J Clin Gastroenterol. 2011;45(8):679-83. [ Links ]
30. Guglielmetti S, Mora D, Gschwender M, Popp K. Randomised clinical trial: Bifidobacterium bifidum MIMBb75 significantly alleviates irritable bowel syndrome and improves quality of life--a double-blind, placebo-controlled study. Aliment Pharmacol Ther. 2011;33(10):1123-32. [ Links ]
31. Hong Y-S, Hong KS, Park M-H, Ahn Y-T, Lee J-H, Huh C-S, et al. Metabonomic understanding of probiotic effects in humans with irritable bowel syndrome. J Clin Gastroenterol. 2011;45(5):415-25. [ Links ]
32. Søndergaard B, Olsson J, Ohlson K, Svensson U, Bytzer P, Ekesbo R. Effects of probiotic fermented milk on symptoms and intestinal flora in patients with irritable bowel syndrome: a randomized, placebo-controlled trial. Scand J Gastroenterol. 2011;46(6):663-72. [ Links ]
33. Simrén M, Ohman L, Olsson J, Svensson U, Ohlson K, Posserud I, et al. Clinical trial: the effects of a fermented milk containing three probiotic bacteria in patients with irritable bowel syndrome - a randomized, double-blind, controlled study. Aliment Pharmacol Ther. 2010;31(2):218-27. [ Links ]
34. Dolin BJ. Effects of a proprietary Bacillus coagulans preparation on symptoms of diarrhea-predominant irritable bowel syndrome. Methods Find Exp Clin Pharmacol. 2009;31(10):655-9. [ Links ]
35. Hun L. Bacillus coagulans significantly improved abdominal pain and bloating in patients with IBS. Postgrad Med. 2009;121(2):119-24. [ Links ]
36. Hong KS, Kang HW, Im JP, Ji GE, Kim SG, Jung HC, et al. Effect of probiotics on symptoms in korean adults with irritable bowel syndrome. Gut Liver. 2009;3(2):101-7. [ Links ]
37. Williams EA, Stimpson J, Wang D, Plummer S, Garaiova I, Barker ME, et al. Clinical trial: a multistrain probiotic preparation significantly reduces symptoms of irritable bowel syndrome in a double-blind placebo-controlled study. Aliment Pharmacol Ther. 2009;29(1):97-103. [ Links ]
38. Agrawal A, Houghton LA, Morris J, Reilly B, Guyonnet D, Goupil Feuillerat N, et al. Clinical trial: the effects of a fermented milk product containing Bifidobacterium lactis DN-173 010 on abdominal distension and gastrointestinal transit in irritable bowel syndrome with constipation. Aliment Pharmacol Ther. 2009;29(1):104-14. [ Links ]
39. Zeng J, Li Y-Q, Zuo X-L, Zhen Y-B, Yang J, Liu C-H. Clinical trial: effect of active lactic acid bacteria on mucosal barrier function in patients with diarrhoea-predominant irritable bowel syndrome. Aliment Pharmacol Ther. 2008;28(8):994-1002. [ Links ]
40. Drouault-Holowacz S, Bieuvelet S, Burckel A, Cazaubiel M, Dray X, Marteau P. A double blind randomized controlled trial of a probiotic combination in 100 patients with irritable bowel syndrome. Gastroentérologie Clin Biol. 2008;32(2):147-52. [ Links ]
41. Sinn DH, Song JH, Kim HJ, Lee JH, Son HJ, Chang DK, et al. Therapeutic effect of Lactobacillus acidophilus-SDC 2012, 2013 in patients with irritable bowel syndrome. Dig Dis Sci. 2008;53(10):2714-8. [ Links ]
42. Guyonnet D, Chassany O, Ducrotte P, Picard C, Mouret M, Mercier C-H, et al. Effect of a fermented milk containing Bifidobacterium animalis DN-173 010 on the health-related quality of life and symptoms in irritable bowel syndrome in adults in primary care: a multicentre, randomized, double-blind, controlled trial. Aliment Pharmacol Ther. 2007;26(3):475-86. [ Links ]
43. Whorwell PJ, Altringer L, Morel J, Bond Y, Charbonneau D, O'Mahony L, et al. Efficacy of an encapsulated probiotic Bifidobacterium infantis 35624 in women with irritable bowel syndrome. Am J Gastroenterol. 2006;101(7):1581-90. [ Links ]
44. O'Mahony L, McCarthy J, Kelly P, Hurley G, Luo F, Chen K, et al. Lactobacillus and bifidobacterium in irritable bowel syndrome: symptom responses and relationship to cytokine profiles. Gastroenterology. 2005;128(3):541-51. [ Links ]
45. Kim HJ, Vazquez Roque MI, Camilleri M, Stephens D, Burton DD, Baxter K, et al. A randomized controlled trial of a probiotic combination VSL# 3 and placebo in irritable bowel syndrome with bloating. Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc. 2005;17(5):687-96. [ Links ]
46. Kajander K, Hatakka K, Poussa T, Färkkilä M, Korpela R. A probiotic mixture alleviates symptoms in irritable bowel syndrome patients: a controlled 6-month intervention. Aliment Pharmacol Ther. 2005;22(5):387-94. [ Links ]
47. Niv E, Naftali T, Hallak R, Vaisman N. The efficacy of Lactobacillus reuteri ATCC 55730 in the treatment of patients with irritable bowel syndrome--a double blind, placebo-controlled, randomized study. Clin Nutr Edinb Scotl. 2005;24(6):925-31. [ Links ]
48. Kim HJ, Camilleri M, McKinzie S, Lempke MB, Burton DD, Thomforde GM, et al. A randomized controlled trial of a probiotic, VSL#3, on gut transit and symptoms in diarrhoea-predominant irritable bowel syndrome. Aliment Pharmacol Ther. 2003;17(7):895-904. [ Links ]
49. Nobaek S, Johansson ML, Molin G, Ahrné S, Jeppsson B. Alteration of intestinal microflora is associated with reduction in abdominal bloating and pain in patients with irritable bowel syndrome. Am J Gastroenterol. 2000;95(5):1231-8. [ Links ]
50. Duncker SC, Wang L, Hols P, Bienenstock J. The D-alanine content of lipoteichoic acid is crucial for Lactobacillus plantarum-mediated protection from visceral pain perception in a rat colorectal distension model. Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc. 2008;20(7):843-50. [ Links ]
51. Duncker SC, Kamiya T, Wang L, Yang P, Bienenstock J. Probiotic Lactobacillus reuteri alleviates the response to gastric distension in rats. J Nutr. 2011;141(10):1813-8. [ Links ]
52. Grangette C, Nutten S, Palumbo E, Morath S, Hermann C, Dewulf J, et al. Enhanced antiinflammatory capacity of a Lactobacillus plantarum mutant synthesizing modified teichoic acids. Proc Natl Acad Sci U S A. 2005;102(29):10321-6. [ Links ]
53. Johnson AC, Greenwood-Van Meerveld B, McRorie J. Effects of Bifidobacterium infantis 35624 on post-inflammatory visceral hypersensitivity in the rat. Dig Dis Sci. 2011;56(11):3179-86. [ Links ]
54. McKernan DP, Fitzgerald P, Dinan TG, Cryan JF. The probiotic Bifidobacterium infantis 35624 displays visceral antinociceptive effects in the rat. Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc. 2010;22(9):1029-1035, e268. [ Links ]
55. Liebregts T, Adam B, Bertel A, Jones S, Schulze J, Enders C, et al. Effect of E. coli Nissle 1917 on post-inflammatory visceral sensory function in a rat model. Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc. 2005;17(3):410-4. [ Links ]
56. Kamiya T, Wang L, Forsythe P, Goettsche G, Mao Y, Wang Y, et al. Inhibitory effects of Lactobacillus reuteri on visceral pain induced by colorectal distension in Sprague-Dawley rats. Gut. 2006;55(2):191-6. [ Links ]
57. Ma X, Mao Y-K, Wang B, Huizinga JD, Bienenstock J, Kunze W. Lactobacillus reuteri ingestion prevents hyperexcitability of colonic DRG neurons induced by noxious stimuli. Am J Physiol Gastrointest Liver Physiol. 2009;296(4):G868-875. [ Links ]
58. Rousseaux C, Thuru X, Gelot A, Barnich N, Neut C, Dubuquoy L, et al. Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptors. Nat Med. 2007;13(1):35-7. [ Links ]
59. Dai C, Guandalini S, Zhao D-H, Jiang M. Antinociceptive effect of VSL#3 on visceral hypersensitivity in a rat model of irritable bowel syndrome: a possible action through nitric oxide pathway and enhance barrier function. Mol Cell Biochem. 2012;362(1-2):43-53. [ Links ]
60. Distrutti E, Cipriani S, Mencarelli A, Renga B, Fiorucci S. Probiotics VSL#3 protect against development of visceral pain in murine model of irritable bowel syndrome. PloS One. 2013;8(5):e63893. [ Links ]
61. Verdú EF, Bercik P, Verma-Gandhu M, Huang X-X, Blennerhassett P, Jackson W, et al. Specific probiotic therapy attenuates antibiotic induced visceral hypersensitivity in mice. Gut. 2006;55(2):182-90. [ Links ]
62. Eutamene H, Lamine F, Chabo C, Theodorou V, Rochat F, Bergonzelli GE, et al. Synergy between Lactobacillus paracasei and its bacterial products to counteract stress-induced gut permeability and sensitivity increase in rats. J Nutr. 2007;137(8):1901-7. [ Links ]
63. Agostini S, Goubern M, Tondereau V, Salvador-Cartier C, Bezirard V, Lévèque M, et al. A marketed fermented dairy product containing Bifidobacterium lactis CNCM I-2494 suppresses gut hypersensitivity and colonic barrier disruption induced by acute stress in rats. Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc. 2012;24(4):376-e172. [ Links ]
64. Ait-Belgnaoui A, Han W, Lamine F, Eutamene H, Fioramonti J, Bueno L, et al. Lactobacillus farciminis treatment suppresses stress induced visceral hypersensitivity: a possible action through interaction with epithelial cell cytoskeleton contraction. Gut. 2006;55(8):1090-4. [ Links ]
65. Ait-Belgnaoui A, Eutamene H, Houdeau E, Bueno L, Fioramonti J, Theodorou V. Lactobacillus farciminis treatment attenuates stress-induced overexpression of Fos protein in spinal and supraspinal sites after colorectal distension in rats. Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc. 2009;21(5):567-573, e18-19. [ Links ]
66. Elsenbruch S. Abdominal pain in Irritable Bowel Syndrome: a review of putative psychological, neural and neuro-immune mechanisms. Brain Behav Immun. 2011;25(3):386-94. [ Links ]
67. Barbara G, Stanghellini V, De Giorgio R, Cremon C, Cottrell GS, Santini D, et al. Activated mast cells in proximity to colonic nerves correlate with abdominal pain in irritable bowel syndrome. Gastroenterology. 2004;126(3):693-702. [ Links ]
68. Keszthelyi D, Troost FJ, Jonkers DM, Helyes Z, Hamer HM, Ludidi S, et al. Alterations in mucosal neuropeptides in patients with irritable bowel syndrome and ulcerative colitis in remission: a role in pain symptom generation? Eur J Pain Lond Engl. 2013;17(9):1299-306. [ Links ]
69. Cremon C, Carini G, Wang B, Vasina V, Cogliandro RF, De Giorgio R, et al. Intestinal serotonin release, sensory neuron activation, and abdominal pain in irritable bowel syndrome. Am J Gastroenterol. 2011;106(7):1290-8. [ Links ]
70. Yu Y-B, Zuo X-L, Zhao Q-J, Chen F-X, Yang J, Dong Y-Y, et al. Brain-derived neurotrophic factor contributes to abdominal pain in irritable bowel syndrome. Gut. 2012;61(5):685-94. [ Links ]
71. Piche T, Barbara G, Aubert P, Bruley des Varannes S, Dainese R, Nano JL, et al. Impaired intestinal barrier integrity in the colon of patients with irritable bowel syndrome: involvement of soluble mediators. Gut. 2009;58(2):196-201. [ Links ]
72. Wilcz-Villega EM, McClean S, O'Sullivan MA. Mast cell tryptase reduces junctional adhesion molecule-A (JAM-A) expression in intestinal epithelial cells: implications for the mechanisms of barrier dysfunction in irritable bowel syndrome. Am J Gastroenterol. 2013;108(7):1140-51. [ Links ]
73. Bertiaux-Vandaële N, Youmba SB, Belmonte L, Lecleire S, Antonietti M, Gourcerol G, et al. The expression and the cellular distribution of the tight junction proteins are altered in irritable bowel syndrome patients with differences according to the disease subtype. Am J Gastroenterol. 2011;106(12):2165-73. [ Links ]
74. Wilcz-Villega E, McClean S, O'Sullivan M. Reduced E-cadherin expression is associated with abdominal pain and symptom duration in a study of alternating and diarrhea predominant IBS. Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc. 2014;26(3):316-25. [ Links ]
[1] A pesar de que en los títulos y en los artículos se habla de la especie L. reuterii los autores rectificaron el nombre de la especie (ver referencia 65 para más información).











 text in
text in