Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957
Rev Col Gastroenterol vol.29 no.2 Bogotá abr./jun. 2014
Aproximación al diagnóstico patológico de las enfermedades colestásicas
Rocío del Pilar López Panqueva MD.(1)
(1) Médica Patóloga, Hospital Universitario Fundación Santa Fe de Bogotá. Universidad de Los Andes. Bogotá, Colombia.
Fecha recibido: 12-05-14 Fecha aceptado: 19-05-14
Resumen
Cualquier enfermedad que lleve a la alteración del flujo biliar o del metabolismo de las sales biliares se traduce en colestasis. Son múltiples las causas que pueden producirla, sea por su localización anatómica intrahepática o extrahepática, agudas o crónicas, con o sin lesión hepatocelular acompañante, o primarias o secundarias, por lo que resultan numerosas las entidades que deben ser consideradas como parte del diagnóstico diferencial de las enfermedades colestásicas y que plantean un gran reto diagnóstico tanto para el clínico, como para el patólogo (1). En el presente estudio se plantea una aproximación diagnóstica basada en patrones histológicos, haciendo énfasis en las enfermedades colestásicas crónicas del adulto, en próximos estudios se tratarán las de la población pediátrica.
Palabras clave
Colestasis, colestasis aguda, colestasis crónica, biopsia hepática, colangitis aguda, cirrosis biliar primaria, colangitis esclerosante primaria, colangitis IgG4.
Abstract
Any disease that leads to impaired bile flow or impaired bile salt metabolism results in cholestasis. There are several causes of the disease related to intrahepatic or extrahepatic anatomical locations, to whether the disease is acute or chronic, to whether or not hepatocellular damage occurs, and to whether or not the condition is primary or secondary. The large number of entities that must be considered in the differential diagnosis of cholestatic diseases poses a major diagnostic challenge for both the clinician and the pathologist (1). This article establishes a diagnostic approach based on histologic patterns which emphasizes adult chronic cholestatic diseases. The next article will focus on the pediatric population.
Keywords
Cholestasis, acute cholestasis, chronic cholestasis, liver biopsy, acute cholangitis, primary biliary cirrhosis, primary sclerosing cholangitis, IgG4 cholangitis.
INTRODUCCIÓN
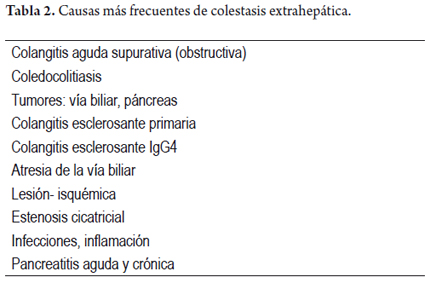
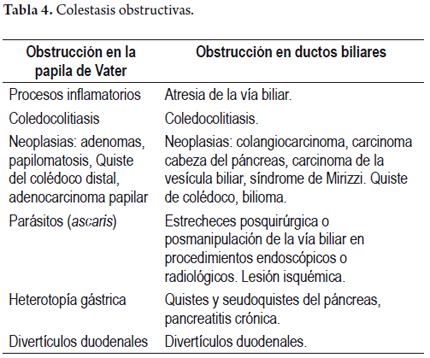
Es importante recordar que el hígado utiliza el transporte activo para la secreción de sales biliares desde el canalículo y a través de las hendiduras hepatocelulares, luego de secretarse, atraen por ósmosis los componentes restantes de la bilis, especialmente sodio y agua; este flujo biliar pasa por un sistema de ductos colectores que constituyen los conductos biliares que drenan la bilis en un circuito que rodea los hepatocitos y, luego, forman los conductos biliares intrahepáticos hasta los conductos hepáticos derecho e izquierdo, conducto hepático común, el cual, junto al cístico, drena la bilis almacenada en la vesícula biliar y constituyen el conducto colédoco, que desemboca en la segunda porción del duodeno a nivel de la ampolla de Vater, donde solubiliza las grasas y vitaminas, facilitando la digestión y absorción de nutrientes. La colestasis puede, entonces, producirse por lesión en cualquiera de estas regiones, y se divide en colestasis intrahepática y colestasis extrahepática, en las tablas 1 y 2 se resumen algunas de las múltiples etiologías. Cuando ocurren con o sin lesión hepatocelular acompañante, en forma aguda, recurrente o si persiste por más de 6 meses se le considera como colestasis crónica (tablas 3 y 4) y pueden presentarse tanto en la edad adulta como la infantil.
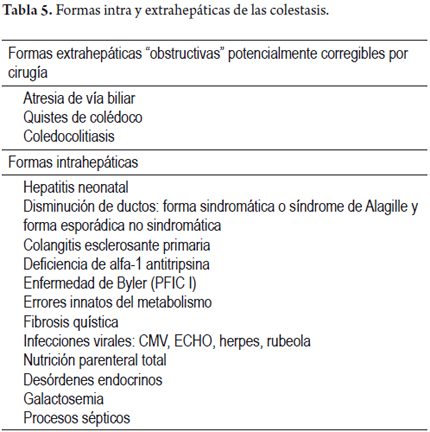
La gran mayoría de las colestasis extrahepáticas se resuelven con tratamiento quirúrgico, endoscópico o con procedimientos invasivos radiológicos, mientras que las colestasis intrahepática, usualmente, requieren otro tipo de terapias (tabla 5). Las manifestaciones clínicas se derivan de la acumulación de bilis, sea en el parénquima hepático, en sangre o en los tejidos, donde se pueden excretar sustancias que fisiológicamente contienen la bilis. Es así, como en ocasiones, en forma indirecta, la disfunción del metabolismo de los ácidos biliares se acompaña también de la alteración en el metabolismo de la bilirrubina, lo cual se traduce en ictericia en la piel y/o las mucosas, acompañado de coluria, acolia o hipocolia. El prurito es un síntoma cardinal en las enfermedades colestásicas crónicas, así como las manifestaciones derivadas de la malabsorción como esteatorrea, déficit de absorción de vitaminas liposolubles, xantomas, xantelasmas, alteraciones de la coagulación, osteopenia, osteoporosis u osteomalacia. Algunas de las alteraciones bioquímicas observadas son la presencia de hiperbilirrubinemia, elevación de la fosfatasa alcalina, o de la gamma glutamiltransferasa, hipercolesterolemia y elevación de las aminotransferasas. Siempre se deben descartar enfermedades virales, especialmente hepatitis B y C, y conocer antecedentes importantes como la presencia de síndrome metabólico, ingesta de tóxicos como el alcohol o medicamentos; igualmente, las imágenes diagnósticas pueden ayudar en el diagnóstico diferencial de las colestasis intrahepáticas o extrahepáticas, e inclusive hacer el diagnóstico etiológico. Sin embargo, en ocasiones es necesario realizar una biopsia hepática, sea para determinar la etiología de una colestasis, o establecer otros parámetros como: actividad inflamatoria, confirmar la presencia de cambios estructurales, excluir patologías asociadas, o establecer si hay progresión de una patología ya diagnosticada; por esta razón, en el presente artículo se enfatiza en los hallazgos histopatológicos más importantes que pueden ser de utilidad, especialmente, en las entidades más frecuentes tanto de la población adulta como infantil, aseverando que siempre deberá hacerse un análisis conjunto con la historia clínica completa, estudios de laboratorio e imagenológicos (2,3,4).
¿CÓMO EVALUAR HISTOPATOLÓGICAMENTE LA ENFERMEDAD COLESTÁSICA?
En las fases más tempranas de la colestasis los cambios son absolutamente reversibles y ultraestructurales, observándose edema de los hepatocitos periportales (cambio hidrópico), con reforzamiento de la membrana citoplasmática, edema mitocondrial y megamitocondrias, hipertrofia del retículo endoplásmico rugoso y liso. En la medida en que la lesión persiste, ya pueden empezar a detectarse cambios en la microscopía de luz.
Los cambios morfológicos que se ven en el estudio histopatológico se dividirán en los que son comunes a la mayoría de las patologías, dando brevemente la explicación fisiopatológica de cada uno de ellos, la aproximación diagnóstica con base en patrones morfológicos y por último las claves del diagnóstico de las entidades que se observan con mayor frecuencia en el estudio patológico.
Se verán, entonces, cambios comunes presentes en casi todas las enfermedades colestásicas agudas o crónicas, los cuales se presentan a nivel hepatocelular, canalicular (ductal y ductular).
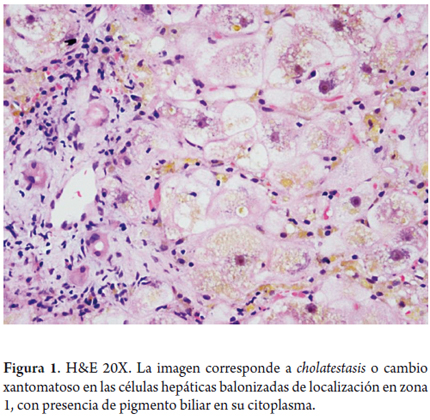
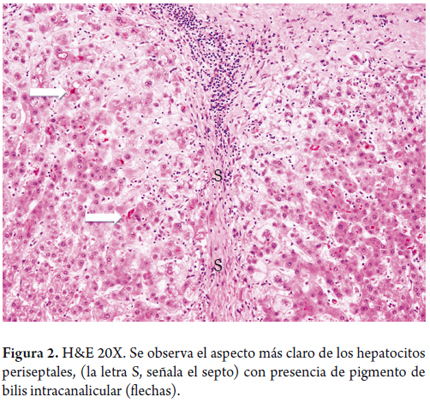
La lesión hepatocelular es causada por la presencia de sales biliares retenidas dentro del hepatocito. Una de las primeras en aparecer ante esta lesión hepatocelular es el edema o balonización, dando la imagen conocida como cholatestasis, cambio xantomatoso, especialmente localizada a nivel periportal o periseptal, lo cual da un panorama más claro a esta zona; también se observan cuerpos de Mallory-Denk, depósitos de cobre y/o de su proteína fijadora (figuras 1 y 2).
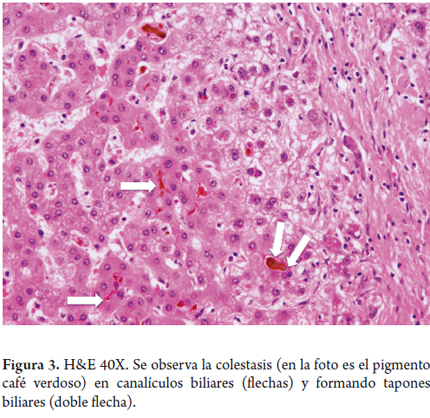
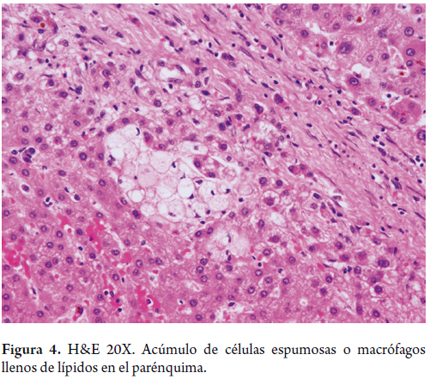
La estasis biliar y la pérdida del tono de los microfilamentos pericanaliculares, lesionan la membrana canalicular, lo cual conlleva al daño de las uniones intercelulares y ocurre el paso de bilis a la sangre, traduciéndose esto en la bilirrubinostasis, primero canalicular y luego ductal. De persistir la lesión puede llevar a la formación de tapones biliares (figura 3), con importante dilatación ductal o canalicular, acompañada de inflamación; y en el parénquima, cúmulos de macrófagos llenos de lípidos (figura 4).
Para diferenciar si el pigmento pardo, en ocasiones muy sutil, observado a nivel hepatocitario, corresponde realmente a un pigmento biliar, son útiles los estudios de histoquímica, por ejemplo azul de Prusia que identifica depósitos de hierro, o la coloración de Ziehl-Nielsen para diferenciar el pigmento de lipofuscina (tinción positiva) del biliar (tinción negativa), los cuales pueden ser muy semejantes a la observación con coloraciones de rutina.
En el intento de ayudar a mejorar el flujo biliar hay proliferación de canalículos biliares secundarios o proliferación colangiolar/ductular, con ductos pequeños angulados e irregulares en su forma, dispuestos en la periferia de los tractos portales; esta reacción ductular es derivada de las células hepáticas periportales progenitoras o stem cell (HPSC), descritas hace una década, y refleja la interacción de mediadores paracrinos y autocrinos, que incluyen la liberación de citocinas como la interleucina 8 (5,6).
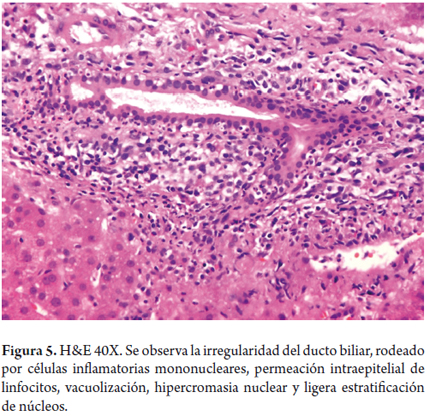
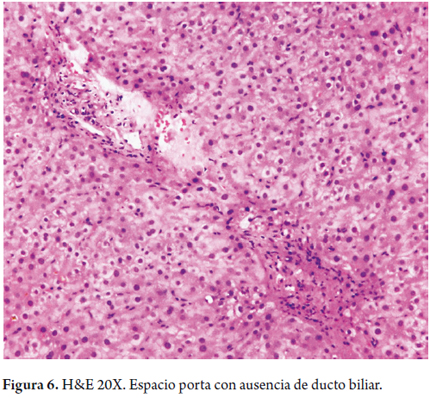
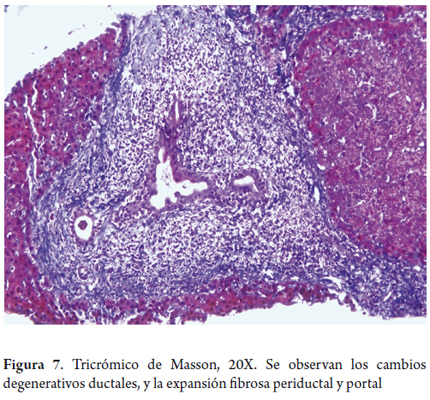
También hay una reacción inflamatoria portal, la cual compromete especialmente los ductos biliares con presencia de células inflamatorias, permeando el epitelio, produciendo cambios degenerativos en los mismos, con irregularidad del contorno, seudoestratificación e hipercromasia nuclear, vacuolización celular y, en ocasiones, se identifican mitosis (figura 5). Es indispensable evaluar también la pérdida de ductos biliares. Se considera que en condiciones normales hasta el 7% de las arterias hepáticas no se acompañan de ductos biliares, pero si en más del 50% de los tractos portales hay ausencia de ductos biliares, con presencia de solamente sus estructuras vasculares, se considera una verdadera pérdida de ductos o ductopenia (figura 6); en ocasiones, para corroborarlo es útil realizar estudios de inmunohistoquímica para citoqueratina 7 o 19, con las que se hacen evidentes los ductos biliares cuando no son observados claramente con las hematoxilina eosina o de histoquímica. Posteriormente, se inicia la fibrosis con proliferación de colágeno ensanchando los espacios porta o con esclerosis periductal y periductular (figura 7).
Siguiendo las recomendaciones del doctor Jay H. Lefkowitch y entendiendo los cambios histopatológicos generales, se describirá lo encontrado en algunas de las patologías colestásicas más frecuentes con base en patrones morfológicos (7,8).
El patrón histológico de la colestasis aguda se refiere a aquella de pocos días o semanas de duración y en la que se pueden 4 diferentes tipos o patrones:
Colestasis obstructiva
Es el primer patrón o de tipo clásico. Es causada por un impedimento mecánico del flujo de bilis, incluyendo a los ductos biliares extrahepáticos y a los ductos perihiliares. Algunos ejemplos etiológicos se resumen en la tabla 4.
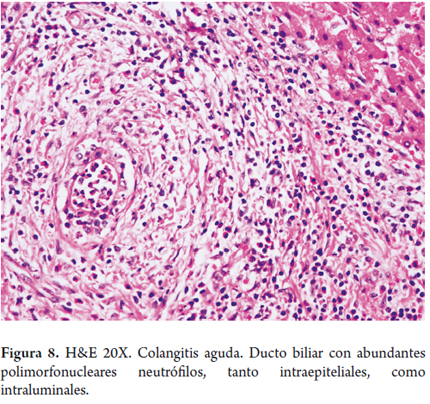
Morfológicamente se traduce en colestasis del parénquima, con estasis biliar que se localiza en la zona 3 o perivenular, con pigmento biliar en hepatocitos y canalículos, algunas veces en células de Kupffer (figura 7) y, dependiendo del sitio de la obstrucción, puede comprometer conductos biliares focales o en varias zonas del hígado; o zonales, comprometiendo extensas áreas del parénquima. Esto se suma a los clásicos cambios a nivel de la triada portal que incluyen edema, proliferación ductular e infiltrado inflamatorio, el cual es predominantemente de polimorfonucleares neutrófilos o colangitis aguda (figura 8), a veces mezclado con linfocitos o plasmocitos, descritos en 1970 por Poulsen (9).
Usualmente, persiste la secreción de bilis por la función residual de los hepatocitos y su circulación por la resorción de los capilares a nivel de las estrechas uniones intercelulares localizadas, especialmente, a nivel periportal; y si la obstrucción es incompleta puede existir reacción ductular sin evidencia de colestasis, por ejemplo, cuando el compromiso obstructivo es segmentario o los ductos perihiliares están intactos, o si recientemente se ha colocado un stent biliar.
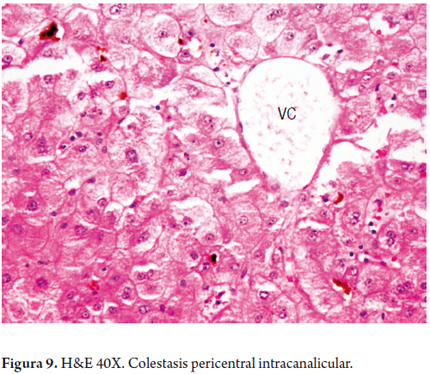
Colestasis pura o blanda
El segundo patrón corresponde a la presencia característica de bilis dentro de los hepatocitos y/o canalículos biliares de la región centrolobulillar o zona 3, sin alteraciones portales o parenquimatosas significantes o llamativas (figura 9).
Este patrón es característico de la colestasis intrahepática observada en los procesos sépticos (por efecto de la circulación de citocinas y endotoxinas), en algunos casos de toxicidad medicamentosa, cuando existe alteración funcional al flujo biliar (como el que ocurre en la lesión de perfusión/reperfusión durante el trasplante hepático), fenómenos de hipoxia o isquemia, o al presentarse mutaciones en las proteínas de transporte de las sales biliares, como por ejemplo en la colestasis intrahepática progresiva familiar, colestasis intrahepática benigna recurrente y en algunas mitocondriopatías (10-13).
Enfermedades del ducto biliar intrahepático
Para reconocer el patrón número 3 es absolutamente necesaria la presencia, en la biopsia hepática, de ductos biliares interlobares acompañados de arteriolas hepáticas de calibre semejante. El clásico ejemplo es la cirrosis biliar primaria (CBP), donde se encuentra, en sus primeras etapas, daño del ducto biliar secundario a la inflamación de la célula del epitelio ductal interlobar, con marginación celular intraepitelial de linfocitos, plasmocitos y/o de algunos eosinófilos, llevando a los cambios degenerativos del epitelio ductal con apoptosis, vacuolización y seudoestratificación nuclear, tan característicos de esta entidad (figura 10) (14).
Cambios muy similares ocurren también en el daño ductal secundario a la toxicidad medicamentosa, como la amoxicilina, y en el rechazo agudo celular postrasplante hepático. En este patrón también se incluyen las enfermedades ductopénicas, en las que hay pérdida de al menos el 50% de los ductos biliares portales, como el síndrome de desaparición de ductos vanishing bile duct sindrome, disminución de ductos sindromática (síndrome de Allagille) o no sindromática, ductopenia idiopática del adulto y las enfermedades colestásicas crónicas clásicas, como cirrosis biliar primaria o la colangitis esclerosante primaria.
Hepatitis asociada a colestasis
En el patrón tipo 4 se observan los cambios clásicos de hepatitis con desarreglo lobulillar, balonización, apoptosis, inflamación lobulillar y portal. La colestasis puede ser inconspicua o leve, como la descrita en las hepatitis virales B y C; se observa mucho más en la HVA y HVE. También puede verse en hepatitis alcohólica, en la inducida por drogas y en hepatitis autoinmune.
Patrón histológico de colestasis crónica
Este patrón se describe cuando hay evidencia de colestasis prolongada, usualmente, durante varias semanas, meses o por largos períodos de tiempo, con compromiso de los ductos biliares grandes o lesión de los ductos biliares intrahepáticos, como en la cirrosis biliar primaria (CBP), y compromiso intrahepático y extrahepático de la colangitis esclerosante primaria (CEP), los cuales pueden tener cambios muy semejantes en fases tardías.
En estos casos, la colestasis ha progresado de centrolobulillar a panlobular, con cambio xantomatoso o cholatestasis en hepatocitos periportales o periseptales, depósito de cobre o de su proteína fijadora, y presencia de cuerpos de Mallory-Denk. La progresión de estos cambios lleva a la cirrosis de tipo biliar, en la cual los nódulos son irregulares, de aspecto geográfico y con un "efecto de halo", que corresponde a una apariencia clara de los hepatocitos de la periferia de los nódulos. Lo anterior ocurre por la mezcla de edema periseptal y cambio seudoxantomatoso. Para la colestasis crónica se describen 3 patrones:
Patrón de tipo 1: presencia de la clásica fibrosis portal y/o periportal
Este se observa, principalmente, cuando la obstrucción crónica de un ducto biliar grande lleva a la expansión con fibrosis portal, formando luego septos porta-porta. Se acompaña de proliferación ductular, pero aún están preservados los ductos biliares interlobares. Son ejemplos característicos la obstrucción de ductos biliares grandes por una lesión tumoral de la cabeza del páncreas, por ejemplo, el adenocarcinoma de la cabeza del páncreas, estrecheces biliares y la atresia de la vía biliar extrahepática.
Patrón de tipo 2: fibrosis periductal con anomalías ductales
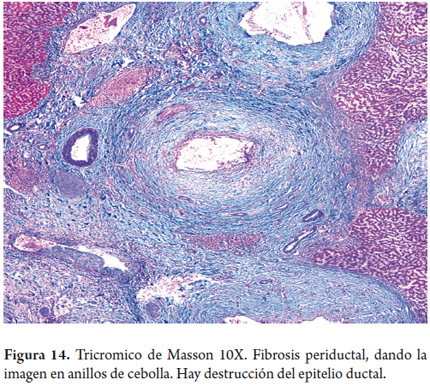
La lesión se centra en los ductos biliares portales, por ejemplo en la colangitis esclerosante primaria con lesiones fibroobliterativas periductales, formando la imagen en anillos de cebolla, tanto en ductos pequeños, como grandes; lesiones semejantes se observan también en la colangitis esclerosante secundaria a otros procesos obstructivos.
Patrón tipo 3: la ductopenia y destrucción ductal atípica
En las enfermedades colestásicas crónicas hay pérdida ductal con o sin reacción ductular y fibrosis muy semejante al tipo 1. Pueden existir además agregados linfoides. Son ejemplos la CBP y CEP, también la reacción toxicomedicamentosa.
A continuación se presentarán las claves diagnósticas, desde el punto de vista netamente patológico, de los desórdenes más conocidos del adulto.
CIRROSIS BILIAR PRIMARIA (CBP)
Es considerada una enfermedad autoinmune, idiopática que ataca con mayor frecuencia a mujeres de edad media (relación mujer: hombre de 9-10:1), en raras ocasiones antes de los 30 años, con antecedente de otras enfermedades autoinmunes, como por ejemplo tiroiditis, síndrome de Sjögren, artritis reumatoidea, síndrome de Raynaud, queratoconjuntivitis, o compromiso generalizado del epitelio ductal de glándula salivar, lacrimal y pancreatobiliar.
El diagnóstico se basa en la combinación de 3 criterios: el primero, bioquímico con evidencia de colestasis, especialmente con elevación de la fosfatasa alcalina de al menos de 6 meses de duración; segundo, la presencia de autoanticuerpos con anticuerpos antimitocondria (AMA) en títulos mayores a 1:40, presentes en al menos el 90-95% de las pacientes; y tercero, la evidencia histopatológica de colangitis no supurativa con destrucción inmunomediada de ductos biliares de pequeño y mediano calibre. El consenso de expertos recomienda tener al menos 2 de estos tres criterios (evidencia clase I nivel B) (15,16,17).
El principal problema para el diagnóstico histopatológico es la focalidad de las lesiones ductales, por lo que es recomendable obtener un muestreo adecuado, de ser posible del hígado derecho y del izquierdo, y tener al menos entre 10 y 15 espacios porta, realizar cortes seriados de hematoxilina-eosina y coloraciones de histoquímica completas, incluyendo cobre y su proteína fijadora.
Las razones que llevan al clínico a realizar una biopsia hepática son limitadas, por lo que puede ser útil para establecer el diagnóstico en pacientes AMA negativos, confirmar la sospecha diagnóstica aún con AMA positivo, excluir enfermedades concurrentes como esteatohepatitis o síndromes de sobreposición (CBP mas hepatitis autoinmune o CBP con colangitis esclerosante primaria), estadificar la enfermedad y monitorizar la progresión o la respuesta al tratamiento (17).
En etapas tempranas los cambios se centran en los tractos portales; a medida que la enfermedad progresa se verán los efectos parenquimatosos de la colestasis crónica, inclusive la inflamación puede atravesar la placa limitante, pero es mínima y difícil de diferenciar de una hepatitis crónica o enfermedad necroinflamatoria.
¿Qué se debe, entonces, tener en cuenta?
La presencia de:
- Colangitis no supurativa y destructiva ductal, caracterizada por la inflamación con infiltrado, especialmente, de plasmocitos, con linfocitos, escasos eosinófilos y macrófagos de localización portal.
- Demostrar lesión ductal florida con sus tres componentes: inflamación, daño del epitelio ductal y disrupción de la membrana basal del ducto biliar. Los ductos que típicamente están comprometidos son los biliares interlobares de 40 a 80 µ de diámetro.
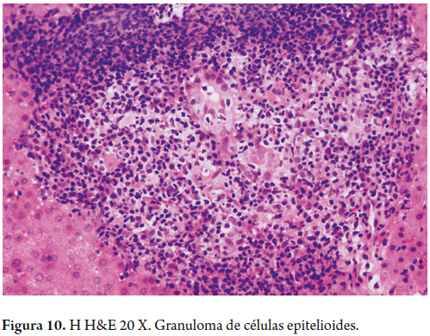
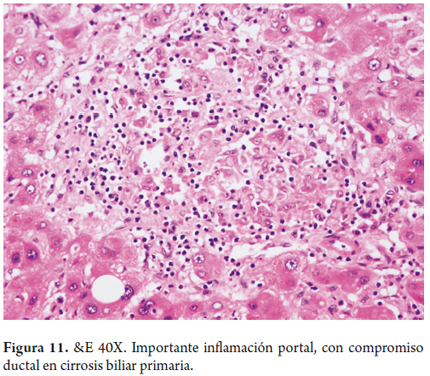
- Colangitis granulomatosa, es la presencia de granulomas de células epitelioides, no necrotizantes, usualmente mal formados, o seudogranulomas que se localizan, especialmente, en los espacios porta o rodeando los ductos biliares que muestran cambios degenerativos (figura 11).
Ocasionalmente hay granulomas y acúmulos de macrófagos lobulillares. La formación de granulomas resulta de una compleja interacción de macrófagos activados y de potentes mediadores quimiotácticos que captan, realizan la diferenciación, proliferación y el acúmulo de monocitos y linfocitos T en el tracto portal (18).
- En fases tardías se pueden observar los cambios clásicos de enfermedad colestásica, con cambio xantomatoso periportal, depósitos de cobre y proteína fijadora y, algunas veces, cuerpos de Mallory-Denk.
- Evidenciar ductopenia, que es la consecuencia final de la destrucción ductal por la inflamación y los granulomas, la cual se ve en estadios 3 y 4.
- Si existe ya cirrosis, frecuentemente es de tipo biliar, con nódulos irregulares; casi nunca los nódulos cirróticos son tan redondeados, parecen fichas de rompecabezas, con halos claros periféricos periseptales, cambio xantomatoso y depósitos de cobre o de su proteína fijadora.
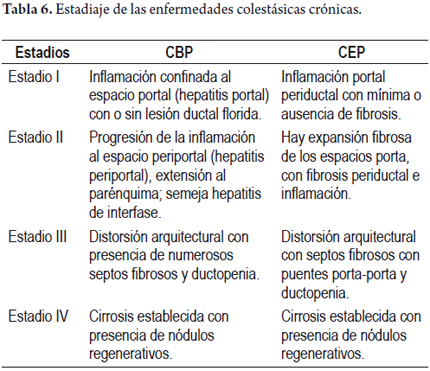
En la CBP las lesiones histológicas se dividen en 4 estadios (tabla 6) (17). El valor de la estadificación es controversial, especialmente por lo heterogéneos que pueden ser y coexistir varios estadíos al mismo tiempo; sin embargo, para la mayoría de autores la presencia de fibrosis en puentes se ha mostrado como un signo de pobre pronóstico.
Algunos subtipos de CBP han sido descritos:
Colangitis autoinmune o CBP AMA negativo en la que el cuadro clínico, bioquímico y patológico es muy semejante a una CBP clásica, pero con AMA negativo; ocurre en mujeres un poco más jóvenes y pueden tener ANA o ASMA positivos en cerca del 10% de los casos.
CBP con Ductopenia, cuadro clínico y bioquímico de CBP, en el cual la biopsia muestra una ductopenia con una inflamación mínima y ausencia de la lesión ductal florida.
Síndromes de sobreposición con CBP más hepatitis autoinmune (HAI), en los cuales se sobreponen tanto en la clínica, como en el cuadro histopatológico las dos entidades.
Cuando se plantea un diagnóstico diferencial con la HAI, ¿se puede favorecer una CBP? A continuación, algunas claves para el diagnóstico:
- Ambas entidades tienen infiltrado plasmocitario predominante.
- La apoptosis es insignificante o ausente en la CBP.
- La hepatitis de interfase es prominente en la HAI.
- Hay más colangitis linfocítica en la CBP.
- La colangitis granulomatosa es muy inusual en la HAI.
- No hay ductopenia en la HAI.
- En la CBP la cirrosis es de tipo biliar.
COLANGITIS ESCLEROSANTE PRIMARIA (CEP)
En esta enfermedad colestásica crónica hay una inflamación inmunomediada con destrucción obliterativa de segmentos del árbol biliar intrahepático y/o extrahepático, siendo estos reemplazados por tejido fibroso y llevando progresivamente a la formación de múltiples estrecheces de la vía biliar, hasta la enfermedad hepática terminal y cirrosis. En el 75% de los casos hay compromiso tanto de los ductos pequeños, como grandes, en el 15% solo los ductos pequeños y en el 10% los ductos grandes únicamente. Ocurre en todos los rangos de edad, pero típicamente se presenta después de la cuarta década de la vida, un poco más en hombres que en mujeres; está estrechamente relacionada con otras enfermedades autoinmunes y con la enfermedad intestinal inflamatoria crónica, especialmente, con colitis ulcerativa (70%) y menos frecuentemente con enfermedad de Crohn (5-10%), siendo diagnosticada incluso antes que la primera manifestación de la CEP en el 75% de los casos, pero solamente el 5% de los pacientes con colitis ulcerativa tienen CEP (19,20).
El diagnóstico de CEP se planteará con al menos tres criterios: el primero, un paciente con perfil bioquímico colestásico; el segundo, muy importante y de primera elección, la colangiorresonancia, que muestra los cambios característicos de estenosis y dilataciones segmentarias, usualmente multifocales; este estudio tiene una sensibilidad del 80% y especificidad del 87%, solo en casos especiales puede ayudar la colangiografía retrógrada endoscópica; el tercer criterio es la exclusión de todas las probables causas secundarias, como por ejemplo, las obstrucciones de la vía biliar por tumores, como el colangiocarcinoma o metástasis, o presencia de cálculos, colangitis IgG4, colangitis piogénica recurrente, infecciones, colangitis isquémica, trauma por cirugía previa de la vía biliar o manipulación radiológica, entre muchas otras causas, algunas de las cuales, en su estadio terminal, llevan a una cirrosis biliar secundaria (20).
La biopsia hepática usualmente no es necesaria para el diagnóstico y, al igual que en la CBP, tiene una utilidad limitada, siendo usada para establecer el diagnóstico de CEP de pequeños ductos (ya que en este caso los estudios radiológicos son normales), también para excluir enfermedades concurrentes, estadificar la lesión o monitorizar la progresión y respuesta al tratamiento (21,22).
¿Cuáles cambios histológicos se deben buscar?
En la lesión inicial de la CEP se requieren observar loa ductos de mediano y gran tamaño (mayores de 100 µ de diámetro), los que no son vistos en las biopsias percutáneas. Además de ser lesiones segmentarias, se deben buscar en etapas tempranas:
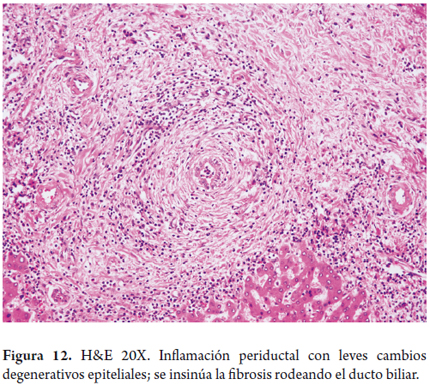
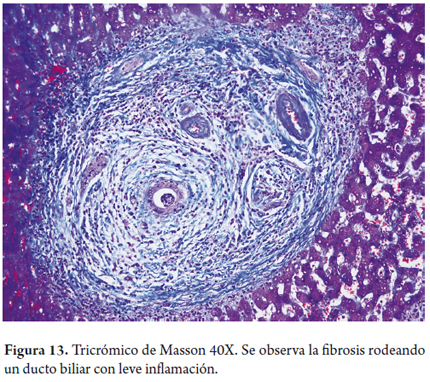
La pericolangitis y colangitis fibrosa son la presencia de infiltrado leve inflamatorio linfocitario, con ocasionales eosinófilos en el espacio porta, el cual tiene un escaso estroma fibroso, edematoso, rodeando el ducto biliar (figuras 12 y 13).
El infiltrado linfocitario permeando el epitelio ductal es variable en densidad y segmentario.
Cambios degenerativos del epitelio ductal con estratificación, vacuolización citoplasmática, desprendimiento epitelial de su membrana basal.
Manguitos concéntricos de tejido fibroso edematoso que rodea los ductos, sin producir obliteración de los mismos; esta es la imagen conocida como "anillos de cebolla" (figura 14).
Cuando los ductos tienen apariencia normal y existe fibrosis periductal, puede ser un hallazgo totalmente inespecífico, pero en el contexto clínico de una colestasis crónica, se debe buscar la colangitis linfocítica o daño ductal en cortes seriados de la biopsia.
En etapas más tardías o en la medida en que progresa la lesión se observa:
Fibrosis periductal, que envuelve progresivamente los ductos biliares comprometidos e incluso lo oblitera hasta convertirse en tejido fibroso esclerótico en el sitio donde antes existía un ducto (colangitis obliterativa fibrosante).
Destrucción del epitelio ductal por la fibrosis con atrofia del epitelio o aplanamiento del mismo y posterior ductopenia.
Colangiectasias y abscesos colangíticos ocurren por el daño ductal, con depósito de bilis, la cual es muy tóxica para el epitelio; usualmente se acompaña de inflamación aguda.
Cambios parenquimatosos asociados a la colestasis con bilirrubinostasis, balonización, cambio xantomatoso, presencia de cuerpos de Mallory-Denk y depósitos de cobre o de su proteína fijadora. Es mínima o no existe lesión de la placa limitante.
Cirrosis de tipo biliar con halos claros periseptales, al igual que lo descrito en la CBP.
Desafortunadamente ninguno de estos cambios es patognomónico de CEP, también son segmentarios, requiriendo un muestreo adecuado. Pueden ocurrir en otras etiologías, como en la obstrucción de la vía biliar de cualquier causa, cirrosis biliar primaria y secundaria, atresia de la vía biliar, síndromes de sobreposición, hepatitis autoinmune o enfermedad de huésped contra injerto, ductopenia idiopática del adulto. La Colangitis esclerosante secundaria es el estadio terminal de entidades como pancreatitis autoinmune/colangitis asociada a IgG4, colangitis eosinofílica, colangiopatía SIDA, colangitis piogénica recurrente y colangitis isquémica, por lo tanto siempre será indispensable un análisis conjunto con la historia clínica completa y con imágenes diagnósticas.
Varios sistemas de estadificación han sido utilizados, ninguno totalmente establecido, pero el descrito por Ludwig es uno de los más aceptados (tabla 6) (23).
Cuando se plantea diagnóstico diferencial con la HAI, o CBP ¿se puede favorecer CEP? Las claves diagnósticas son:
- El infiltrado plasmocitario es mucho mayor en la HAI que en la CEP y menos que en la CBP.
- La necroinflamación, hepatitis de interfase y apoptosis son insignificante o no existen en la CEP.
- Puede existir colangitis linfocítica en ambas, pero es mayor en la CEP.
- La colangitis obliterativa fibrosa no se observa en la HAI.
- La colangitis granulomatosa no existe en la CEP.
- No hay pérdida ductal o ductopenia en la HAI.
- La cirrosis es de tipo biliar en la CEP y en CBP.
COLANGITIS ASOCIADA A IGG4
La enfermedad sistémica por IgG4 es de patogénesis desconocida y está caracterizada por infiltrados plasmocitarios reactivos para IgG4, con los estudios de inmunohistoquímica, infiltrado de linfocitos T y fibrosis ductal. Compromete numerosos órganos, especialmente el páncreas (pancreatitis autoinmune) y la vía biliar (colangitis IgG4), tiene elevados niveles séricos de IgG4. Su presentación clínica es la de una enfermedad colestásica crónica y los hallazgos radiológicos hacen pensar en primera instancia en una neoplasia pancreática; el compromiso hepático puede darse de dos maneras: con formación de masa en la región hiliar, semejando colangiocarcinoma, o como colangitis asociada a IgG4, que semeja la colangitis esclerosante primaria, al producir estenosis de la vía biliar intrahepática o extrahepática. Estas entidades deben ser consideradas en el diagnóstico diferencial. La colangitis IgG4 no está asociada a enfermedad intestinal inflamatoria crónica.
Identificarla es muy difícil, requiere una alta sospecha y tiene una favorable y rápida respuesta al tratamiento con esteroides (24,25).
CONCLUSIÓN
Los procesos colestásicos son, definitivamente, un reto tanto para el clínico, como para el patólogo. La biopsia constituye, en algunas ocasiones, un apoyo importante para el entendimiento y manejo integral del paciente; pero la más importante "clave para el diagnóstico correcto" es una adecuada correlación clinicopatológica.
REFERENCIAS
1. Li MK, Crawford JM. The pathology of cholestasis. Semin Liver Dis. 2004;24(1):21-42. [ Links ]
2. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of cholestatic liver diseases. J Hepatol. 2009;51(2):237-67. [ Links ]
3. Jüngst C, Berg T, Cheng J, Green RM, Jia J, Mason AL, et al. Intrahepatic cholestasis in common chronic liver diseases. Eur J Clin Invest. 2013;43(10):1069-83. [ Links ]
4. Rockey DC, Caldwell SH, Goodman ZD, Nelson RC, Smith AD, American Association for the Study of Liver Diseases. Liver biopsy. Hepatol Baltim Md. 2009;49(3):1017-44. [ Links ]
5. Isse K, Harada K, Nakanuma Y. IL-8 expression by biliary epithelial cells is associated with neutrophilic infiltration and reactive bile ductules. Liver Int Off J Int Assoc Study Liver. 2007;27(5):672-80. [ Links ]
6. Roskams TA, Theise ND, Balabaud C, Bhagat G, Bhathal PS, Bioulac-Sage P, et al. Nomenclature of the finer branches of the biliary tree: canals, ductules, and ductular reactions in human livers. Hepatol Baltim Md. 2004;39(6):1739-45. [ Links ]
7. Lefkowitch JH. Advances in hepatobiliary pathology: update for 2010. Clin Liver Dis. 2010;14(4):747-62. [ Links ]
8. Lefkowitch JH. Hepatobiliary pathology. Curr Opin Gastroenterol. 2008;24(3):269-77. [ Links ]
9. Christoffersen P, Poulsen H. Histological changes in human liver biopsies following extrahepatic biliary obstruction. Acta Pathol Microbiol Scand Suppl. 1970;212:Suppl 212:150+. [ Links ]
10. Pauli-Magnus C, Meier PJ. Hepatobiliary transporters and drug-induced cholestasis. Hepatol Baltim Md. 2006;44(4):778-87. [ Links ]
11. Scheimann AO, Strautnieks SS, Knisely AS, Byrne JA, Thompson RJ, Finegold MJ. Mutations in bile salt export pump (ABCB11) in two children with progressive familial intrahepatic cholestasis and cholangiocarcinoma. J Pediatr. 2007;150(5):556-9. [ Links ]
12. Strautnieks SS, Byrne JA, Pawlikowska L, Cebecauerová D, Rayner A, Dutton L, et al. Severe bile salt export pump deficiency: 82 different ABCB11 mutations in 109 families. Gastroenterology. 2008;134(4):1203-14. [ Links ]
13. López-P R del P, Forero J-D, Sierra F. [Methimazole-induced cholestatic jaundice in a hyperthyroid patient]. Acta Gastroenterol Latinoam. 2014;44(1):52-8. [ Links ]
14. Kaplan MM, Gershwin ME. Primary biliary cirrhosis. N Engl J Med. 2005;353(12):1261-73. [ Links ]
15. Flores A, Mayo MJ. Primary biliary cirrhosis in 2014. Curr Opin Gastroenterol. 2014;30(3):245-52. [ Links ]
16. Nguyen DL, Juran BD, Lazaridis KN. Primary biliary cirrhosis. Best Pract Res Clin Gastroenterol. 2010;24(5):647-54. [ Links ]
17. Lindor KD, Gershwin ME, Poupon R, Kaplan M, Bergasa NV, Heathcote EJ, et al. Primary biliary cirrhosis. Hepatol Baltim Md. 2009;50(1):291-308. [ Links ]
18. Jüngst C, Berg T, Cheng J, Green RM, Jia J, Mason AL, et al. Intrahepatic cholestasis in common chronic liver diseases. Eur J Clin Invest. 2013;43(10):1069-83. [ Links ]
19. LaRusso NF, Shneider BL, Black D, Gores GJ, James SP, Doo E, et al. Primary sclerosing cholangitis: summary of a workshop. Hepatol Baltim Md. 2006;44(3):746-64. [ Links ]
20. Chapman R, Fevery J, Kalloo A, Nagorney DM, Boberg KM, Shneider B, et al. Diagnosis and management of primary sclerosing cholangitis. Hepatol Baltim Md. 2010;51(2):660-78. [ Links ]
21. Burak KW, Angulo P, Lindor KD. Is there a role for liver biopsy in primary sclerosing cholangitis? Am J Gastroenterol. 2003;98(5):1155-8. [ Links ]
22. O'Leary JG, Pratt DS. Cholestasis and cholestatic syndromes. Curr Opin Gastroenterol. 2007;23(3):232-6. [ Links ]
23. LaRusso NF, Shneider BL, Black D, Gores GJ, James SP, Doo E, et al. Primary sclerosing cholangitis: summary of a workshop. Hepatol Baltim Md. 2006;44(3):746-64. [ Links ]
24. Webster GJM, Pereira SP, Chapman RW. Autoimmune pancreatitis/IgG4-associated cholangitis and primary sclerosing cholangitis--overlapping or separate diseases? J Hepatol. 2009;51(2):398-402. [ Links ]
25. Kamisawa T, Okamoto A. IgG4-related sclerosing disease. World J Gastroenterol WJG. 2008;14(25):3948-55. [ Links ]











 texto en
texto en