Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.29 no.3 Bogotá Sept. 2014
Resistencia antibiótica del Helicobacter pylori en América Latina y el Caribe
Julián David Martínez M. MD. (1), Sandra Consuelo Henao R. MD. (2), Jorge Iván Lizarazo R. MD. (3)
(1) Gastroenterólogo. Profesor asociado, departamento de Medicina, Universidad Nacional de Colombia. Unidad de Gastroenterología, Hospital Universitario de La Samaritana. Bogotá, Colombia.
(2) Profesora asociada, departamento de Microbiología, Universidad Nacional de Colombia. Bogotá, Colombia.
(3) Gastroenterólogo. Unidad de Gastroenterología, Hospital Universitario de La Samaritana, Bogotá. Colombia.
Fecha recibido: 30-07-13 Fecha aceptado: 21-07-14
Resumen
El tratamiento de la infección por Helicobacter pylori continúa siendo un problema no resuelto en la práctica clínica con un alto porcentaje de fallas en su erradicación; la principal causa es la resistencia antibiótica que varía dependiendo del área geográfica estudiada. Se han desarrollado diversas técnicas para el estudio de la sensibilidad in vitro, pero su utilización en la práctica clínica es difícil de aplicar y costosa. También es importante reconocer que no siempre esta tiene una relación directa con los estudios in vivo pero pueden contribuir a mejorar los resultados de erradicación. En el presente artículo se revisan los mecanismos de resistencia y los artículos publicados en América Latina, sobre resistencia in vitro a los antibióticos más empleados en los esquemas de erradicación. La revisión encontró 35 estudios en Latinoamérica con un total de 3.358 aislados. Las técnicas de sensibilidad empleadas en los estudios de la región fueron E-test 48%, dilución en agar 37% y la difusión en agar 8%. Los estudios presentan bastante heterogeneidad con importantes diferencias entre los países de la región e incluso en estudios realizados en un mismo país. La resistencia in vitro, parametronidazol fue de 65,7%, para amoxicilina de 6,5%, para claritromicina de 14%, para tetraciclina de 8,3%, para levofloxacina de 39% y para furazolidona de 6,9%.
Palabras clave
Helicobacter pylori, resistencia, antibióticos, América Latina.
INTRODUCCIÓN
La infección por Helicobacter pylori (H. pylori) es considerada la principal causa de gastritis crónica, úlcera péptica, linfoma de MALT (del inglés Mucosal Associates Lymphoide Tissue) y adenocarcinoma gástrico (1, 2).
El tratamiento de la infección tiene en la actualidad esquemas considerados de primera línea; el más utilizado a nivel mundial es la triple terapia con inhibidor de la bomba de protones (IBP), amoxicilina, metronidazol o claritromicina en esquemas de 7 a 14 días. Se han propuesto otros esquemas como la terapia secuencial, la concomitante y la cuádruple; sin embargo, en muchos zonas del mundo las tasas de curación se consideran inaceptables, situación que también está presentándose con esquemas de segunda línea y tercera línea que incluyen antibióticos como levofloxacina. La resistencia bacteriana es la principal causa del fracaso de las terapias antimicrobianas (6, 7). La baja adherencia también es una causa de fallas en la erradicación (3, 4).
La resistencia del H. pylori puede ser:
- Primaria o natural, que se define como la incapacidad intrínseca del antibiótico para erradicar la infección desde el primer tratamiento.
- Secundaria o adquirida, que se desarrolla después de un tratamiento con un antibiótico al cual la bacteria era sensible.
La resistencia desarrollada por H. pylori se debe esencialmente a mutaciones cromosomales y se transmite en forma vertical por poblaciones bacterianas resistentes a la descendencia con un aumento progresivo de la resistencia. La resistencia por mutaciones cromosomales difiere de aquella por plásmidos, en donde se transmite rápidamente por difusión en forma horizontal en la población bacteriana que lo adquiere (11, 49). Se ha identificado que los genes implicados en las mutaciones cromosomales del H. pylori tienen un número de mutaciones puntuales que se pueden detectar por métodos moleculares (49).
Las técnicas de laboratorio que detectan la resistencia in vitro se dividen en métodos fenotípicos y métodos genotípicos.
Los métodos fenotípicos son empleados en la mayoría de las publicaciones y comprenden dos grupos de técnicas: las de difusión y las de dilución.
Las técnicas de difusión o método de Kirby Bauer son métodos cualitativos, no determinan la concentración inhibitoria mínima (CMI) a la cual el microorganismo es sensible. En este grupo se destaca la técnica de Épsilon (E- test), que tiene una buena correlación con el método de referencia pero puede sobre estimar la resistencia del H. pylori para metronidazol (8).
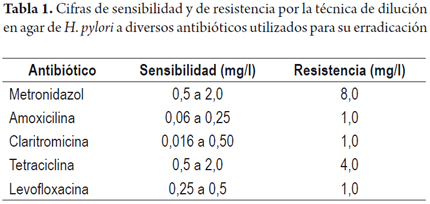
Las técnicas de dilución determinan la CMI, que se define como la mínima cantidad de antibiótico que inhibe el crecimiento bacteriano y se expresa en microgramos de antibiótico por mililitro de medio de cultivo (ug/ml o mg/l). En la tabla 1 se presentan los datos de CMI para antibióticos empleados en el tratamiento de la infección por H. pylori (9, 10).
La técnica de dilución en agares es la prueba más utilizada, considerada como el patrón de oro por el Instituto de Estándares Clínicos y de Laboratorios (CLSI). La interpretación de la CMI de cada antibiótico se debe comparar con los "puntos de corte", determinados por comités internacionales.
Los métodos genotípicos para detección de resistencia son métodos que utilizan pruebas moleculares (PCR, PCR-RFLP), se pueden aplicar en muestras de mucosa gástrica o heces humanas. Estos métodos son más rápidos en establecer la resistencia por su capacidad de determinar cambios específicos del genoma bacteriano que confieren la resistencia antibiótica.
El objetivo de esta revisión es presentar los estudios publicados en América Latina y el Caribe sobre la resistencia del H. pylori en diferentes técnicas in vitro. Consideramos importante conocer la situación de la región porque es un hecho que la resistencia tiene variaciones geográficas a nivel mundial.
MATERIALES Y MÉTODOS
Se consultaron las bases de datos MEDLINE, BIREME, LILACS, SCIELO, en búsqueda de publicaciones científicas realizados en países de América Latina y el Caribe. La búsqueda incluyó artículos en español, portugués e inglés. Se incluyeron aquellos que estudiaron resistencia in vitro de H. pylori a los antibióticos más utilizados en los esquemas de tratamiento.
Las publicaciones se organizaron por fecha de publicación, país del estudio, número de muestras, técnica de laboratorio y antibiótico.
RESULTADOS
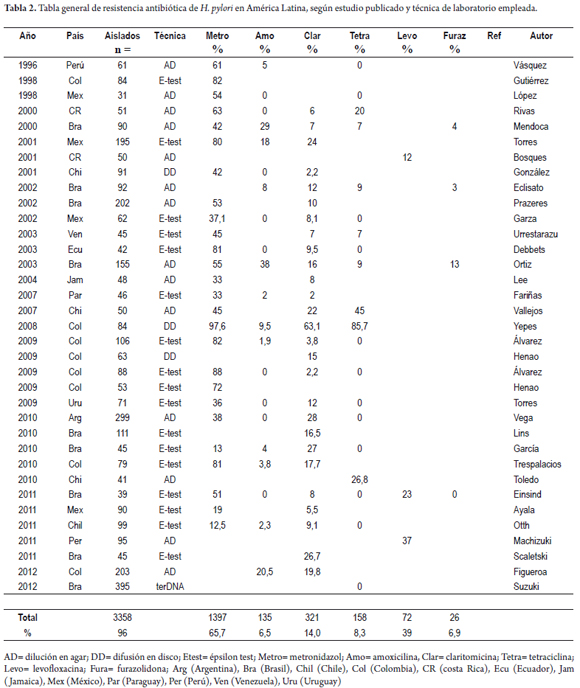
Los artículos publicados encontrados en estas bases de datos fueron 35, que agrupan en total 3.358 muestras aisladas, de los cuales 3.262 provenían de adultos y 96 de niños (12-46). El periodo de búsqueda fue el comprendido entre 1996 a 2012 e incluyó las publicaciones de países de Latinoamérica y el Caribe. El número de muestras estuvo entre un rango de 395 a 18 con un promedio de 96 muestras por estudio.
El número de publicaciones por país fueron: Brasil 9, Colombia 8, México 5, Chile 4, Perú, Costa Rica, Argentina, Ecuador, Jamaica, Paraguay, Uruguay y Venezuela 1.
Las técnicas utilizadas para determinar la sensibilidad antibiótica del H. pylori fueron: el E-test (épsilon test) en 17estudios (48%), la dilución en agar 14 estudios (37%), la difusión en disco 3 (8%).
Los mecanismos de resistencia y los resultados por países en Latinoamérica y el Caribe se presentan a continuación.
Metronidazol
Es un compuesto heterocíclico con un núcleo de 5 carbonos y un radical nitro (NO2). Los nitroimidazoles son activados al ingresar en la célula por la enzima NADPH nitrorreductasa, los transforma en intermediarios imidazoles que ocasionan daños estructurales en el ADN, inhibición de la síntesis de ácidos nucleicos y muerte celular (47).
La resistencia a nitroimidazoles involucra dos genes denominados rdxA y frxA. El gen rdxA codifica para una NADPH nitrorreductasa insensible al oxígeno, dona electrones y activa al metronidazol. El gen frxA codifica para la NADPH flavinoxidorreductasa y contribuye en la activación del metronidazol en el interior celular (47).
Las mutaciones que inactivan el gen rdxA originan codones de parada o sustituciones que hacen a la proteína disfuncional. En algunos casos, el gen frx A promueve la aparición de resistencia y en otros se presenta mutando junto con el gen rdxA (48).
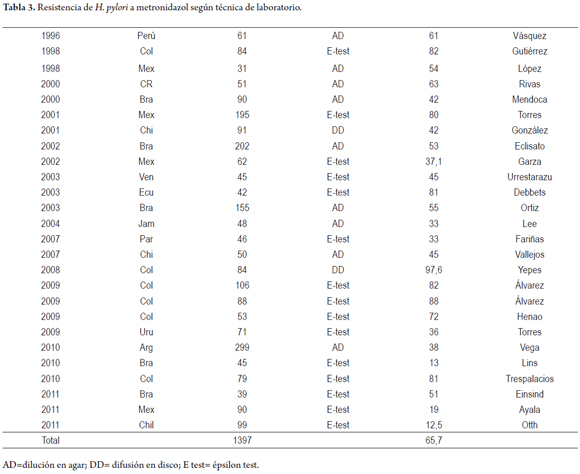
En Latinoamérica se encontraron 26 estudios para metronidazol que agrupan 2.263 aislados, en adultos 2.212 y en niños 51 (12-30, 32, 35, 37, 38, 40-42). Las publicaciones tienen un amplio rango con porcentajes, entre 97,6% en Colombia (29) y 12,5% en Chile (42); dentro de los países y subregiones también hay diferencias notables.
En México y Centro América, en tres de cuatro estudios, la prevalencia de la resistencia superó el 50%, en Jamaica 33%, en Brasil fue superior al 50%. En nuestro país el rango de resistencia está entre 97,6% y 82% (13, 29, 30, 32, 33, 38).
En el sur de Latinoamérica las resistencias fueron: en Argentina 38%, Chile 12%, Paraguay 33% y Uruguay 38% (27, 32, 34, 41).
En la tabla 2 se presenta un resumen de estos estudios.
La prevalencia de la resistencia publicada para metronidazol en países desarrollados muestra en Europa 20%, USA 40% y Japón 12%.
La resistencia a metronidazol se ha relacionado con el uso frecuente en enfermedades parasitarias e infecciones dentales y puede aumentar en mujeres por su uso en infecciones ginecológicas (49, 50) (tabla 3).
Amoxicilina
Es una penicilina semisintética que inhibe la síntesis de la pared bacteriana ocasionando un desequilibrio osmótico y lisis bacteriana. La amoxicilina para su acción bactericida requiere que la bacteria esté en fase de replicación. El ingreso a la célula del medicamento necesita de proteínas ubicadas en la superficie de la membrana celular (PBPs del inglés penicillin binding proteins), para que el anillo betalactámico pueda bloquear la síntesis del péptido glicano de la pared celular. La amoxicilina es lábil al ácido, los IBP mejoran su estabilidad y biodisponibilidad (47).
La resistencia se presenta por mutaciones de las PBPs. La mutación PBP1A presenta mayor afinidad por el fármaco y al manifestarse afecta su efectividad antibiótica. La mutación S414R sola puede ocasionar fenotipos resistentes. Otras mutaciones informadas son la S402G, E406A, S417T, T555S, N561Y, S542R, T540I y I562V (51, 52).
En Latinoamérica se encontraron 20 publicaciones para amoxicilina; en conjunto se agrupan 2.076 aislados de los cuales 51 fueron en niños. Los estudios tienen bastante variación en el porcentaje de resistencia con un rango de 0% a 38% (25). Las resistencias más altas se informaron en Brasil con 29 y 38% (16, 25) seguida por Colombia con 20,5% y 9,5% y México con 18% (12, 29, 45). En contraposición a estos resultados, en 9 estudios no encontraron cepas resistentes, lo cual hace que sea difícil sacar conclusiones con relación a un aumento de resistencia a amoxicilina en la región (14, 15, 19, 22, 24, 32, 34, 35, 40).
La elevada resistencia en los trabajos mencionados anteriormente contrasta también con las publicaciones de otras regiones del mundo. Megraud publica información de 18 estudios en Europa, Asia, Estados unidos y Medio Oriente con resistencias entre 0 y 0,9% (49).
En Taiwán se detectó la existencia de una cepa resistente a amoxicilina (CIM; 256 mg/l) y productora de betalactamasa, TEM-1 codificada por el gen blaTEM 1 (53).
Claritromicina
La claritromicina es un macrólido sintético, inhibe la síntesis de proteínas bacteriana al unirse a la subunidad ribosomal 50s e inhibe la translocación del ARN de transferencia que se utiliza en la síntesis de polipéptidos.
La resistencia a claritromicina se presenta por mutaciones puntuales en el gen rrn 23S que codifica para el ARNr 23S. Las mutaciones responsables de 90% de los casos de resistencia se producen por sustitución de la adenina por citosina o guanina en la posición 2142 (A2142C o 2142G) o de una adenina por una guanina en posición 2143 (A2143G), otras mutaciones son menos frecuentes como la A2143G.
La frecuencia in vitro de la mutación fluctúa entre 3,2 X 10-7 a 6,0 X 10-8. Los resultados in vitro no siempre predicen los resultados in vivo porque en este último pueden ser mayores debido al estrés oxidativo.
Se ha descrito otro mecanismo de resistencia por el sistema de bombas de expulsión. La resistencia intrínseca por sistemas de eflujo ha sido propuesta como un mecanismo de multirresistencia. Los IBP pueden inhibir la actividad de las bombas de eflujo bacteriano y su utilización disminuye los valores de MIC para claritromicina, metronidazol, amoxicilina y furazolidona en aislamientos multirresistentes.
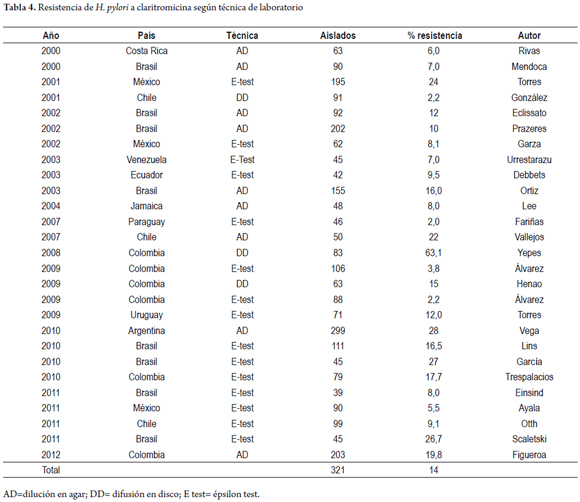
En Latinoamérica se encontraron 27 estudios con un total de 2.292 aislados de H. pylori. Las tasas más altas se observaron en México, Colombia, Argentina y Brasil (17, 29, 35, 44).
En Colombia hay varios estudios publicados utilizando diferentes técnicas de laboratorio tanto fenotípicas como genotípicas. En la primera publicación, en el año 2008, con técnica de difusión en disco, la resistencia fue de 63,1%, porcentaje que se ha considerado muy alto y solamente se había publicado en Perú en 1996 una resistencia de 50%. Estos porcentajes tan elevados no se han encontrado en estudios más recientes. En Colombia, en el año 2009, con la técnica de difusión en disco, en la misma zona geográfica, la resistencia fue de 15% (12, 29, 31). En la tabla 4 se resumen los 27 estudios de resistencia in vitro a claritromicina.
Tetraciclina
Las tetraciclinas actúan inhibiendo la síntesis proteica bacteriana uniéndose a la subunidad 30S del ribosoma e inhiben la unión de los aminoácidos a la cadena polipeptídica en formación.
La mutación puntual en el gen rrn 16S codifica para el ácido ribonucleico ribosomal 16S de la subunidad 30S e impide la unión del aminoacil ARN de transferencia. Las mutaciones se encuentran en la tripleta de bases adenina, guanina, adenina en las posiciones 926 a la 928 (AGA 926-928) del gen rrn 16s en la llamada caja C. Las mutaciones en las posiciones 965 a 967 que codifica para la proteína de flujo TetA (P) disminuye la afinidad del antibiótico (6, 10, 54).
En Latinoamérica se encontraron 20 estudios con un total de 1.903 aislados. En los estudios realizados con la técnica de dilución en agar en Brasil entre los años 2000 a 2003 la resistencia osciló de 0% a 9%, en Argentina, Perú y México fue 0%. En Chile fue de 26,8%, una resistencia inusualmente alta.
En los estudios realizados por la técnica de E-test en Colombia, Chile, Ecuador y Uruguay la resistencia fue 0% y en Venezuela 7%.
En Colombia, un estudio realizado con la técnica de difusión en disco con 115 aislados muestra una resistencia de 85,7%, pero este fue el único estudio realizado (12, 14, 16, 20, 23-25, 28-30, 32, 34, 35, 42).
Levofloxacina
Las fluoroquinolonas actúan inhibiendo las topoisomerasas bacterianas. La topoisomerasa IV y la topoisomerasa II o Girasa del ADN compuesta de dos subunidades A y dos B codificada por el gen gyrA. La girasa del ADN ayuda a remover el superenrollamiento del ADN al inicio de la replicación y mantiene la estructura helicoidal del ADN. Las quinolonas detienen la replicación del ADN porque inhiben la subunidad A de la girasa del ADN en la región determinante de resistencia a quinolonas QRDR (del inglés Quinolone Resistance Determining Region) y las mutaciones de esta región originan resistencia a levofloxacina. Las mutaciones en el gen gyrA en las posiciones 91 (Asp91Gly, Asn, Ala o Tyr), 87 (Asn87Lys) y 88 (Ala88Val). Las mutaciones en las posiciones 91 y 87 se han encontrado presentes en 100% de los aislados resistentes (56). En Latinoamérica se encontraron 3 publicaciones de Costa Rica, Brasil y Perú, con la tasa más alta en Perú con 37% (18, 40, 43).
En Europa, estudios de resistencia: en Francia dos 3,8%, y 3,3%; en Holanda 4,7%; en Portugal 20,9% que es la tasa de resistencia más alta en este continente. La resistencia es cruzada con otras quinolonas (42, 55).
En Taiwán la resistencia se cuadruplicó después de 2004 de 3,2% a 16,3%. En Europa la resistencia promedio informada en el año 2009 fue de 14,1% (4 a 28%) (5).
Furazolidona
Es medicamento sintético derivado del furano. El mecanismo de acción interviene con sistemas enzimáticos vitales para las bacterias, inhibe la monoaminooxidasa, disminuye los procesos oxidativos de las bacterias y sus metabolitos secundarios dañan el ARN. La furazolidona ha sido utilizada como antibacteriano alternativo cuando se observan altas tasas de resistencia a metronidazol (20).
Los mecanismos de resistencia no son claros, la bacteria utiliza otras reductasas diferentes a las relacionadas con la resistencia ametronidazol (RdxA, FrxB, FdxB). Las potenciales reductasas son la piruvato flavodoxin oxidorreductasa y la 2-oxoglutarato reductasa, enzimas que podrían ser esenciales para la bacteria por lo que se podría explicar la baja tasa de mutación y por consiguiente la baja tasa de resistencia a la furazolidona reportada en la mayoría de estudios.
En Latinoamérica existen pocos estudios y la mayoría de estos han sido realizados en Brasil, con resistencias de 4% en el año 2000 y de 7,5% en 2002. En el estado de Sao Paulo, Queiroz y cols no reportan ningún aislado resistente en el año 2002, Godoy Ortiz y cols en el 2003 encontraron una resistencia de 13%, esta tasa de resistencia duplica la encontrada en otros estudios realizados en la misma región geográfica (16, 58).
DISCUSIÓN
La resistencia antibiótica del H. pylori es un problema creciente en todo el mundo y es la principal causa de fallas en la erradicación con los esquemas actuales. Las tasas de resistencia varían de acuerdo a la zona geográfica. El estudio de la resistencia in vitro es complejo y costoso, por lo cual su utilización en la práctica clínica generalmente no está disponible. Los genes comprometidos en las mutaciones cromosomales que originan la resistencia para la mayoría de los antibióticos se trasmiten en forma vertical a la descendencia en las poblaciones bacterianas una vez la adquieren. La mayoría de mutaciones son puntuales y se pueden detectar con métodos moleculares basados en técnicas de PCR en tiempo real. En un futuro es posible que estas técnicas puedan ser utilizadas en forma más amplia en la práctica clínica y permitan tratamientos más orientados para una infección cuya erradicación continúa siendo un problema no resuelto.
La mayoría de los estudios proviene de otras regiones del mundo por lo que consideramos importante conocer los estudios en Latinoamérica y el Caribe que muestren la situación en nuestro continente. La revisión abarcó un periodo de 16 años e incluyó publicaciones en distintos idiomas. Se encontraron treinta y cinco estudios publicados que muestran que la región no es ajena al problema de la resistencia antibiótica.
La resistencia a claritromicina se considera en la actualidad que tiene mayor impacto en las fallas a la erradicación, en Latinoamérica se encontraron 27 estudios con resultados bastante heterogéneos con rangos entre 2,0% y 63,1%. Sin embargo, en la mayoría de estudios los resultados no soportan estos porcentajes extremos.
El factor de riesgo más importante para el desarrollo de resistencia a claritromicina es el consumo previo de macrólidos. En niños, el aumento de la resistencia se ha relacionado con la utilización frecuente de este antibiótico en infecciones respiratorias (49). La utilización de este medicamento debe ser considerada solo en pacientes que no informen tratamientos previos con macrólidos.
El método más promisorio es la detección por PCR en tiempo real basados en la amplificación del gen mutante 23S rRNA para la detección de la resistencia a claritromicina.
Los 26 estudios de resistencia in vitro a metronidazol en Latinoamérica también tienen resultados heterogéneos con rangos de 97,6% en Colombia (29) a 12,5% en Chile (42), así como diferencias notables entre subregiones del mismo país. Los estudios de resistencia in vitro con metronidazol han sido cuestionados, porque a diferencia de lo que sucede con claritromicina, los métodos fenotípicos tienen limitación por un alto nivel de fallas en la reproducibilidad con porcentajes de discrepancias de 10-20% (49).
Se encontraron 20 estudios para tetraciclina en Latinoamérica, la resistencia varió de 0% a 9%, es baja y solamente un estudio en Chile con 26,8% y un estudio en Colombia con la técnica de difusión en disco de 85,7%; este porcentaje tan alto no ha sido reproducido en ningún otro estudio, lo que hace pensar que la resistencia es baja para seguir siendo utilizadas.
Los estudios para amoxicilina en Latinoamérica fueron 20 publicaciones con un rango bastante amplio de 0%-38%, a nivel mundial se han documentado tasas bajas de resistencia, en Latinoamérica muchos estudios encontraron 0% de resistencia; sin embargo, como mencionamos anteriormente, el rango es amplio, pero si se confirman los porcentajes altos de resistencia de algunos estudios sería una situación alarmante, comprometiendo su utilización en la mayoría de esquemas donde se considera fundamental por su efectividad y bajo costo.
Para levofloxacina solamente se encontraron 3 publicaciones en Latinoamérica con porcentajes altos de resistencia de 37% a 39%. Hay que tener en cuenta que son muy pocos los estudios para este antibiótico, es un medicamento costoso por lo cual su utilización generalmente se considera en esquemas de segunda línea, excepto en pacientes con historia de uso previo de macrólidos en quienes en ocasiones se utiliza como primera línea o en regiones geográficas en donde se demuestre resistencia a claritromicina mayor de 20% y resistencia a quinolonas inferior a 10% (57).
Los estudios para furazolidona encontraron rangos de 0% a 13%, hay escasas publicaciones la mayoría de las cuales se realizaron en Brasil. La furazolidona ha emergido como un antibacteriano útil en el tratamiento del H. pylori, porque es de bajo costo y se encuentra disponible en casi todo el continente y pueden beneficiarse de su utilización casos seleccionados. La utilización de furazolidona ha sido prohibida en países europeos por los informes de posibles alteraciones del DNA y su relación con carcinogénesis.
La presente revisión agrupa un amplio número de publicaciones de resistencia in vitro en Latinoamérica y el Caribe, muchas de estas publicaciones no tienen amplia difusión por no encontrarse en inglés. Los estudios nos muestran una resistencia alta para muchos antibióticos, con una situación similar a otros continentes (59). El impacto es preocupante en un continente con zonas de alta prevalencia de la infección y también con altas tasas de prevalencia de enfermedades graves relacionadas con la infección como son las lesiones preneoplásicas y el adenocarcinoma gástrico. Latinoamérica tiene profundas diferencias en el desarrollo económico y en los servicios de salud, también una marcada disparidad entre las áreas urbanas y rurales; se requieren fármacos útiles y a costos económicos razonables, los estudios de la región plantean un continuo reto para los médicos latinoamericanos y crea la necesidad de continuar con la investigación para mejorar los resultados de erradicación en nuestros países.
Conflictos de interés
Los autores no declaran conflicto de interés.
Financiación
El costo económico del presente trabajo fue asumido por los autores.
REFERENCIAS
1. Malfertheiner P, Megraud F, OMorain CA, Atherton J, Axon ATR, Bazzoli F, et al. The European Helicobacter Study Group (EHSG) Management of Helicobacter pylori infection-the Maastricht IV/ Florence Consensus Report Gut 2012; 61: 646-664. [ Links ]
2. Roesler BM, Botelho Costa SC, Robilotta, Zeitune JM. Eradication and Treatment of Helicobacter pylori Infection: Its Importance and Possible Relationship in Preventing the Development of Gastric Cancer. ISRN Gastroenterology 2012. [ Links ]
3. Graham DY, Fischbach L. Helicobacter pylori treatment in the era of increasing antibiotic resistance. Gut 2010; 59: 1143-1153. [ Links ]
4. Chuah S-K, Tsay F-W, Hsu PI, Wu DC. A new look at anti-Helicobacter pylori therapy. World J Gastroenterol 2011; 17: 3971-3975. [ Links ]
5. Kuo CH, Kuo FC, Hu HM, Liu CJ, Wang S, Chen YH, et al. The optimal First –Line Therapy of Helicobacter pylori Infection in Year 2012. Gastroenterology Research and Practice 2012. [ Links ]
6. Megraud F. Antibiotic resistance in Helicobacter pylori infection British Medical Bulletin 1998; 54: 207-216. [ Links ]
7. Vakil N, Megraud F. Eradication therapy for Helicobacter pylori. Gastroenterology 2007; 133: 985-1001. [ Links ]
8. Clinical and Laboratory Standards Institute, Performance standards for antimicrobial susceptibility testing. Seventeenth information al supplement. Wayne, Pennsylvania: Clinical and Laboratory Standards Institute; 2007. [ Links ]
9. Megraud F. Whats the relevance of Helicobacter pylori to antimicrobials agents? En Hunt RH, Tygat GNJ, (Eds.). Helicobacter pylori: Basic mechanisms to clinical cure 1996. Dordrecht; Kluwer 1996; 348-356. [ Links ]
10. Zullo V, Hassan C, Giorgio F, Rosania R, Ierardi E. Mechanisms of Helicobacter pylori antibiotic resistance: An updated appraisal. World J Gastrointest Pathophysiol 2011; 2: 35-41. [ Links ]
11. Pajares García JM, Pajares-Villaroya R, Gilsbert JP. Helicobacter pylori: resistencia a los antibióticos. Revista española de Enfermedades Digestivas 2007. [ Links ]
12. Vásquez A, Valdez Y, Gillman RH, McDonald JJ, Westblon TU, Bergg D, et al. Metronidazole and Clarithromycin Resistance in Helicobacter pylori Determinate by measuring MICs of antimicrobial agents in color indicator egg yolk Agar in a miniwell format. J Clin Microbiology 1996; 34: 1232-1234. [ Links ]
13. Gutiérrez O, Otero W. Resistencia de Helicobacter pylori al metronidazol en Colombia. Rev Col Gastroenterología 1998; 12: 31-5. [ Links ]
14. López V. Y, Rangel F, Sigfrido M, Calva JJ. Resistencia a antimicrobiano de Helicobacter pylori en un centro de referencia infectológico. Rv Invest Clin 1998; 50: 19-24. [ Links ]
15. Rivas F, Rivera P, Hernández F, Hevia F, Guillén F, Ricaamayo G. Antibiótico sensibilidad del Helicobacter pylori mediante microdilución. Rev Med Panamá 2000; 25: 19-23. [ Links ]
16. Mendoca S, Ecclissato C, Sartoti MS, Godoy APO; Guerzoni RA, Dregger M, et al .Prevalence of Helicobacter pylori Resistance to Metronidazole, Clarithromicyn, Amoxicillin; Tetraciclyne, and Furazolidone in Brazil. Helicobacter 2000; 5: 79-83. [ Links ]
17. Torres J, Camorlinga M, Pérez G, Madrazo A, Dehesa M, González G, et al. Increasing Multidrug Resistance in Helicobacter pylori Stains Isolates from Children and Adults in Mexico. J Clin Microbiol 2001; 39: 2677-2680. [ Links ]
18. Bosques FJ, Alanís O, Garza E, Maldonado HJ, Tijerina R. Susceptibilidad de Helicobacter pylori a ofloxacina y levofloxacina. MedUniver 2001; 3: 124-127. [ Links ]
19. González C, García A, Daroch F, Kawaguchi F, Solar H, Rivera N,y cols. Suceptibilidad in vitro de cepas de Helicobacter pylori: aislamiento de cepas resistentes a claritromicina. Rev Med Chile, 2001; 129(6). [ Links ]
20. Ecclissato C, Morchioretto MAM, Mendoca S, Godoy APO, Guersoni M, Deguer H, et al. Increased Primary Resistence to Recommended Antibiotics Negatively Afects Helicobacter pylori Eradication. Helicobacter 2002; 7: 53-59. [ Links ]
21. Prazeres P, Magalhaes DM, Campos DV, Aguiar G, Nogueria E, Santos A, et al. Helicobacter pylori Primary Resistanceto Metronidazole and Clarithromicyn in Brazil. Antimicrob Agents Chemother 2002; 46: 2021-2023. [ Links ]
22. Garza-González E, Pérez-Pérez GI, Alani-Aguilar O, Tijerina-Menchaca R, Maldonado-Garza HJ, Bosque-Padilla FJ. Antibiotic susceptibility of Helicobacter pylori strains isolated from northeastern Mexico. J Chemother 2002; 14: 342-345. [ Links ]
23. Urrestarazu MI, Serrano N, Piñero R, Cavazza ME. Susceptibilidad del Helicobacter pylori a los antimicrobianos. Rev Soc Ven Microbiol 2003; 14-15. [ Links ]
24. Debets-Ossemkopp Y, Reyes G, Mulder J. van de Stegge B, Peters J, Savelkoul P, et al. Characteristic of clinical Helicobacter pylori strains from Ecuador. J Antimicrobial Chemother 2003; 51: 141-145. [ Links ]
25. Ortiz AP, Ribeiro ML, Borges YH, Vitiello L, Bueno M, Mendoca S, et al. Analysis of antimicrobial susceptibility and virulence factor in Helicobacter pylori clinical isolates. BMC Gastroenterology 2003; 3: 20. [ Links ]
26. Lee MG, Arthurs M, Smikle M, Dowe G, Levy W, Barton EN. Antibiotic Sensibility of Helicobacter pylori in Jamaica. West Med Indian J 2004; 53: 374-377. [ Links ]
27. Fariña N, Kasamatsu E, Samudio M, Moràn M, Sanabria R, Laspina F. Susceptibilidad antibiótica de cepas de Helicobacter pylori aisladas en pacientes con enfermedad gastroduodenal. Rev Med Chile 2007; 135: 1009-1014. [ Links ]
28. Vallejos C, Garrido L, Cáceres D, Madrid AM, Defilippi C, Defilippi C y cols. Prevalencia de la resistencia a metronidazol, claritromicina y tetraciclina en Helicobacter pylori aislado de pacientes de la Región Metropolitana. Rev Med Chile 2007; 135: 287-293. [ Links ]
29. Yepes CA, Rodríguez A, Ruiz A, Ariza B, Resistencia antibiótica del Helicobacter pylori en el hospital universitario San Ignacio de Bogotá. Acta Médica Colombiana 2008; 33: 11-14. [ Links ]
30. álvarez A, Moncayo JI, Santacruz JJ, Santacoloma M, Corredor LF, Reinosa E. Antimicrobial Susceptibility and Mutations Involved in Clarithromicyn Resistance Helicobacter pylori from Patients in the Western Central Region of Colombia. Antimicrob Agents Chemother 2009; 53: 4022-4024. [ Links ]
31. Henao R. SC, Quiroga A, Martínez M. JD, Otero W. Resistencia primaria a la claritomicina en aislamientos de Helicobacter pylori. Rev Col Gastroenterol 2009; 24: 110-114. [ Links ]
32. álvarez A, Moncayo JI, Santacruz JJ, Corredor LF, Reinosa E, Martínez JW, y cols. Resistencia a Metronidazol y Claritromicina en aislamientos de Helicobacter pylori de pacientes dispépticos de Colombia, Rev Med Chile 2009; 137: 1309-1314. [ Links ]
33. Henao R, Otero W, ángel LA, Martínez M. JD. Resistencia primaria al metronidazol en aislamientos de Helicobacter pylori en pacientes adultos de Bogotá, Colombia. Rev Col Gastroenterol 2009; 24: 10-15. [ Links ]
34. Torres ME, Pérez G, Olivares A, Fernández L, Raisler K, González N, et al. Antimicrobial susceptibility of Helicobacter pylori and mechanisms of clarithromycin resistance in strains isolated from patients in Uruguay, Rev Esp Enferm Dig 2009; 101: 757-762. [ Links ]
35. Vega AE, Cortiñas TI, Puig ON, Silva HJ. Molecular characterization and susceptibility testing of Helicobacter pylori stains isolated in western Argentina. Intern J of Infectious Dis 2010; 14S: 85-92. [ Links ]
36. Lins AK, Lima RA, Magalhaes M. Clarithromycin-Resistant Helicobacter pylori in Recife, Brazil, Directly Identified from Gastric Biopsies by Polymerase Chain Reaction. Arq Gastroenterol 2010; 47: 379-382. [ Links ]
37. García GT, Aranda KRS, Goncalves M, Cardoso SR, Kiyosi I, Neusa S. High prevalence of Clarithromicyn Resistance and cagA, vacA, iceA2and babA2 Genotypes of Helicobacter pylori in Brazil Children J Clin Microbiol 2010; 48: 4266. [ Links ]
38. Trespalacios A, Otero W, Mercado M. Resistencia del Helicobacter pylori a metronidazol, claritromicina y amoxicilina en pacientes colombianos. Rev Col Gastroenterol 2010; 25: 31-38. [ Links ]
39. Toledo H, López-Solis R. Tetracycline resistance in Chilean isolates of Helicobacter pylori. J Antimicrob Chemother 2010; 65: 470-473. [ Links ]
40. Eisig JN, Silva FM, Barbuti RC, Navarro T, Moraes J, Pedrazzoli J. Helicobacter pylori antibiotic resistance in Brazil: clarithromycin is still a good option. Arq Gastroenterol 2011; 48: 261-264 [ Links ]
41. Ayala G, Galván M, Chihu L, Fierros G, Sánchez A, Carrillo B, et al. Resistance to antibiotics and characterization of Helicobacter pylori strains from antrum and body from adults in Mexico. Microb Drugs Resist 2011; 17: 149-155. [ Links ]
42. Otth L, Wilson M, Fernández H, Otth C, Toledo C, Cárcamo V, et al. Isolation of Helicobacter pylori in Gastric Mucosa and Susceptibility to Five Antimicrobial Drugs in Southern Chile. Braz J Microbiology 2011; 42: 442-447. [ Links ]
43. Mochizuki H, Nogueira AP. Determinación de la susceptibilidad de cepas de Helicobacter pylori a levofloxacino en formato pequeño y método de difusión en disco usando agar yema de huevo. Rev Gastroenterol Perú 2011; 31: 224-229. [ Links ]
44. Scalestky I, Aranda K, García G, Goncalves M, Cardoso S, Iriya K, et al. Application of Real Time PCR Stool Assay for Helicobacter pylori Detection And Clarthromycin Susceptibility Testing in Brazilian Children. Helicobacter 2011; 16: 311-315. [ Links ]
45. Figueroa M, Cortés A, Pazos A, Bravo LE. Sensibilidad in vitro a amoxicilina y claritromicina de Helicobacter pylori obtenido de biopsias gástricas de pacientes de zona de bajo riesgo para cáncer gástrico. Biomédica 2012; 32: 32-42. [ Links ]
46. Suzuki RB, Almeida CM, Speranca MA. Absence of Helicobacter pylori high tetracycline resistant 16S rDNA AGA929-928TTC genotype in gastric biopsy specimens from dyspeptic patients in the interior of city Sao Paulo, Brazil. BMC Gastroenterology 2012; 12: 49-54. [ Links ]
47. Van der Wouden EJ, Thijs JC, Kusters JG, Van Zwett AA, Klieibeur JC. Mechanism and clinical significance of metronidazole resistance in Helicobacter pylori. Scand J Gastroenterol 2001; 36: 10-14. [ Links ]
48. Solca NM, Bernasconi MV, Piffaretti JC. Mechanism of metronidazol resistance in Helicobacter pylori: comparison of the rdxA gene sequences in 30 straints. Antimicrob Agents Chemother 2000; 44: 2207-2210. [ Links ]
49. Megraud FH. Pylori antibiotic resistance: Prevalence, Importance, and advances in testing. GUT 2004; 53: 1374-1384. [ Links ]
50. Glupczynski Y, Megraud F, López-Brea M, et al. European multicenter survey of in vitro antimicrobial resistance in Helicobacter pylori. Eur J Clin Microbiol Infect Dis 2000; 11: 820-823. [ Links ]
51. Ortiz AP, Reis FC, Ferraz LFC, Gerrits MM, Mendoca S, Kuster JG, et al. Differentially expressed genes in responses to amoxicillin in Helicobacter pylori analyzed by RNA arbitrarily primed PCR. FEMS Inmunol Med Microbiol 2006; 60: 226-230. [ Links ]
52. Gerrits MM, Godoy AP, Kuipers EJ, Ribeiro ML, Stoof J, Mendoca S, et al. Multiple mutations in or adjacent to the conserved penicillin-binding protein motifs of thepenicilin-bindingprotein1A confer amoxicillin resistance to Helicobacter pylori, Helicobacter 2006; 11: 181-184. [ Links ]
53. Tseng YS, Wu DC, Chang CY, Kuo CH, Yang YC, Jan CM, et al. Amoxicillin resistance with beta lactamase production in Helicobacter pylori. Eur J ClinInvest 2009; 39: 807-812. [ Links ]
54. Hernández M, Reyes O, Rodríguez J, González BL. La resistencia a antibióticos en Helicobacter pylori. Rev Cubana Med 2008; 47(4): 10-14. [ Links ]
55. Megraud F, Lehours. Helicobacter pylori detection and susceptibility testing. Clinical microbiology reviews 2007; 20 (2): 280-322. [ Links ]
56. De Francesco V, Ierardi E, Zullo A, Hassan C, Zullo A. Helicobacter pylori therapy: Present and future. World J Gastrontest 2012; 3: 68-73. [ Links ]
57. Berning M, Krasz S, Miehker S. Should quinolones come first in Helicobacter pylori therapy". Therapeutic Advances in Gastroenterology 2011; 4: 103-114. [ Links ]
58. Alarcón P, de la Obra D, García-Campos JA, Díaz-Regañón J y López-Brea M. Actividad in vitro de la furazolidona y la nitrofurantoína en aislamientos clínicos de Helicobacter pylori y estudio de la tasa de mutación. Rev Esp Quimioterap 2005; 18: 313-318. [ Links ]
59. Ramírez RA, Sánchez SR. Helicobacter pylori 25 años después (1983-2008). Rev gastroenterol Perú 2009; 29: 158-170. [ Links ]











 text in
text in