Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.29 no.3 Bogotá Sept. 2014
Eficacia de la erradicación del Helicobacter pylori en la prevención del cáncer gástrico: Revisión sistemática y metanálisis
David B. Páramo Hernández MD. (1), Iván Arturo Rodríguez Sabogal MD. (2), Jose Daniel Toledo Arenas MD. MSc. (3)
(1) Gastroenterólogo, Epidemiólogo Clínico, Hospital Santa Clara, Universidad El Bosque, Bogotá, Colombia E-mail: paramo.david@gmail.com
(2) Médico Internista, Epidemiólogo Clínico, Universidad El Bosque, Hospital Santa Clara, Clínica Reina Sofía. Bogotá, Colombia
(3) Médico Psiquiatra, Epidemiólogo, Magister en Experimentos Clínicos Controlados, Profesor titular de Epidemiología Universidad El Bosque. Bogotá, Colombia
Fecha recibido: 25-11-13 Fecha aceptado: 21-07-14
Resumen
Esta revisión sistemática y metanálisis ha tenido como objetivo definir la eficacia de la erradicación de Helicobacter pylori sobre la prevención del cáncer gástrico.
Realizamos una revisión de la literatura utilizando las principales bases de datos como PUBMED, EMBASE, CINAHL (EBSCO), Google académico, LILACS, Cochrane, ProQuest, disertaciones y tesis, obteniendo 3934 referencias, aplicando los criterios de inclusión y exclusión se seleccionaron 7 experimentos clínicos aleatorizados controlados. Utilizando la valoración de riesgo de sesgos de Cochrane, se evaluó la calidad de los estudios. El análisis estadístico se realizó con REVMAN 5.2.
Con un total de 5.552 sujetos, se encontró desarrollo de cáncer gástrico en 55 (2,41%) de 2278 pacientes a quienes se erradicó el H. pylori y en 96 (4,22%) de 2.272 a quienes no se les erradicó, RR: 0,57 (IC= 0,42-0,79). El tiempo de seguimiento osciló entre 3 y 15 años. El análisis de heterogeneidad (Chi cuadrado) tuvo un valor de p no significativo (p= 0,48) confirmando la NO presencia heterogeneidad, permitiendo el metanálisis. Con el gráfico de embudo (Funnel Plot), se descartó el sesgo de publicación y el análisis de sensibilidad no mostró cambios significativos.
En conclusión, este estudio sugiere que la erradicación del H. pylori disminuye el riesgo de cáncer gástrico, particularmente en poblaciones de alto riesgo, con una calidad de evidencia moderada. Recomendando en la práctica, la terapia de erradicación de H. pylori como medida de prevención.
Palabras clave
Helicobacter pylori, erradicación, cáncer gástrico.
INTRODUCCIÓN
El cáncer gástrico representa una de las primeras causas de mortalidad por neoplasia maligna en Colombia (1, 2) y en el mundo (3, 4) y el Helicobacter pylori ha sido uno de los más importantes factores de riesgo reconocidos en la génesis del cáncer gástrico (5-7).
El H. pylori es clasificado por la IARC (Internacional Agency for Research on Cancer), como carcinógeno biológico del grupo 1. Este grupo de carcinógenos tiene una asociación probada entre el agente y la neoplasia implicada (8). Por esto, la erradicación del H. pylori ha sido propuesta como una estrategia de quimio-prevención primaria para reducir la incidencia de cáncer gástrico (1, 9-12).
El comportamiento de las tasas de mortalidad del cáncer gástrico en Colombia ha tenido una tendencia a permanecer estable a pesar del mejoramiento de las condiciones de vida de la población, el mayor acceso a los servicios de salud y a los servicios especializados de endoscopia digestiva y gastroenterología. Llama la atención, luego de cerca de 25 años de tratamientos de erradicación del Helicobacter pylori (Hp) en la población que ha recibido servicios médicos que la tasa de mortalidad desde el año 2000 al 2009 se encuentra estable alrededor de 10 muertes por 100.000 habitantes (1, 2). Aunque la evidencia demuestra que H. pylori es un carcinógeno y que la infección crónica lleva a desarrollar cáncer gástrico en individuos susceptibles, el desarrollo de estudios que demuestren que la erradicación de la bacteria reduce la incidencia de la neoplasia ha tenido retos: varios modelos estadísticos calculan que es necesario realizar un estudio que demuestre esta hipótesis con una muestra de aproximadamente 17.625 sujetos de edad media, seguidos durante al menos 10 años. Sin embargo, desde el punto de vista logístico, metodológico y financieramente esto no ha sido posible (9). Los estudios en su mayoría no tienen aleatorización, presentan fallas en su diseño, no cuentan con muestras de individuos suficientes para demostrar esta causalidad, sus periodos de seguimientos son cortos o en el seguimiento prolongado presentan una pérdida importante de la muestra (13).
La presente revisión y metanálisis de experimentos clínicos controlados aleatorizados tiene por objetivo definir la eficacia de la erradicación del H. Pylori para la prevención del desarrollo de cáncer gástrico.
MÉTODOS
Una vez diseñado el protocolo de investigación, se inició la revisión sistemática de la literatura, tomando como fuente de información las bases de datos de: PubMed/Medline, Google Académico, EMBASE, LILACS, Colaboración Cochrane y ProQuest Disertaciones y tesis. Utilizando los términos normalizados (MESH): "Stomach neoplasms", "Eradication" y "Helicobacter pylori", aplicando el operador booleano AND, limitando la búsqueda a humanos y estudios clínicos controlados aleatorizados. Se revisaron las publicaciones hasta el 31 de diciembre de 2012. Luego, de forma independiente, los dos autores principales, mediante la técnica de descarte por título y abstracts realizaron una primera selección de estudios. Posteriormente al conjunto de artículos seleccionados por mutuo acuerdo de los investigadores, se les aplicó los criterios de inclusión y exclusión, obteniendo una muestra depurada de estudios a la cual se le aplicaría la evaluación de riesgo de sesgos propuesta por Cochrane mediante el software RevMan 5.2 versión en inglés, no disponible en español (14). El protocolo no se registró en la colaboración Cochrane ni está disponible en la red.
Criterios de inclusión y exclusión
Se seleccionaron estudios clínicos controlados aleatorizados completados o publicados hasta diciembre 31 de 2012 que cumplieran los criterios de inclusión: Estudios clínicos controlados aleatorizados con cegamiento o sin él con individuos, con edad entre los 16 y 89 años. De cualquier raza, género, escolaridad o estrato socioeconómico, que recibieron tratamiento para erradicación de H. pylori y en quienes se corroboró la eliminación del microorganismo; que evaluaron el desarrollo de cáncer gástrico posterior a la erradicación de H. pylori y que reportaron los resultados con medidas de asociación como son la razón de riesgos y el intervalo de confianza, o que pudieran ser calculados.
Se excluyeron estudios mal referenciados como clínicos controlados aleatorizados (cohortes, casos y controles, metanálisis, revisiones sistemáticas, guías de manejo, series de casos). Idiomas no factibles de traducir por los autores. La no consecución de estudios en texto completo y artículos no relevantes luego de leer el abstract o resumen.
Valoración de la calidad de los estudios
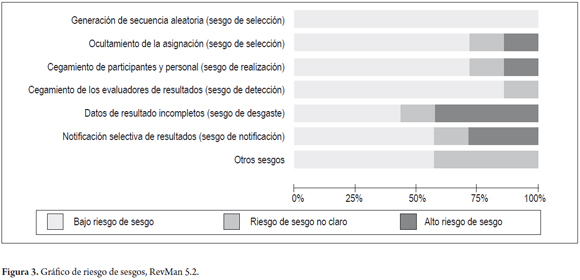
La calidad de los estudios fue valorada independientemente por dos autores y las diferencias dirimidas por el tercer autor. Se utilizó la herramienta para la evaluación del riesgo de sesgos según colaboración Cochrane (14). Cada estudio fue evaluado en los diferentes tipos de sesgos y cada tipo de sesgo fue calificado en alto riesgo, bajo riesgo y riesgo no claro, de acuerdo a los criterios especificados para aplicar y calificar en cada caso. De tal manera que se evaluaron los siguientes tipos de sesgo: la generación de la secuencia de aleatorización, el ocultamiento de la secuencia de asignación, el cegamiento de los participantes y del personal, el cegamiento de los evaluadores, los datos de los abandonos y resultados incompletos, la notificación selectiva de resultados, y otros sesgos (14).
ANáLISIS Y SÍNTESIS DE LOS DATOS
Mediante el Software Review Manager, RevMan 5.2 de la colaboración Cochrane (versión en inglés), se realizó el análisis y evaluación de cada uno de los estudios clínicos seleccionados. Se ingresaron los datos de identificación de cada estudio y posteriormente se realizó la evaluación de riesgo de sesgos, obteniendo el gráfico de riesgo de sesgos y el resumen de riesgo de sesgos. Posteriormente, con este mismo software se realizó el test de heterogeneidad mediante chi cuadrado y la prueba I cuadrado. Para la evaluación de sesgo de publicación se realizó el gráfico Funnel Plot (Embudo).
Luego se realizó la combinación de los resultados, mediante el método estadístico de Mantel-Haenszel, con el modelo de análisis de efectos fijos, tomando como medida del efecto la razón de riesgos o RR, obteniendo datos en una tabla y de forma gráfica con el Forest Plot (árbol o bosque). Para el análisis de sensibilidad se repitió el metanálisis retirando de forma selectiva cada uno de los estudios, evaluando el cambio en la dirección y magnitud del RR y el intervalo de confianza. Finalmente se calculó el número necesario a tratar (NNT) como medida del impacto de la intervención que permite generalizar los resultados.
RESULTADOS
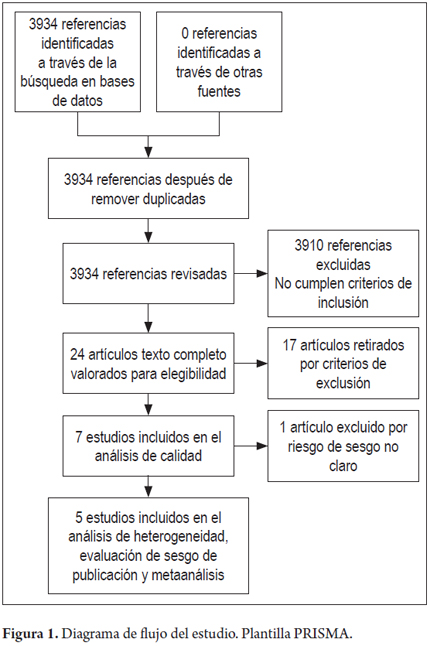
Se encontraron un total de 3.934 referencias. Después de aplicar los criterios de inclusión y exclusión se obtuvieron 7 estudios clínicos controlados aleatorizados (figura 1), y sus características principales se encuentran en las tablas 1 y 2, para un total de 5.757 pacientes (2882 en el grupo evento y 2885 en el grupo control). Es de anotar que de Zhou y colaboradores solo se incluyeron datos del último estudio publicado (20).
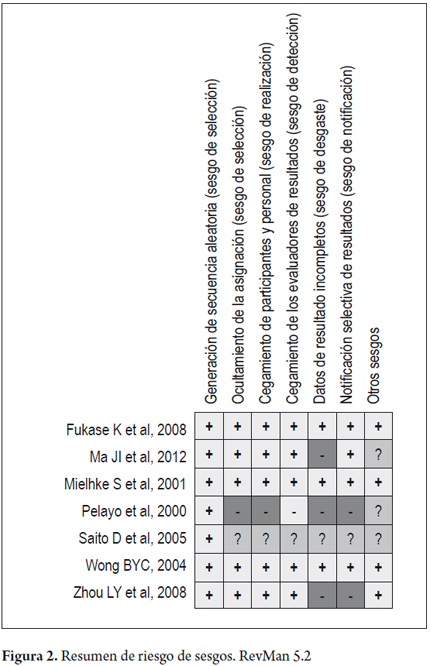
Se obtuvo el gráfico de resumen de riesgo de sesgos (figura 2). Siendo evidente que el estudio de Saito D, et al 2005 no permite evaluar muchos de los sesgos por falta de información en la publicación, el estudio de Pelayo, et al 2000 presenta cuatro sesgos en riesgo alto, seguido del estudio de Zhou, et al 2004. Los demás estudios en general tienen un bajo riesgo de sesgo.
Luego de forma global, mediante la elaboración del gráfico de riesgo según sesgo, de RevMan 5.2 (figura 3), se puede analizar de forma resumida el efecto de todos los estudios en cada uno de los sesgos evaluados. El sesgo con más alto riesgo es el sesgo de desgaste (attrition bias) dado por el reporte incompleto de los resultados en las publicaciones; seguido del sesgo de notificación (reporting bias) por el reporte selectivo de resultados.
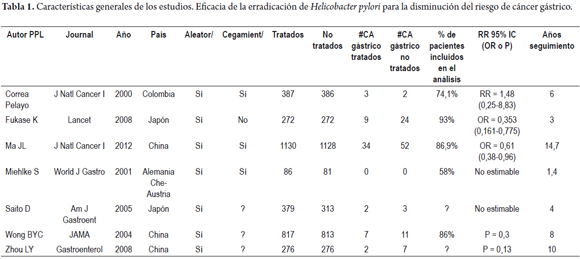
De esta forma contamos con siete estudios clínicos controlados aleatorizados: Pelayo, et al en el año 2000, Milhke, et al 2001, Wong, et al 2004, Saito D, et al en 2005, Fukase K, et al 2008, Zhou LY, et al 2008 y un estudio reciente que aporta el mayor número de muestra y peso al análisis que es el de Ma JL en 2012. Teniendo en cuenta el riesgo de sesgo no claro en 6 de 7 ítems de la evaluación, se decidió la exclusión del estudio de Saito D, et al de 2005 (15-19).
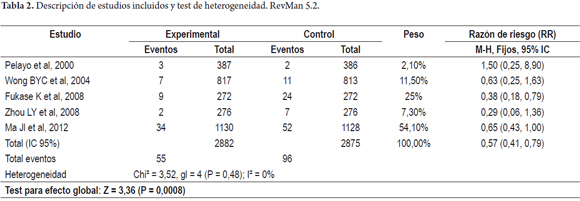
Para el test de heterogeneidad al ingresar los datos no fue posible realizar estimaciones con el estudio de Milhke, et al 2001, debido a que no hubo ningún evento (Ca gástrico) presente en el grupo experimental ni control, por lo que el análisis se realizó con los cinco estudios restantes.
Se obtuvo un chi² de 3,52 con un valor de p= 0,48 no significativo, que demuestra que no hay heterogeneidad entre los estudios, lo cual permite la combinación de los resultados (Metaanálisis). Para corroborar este hallazgo se practicó también la prueba I² (% de variabilidad en el efecto estimado debido a la heterogeneidad más que al simple error), y se obtuvo un reporte de 0% que implica que el efecto de la heterogeneidad puede no ser importante (tabla 1).
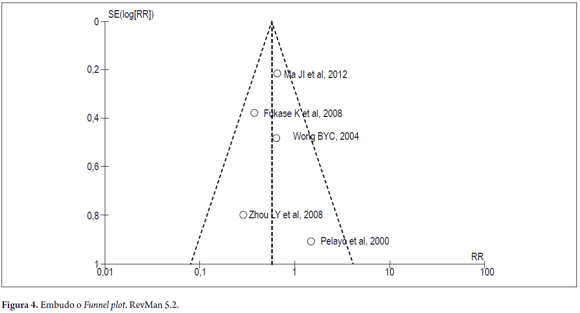
La evaluación del sesgo de publicación de forma visual mediante el gráfico de embudo (Funnel plot) mantuvo la simetría de los puntos, indicando la ausencia de sesgo de publicación (figura 4).
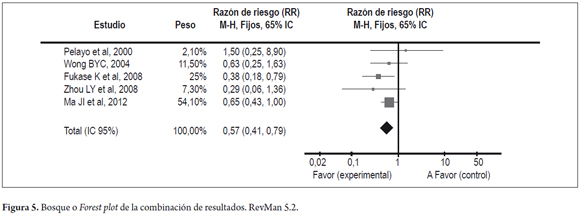
Se realizó la combinación de resultados (metanálisis), para cada uno de los estudios el estadístico resumen (RR) no mostró un IC significativo, con valores sobre la unidad, excepto en el estudio de Fukase, con RR= 0,38 (IC 95%: 0,18-0,79). El estudio de Ma JL, et al, 2012, fue el de mayor peso en la muestra con un 54,1% de las observaciones.
Al combinar los resultados, comparando erradicación de H. pylori vs. no intervención, el RR encontrado fue 0,57 (IC95%: 0,41-0,79), a favor de la intervención como medida preventiva de forma estadísticamente significativa (figura 5). La dirección de la medida resumen combinada (Rombo), se encuentra a favor de la intervención (erradicación de H. Pylori) como medida protectora para el desarrollo de cáncer gástrico, con un intervalo de confianza significativo.
El análisis de sensibilidad no mostró cambio en la dirección del efecto, ni en su magnitud, conservando la significancia estadística. Solo en el caso del retiro del estudio de Fukase se presentó perdida de la significancia estadística, pero se conservó la dirección del RR.
Se determinó el número necesario a tratar (NNT) de 68 (IC95%: 42-158), interpretado como si por cada 68 personas que reciben tratamiento de erradicación de Helicobacter pylori se lograra prevenir un caso de cáncer gástrico. Lo cual, aplicado a salud pública representa una importante intervención, sin poder definir su costo efectividad en los estudios analizados ni en esta revisión y metanálisis.
Finalmente, de forma reciente la colaboración Cochrane introdujo la evaluación de la calidad de la evidencia con el enfoque GRADE, este enfoque define la calidad del conjunto de las evidencias como el grado en que es posible confiar en que la estimación del efecto o asociación se encuentran cerca de la magnitud de interés.
Mediante el software GRADE profiler disponible y compatible junto con RevMan 5.2 en la colaboración Cochrane, se determinó la calidad de la evidencia como moderada, debido a la presencia de imprecisión, dado por el uso de estudios con pocos pacientes, pocos eventos y la presencia de intervalos de confianza amplios.
DISCUSIÓN
La presente revisión sistemática y metanálisis ha pretendido valorar la eficacia de la erradicación del H. pylori en la prevención del cáncer gástrico. Analizando 5 experimentos clínicos, se agruparon 5.757 sujetos, mostrando que esta intervención reduce el riesgo de cáncer gástrico con un riesgo relativo 0,57 (IC = 0,42-0,79), lo cual sugiere que la erradicación es una medida eficaz en la reducción del riesgo de cáncer gástrico y es estadísticamente significativa.
Con respecto a la revisión sistemática (23) y el único metanálisis encontrado que valoró esta pregunta publicado por Fuccio y colaboradores (24) en Annals of Internal Medicine en 2009, las conclusiones coinciden en el tamaño del efecto y su dirección, pero nuestro trabajo incluyó solo experimentos clínicos controlados y aleatorizados que valoran como desenlace final la incidencia de cáncer gástrico luego de la erradicación de la bacteria. A diferencia de Fuccio, pudimos incluir la experiencia de Ma JL y colaboradores (22) publicada en 2012 con un seguimiento a 15 años y un número de pacientes considerable. Fuccio y colaboradores (24) incluyen en su revisión un mayor número de experiencias pero estas tienen como desenlace final el efecto de la erradicación sobre las lesiones preneoplásicas.
A este respecto, la literatura médica ha revisado cuál es el momento más propicio para la intervención dentro de los pasos de la carcinogénesis gástrica y todo sugiere que probablemente una intervención como la erradicación en las fases tempranas de la enfermedad sería de mayor beneficio en la prevención del cáncer gástrico y de la regresión de las lesiones preneoplásicas (9, 11, 12, 25-27) y este fue un aspecto que no tuvimos en cuenta dentro de nuestra revisión.
Si bien la intervención sugiere que la quimio-prevención (erradicación) resulta beneficiosa y eficaz en la prevención del cáncer, el impacto podría ser modesto (58%), y podría prevalecer la controversia sobre su eficacia real. Sin embargo, ha soportado importantes propuestas a nivel de salud pública en el mundo y particularmente en los países afectados por el cáncer gástrico (28), dirigidas hacia la utilización de las terapias de erradicación del H. pylori para la prevención de la enfermedad. Adicionalmente, importantes consensos internacionales han incluido este concepto como evidencia suficiente para recomendar la terapia de la erradicación dirigida a este fin específico (29, 30).
Otro aspecto de gran importancia a nivel de salud pública, son los factores etiológicos reconocidos, como son los dietarios (la ingesta de sal y de nitritos y nitratos) (9, 11, 31-35), que no fueron includios en estos estudios.
Algunas de las limitaciones del estudio son que incluyó un número reducido de experimentos clínicos, y estos solo se realizaron en regiones de alta prevalencia de la enfermedad, con tiempos de seguimiento muy variables. Algunas condiciones particulares en los estudios como es el caso de Fukase y colaboradores (21) que incluyó pacientes con carcinoma gástrico temprano resecado y realizó el seguimiento para detección de carcinomas de novo. El estudio de Ma y colaboradores (22) que presentó seguimiento durante 15 años, con 2.258 sujetos, tuvo gran peso en la muestra de nuestro estudio, representando 60,4% de pacientes, con un riesgo relativo 0,65 (IC= 0,43-1,0) a favor de la reducción del riesgo con la intervención. Al realizar los análisis de sensibilidad, el peso de este estudio resultó muy significativo dentro de los resultados obtenidos; sin embargo, su exclusión no alteró los resultados.
La revisión muestra que la posibilidad de estudios clínicos controlados aleatorizados probablemente no resulte en la modificación de los conceptos actuales, además de que representan dificultades logísticas, metodológicas y desde luego financieras con seguimientos a muy largo plazo con una dificultad mayor dado que las inclusiones de controles o grupos placebos tendrían importantes objeciones éticas (24).
De otra parte, otro de los retos futuros atañe al desarrollo de esquemas terapéuticos eficaces para la erradicación del H. pylori como también es necesario valorar los porcentajes de erradicación, las tasas de reinfección o la recurrencia de la infección por H. pylori, los porcentajes de resistencia a los diferentes antibióticos, y el análisis de cepas patógenas y los polimorfismos genéticos inherentes a las poblaciones de estudio (36-40), resolver los cuestionamientos inherentes a las neoplasias gástricas aparecidas en pacientes a quienes se les ha erradicado la bacteria (41) y finalmente por supuesto al desarrollo de la vacuna anti-Helicobacter.
CONCLUSIONES
Desde el punto de vista práctico, consideramos que si bien el impacto sobre la prevención fue estadísticamente y clínicamente significativos, el tamaño del efecto fue modesto y la calidad de la evidencia moderada, se podría recomendar la práctica de la terapia de erradicación de H. pylori como medida de prevención de cáncer gástrico, particularmente en países de alto riesgo de neoplasia gástrica. En cuanto a las implicaciones para investigación futura consideramos que los hallazgos de esta revisión son consistentes y es poco probable que cambie su resultado con nuevos estudios y se abre el panorama para la investigación de nuevos aspectos etiopatogénicos y preventivos de la enfermedad.
Declaración de conflictos de interés
Los 3 autores declaran que no tienen ningún conflicto de interés para el desarrollo de la investigación y publicación de este artículo.
REFERENCIAS
1. Otero W. Cáncer gástrico en Colombia: un diagnóstico tardío que amerita el compromiso del Estado. Revista Colombiana de Gastroenterología. 2008; 4(23): 302-304. [ Links ]
2. Instituto Nacional de Cancerología E.S.E e Instituto Geográfico Agustín Codazzi. Atlas de mortalidad por cáncer en Colombia. Tercera edición. Bogotá: Imprenta Nacional; 2011. [ Links ]
3. Jemal A, Siegel R, Ward E, Hao Y, Xu J, Murray T, et al. Cancer statistics, 2008. CA Cancer J Clin 2008; 58: 71-96. [ Links ]
4. GLOBOCAN 2008 (IARC)(Internet): International Agency of Research on Cancer, WHO, Section of Cancer Information, Citado (12/6/2013). Disponible desde: http://www-dep.iarc.fr . [ Links ]
5. Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet 1984; 8390(1): 1311-1314. [ Links ]
6. Yamada T, Searle JG, Ahnen D. Helicobacter pylori in peptic ulcer disease. JAMA 1994; 272(1): 65-69. [ Links ]
7. Uemura N, Okamoto S, Yamamoto S. Helicobacter pylori infection and the development of gastric cancer. NEJM 2001; 345(11): 784-789. [ Links ]
8. International Agency for Research on Cancer, Schistosomes, Liver Flukes and Helicobacter pylori, vol. 61 of IARC Monographs on the Evaluation of Carcinogenic Risks to Human. IARC, Lyons, France, 1994. [ Links ]
9. Correa P, Piazuelo MB, Camargo MC. The future of gastric cancer prevention. Gastric Cancer 2004; 7: 9-16. [ Links ]
10. Ando T, Goto Y, Ishiguro K, et al. The interaction of host genetic factors and Helicobacter pylori infection. Inflammopharmacology 2007; 15: 10-4. [ Links ]
11. Correa P, Haenszel W, Cuello C, Tannenbaum S, Archer M. A model for gastric cancer epidemiology. Lancet 1975; 2: 58-60. [ Links ]
12. Correa P. Human gastric carcinogenesis: a multistep and multifactorial process. First American Cancer Society Award Lecture on cancer epidemiology and prevention. Cancer Res 1992; 52: 6735-40. [ Links ]
13. Sun TT, Wang JL, Fang JY. Quality of RCTs exploring Helicobacter pylori eradication for the prevention of gastric cancer and preneoplastic lesions. Expert Rev Anticancer Ther 2011; 11(10): 1509-1519. [ Links ]
14. Evaluación del riesgo de sesgos en los estudios incluidos. Manual Cochrane de revisiones sistemáticas de intervenciones. Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions. Version 5.1.0(updated March 2011). The Cochrane Collaboration, 2011; 197-255. Disponible desde www.cochrane-handbook.org. [ Links ]
15. Correa P, Fontham ET, Bravo JC, Bravo LE, Ruiz B, Zarama G, et al. Chemoprevention of gastric dysplasia: randomized trial of antioxidant supplements and anti-helicobacter pylori therapy. J Natl Cancer Inst 2000; 92(23): 1881-1888. [ Links ]
16. Miehlke S, Kirsch C, Dragosics B, Gschwantler M, Oberhuber G, Antos D, et al. Helicobacter pylori and gastric cancer: current status of the Austrain Czech German gastric cancer prevention trial (PRISMA Study). World J Gastroenterol 2001; 7(2): 243-247. [ Links ]
17. Wong BC, Lam SK, Wong WM, Chen JS, Zheng TT, Feng RE, et al. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial. JAMA 2004; 291(2): 187-194. [ Links ]
18. Saito D, Boku N, Fujioka T, Fukuda Y. Impact of H. pylori eradication on gastric cancer prevention: endoscopic results of the Japanese Intervention Trial (JITHP-Study). A randomized multi-center trial.(Abstract). Gastroenterology 2005; 128: A4. [ Links ]
19. Zhou L, Sung JJ, Lin S, Jin Z, Ding S, Huang X, et al. A five-year follow-up study on the pathological changes of gastric mucosa after H. pylori eradication. Chin Med J (Engl) 2003; 116(1): 11-14. [ Links ]
20. Zhou L. Ten-year follow-up study on the incidence of gastric cancer and the pathological changes of gastric mucosa after H. pylori eradication in China(Abstract). Gastroenterology 2008; 134: A233. [ Links ]
21. Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, et al. Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label, randomised controlled trial. Lancet 2008; 372(9636): 392-397. [ Links ]
22. Ma JL, Zhang L, Brown LM, Li JY, Shen L, Pan KF, et al. Fifteen-year effects of Helicobacter pylori, garlic, and vitamin treatments on gastric cancer incidence and mortality. J Natl Cancer Inst 2012; 104(6): 488-492. [ Links ]
23. Fuccio L, Zagari RM, Minardi ME, Bazzoli F. Systematic review: Helicobacter pylori eradication for the prevention of gastric cancer. Aliment Pharmacol Ther 2007; 25(2): 133-141. [ Links ]
24. Fuccio L, Zagari RM, Eusebi LH, Laterza L, Cennamo V, Ceroni L, et al. Meta-analysis: can Helicobacter pylori eradication treatment reduce the risk for gastric cancer? Ann Intern Med 2009; 151(2): 121-128. [ Links ]
25. Ito M, Haruma K, Kamada T, Mihara M, Kim S, Kitadai Y, et al. Helicobacter pylori eradication therapy improves atrophic gastritis and intestinal metaplasia: a 5-year prospective study of patients with atrophic gastritis. Aliment Pharmacol Ther 2002; 16(8): 1449-1456. [ Links ]
26. Kodama M, Murakami K, Okimoto T, Sato R, Uchida M, Abe T, et al. Ten-year prospective follow-up of histological changes at five points on the gastric mucosa as recommended by the updated Sydney system after Helicobacter pylori eradication. J Gastroenterol 2012; 47(4): 394-403. [ Links ]
27. Leung WK, Lin SR, Ching JY, To KF, Ng EK, Chan FK, et al. Factors predicting progression of gastric intestinal metaplasia: results of a randomised trial on Helicobacter pylori eradication. Gut 2004; 53(9): 1244-1249. [ Links ]
28. Asaka M. A new approach for elimination of gastric cancer deaths in Japan. Int J Cancer 2013; 132(6): 1272-1276. [ Links ]
29. Malfertheiner P, Megraud F, OMorain CA, Atherton J, Axon AT, Bazzoli F, et al. Management of Helicobacter pylori infection--the Maastricht IV/ Florence Consensus Report. Gut 2012; 61(5): 646-664. [ Links ]
30. Fock KM, Talley N, Moayyedi P, Hunt R, Azuma T, Sugano K, et al; Asia-Pacific Gastric Cancer Consensus Conference. Asia-Pacific consensus guidelines on gastric cancer prevention. J Gastroenterol Hepatol 2008; 23: 351-65. [ Links ]
31. Correa P, Haenszel W, Cuello C, Tannenbaum S, Archer M. A model for gastric cancer epidemiology. Lancet 1975; 2: 58-60. [ Links ]
32. Correa P, Houghton J. Carcinogenesis of Helicobacter pylori. Gastroenterology 2007; 133(2): 659-672. [ Links ]
33. Gaddy JA, Radin JN, Loh JT, Zhang F, Washington MK, Peek RM,Jr, et al. High Dietary Salt Intake Exacerbates Helicobacter pylori-Induced Gastric Carcinogenesis. Infect Immun 2013; 81(6): 2258-2267. [ Links ]
34. Gonzalez CA, Lopez-Carrillo L. Helicobacter pylori, nutrition and smoking interactions: their impact in gastric carcinogenesis. Scand J Gastroenterol 2010; 45(1): 6-14. [ Links ]
35. Kato S, Tsukamoto T, Mizoshita T, Tanaka H, Kumagai T, Ota H, et al. High salt diets dose-dependently promote gastric chemical carcinogenesis in Helicobacter pylori-infected Mongolian gerbils associated with a shift in mucin production from glandular to surface mucous cells. Int J Cancer 2006; 119(7): 1558-1566. [ Links ]
36. García-González MA, Lanas A, Quintero E, et al. Gastric cancer susceptibility is not linked to pro-and anti-inflammatory cytokine gene polymorphisms in whites: a nationwide multicenter study in Spain. Am J Gastroenterol 2007; 102: 1878-92. [ Links ]
37. Hurme M, Lahdenpohja N, Santtila S. Gene polymorphisms of interleukins 1 and 10 in infectious and autoimmune diseases. Ann Med 1998; 30: 469-73. [ Links ]
38. Machado JC, Pharoah P, Sousa S, et al. Interleukin 1B and interleukin 1RN polymorphisms are associated with increased risk of gastric carcinoma. Gastroenterology 2001; 121: 823-9. [ Links ]
39. Figueiredo C, Machado JC, Pharoah P, et al. Helicobacter pylori and interleukin 1 genotyping: an opportunity to identify high-risk individuals for gastric carcinoma. J Natl Cancer Inst 2002; 94: 1680-7. [ Links ]
40. El-Omar EM, Rabkin CS, Gammon MD, et al. Increased risk of noncardia gastric cancer associated with proinflammatory cytokine gene polymorphisms. Gastroenterology 2003; 124: 1193-201. [ Links ]
41. Iijima K, Abe Y, Koike T, Uno K, Endo H, Hatta W, et al. Gastric cancers emerging after H. pylori eradication arise exclusively from non-acid-secreting areas. Tohoku J Exp Med 2012; 226(1): 45-53. [ Links ]











 text in
text in