Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.29 no.3 Bogotá Sept. 2014
Tratamiento acortado a 16 semanas en paciente con infección por genotipo 2 del virus de hepatitis C. Reporte de un caso y revisión de la literatura
Rolando J. Ortega Q. MD. (1), Mario Moscote G. MD. (2), Moisés Diago M. MD. (3)
(1) Internista, Gastroenterólogo, Hepatólogo. Director División Hepatología y Director Adjunto División de Gastroenterología. Clínica General del Norte, Barranquilla. Instituto de Investigaciones Biomédicas, Facultad de Ciencias de la Salud Universidad de San Buenaventura. Cartagena, Colombia. E-mail: rolandoortegaquiroz@gmail.com
(2) Internista, Gastroenterólogo. Director División Gastroenterología. Clínica General del Norte. Barranquilla, Colombia.
(3) Internista, Gastroenterólogo y Hepatólogo. Jefe de Sección de Patología Digestiva. Director Servicio Hepatología. Hospital General de Valencia. Valencia, España. E-mail: moisesdiagom@gmail.com
Fecha recibido: 10-03-14 Fecha aceptado: 21-07-14
Resumen
Presentamos el caso de una paciente de 46 años con hepatitis C infectada por el genotipo 2 quien recibió tratamiento acortado con dosis bajas de interferón pegilado alfa 2b (1 mcg/k semana SC) y ribavirina (800 mg día oral) durante 16 semanas alcanzando respuesta viral sostenida a las 12 (RVS12) y a las 24 semanas (RVS24). La tolerancia al tratamiento fue muy buena sin presentarse anemia clínicamente significativa o efectos adversos. Se plantea la posibilidad de este tipo de terapia en pacientes con factores relacionados con un buen pronóstico como carga viral baja, poca fibrosis (< F2), respuesta viral rápida (RVR) e IL28B genotipo CC. Esta estrategia puede reducir significativamente los costes relacionados con los nuevos antivirales de acción directa (AAD) tipo sofosbuvir asociado a ribavirina que deben ser administrados durante 12 semanas.
Palabras clave
Hepatitis C, genotipo 2, tratamiento dual acortado, respuesta viral rápida.
INTRODUCCIÓN
La infección crónica por el virus de la hepatitis C se estima que afecta a alrededor de 160 millones de personas, representando una de las principales causas de hepatitis crónica, cirrosis, la principal etiología del hepatocarcinoma en Occidente y constituye la primera indicación para trasplante de hígado (1, 2). Los mecanismos por los cuales el virus infecta el hepatocito y se replica han sido parcialmente aclarados y objeto de amplias revisiones recientes (3). El virus de la hepatitis C presenta una alta heterogeneidad en su secuencia genética, lo que establece la clasificación en genotipos (diferencia mayor del 25-30%) y subtipos (diferencia mayor del 15%), los cuales se nombran con números y letras. Existen en la actualidad 7 genotipos numerados del 1 al 7 y al menos 67 subtipos nombrados con letras (4). Hasta la fecha no hay una clara relación entre el genotipo y la patogenicidad del virus y se ha estudiado en detalle la progresión de la fibrosis y la hepatocarcinogénesis (5). El tratamiento actual en nuestro país para el genotipo 2 es la combinación de interferón pegilado alfa 2 a/b con ribavirina a dosis fija 800 mg día por 24 semanas, o menor tiempo si se alcanza respuesta viral rápida (RVR), lo que representa un RNA negativo a la semana 4 de tratamiento (6). Recientemente han sido aprobados nuevos antivirales de acción directa (AAD) como el sofosbuvir que combinado con ribavirina acortan el tiempo de terapia a 12 semanas con menores efectos adversos (7, 8). Se presenta el caso de una paciente con infección por el genotipo 2 de la hepatitis C, quien recibe terapia dual interferón pegilado y ribavirina acortada a 16 semanas, alcanzando respuesta viral sostenida (RVS) a 12 y 24 semanas.
CASO CLÍNICO
Paciente de 46 años sexo femenino, quien es detectada positiva para anti-HCV en mayo 2012 durante donación en banco de sangre. Niega antecedentes transfusionales, uso de drogas, tatuajes, piercing u otra forma conocida como facilitadora de transmisión. Cesárea hace 20 años (1), G1P1A0, legrado biopsia por metrorragias hace 21 años, uso de "sueros vitaminados" hace 25 años sin un motivo específico. Consulta al servicio de hepatología en febrero de 2013, dos meses después de recibir notificación de confirmación del banco de sangre. Se realiza carga viral que informa 47.526 UI/ml, Log 4,68, utilizando RT-PCR cuantitativo en tiempo real (TaqMan) con un índice de sensibilidad (detección) desde 10 UI/ml. El resultado del genotipo es 2 empleando RT-PCR. El estudio del polimorfismo de la IL 28B (rs 12979860) es informado como genotipo CC. Para estadificar la evolución se realiza una elastografía de transición empleando el equipo Fibroscan 502 de Echosens que muestra 4,4 kPa (10 mediciones válidas, IQR 0,3), lo que corresponde a una fibrosis F0. Al examen físico, IMC 24,9, buenas condiciones generales, no signos de hepatopatía crónica. La analítica muestra Hb 13,1 g/dl, Leu 4810 mm3, Neu 2410 mm3, plaquetas 330,000 mm3, AST 22 UI (30), ALT 30 UI (30), GGTP 10 UI (40), fosfatasa alcalina 92 UI (206), TSH 1,6, PT 9, INR 0,8, bilirrubina total 0,6 mg/dl, glicemia 96 mg/dl, creatinina 0,8 mg/dl, ácido úrico 4,6 mg/dl, albúmina 4,2 g/dl, proteínas 7,1 g/dl. Gravindex negativo. Ecografía abdominal normal. Se discute con paciente estadio evolutivo sin evidencia de fibrosis o actividad inflamatoria. Sin embargo, por motivos personales y temor al efecto del virus solicita tratamiento, por lo que se propone posibilidad de terapia dual acortada a 16 semanas según cinética viral durante tratamiento. Se inicia terapia el 31 de mayo 2013 con interferón pegilado alfa 2b (1 mcg kg) 60 mcg SC semanal y ribavirina 800 mg día dosis dividida cada 12 horas. La cinética viral muestra carga viral negativa semana 2, semana 4 negativa, semana 12 negativa y semana 16 negativa finalizando tratamiento. Los controles para evaluar respuesta viral sostenida (RVS) y curación son negativos a la semana 12 (RVS12) y a la semana 24 (RVS 24). La tolerancia a tratamiento fue muy buena presentando leves síntomas flu-like que resolvieron en las primeras 4 semanas, una caída de hemoglobina 2 g/dl en total sin repercusión en su actividad diaria y discreta disminución de neutrófilos y plaquetas que alcanza su nadir a la semana 12 (1.940 mm3 y 268.000 mm3 respectivamente). A las 12 semanas después de finalizado el tratamiento, el hemograma recupero sus valores iniciales y la AST 16 UI (30), ALT 20 UI (30).
DISCUSIÓN
La hepatitis C representa un problema de salud pública mundial con evidencias actuales que sugieren que se asocia con una enorme carga clínica y económica. La prevalencia de la cirrosis relacionada con la hepatitis C ha aumentado en la última década y se proyecta continuará aumentando alcanzando un nadir en los próximos 10 a 15 años. La prevalencia de hepatitis C en pacientes con hepatocarcinoma oscila entre un 20% y un 90% y el riesgo relativo de un individuo infectado es 25 veces mayor que la población general. La mortalidad relacionada con el hígado es significativamente mayor en pacientes con infección crónica, principalmente en mayores de 40 años. La recurrencia del virus después del trasplante es universal, con una rápida progresión hacia la fibrosis, cirrosis y descompensación (40% a 5 años) (9). La hepatitis C tiene un curso crónico y solo excepcionalmente se produce el aclaramiento espontáneo del virus.
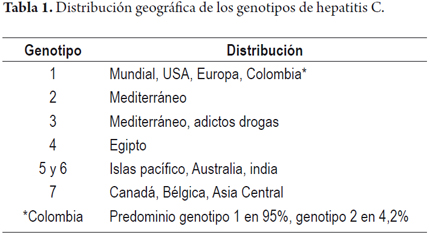
El genotipo 1 es el más prevalente en USA (1a) y Europa (1b) alcanzando 75%. El genotipo 2 prevalece en el Mediterráneo, el genotipo 3 afecta más a grupos con adicción a drogas, el genotipo 4 se ha aislado en Egipto, el genotipo 5 y 6 se ha encontrado en las islas del Pacífico, India, Australia, Nueva Zelanda y el genotipo 7 en Canadá, Bélgica y áfrica Central (2,4). En Colombia, en una serie de 284 pacientes con hepatitis C se evidenció una prevalencia de genotipo 1a 16%, genotipo 1b 71%, genotipo 1a y 1b de 8%, (total genotipo 1 de 95%), genotipo 2 de 4,2% y genotipo 3 de 0,7% (10) (tabla 1).
Existen evidencias que sugieren que el tratamiento de la hepatitis C es recomendable ya que se asocia con mejora en la calidad de vida, la inflamación, la fibrosis, la presión portal, el riesgo de hepatocarcinoma, insuficiencia hepática y la mortalidad (11, 12).
Los pacientes con moderada o nula fibrosis (F0-F2), genotipo 2, carga viral baja menor de 400,000 UI/ml, genotipo CC de IL28B, ausencia de síndrome metabólico, sexo femenino, no abuso de alcohol, ni coinfección con VIH, se asocian con mayor probabilidad de alcanzar una RVS (2, 13, 14) (tabla 2).
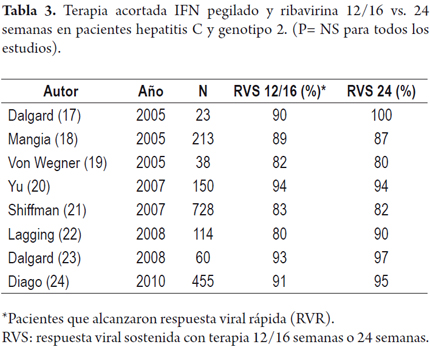
Desde los estudios iniciales con inferferón pegilado alfa 2b se pudo notar que no hubo diferencia de respuesta entre 1,5 y 1,0 mcg/kg/semana (15). Adicionalmente los pacientes con genotipo 2/3 se demostró que alcanzaban igual RVS con dosis bajas (800 mg/día) vs. dosis altas por peso de ribavirina y con tiempos más cortos a 24 semanas, en comparación al genotipo 1 que requería 48 semanas (16). Las tasas de RVS estaban entre 75 y 80% en estos pacientes, lo que motivó una serie de estudios para evaluar tiempos más cortos de tratamiento y si efectivamente la respuesta de los genotipos 2 y 3 era similar. En los resultados se hizo evidente que los pacientes con genotipo 2 y carga viral baja menor de 400.000 UI/ml, alcanzaban una RVS hasta en 93% con solo 12-16 semanas de tratamiento si eran negativos a la semana 4 lo que indica una respuesta viral rápida (17-24) (tabla 3). En un análisis del estudio ACCELERATE que incluyo un total de 1309 pacientes con genotipo 2/3, un 66% (863 pacientes) alcanzaron una respuesta viral rápida (RVR) y fueron aleatorizados a 16 semanas (458) vs. 24 semanas (405) de tratamiento. La RVS en pacientes con carga viral < de 400.000 UI/ml fue de 91% vs. 95% (P= 0,20) respectivamente, lo que pone de manifiesto el valor predictivo de la RVR en este grupo con carga viral baja (24). En otro estudio, los pacientes con genotipo 3 mostraban una menor respuesta al tratamiento, posiblemente por la esteatosis asociada (25). Dos metanálisis de tratamiento dual en genotipos 2 y 3 que incluyeron 7 y 8 estudios respectivamente, concluyeron que la RVS global en genotipos 2 era 74% y genotipo 3 de 68%. Los pacientes con genotipo 2 y respuesta viral rápida (RVR), lo que se consigue entre 60 y 85% de los casos, alcanzaron tasas de RVS entre 93 y 100%. No se encontraron diferencias estadísticamente significativas entre 12-16 y 24 semanas de duración de tratamiento (26, 27). En un estudio la disminución de las dosis de ribavirina de 800 mg/día a 400 mg/día no afectó la tasa de RVS a 24 semanas (28).
La incorporación en el año 2011 de los inhibidores de proteasa (IP) de primera generación boceprevir y telaprevir benefició exclusivamente a pacientes con genotipo 1, aumentando en 30% la RVS desde 40% a 70% (6, 7). Sin embargo, un estudio reciente que incluyó 233 pacientes naive con genotipo 1, fibrosis < F3, y carga viral basal menor de 600.000 UI, separó en dos grupos aquellos que alcanzaban RVR (48%) después de un Lead-in. Un primer grupo continuó terapia dual interferón pegilado alfa 2b más ribavirina hasta 24 semanas y el segundo grupo terapia triple con boceprevir hasta la semana 28. No hubo diferencias en la RVS12 que alcanzó 90% en ambos grupos (29).
La reciente aprobación y en curso de los nuevos antivirales de acción directa (AAD) que incluyen inhibidores nucleósidos de la RNA polimerasa (sofosbuvir), inhibidores de NS5A (daclatasvir, ledipasvir), IP de segunda generación (simeprevir, faldaprevr), abren un nuevo escenario en el tratamiento de los pacientes con hepatitis C. Terapias cortas, más eficaces, menos tabletas, no interacciones y un mejor perfil de seguridad hacen que estos medicamentos sean la primera línea en un futuro cercano (8). Los estudios Electron, Fusion, Fission, Neutrino con sofosbuvir, dejan en evidencia la excelente respuesta en pacientes con todos los genotipos incluyendo el genotipo 2. La combinación sofosbuvir y ribavirina por 12 semanas permite alcanzar una RVS en más de 93% de los pacientes con genotipo 2, tanto naive como en no respondedores previos. Una menor respuesta se logra en pacientes no respondedores previos con fibrosis avanzada, quienes necesitarán 16 semanas de tratamiento. Un poco más difícil pareciera ser la curación del genotipo 3 que deberá ser manejado con esquemas diferentes al genotipo 2, que incluyen un mayor tiempo de la combinación sofosbuvir y ribavirina por 24 semanas y quizá un tercer antiviral asociado (30-32). Recientemente la Asociación Americana para el Estudio del Hígado (AASLD) y la Asociación Europea para el Estudio del Hígado (EASL) han publicado sus guías con las recomendaciones basadas en los estudios de fase 3 recientemente liberados. Para pacientes naive no cirróticos (< F3) con infección por el genotipo 2, la combinación de sofosbuvir 400 mg y ribavirina 1.000-1.200 mg día durante 12 semanas representa la primera opción de tratamiento. En pacientes con cirrosis o no respuesta a tratamiento previo esta terapia debe ser extendida a 16 o 20 semanas. La combinación de interferón pegilado, ribavirina y sofosbuvir durante 12 semanas representa una alternativa (33, 34).
Queda por definir los costos de las nuevas terapias y las aprobaciones en cada uno de nuestros países, teniendo en cuenta la condición del paciente y las limitaciones económicas de los sistemas de salud.
La conclusión de este caso es que el tratamiento con dosis bajas de interferón pegilado y ribavirina, durante un tiempo corto de 16 semanas, representa una alternativa para pacientes con genotipo 2 y buenos factores predictores de respuesta, tales como fibrosis < F2, carga viral baja menor de 400.000 UI/ml, respuesta viral rápida y genotipo CC de IL28B. Esto es sobre todo importante en pacientes que deseen tratarse antes de alcanzar estadios avanzados de fibrosis, con una buena tolerancia a las medicaciones y menores costos en relación con los nuevos antivirales.
Agradecimiento
Angie López, enfermera del programa de consulta externa de hepatología de la Clínica General del Norte, Barranquilla.
REFERENCIAS
1. Blachier M, Leleu H, Peck-Radosavljevic M, et al. The burden of liver disease in Europe: A review of available epidemiological data. J Hepatol 2013; 58: 593-608. [ Links ]
2. Rosen H. Chronic hepatitis C infection. N Eng J Med 2011; 364: 2429-2438. [ Links ]
3. Polyak S, Morishima Ch, Scott J, et al. A summary of the 18th international symposium on hepatitis C virus and related virus. Gastroenterology 2012; 142: e1-e5. [ Links ]
4. Smith D, Bukh J, Kuiken C, et al. Expanded classification of hepatitis C virus into 7 genotypes and 67 subtypes: updated criteria and genotype assignment web resourse. Hepatology 2014; 59: 318-327. [ Links ]
5. Asselah T, Biéche I, Sabbagh A, et al. Gene expression and hepatitis C virus infection. Gut 2009; 58: 846-858. [ Links ]
6. Jake Liang T, Ghany M. Current and future therapies for hepatitis C virus infection. N Eng J Med 2013; 368: 1907-1917. [ Links ]
7. Jesudian A, De Jong Y, Jacobson I. Emerging therapeutic for hepatitis C virus infection. Clin Gastroenterol Hepatol 2013; 11: 612-619. [ Links ]
8. Mariño Z, Van Bommel F, Forns X, et al. New concepts of sofosbuvir-based treatment regimens in patients with hepatitis C. Gut 2014; 63: 207-215. [ Links ]
9. Younossi Z, Fanwal F, Saab S, et al. The impact of hepatitis C burden: an evidence-based approach. Aliment Pharmacol Ther 2014; 39: 518-531. [ Links ]
10. Arias Y, Echeverri J, Castro M, et al. Frecuencia de genotipos y subtipos de virus de la hepatitis C en pacientes Colombianos con infección crónica. Rev Médica Sanitas 2010; 13: 10-19. [ Links ]
11. Van der Meer A, Wedemeyer H, Feld J, et al. Is there sufficient evidence to recommend antiviral therapy in hepatitis C. J Hepatol 2014; 60: 191-196. [ Links ]
12. Chou R, Hartung D, Rahaman B, et al. Comparative effectiveness of antiviral treatment for hepatitis C virus infection in adults: A systematic review. Ann Inter Med 2013; 158: 114-123. [ Links ]
13. Nelson Hayes C, Imamura M, Aikata H, et al. Genetics of IL28B and HCV response to infection and treatment. Nat Rev Gastroenterol Hepatol 2012; 9: 406-417. [ Links ]
14. Ge D, Fellay J, Thompson A, et al. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature 2009; 46: 399-401. [ Links ]
15. Hoofnagle J, Seef L. Peginterferon and Ribavirin for chronic hepatitis C. N Eng J Med 2006; 355: 2444-2451. [ Links ]
16. Hadziyannis S, Sette H, Morgan T, et al. Peginterferon alfa 2a and ribavirin combination therapy in chronic hepatitis C. Ann Int Med 2004; 140: 346-355. [ Links ]
17. Dalgard O, Bjoro K, Hellum KB, et al. Treatment with pegylated interferon and ribavirin in HCV infection with genotype 2 or 3 for 14 weeks: A pilot study. Hepatology 2004; 40: 1260-1265. [ Links ]
18. Mangia A, Sontoro R, Minerva N, et al. Peginterferon alfa 2b and ribavirin for 12 vs 24 weeks in HCV genotype 2 or 3. N Eng J Med 2005; 352: 2609-2617. [ Links ]
19. Von Wagner M, Huber M, Berg T, et al. Pegiterferon alfa 2a and ribavirin for 16 or 24 weeks in patients with genotype 2 or 3 chronic hepatitis C. Gastroenterology 2005; 129: 522-527. [ Links ]
20. Lu ML, Dai Ch, Huang JF, et al. A randomized study of peginterferon and ribavirin for 16 vs 24 weeks in patients genotype 2 chronic hepatitis C. Gut 2007; 56: 553-559. [ Links ]
21. Shiffman M, Suter F, Bacon B, et al. Peginterferon alfa 2a and ribavirin for 16 and 24 weeks in HCV genotype 2 or 3. N Eng J Med 2007; 357: 124-134. [ Links ]
22. Lagging M, Langeland N, Pedersen C, et al. Randomized comparison of 12 or 24 weeks of peginterferon alfa 2a and ribavirin in chronic hepatitis C virus genotype 2/3 infection. Hepatology 2008; 47: 1837-1845. [ Links ]
23. Dalgard O, Bjoro K, Ring-Larsen H, et al. Pegilated interferon alfa and ribavirin for 14 vs 24 weeks in patients hepatitis C genotype 2 or 3 and rapid virological response. Hepatology 2008; 47: 35-43. [ Links ]
24. Diago M, Shiffman M, Bronowicki JP, et al. Identifying hepatitis C virus genotype 2/3 patients who can receive a 16 week abbreviated course of Peginterferon alfa 2a (40 KD) plus ribavirin. Hepatology 2010; 51: 1897-1903. [ Links ]
25. Zeuzem S, Hultcrantz R, Bourliere M, et al. Peginterferon alfa 2b plus ribavirin for treatment chronic hepatitis C in previously untreated patients infected with HCV genotypes 2 or 3. J Hepatol 2004; 40: 993-999. [ Links ]
26. Andriulli A, Mangia A, Iacobellis A, et al. Meta-analysis: the outcome of antiviral therapy in HCV genotype 2 and 3 infected patients with chronic hepatitis. Aliment Pharmacol Ther 2008; 28: 397-404. [ Links ]
27. Romero-Gómez M, Lacalle Remigio JR. Tratamiento de la hepatitis C por genotipos 2 y 3: revisión sistemática. Gastroenterol Hepatol 2006; 29: 139-145. [ Links ]
28. Ferenci P, Brunner H, Laferl H, et al. A randomized, prospective trial ribavirin 400 mg/day vs. 800 mg/day in combination with peginterferon alfa 2a in hepatitis C virus genotype 2 or 3. Hepatology 2008; 47: 1816-1823. [ Links ]
29. Pearlman B, Ehleben C. Hepatitis C genotype 1 virus with low viral load and rapid virological response to peginterferon/ribavirin obviates a protease inhibitor. Hepatology 2014; 59: 71-77. [ Links ]
30. Gane E, Stedman C, Hyland R, et al. Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C (Electron). N Eng J Med 2013; 368: 34-44. [ Links ]
31. Jacobson I, Gordon S, Kowdley K, et al. Sofosbuvir for hepatitis C genotype 2 or 3 in patients without treatment options (Positron-Fusion). N Eng J Med 2013; 368: 1867-1877. [ Links ]
32. Lawitz E, Mangia A, Wyles D, et al. Sofosbuvir for previously untreated chronic hepatitis C infection (Fission-Neutrino). N Eng J Med 2013; 368: 878-887. [ Links ]
33. Pawlotsky JM, Aghemo A, Dusheiko G, et al. EASL clinical practice guidelines 2014: management of hepatitis C virus infection. www.easl.eu. [ Links ]
34. AASLD-IDSA Hepatitis C Guidelines 2014. Recommen-dations for testing, managing and treating hepatitis C. www.hcvguidelines.org. [ Links ]











 text in
text in