Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.29 no.3 Bogotá Sept. 2014
Manejo de las fístulas de las anastomosis esófago-intestinales con prótesis autoexpandibles (PAE) en pacientes con cáncer. Reporte de casos
Ricardo Oliveros Wilches MD. (1), Raúl Pinilla Morales MD. (1), Haylmanrth Contreras Parra MD. (1), Oscar Guevara Cruz MD. (1)
(1) Instituto Nacional de Cancerología, Cirugía Gastrointestinal y Endoscopia Digestiva. Bogotá, Colombia.
Fecha recibido: 16-01-14 Fecha aceptado: 21-07-14
Resumen
Objetivo. Mostrar la experiencia en el manejo de pacientes con dehiscencia de las anastomosis esófago-yeyunales o esófago-gástricas con prótesis autoexpandibles esofágicas (PEA).
Material y métodos. Durante los años 2012 y 2013 se registraron las complicaciones posgastrectomía total en pacientes con cáncer gástrico con anastomosis efectuadas a nivel abdominal o a nivel torácico. Se incluyeron solo los pacientes con dehiscencias o fugas de las anastomosis. Se elaboró una hoja de registro donde se consignó de cada paciente la edad, sexo, localización de la lesión, estado clínico, si recibió repleción nutricional, quimioterapia y o radioterapia, día de presentación de la fístula o dehiscencia, cuantificación del tamaño, tipo de manejo, mortalidad, prótesis utilizada, número de prótesis, migración y retiro.
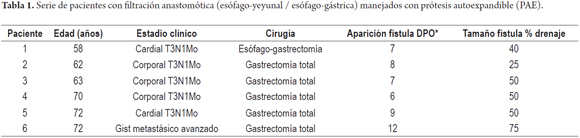
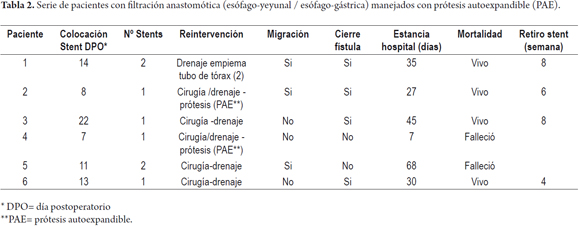
Resultados. Se registraron 6 pacientes, 5 con dehiscencia a nivel abdominal y uno a nivel torácico. Cinco con adenocarcinoma gástrico y uno por GIST gástrico con metástasis hepáticas. Dos habían recibido repleción nutricional por perdida mayor de 10% de su peso corporal. A todos los pacientes se les realizó anastomosis con sutura mecánica. Cuatro hombres y dos mujeres. A cinco pacientes se les realizó estudio radiológico con medio de contraste hidrosoluble, confirmando la dehiscencia en tres de ellos. Todos los pacientes fueron manejados con reexploración quirúrgica y drenaje. Solo a dos pacientes se les colocó la prótesis durante la nueva cirugía. Dos pacientes requirieron de una segunda prótesis por migración. En total la migración se observó en 50% de los pacientes. La estancia hospitalaria más larga fue de 68 días, con una mortalidad de dos pacientes (33%), uno con una fístula crónica manejada con dos prótesis y el otro el mismo día de su reintervención. Las prótesis fueron retiradas después de la cuarta semana.
Conclusiones. La frecuencia de esta complicación varía de 0 a 30%. El reconocimiento temprano y manejo oportuno son esenciales en el manejo de esta complicación. Hace unos años, el manejo de esta complicación era casi exclusivo del cirujano y la reintervención la regla. Actualmente, el manejo de esta complicación es controversial y no existen pautas definitivas. Sin embargo, el abordaje y manejo depende de la condición clínica del paciente, del tamaño de la dehiscencia y de la vitalidad de los bordes. La tendencia es tratar de preservar la continuidad intestinal y que la endoscopia haga parte del diagnóstico y manejo de esta complicación con una serie de nuevas herramientas dentro de las cuales la más utilizada son las prótesis autoexpandibles.
Palabras clave
Fuga anastomótica, fístula anastomótica, gastrectomía, esofaguectomía, manejo, prótesis esofágicas autoexpandibles.
Las fugas de las anastomosis esófago-yeyunales o esófago-gástricas son una complicación poco frecuente; sin embargo, conllevan a una situación muy compleja por la morbilidad y mortalidad que se refleja en largas hospitalizaciones y aumento en los costos hospitalarios (1, 2).
La frecuencia de esta complicación varía de 0 a 30%, dependiendo del hospital, del volumen quirúrgico y de la experiencia del cirujano (3). El reconocimiento temprano y el oportuno y adecuado tratamiento son esenciales en el manejo de estos pacientes (4).
El diagnóstico de la fuga debe sospecharse cuando existe alguna alteración o anormalidad en el postoperatorio de este tipo de cirugías. Debe utilizarse un estudio radiológico con medio de contraste hidrosoluble o un trago de azul de metileno diluido, o un estudio tomográfico con medio de contraste vía oral inmediatamente antes de las adquisición de las imágenes o una endoscopia digestiva alta para confirmarla o descartarla (5).
Durante los últimos años, el manejo de esta complicación casi era exclusivo del cirujano y la reintervención era la regla, para drenaje de colecciones y refuerzo en el sitio dehiscente de la anastomosis (6, 7). Otra alternativa era desfuncionalizar la anastomosis con desarticulación, esofagostoma cervical y yeyunostomía para alimentación, con posterior reconstrucción del tracto digestivo unos seis meses después (8). Actualmente, el manejo de esta complicación es controversial y no se han establecido unas pautas definitivas. Sin embargo, el abordaje y manejo depende de la condición clínica del paciente, del tamaño de la dehiscencia y de la vitalidad de los bordes de la anastomosis (9). Por ello algunos autores recomiendan individualizar el manejo de cada paciente tratando de preservar la continuidad intestinal (4, 10).
Los síntomas de esta complicación varían desde pacientes completamente asintomáticos o silentes hasta pacientes con cuadros de sepsis severa (4, 10). Dentro de las actuales alternativas de manejo se encuentran: el tratamiento conservador, la reintervención con drenaje, el manejo endoscópico con o sin drenaje, sumado a los cuidados del paciente en condiciones críticas como la nutrición enteral, parenteral, cubrimiento con antibióticos, drenaje de colecciones perianastomóticas y manejo en la unidad de cuidados intensivos (UCI) (11).
La tendencia actual es que la endoscopia haga parte del diagnóstico temprano y del manejo de esta complicación, con diferentes alternativas como las PAE, el cierre asistido por succión (de la sigla en inglés endoluminal vacuum assisted closure (VAC-E), los clips, sellantes y tapones con mallas de vicryl o surgisis (10, 12).
El propósito de este trabajo es mostrar la experiencia en el manejo de pacientes con dehiscencia de la anastomosis esófago-yeyunal o esófago-gástrica, con PAE.
MATERIAL Y MÉTODOS
Durante los años 2012 y 2013, se registraron las complicaciones posgastrectomía total, en pacientes con cáncer gástrico, con anastomosis efectuadas a nivel abdominal o a nivel torácico. Se incluyeron solo los pacientes con dehiscencias de la anastomosis. De diciembre del 2011 a diciembre del 2012, se realizaron 145 gastrectomías por cáncer gástrico, en nuestra institución, siendo 72 de ellas gastrectomía totales, una de ellas con anastomosis a nivel torácico.
Se elaboró una hoja de registro donde se consignaba la edad, sexo, localización de la lesión, estado clínico, la utilización o no de repleción nutricional, quimioterapia o radioterapia preoperatorias, día de presentación de la fístula o dehiscencia de la anastomosis, cuantificación del tamaño de la dehiscencia, descripción del tipo de manejo: quirúrgico, conservador y o endoscópico, día de colocación de la PAE, mortalidad, número de PAE, migración de la prótesis, éxito endoscópico (demostrado con la ausencia de la fuga en controles radiológicos posteriores) y tiempo de retiro de la prótesis endoscópica.
A los pacientes se les realizó un estudio radiológico con medio de contraste hidrosoluble al 7 día postoperatorio independientemente del curso de su cirugía. Todos los pacientes tuvieron drenaje perianastomótico. Cuando se tuvo duda de la presencia de una dehiscencia de la anastomosis, con el estudio radiológico, el paciente recibió un trago de azul de metileno diluido. Si se tenía certeza de la presencia de una fístula o dehiscencia el paciente era evaluado para definir el manejo correspondiente, basado en la clínica, con previo estudio tomográfico. Cuando se definió el manejo con colocación de prótesis, el paciente fue llevado a cirugía para lavado, drenaje y preferiblemente colocación de la prótesis durante la misma cirugía con avance de sonda de nutrición enteral. El tamaño de la dehiscencia se obtuvo del informe endoscópico y o quirúrgico. Se trató de tener un estudio radiológico o endoscópico para control de la efectividad de la prótesis en el sellamiento de la fistula de forma temprana. Cuando no fue factible la colocación de la prótesis durante la cirugía esta fue colocada días después. El retiro de la prótesis l se efectuó entre la cuarta y octava semanas. Las prótesis utilizadas fueron tecnostent, E16-12, monocuerpo 18-12 y prótesis de fabricación China, con diámetro de 18 mm y 12 de longitud.
RESULTADOS
Por tratarse de una complicación poco frecuente, se registraron 6 pacientes con las características anotadas en las tablas 1 y 2.
Cinco de los seis pacientes fueron llevados a cirugía por adenocarcinomas gástricos y el sexto paciente por un tumor del estroma gastrointestinal avanzado con metástasis hepáticas, quien había recibido manejo neoadyuvante con imatinib.
Dos pacientes recibieron repleción nutricional preoperatoria por pérdida mayor de 10% de su peso corporal.
En cinco pacientes el manejo quirúrgico fue una gastrectomía total, con reconstrucción en Y de Roux, hecha con sutura mecánica de forma término-lateral. Al otro paciente se le practicó una esofagogastrectomía, con anastomosis término-lateral intratorácica con sutura mecánica.
A cinco pacientes se les practicó estudio radiológico con medio de contraste hidrosoluble, confirmando dehiscencia o fuga en tres de ellos. El cuarto requirió trago de azul de metileno para confirmarlo y el quinto consultó dos días después de ser dado de alta con estudio radiológico aparentemente normal. El paciente restante fue llevado directamente a cirugía por el cuadro clínico.
En todos los pacientes se optó por la reintervención, es decir, fueron llevados a cirugía, para drenaje e inspección de la anastomosis. A dos de ellos se les practicó endoscopia durante la cirugía, con evaluación de la anastomosis, colocación de la PAE y avance de sonda de nutrición enteral. A otros dos pacientes se les colocó la PAE dos días después de ser llevados a cirugía y a los dos pacientes restantes una semana y dos semanas después de ser llevados a la reintervención.
Dos pacientes requirieron colocación de un nueva PAE por migración, a la semana y a la cuarta semana. Otra paciente consultó a la cuarta semana por vómitos encontrándose migración de la PAE pero demostrándose sellamiento y cicatrización de la fuga.
Un paciente, a pesar de recibir dos PAE no mostró cierre de la fuga 12 semanas después. Este paciente fue uno de los que recibieron repleción nutricional por 14 días antes de la cirugía y falleció. El otro paciente falleció la noche de la reintervención.
Las PAE fueron retiradas luego de la 4ª semana; en los cuatro pacientes que no fallecieron, con cierre de la dehiscencia en todos ellos.
La estancia hospitalaria más larga fue de 68 días, correspondiendo al paciente que no cerró la fístula y necesitó dos PAE. Ninguno de los pacientes recibió quimioterapia ni radioterapia preoperatoria.
En resumen, cuatro hombres y dos mujeres, con edades entre los 58 y 72 años. Presencia de fistula o fuga entre el séptimo y decimosegundo día postoperatorio. Dos pacientes fallecieron. En la mitad de los pacientes se evidenció migración de la PAE con evidencia de cierre de la fuga en cuatro pacientes.
DISCUSIÓN
En nuestro medio, 50% de las gastrectomías por cáncer gástrico localizado son totales (13). Esto conlleva la realización de anastomosis esófago-yeyunales a nivel abdominal o en un porcentaje menor anastomosis a nivel torácico, ya sea por resección del esófago distal o por esófago-gastrectomías. Las complicaciones de este tipo de procedimientos son la estenosis, el sangrado y las filtraciones o fugas (14).
Las fugas anastomóticas y la infección intrabdominal han sido miradas como las principales complicaciones luego de una gastrectomía radical (15).
La fuga de la anastomosis esófago-yeyunal después de cirugía por cáncer es una complicación seria que conlleva cifras importantes de morbilidad y mortalidad. El tratamiento óptimo no está descrito y las opciones son la cirugía o reintervención, manejo conservador con drenaje externo y manejo endoscópico con o sin drenaje externo, dependiendo del cuadro clínico del paciente. En la última década esta complicación ha tenido diferentes enfoques de manejo principalmente desde el punto de vista endoscópico (14).
La filtración o fuga de la anastomosis es la salida del contenido intestinal a través de la línea de sutura de las dos vísceras en este caso del esófago con el yeyuno o del esófago con el estómago, con la posibilidad de coleccionar a nivel perianastomótico o cerca de la anastomosis causando fiebre, septicemia, absceso, alteración metabólica y falla uni o multiorgánica. Este contenido puede emerger a través del dren perianastomótico o de los tubos de tórax dejados vecinos a la sutura (16).
La fuga anastomótica después de cirugía esofágica varía de 0% a 30%, siendo las ocurridas a nivel intratorácico las asociadas con mayor morbilidad y mortalidad (8, (10).
Mientras la reexploración quirúrgica ha permanecido como la opción preferida para el tratamiento de las fugas de las anastomosis esófago-yeyunales esta conducta está asociada con cifras altas de morbilidad y mortalidad, conllevando alta estancia hospitalaria y aumento en los costos médicos (17).
Como alternativa al manejo quirúrgico, se describen varias opciones endoscópicas las cuales están asociadas a cifras variables de éxito, con pequeñas series de casos y pacientes heterogéneos. Sin embargo, el mejor abordaje para esta complicación no ha sido establecido (8, 10).
Por lo anterior se plantean las siguientes preguntas con respecto al interrogante de cuál será el mejor manejo para pacientes con fuga de la anastomosis esófago-yeyunal o esófago-gástrica.
1. Al paciente, en el postoperatorio de una gastrectomía total o esófago-gastrectomía¿debe realizársele un estudio radiológico con medio de contraste hidrosoluble?
2. Cuando se sospecha una fuga de la anastomosis, ¿debe realizarse un estudio diagnóstico: radiológico, con medio de contraste?, ¿tomográfico o endoscópico?
3. ¿Qué pacientes con fuga de la anastomosis deben ser manejados de forma conservadora?
4. ¿Qué pacientes con fuga de la anastomosis deben recibir manejo endoscópico?
5. ¿Qué pacientes con fuga de la anastomosis deben ser llevados a cirugía?
6. ¿De qué depende que se tome una u otra decisión?
7. ¿Losos pacientes deben tener una evaluación endoscópica temprana?
8. Si la endoscopia hace parte del tratamiento, qué herramienta debe ser utilizada?
9. ¿Debe utilizarse una sola herramienta endoscópica?
10. ¿Cuánto tiempo debe ser utilizada la herramienta endoscópica?
El resultado del manejo de esta complicación depende de la experiencia del cirujano y del grupo tratante. El principal objetivo del manejo de la fuga de una anastomosis esófago intestinal es la obliteración o el sellamiento temprano para evitar el escape del contenido intestinal a la cavidad pleural o abdominal con la consecuente formación de abscesos, septicemia, peritonitis, empiema y falla orgánica (10, 17).
Por ello es fundamental el diagnóstico temprano de esta complicación. Las filtraciones de las anastomosis se presentan entre el séptimo y décimo día postoperatorio, por lo que cualquier irregularidad en el curso de una cirugía esofágica por cáncer obliga a realizar alguna ayuda diagnóstica que permita confirmarlo o descartarlo (18).
Con respecto a la evaluación inicial por medio de esofagograma con medio hidrosoluble, tomografía con contraste oral o endoscopia temprana existen las siguientes consideraciones: el diagnóstico temprano requiere de un alto índice de sospecha por parte del cirujano. Se ha sugerido que el esofagograma con medio de contraste hidrosoluble tiene pobre sensibilidad y especificidad, fallando en identificar filtraciones clínicamente significativas o demostrando falsas filtraciones por el tipo de reconstrucción, término-lateral. Por ello algunos autores sugieren no utilizar este método (21). Lamb, en un estudio de 66 pacientes con trago de medio hidrosoluble encontró una sensibilidad de 66% y concluye que no hay papel para el uso rutinario de este método diagnóstico después de una gastrectomía total (19). Otros autores mencionan que el estudio radiológico con medio de contraste falló en evidenciar una filtración o dehiscencia en cerca de la mitad de los pacientes (20).
En relación al estudio tomográfico con medio de contraste oral, hay poca evidencia en la literatura. En un estudio de 25 pacientes se encontró ser más exacto que la fluoroscopia con medio de contraste (21).
La endoscopia fue utilizada por Griffin en 291 pacientes, con mínima insuflación de aire para identificar filtración en pacientes sintomáticos. La ventaja de la endoscopia sobre los estudios radiológicos incluye visualización y cuantificación del defecto (22). Se puede detectar la presencia de necrosis de los bordes, lo cual no es valorable con los otros métodos. La endoscopia puede ser utilizada en la UCI, facilita la colocación de una sonda nasogástrica o nasoyeyunal para drenaje o alimentación distal enteral. La sensibilidad y especificidad de la endoscopia para diagnosticar filtración de la anastomosis es aproximadamente de 95% (10, 16, 23). La endoscopia debe ser realizada tan pronto como el desarrollo del postoperatorio de una esofagectomía difiera de su curso normal (8).
En este trabajo no aleatorizado prospectivo con 38 pacientes a los cuales se les realizaron los 3 estudios descritos se encontró igual sensibilidad (87,5%) para el estudio radiológico con medio hidrosoluble y tomográfico y una especificidad de 90% y 100% respectivamente. Para la valoración endoscópica la sensibilidad y especificidad fue de 100%. Varios estudios han mencionado que el estudio radiológico con medio de contraste oral no es el método ideal para investigar la filtración de una anastomosis del tracto digestivo. Además, pueden existir falsos positivos por el tipo de anastomosis. Un diagrama detallado de la anastomosis quirúrgica debe ser aportado por el cirujano al radiólogo para una adecuada interpretación. Se utiliza medio de contraste hidrosoluble pero el bario tiene más sensibilidad (21).
La tomografía axial computarizada (TAC) puede ser realizada más fácilmente al paciente muy enfermo o aquellos con pobre movilidad y permite reconocer hallazgos asociados como abscesos, derrame pleural, neumotórax, anormalidades pulmonares. Griffin mostró que la endoscopia es más exacta en la investigación de la filtración de la anastomosis mostrando una sensibilidad de 100% y además es útil para valorar la vitalidad de los bordes, útil en pacientes críticos y cuando no es confirmada por radiología (21).
En resumen, los estudios postoperatorios para identificar filtraciones no son garantía. Pacientes con sospecha clínica pueden tener un estudio radiológico con medio hidrosoluble para confirmar hallazgos clínicos o pueden tomar un trago de azul de metileno si tienen drenaje externo. El TAC con medio de contraste oral es una buena alternativa en pacientes con menos movilidad y para identificar complicaciones como abscesos, derrame pleural etc. La endoscopia es excelente en valorar la integridad de la anastomosis y es ideal cuando hay incongruencia con los hallazgos radiológicos (21).
Existe en la literatura actualmente mayor tendencia al manejo conservador o no operatorio, implicando con ello la utilización de varias herramientas endoscópicas para sellar u obliterar el orificio fistuloso. Debe tenerse en mente la necesidad o no de drenaje de colecciones perianastomóticas, guiadas por TAC, la nutrición parenteral y o enteral, el cubrimiento con antibióticos y manejo en la UCI. Cuando se piensa en la reintervención la morbilidad y mortalidad son mayores comparadas al manejo conservador (24).
Dentro de las nuevas alternativas endoscópicas se encuentran las PAE, totalmente recubiertas, la utilización del sistema VAC endoscópico, los clips, los sellantes como el fibrin glue o cianocrilatos, el surgisis o colocación de malla de vicryl con sellamiento y la utilización de la trampa de oso.
La pregunta es: ¿cuál de ellas debe ser utilizada?, ¿en qué momento? ¿Cuál es la primera elección? y ¿hay necesidad de utilizar más de una de ellas?
Esta pregunta tampoco tiene contestación. Sin embargo, la literatura tiene mayores publicaciones con la utilización de PAE, con éxito clínico de 70 a 80% (10, 25-27). Tienen la facilidad de su colocación en salas de cirugía, de endoscopia o en la UCI. Sus complicaciones están relacionadas con la migración, con cifras cercanas a 50%. Las PAE deben ser cubiertas completamente lo cual facilita su retiro y también la migración. Deben tener mayor diámetro que la luz esofágica para que el adosamiento a la mucosa facilite el sellamiento u obliteración del orificio de filtración o fuga (24). Cuando se realiza la endoscopia no debe existir espacio entre la prótesis y la pared esofágica. Una vez colocada la prótesis debe tenerse un control radiológico con medio de contraste 24 horas después para evaluar su posición así como la detención de la fuga del medio de contraste fuera de la luz intestinal. Si existe sellamiento adecuado de la filtración, la vía oral puede ser reiniciada. Las PAE deben ser retirados a la sexta semana cuando se sabe que la mayoría de las filtraciones han cicatrizado (27). En casos de fístulas recalcitrantes o que no cierran después de la sexta semana, se puede utilizar una segunda prótesis o asociar otras herramientas endoscópicas (28).
Se han descrito casos de perforación con la colocación de la prótesis pero la complicación más frecuente es la migración (16 % a 37%) (24). Cuando el control radiológico de las 24 horas no muestra un sellamiento de la filtración es necesario el retiro y la colocación de una nueva prótesis de mayor diámetro. La terapia con la prótesis debe estar acompañada de una evaluación de la región perianastomótica con una TAC con medio de contraste por vía oral. Si los drenes han sido retirados y se han detectado nuevas colecciones debe realizarse drenaje con tubos de tórax o guías dirigidas por control tomográfico. En estos casos todos los pacientes deben recibir antibióticos de amplia cobertura (24).
En la literatura, las prótesis autoexpandibles preferidas son las Polyflex (24, 25). En nuestro medio hemos utilizado las prótesis monocuerpo de 18 mm de dm y se están diseñando de mayor diámetro en su parte proximal (18 a 23 mm) para filtraciones a nivel cervical y de 21 a 25 mm para pacientes con fugas intratorácicas. Los Wallstents deben ser evitados para fugas de las anastomosis esófago-yeyunales (18).
En relación al tamaño de la dehiscencia, las de 30% a 70% deben ser tratadas con PAE. (27) Las dehiscencias de mayor tamaño o dehiscencia completa requieren cirugía. Sin embargo, existe en la literatura reporte de un caso con dehiscencia completa con resultado exitoso luego de la colocación de una PAE (29). Las dehiscencias menores de 30% de la circunferencia pueden ser manejadas con clips, inyección de fibrina glue o colocación de prótesis (10).
Aparte del tamaño y localización de la fístula, el tiempo de diagnóstico y la condición general del paciente también determinan el resultado final del manejo (24).
Otro sistema endoscópico utilizado es el VAC-E (30). Se apoya en el VAC, modalidad de tratamiento cerrado para las heridas cutáneas infectadas, basado en la presión negativa aplicado a la herida a través de una esponja. La esponja con la aplicación negativa uniforme sobre la superficie permite la formación de tejido de granulación, la remoción de secreciones, reduce el edema y mejora el flujo sanguíneo permitiendo el cierre de la herida. Un tubo duodenal pasado por la nariz, el cual en su punta tiene adosado con material de sutura un segmento de esponja, utilizada en el sistema VAC, diseñado del tamaño de la filtración o dehiscencia. La esponja es llevada con una pinza endoscópica e introducida dentro de la cavidad necrótica. Una succión continua de 125 mmHg fue aplicada. Esta esponja es cambiada 2 a 3 veces por semana, hasta que la cavidad muestre cambios de sellamiento o reducción en tamaño. La literatura muestra que el sistema VAC-E es seguro y efectivo en el tratamiento de las filtraciones posquirúrgicas intratorácicas con adecuados resultados finales (30).
El sistema E-VAC parece ser tan efectivo como la utilización o colocación de prótesis; sin embargo, se necesitan varias sesiones de endoscopia a la semana para cambiar la esponja lo cual puede resultar molesto para el paciente máxime si tiene otra sonda nasoenteral distal para la alimentación. En un estudio retrospectivo, no aleatorizado, se utilizó prótesis en 39 pacientes y E-VAC en 32, con cierre de la fístula en 53,8% de los pacientes con prótesis y de 84,4% en los del VAC, con hospitalizaciones de 41 días vs. 48,5 respectivamente. Mortalidad de 11 pacientes con prótesis y de 5 en el otro grupo. Estos autores concluyen que el sistema E-VAC es tan seguro y efectivo en el tratamiento y manejo de fístulas posquirúrgicas. También debe ser considerado en casos refractarios a otros tratamientos endoscópicos (31).
Dentro de las alternativas de manejo para las filtraciones de las anastomosis esófago-yeyunales y esófago-gástricas está la aplicación de sellantes de fibrina, (combinación de fibrinógeno y trombina) solo o en combinación con un tapón de malla de vicryl (32). Está descrita su utilización en casos de fístulas menores a 1 cm de diámetro y profundidad. Una vez hecho el diagnóstico endoscópico y definido el tamaño de la filtración se practica lavado de la cavidad con solución salina. Cuando la cavidad se encuentre limpia, esta es rellenada con una malla de vicryl (Polyglactin 910), la cual posee unos poros pequeños mayores de 2 mm suficientes para absorber la fibrina que es aplicada poco después. Con el endoscopio y una pinza de fórceps, la malla es dejada dentro de la cavidad de la filtración a manera de carpeta, con aplicación de 2 a 3 cc de fibrina (Tissucol). Además, la fibrina es aplicada en los bordes de la filtración anastomótica. Estos autores (12) describen 71 pacientes, 24 tratados solo con fibrina, 15 con fibrina más colocación de malla de vicryl como tapón y 32 casos con lavado y nutrición enteral. En 13 de los 15 pacientes manejados con fibrina y malla de vicryl, la filtración cerró completamente. Sin embargo, todos estos pacientes tenían fistulas a nivel cervical, las cuales son de mejor pronóstico. El éxito de cierre de fístulas está descrito entre 75 y 85%, de acuerdo a la literatura, pero el cierre y el número de sesiones del procedimiento varía considerablemente. Cuando las fístulas son menores de 1 cm se necesitan en promedio 4,6 sesiones (12, 33).
La aplicación de biomateriales (Surgisis), los cuales son compuestos elaborados a partir de una matriz acelular, derivada de la submucosa del intestino delgado del porcino, estimula la proliferación celular y la formación de una verdadera red de fibroblastos, la cual es incorporada posteriormente por la cicatriz, sin estimular una reacción inflamatoria a cuerpo extraño. Su aplicación está descrita en pacientes con fístulas recalcitrantes, es decir, fístulas que no cierran con las medidas generales y asociadas a otras herramientas (28).
La aplicación de clips endoscópicos se realiza especialmente con fines hemostáticos y en casos de perforaciones tempranas antes de que aparezca una reacción inflamatoria. Cuando los orificios fistulosos se encuentran indurados o fibróticos, su utilidad es limitada por la dificultad de aproximar los bordes porque la mayoría de las veces terminan con desgarros y agrandamiento de estos. Se ha propuesto su aplicación asociada a otras técnicas endoscópicas (5).
El OSTC over the scope clip ("trampa de oso") fue introducido en el 2007, el cual consiste de un clip que está precargado en una copa transparente adosada en la parte distal del endoscopio, el cual puede ser liberado con el canal de trabajo de una forma similar al sistema de ligadura de bandas. Ha sido exitoso en el tratamiento de perforaciones, sangrado y fístulas. La literatura muestra series con grupos pequeños de pacientes, muy heterogéneos con éxito alrededor de 50% en casos de fístulas con el agravante de encontrar orificios fistulosos con fibrosis en sus bordes. El grupo donde el resultado fue favorable tenía orificios fistulosos de 10 mm de diámetro y de 17 mm en el grupo desfavorable. A nivel experimental se ha demostrado que el OSTC puede cerrar defectos hasta de 30 mm de diámetro. En el grupo de pacientes con fístulas la eficacia varía de 43% a 65%, incluyendo diferentes localizaciones. En resumen, el OSTC es una alternativa segura y efectiva para el cierre de fístulas; sin embargo, su eficacia terapéutica es baja en casos de fístulas crónicas y asociadas a fibrosis. También está descrito su uso asociado a otras técnicas endoscópicas (34, 35).
Otra pregunta sería ¿cuándo el paciente debe ser llevado a cirugía en el postoperatorio de una cirugía esofágica con anastomosis esófago-yeyunal o esófago-gástrica? La fuga de la anastomosis esofágica es una complicación fatal para cualquier cirujano (20). Se necesita de una alta sospecha clínica para el diagnóstico temprano. La literatura nos muestra que el espectro de síntomas en el postoperatorio es amplio desde cuadros silentes o asintomáticos hasta cuadros de sepsis fulminante; 20 a 50% de todas las fugas anastomóticas permanecen clínicamente silentes (5). Los pacientes con cuadros de sepsis temprana fulminante en las primeras 48 horas nos hablan de probable necrosis de los bordes o del tubo gástrico ascendido, confirmado por endoscopia, lo que implicaría una reintervención con una nueva anastomosis o desarticulación de la anastomosis con cerclaje esofágico, o esofagostoma cervical con yeyunostomía y múltiples lavados del tórax y/o cavidad abdominal (36).
Hasta hace poco los endoscopistas estaban temerosos de evaluar pacientes con filtraciones gastrointestinales. La endoscopia ha mostrado ser segura y efectiva en el diagnóstico y manejo de pacientes con fugas de las anastomosis (22, 36, 37).
Existen cuatro objetivos cuando se define por el manejo quirúrgico: prevención de la contaminación pleural o abdominal, restablecimiento de la integridad del esófago, eliminación de la infección y soporte nutricional. El reparo quirúrgico requiere anestesia general, retoracotomía o laparotomía, disección mediastinal para reparo o desfuncionalización, lo que implica mayor morbilidad, mortalidad y costos hospitalarios (18).
En resumen, el manejo de las filtraciones de las anastomosis esófago intestinales debe ser individualizado y guiado por la severidad de los síntomas y la magnitud de la dehiscencia. El diagnóstico temprano, tratamiento oportuno y adecuado son pilares en el manejo exitoso de pacientes con esta complicación. Pacientes asintomáticos y algunos sintomáticos con pequeñas fugas contenidas pueden ser manejados de forma conservadora (20, 22).
Es crítico diferenciar entre fuga o necrosis de la anastomosis o del conducto ascendido y en este punto es fundamental la evaluación endoscópica (37). La cirugía o reintervención está indicada en pacientes sintomáticos, con fugas anastomóticas no contenidas y aquellos en los cuales el manejo conservador ha fallado. Algunos cirujanos se inclinan por desarticulación de la anastomosis con esofagostoma cervical y yeyunostomía, procedimiento casi reservado para necrosis del tubo gástrico o de la anastomosis. Sin embargo, siempre debe tratarse de preservar la continuidad intestinal y es cuando el manejo endoscópico debe ser tenido en cuenta (20, 36).
Cuando la dehiscencia varía de 30% a 70% de la circunferencia la PAE es la mejor alternativa. El VAC endoscópico es otra alternativa en estos casos. En casos de dehiscencias menores de 30% de la circunferencia, los clips, los sellantes solos o acompañados de mallas de vicryl pueden ser parte del manejo.
Las anastomosis intratorácicas acarrean una dificultad adicional en cuanto la presión negativa ofrecida por esta región puede ser una causa para la falla de las opciones que usualmente funcionan en las anastomosis a nivel abdominal. Es bueno puntualizar que el sellamiento temprano y oportuno de la fístula podría evitar complicaciones sépticas irreversibles e incluso luego de colocarla se debe descartar la persistencia de colecciones, que obligarían a drenajes o a revisión quirúrgica.
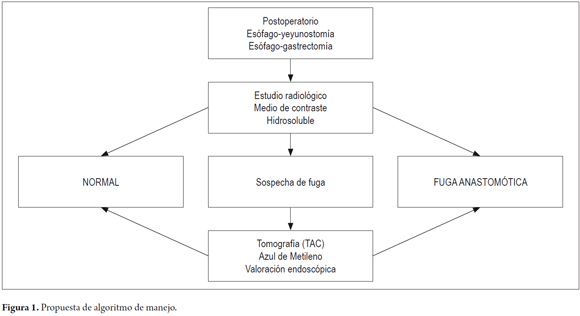
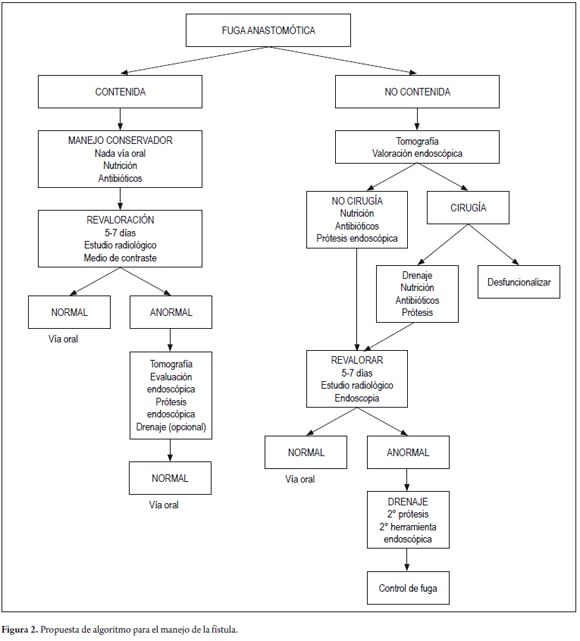
Por tratarse de una complicación poco frecuente y con la experiencia del grupo en el manejo de prótesis autoexpandibles en patología maligna se diseñó un algoritmo de manejo de pacientes con esta complicación, como aporte a un futuro consenso de expertos.
ALGORITMO
1. Sospecha de dehiscencia de la anastomosis cuando se detecte alguna alteración del curso normal del postoperatorio del paciente con cirugía esofágica.
2. Diagnóstico de la dehiscencia con estudio radiológico con medio de contraste oral hidrosoluble, tomografía con medio de contraste oral y endoscopia digestiva alta.
3. Valoración de la condición clínica del paciente.
4. Valoración conjunta entre el cirujano y endoscopista.
5. Definición del tipo de fístula (fulminante, silenciosa o silente, clínicamente detectada o no contenida).
6. Escogencia del tratamiento: conservador, manejo endoscópico o quirúrgico.
7. Escogencia del tratamiento endoscópico. ¿Stent?, VAC E, sellantes de fibrina, clips, OSTC, o combinación de ellos.
8. Definir manejo con drenaje externo (figuras 1 y 2).
REFERENCIAS
1. Kwak HS, Lee JM, Jin GY. Treatment of Gastrojejunal Anastomotic Leak with a Covered Metallic Stent. Hepato-Gastroenterology 2003; 50: 62-641. [ Links ]
2. Sierzega M, Kolodziejczyk P, Kulig J and the Polish Gastric Cancer Study Group. Impact of anastomotic leakage on long-term survival after total gastrectomy for carcinoma of the stomach. Br J Surg 2010; 97: 1035-1042. [ Links ]
3. Lang H, Piso P, Stukenborg C, et al. Management and results of proximal anastomotic leaks in a series of 1114 total gastrectomies for gastric carcinoma. Eur J Surg Oncol 2000; 26: 168-171. [ Links ]
4. Pross M, Manger T, Reinheckel T, et al. Endoscopic treatment of clinically symptomatic leaks of thoracic esophageal anastomoses. Gastrointest Endosc 2000; 51(1): 73-76. [ Links ]
5. Messmann H, Schmidbaur W, Jackle J, et al. Endoscopic and surgical management of leakage and mediastinitis after esophageal surgery. Best Prac Res Clin Gastroenterol 2004; 18(5): 809-827. [ Links ]
6. Roy-Choudhury S, Nicholson A, Weedgwood K, et al. Symptomatic Malignant Gastroesophageal Anastomotic Leak: Management with Covered Metallic Esophageal Stents. AJR 2001; 176: 161-165. [ Links ]
7. Bruce J, Krukowski ZH, Al-Khairy G, et al. Systematic review of the definition and measurement of anastomotic leak after gastrointestinal surgery. Br J Surg 2001; 88: 1157-1168. [ Links ]
8. Tuebergen D, Rijcken E, Mennigen R, et al. Treatment of Thoracic Esophageal Anastomotic Leaks and Esophageal Perforations with Endoluminal Stents: Efficacy and Current Limitations. J Gastrointest Surg 2008; 12: 1168-1176. [ Links ]
9. Cardoso E, Silva RA, Moreira-Dias L. Use of cardiac septal occluder device on upper GI anastomotic dehiscences: a new endoscopic approach (with video). Gastrointest Endosc 2012; 76(6): 1255-1258. [ Links ]
10. Schubert D, Scheidbach H, Kuhn R, et al. Endoscopic treatment of thoracic esophageal leaks by using silicone-covered, self-expanding polyester stents. Gastrointest Endosc 2005; 61(7): 891-896. [ Links ]
11. Fernández A, Vila AA, Vázquez S, et al. Self-expanding plastic stents for the treatment of post-operative esophago-jejuno anastomosis leak. A case series study. Rev Esp Enferm Dig (Madrid) 2010; 102(12): 704-710. [ Links ]
12. Böhm G, Mossdorf A, Klink C, et al. Treatment algorithm for postoperative upper gastrointestinal fistulas and leaks using combined Vicryl plug and fibrin glue. Endoscopy 2010; 42: 599-602. [ Links ]
13. Guevara O, Barrera O, Oliveros R, et al. Morbi-mortalidad y clasificación de Clavien de las complicaciones, en 100 gastrectomías consecutivas por Cancer Gástrico. Ponencia en el Congreso Nacional de Cirugía. Colombia, 2011. [ Links ]
14. Kim JK, Shin SK, Lee HJ, et al. Endoscopic management of anastomotic leakage after gastrectomy for gastric cancer: how efficacious is it? Scan J Gastroenterol 2013; 48: 111-118. [ Links ]
15. Sah BK, Chen MM, Yan M, et al. Reoperation for early postoperative complications after gastric cancer surgery in a Chinese hospital. World J Gastroenterol 2010; 16(1): 98-103. [ Links ]
16. DCunha J, Rueth NM, Groth SS, et al. Esophageal stents for anastomotic leaks and perforations. J Thorac Cardiovasc Surg 2011; 142: 39-46. [ Links ]
17. Moros ME, Martín P, álvarez LF, et al. Manejo endoscópico de fístulas gastrointestinales. En Landazábal G, (Ed.). Endoscopia y patología biliodigestiva. Capítulo 36. 2011. p. 467-479. [ Links ]
18. Raju GS. Endoscopic Management of Gastrointestinal Leaks. Gastrointest Endosc Clin N Am 2007; 17: 487-503. [ Links ]
19. Lamb PJ, Griffin SM, Chandrashekar MV, et al. Prospective study of routine contrast radiology after total gastrectomy. Br J Surg 2004; 91(8): 1015-9. [ Links ]
20. Crestanello JA, Deschamps C, Cassivi SD, et al. Selective management of intrathoracic anastomotic leak after esophagectomy. J Thorac Cardiovasc Surg 2005; 129(2): 254-260. [ Links ]
21. Hogan B, Winter D, Broe D, et al. Prospective trial comparing contrast swallow, computed tomography and endoscopy to identify anastomotic leak following oesophagogastric surgery. Surg Endosc 2008; 22: 767-771. [ Links ]
22. Low D. Diagnosis and Management of Anastomotic Leaks after Esophagectomy. J Gastrointest Surg 2011; 15: 1319-1322. [ Links ]
23. Griffin SM, Lamb PJ, Dresner SM, et al. Diagnosis and management of a mediastinal leak following radical oesophagectomy. Br J Surg 2001; 88: 1346-1351. [ Links ]
24. Feith M, Gillen S, Schuster T, et al. Healing occurs in most patients that stents for anastomotic leakage; dislocation remains a problem. Clin Gastroenterol and Hepatol 2011; 9: 202-210. [ Links ]
25. Nowakowski P, Ziaja K, Ludyga T, et al. Self-expandable metallic stents in the treatment of post-esophagogastrostomy/ post-esophagoenterostomy fistula. Diseases of the Esophagus 2007; 20: 358-360. [ Links ]
26. Freeman RK, Ascioti AJ, Giannini T, et al. Analysis of Unsuccessful Esophageal Stent Placements for Esophageal Perforation, Fistula, or Anastomotic Leak. Ann Thorac Surg 2012; 94: 959-965. [ Links ]
27. Boeckel P, Dua K, Lam Weusten B, et al. Fully covered self-expandable metal stens (SEMS), partially covered SEMS and self-expandable plastic stents for the treatment of benign esophageal ruptures and anastomotic leaks. BMC Gastroenterology 2012; 12: 19. [ Links ]
28. Tringali A, Daniel FB, Familiari P, et al. Endoscopic treatment of a recalcitrant esophageal fistula with new tools: stents, Surgisis, and nitinol staples (with video). Gastrointest Endosc 2010; 72(3): 647-650. [ Links ]
29. Sampaio JA, Waechter FL, Pereira-Lima J, et al. Successful treatment of esophagojejunaldisconnection after total gastrectomy by insertion of a covered self-expandable esophageal metallic stent. Gastrointest Endosc 2003; 58: 453-6. [ Links ]
30. Wedemeyer J, Brangewitz M, Kubicka S, et al. Management of major postsurgical gastroesophageal intrathoracic leaks with an endoscopic vacuum-assisted closure system. Gastrointest Endosc 2010; 71(2): 382-386. [ Links ]
31. Brangewitz M, Voigtlander T, Helfritz FA, et al. Endoscopic closure of esophageal intrathoracic leaks: stent versus endoscopic vacuum-assisted closure, a retrospective analysis. Endoscopy 2013; 45: 433-438. [ Links ]
32. Disibeyaz S, Parlak E, Koksal S, et al. Endoscopic treatment of a large upper Gastrointestinal Anastomotic leak Using a Prolene Plug and Cyanoacrylate. Endoscopy 2005; 37: 1032-1033. [ Links ]
33. Lippert E, Klebl F, Schweller F, et al. Fibrin glue in the endoscopic treatment of fistulae and anastomotic leakages of the gastrointestinal tract. Int J Colorectal Dis 2011; 216: 303-311. [ Links ]
34. Galizia G, Napolitano V, Castellano P, et al. The Over-The-Scope-Clip (OTSC) System is Effective in the Treatment of Chronic Esophagojejunal Anastomotic Leakage. J Gastrointest Surg 2012; 16: 1585-1589. [ Links ]
35. Disibeyaz S, Seref Koksal A, Parlak E, et al. Endoscopic closure of gastrointestinal defects with an over the scope clip device. A case series and review of the literature. Clin Res Hepatol Gastroenterol 2012; 36: 614-621. [ Links ]
36. Martin L, Hofstetter W, Swisher S, et al. Management of Intrathoracic Leaks Following Esophagectomy. Adv in Surg 2006; 40: 173-190. [ Links ]
37. Schubert D, Dalicho ST, Florh L, et al. Postoperatives Komplikations management nach Osophaguschirurgie. Chirurg 2012; 83: 712-718. [ Links ]











 text in
text in