Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.29 no.3 Bogotá Sept. 2014
Criptococosis esófago-gastroduodenal: reporte de caso
Albis Cecilia Hani MD. (1), Rómulo Vargas MD. (2), Alejandro Concha MD. (2), Valeria Atenea Costa MD. (3)
(1) Jefe de Servicio de Gastroenterología y Endoscopia Digestiva, Hospital Universitario San Ignacio, Universidad Javeriana, Bogotá, Colombia.
(2) Profesor de Gastroenterología y Endoscopia Digestiva, Hospital Universitario San Ignacio, Universidad Javeriana, Bogotá, Colombia.
(3) Residente de Postgrado de Gastroenterología y Endoscopia Digestiva, Hospital Universitario San Ignacio, Universidad Javeriana, Bogotá, Colombia.
Fecha recibido: 03-02-14 Fecha aceptado: 21-07-14
Resumen
Existen pocos pacientes inmunodeprimidos o no, con implicación del tracto gastrointestinal por Cryptococcus neoformans, tanto en su manifestación local como enfermedad aislada y diseminada tipo criptococcemia. Reportamos un caso de criptococosis con compromiso esofágico, gástrico y duodenal en un paciente diagnosticado con SIDA C3. Según nuestro conocimiento, y búsqueda en la literatura, ha sido el único caso reportado en Colombia y América Latina.
Palabras clave
Criptococosis digestiva, Cryptococcus neoformans, afectación esófago-gastroduodenal, VIH / SIDA.
REPORTE DE CASO
Paciente masculino de 40 años, de origen y procedencia de Bogotá, cesante, casado, quien consultó por cuadro de dolor lumbar de características mecánicas no irradiado. Adicionalmente presentaba un mes de evolución con masa a nivel de mesogastrio, dolorosa, con aumento en sus dimensiones de manera progresiva, sensación de distensión abdominal, sin emesis, disfagia o alteraciones en el hábito intestinal.
Dentro de los antecedentes personales: SIDA C3 (CD4 46 - carga viral 44.744 copias) diagnóstico en 2011.Tuberculosis miliar, compromiso de ganglios mesentéricos, peritoneal, pulmonar, coinfección con hepatitis B y perfil virológico desconocido. Sarcoma de Kaposi oral y cutáneo. Úlcera herpética perineal. Infección por CMV. Farmacodependencia (bazuco) y trastorno de personalidad-antisocial, alcoholismo. Fumador activo de 30 paquetes/año. Antecedente quirúrgico de laparotomía por adenopatías abscedadas.
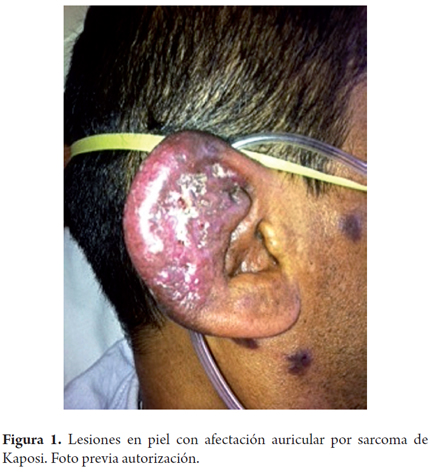
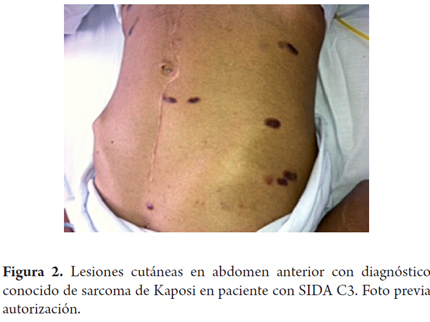
Al examen físico encontramos a un paciente con Fc 88 fr 18 PA 120/80 sat 95% con O2 por cánula nasal. Mucosas secas. Presentaba máculas violáceas generalizadas en cara, pabellón auricular derecho con infiltración, tórax, abdomen y extremidades (figuras 1 y 2). En pene presentaba lesión en frenillo, violácea, con ulceración superficial en surco balano prepucial. Abdomen plano blando, presenta masa a nivel de mesogastrio de bordes bien definidos, poco móvil, con dolor a palpación. Extremidades hipotróficas.
Se le realizó una tomografía abdominal contrastada con hallazgos de engrosamiento concéntrico de la pared gástrica, en la región antropilórica, asociado a múltiples adenopatías.
En la tomografía de tórax se observó marcado y profuso engrosamiento de septos inter e intralobulillares, con opacidad en vidrio esmerilado y en esta localización configurando un patrón en adoquín desordenado. Adicionalmente, había múltiples nódulos de contorno ligeramente irregular que se localizaban preferencialmente en la periferia de ambos pulmones. Se observaron ganglios aumentados de tamaño en las estaciones prevascular, ventana aorto pulmonar, subcarinal y axila izquierda. Las estructuras vasculares eran normales.
Se le realizó un hemocultivo y biopsia de medula ósea donde creció Cryptococus neoformans.
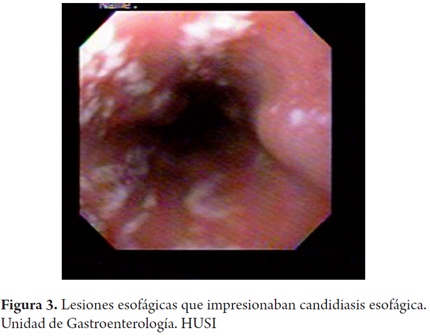
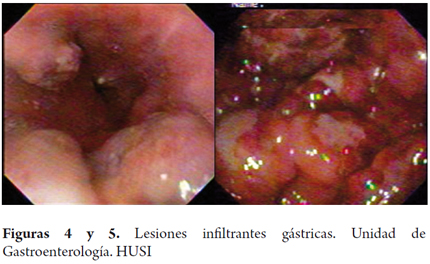
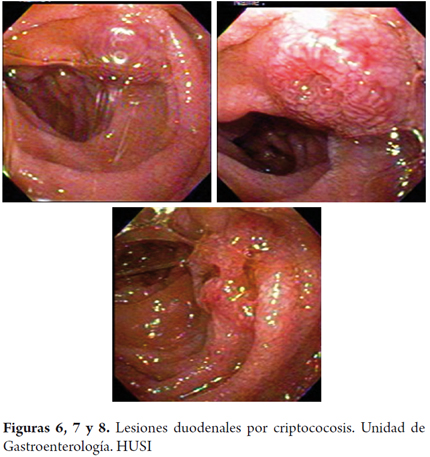
Adicionalmente, se le realizó endoscopia de vías digestivas altas, observándose en el tercio medio y proximal del esófago múltiples lesiones blanquecinas de apariencia algodonosa en el tercio distal (figura 3). Hacia la vertiente izquierda había presencia de una lesión elevada violácea de 1 cm, dura a la toma de biopsia. En el fundus en retroflexión se apreciaban dos lesiones elevadas de 1 y 2 cm respectivamente hacia curvatura mayor y menor con aspecto violáceo, depresión central; en el cuerpo gástrico ausencia de distensión a la insuflación, con pliegues distorsionados y disminución del calibre de la luz con evidencia hacia la incisura - curvatura menor de una lesión elevada de aproximadamente 3 cm. De esta lesión y de los pliegues se tomaron biopsias. El antro presentaba ausencia de distensión a la insuflación con igual aspecto infiltrado descrito en el cuerpo pero sin lesión exofítica evidente (figuras 4 y 5). El píloro era céntrico de apariencia infiltrada. En el bulbo duodenal se evidenciaron lesiones elevadas múltiples, violáceas de entre 6 y 12 mm con depresión central, que se extendían hasta segunda y tercera porción duodenal (figuras 6, 7 y 8).
El diagnóstico endoscópico inicial fue:
1. Candidiasis esofágica grado II a descartar.
2. Lesión elevada en esófago (¿sarcoma de Kaposi esofágico?).
3. Lesiones de apariencia neoplásica en fondo y subcardial en estudio (sarcoma de Kaposi?)
4. Compromiso gástrico difuso infiltrativo en estudio (¿linitis plástica? - ¿Kaposi gástrico?)
5. Lesiones de apariencia neoplásica en duodeno a estudio (¿sarcoma de Kaposi duodenal?).
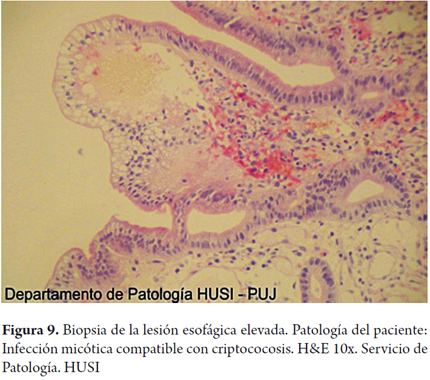
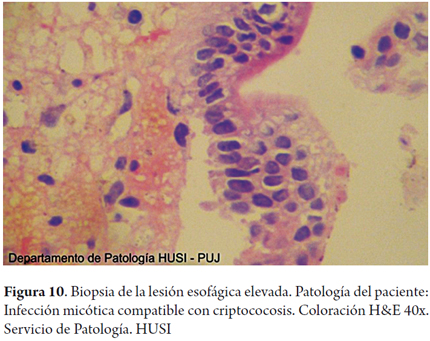
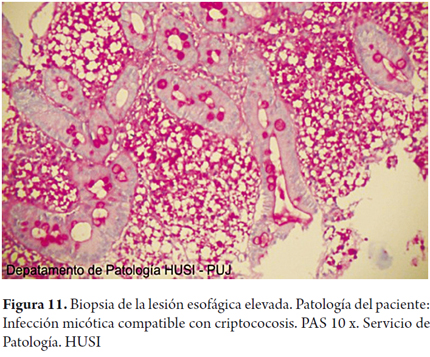
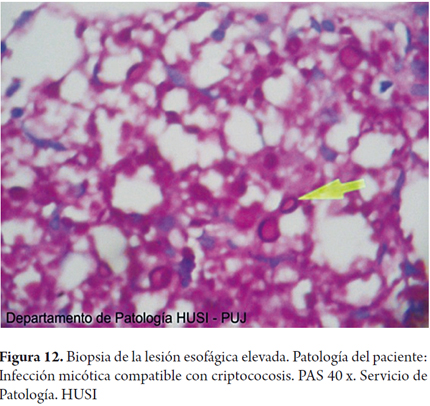
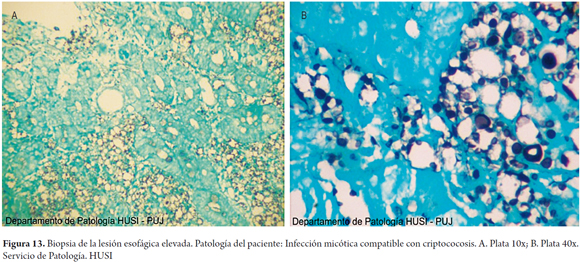
Se realizaron coloraciones de histoquímica especiales para hongos en las biopsias de esófago, estómago y duodeno demostrando formas compatibles con criptococosis (figuras 9, 10, 11, 12 y 13).
Con los hallazgos clínicos, endoscópicos y anatomopatológicos descritos, se hizo el diagnóstico de criptococosis esófago-gastroduodenal. Se inició terapia antifúngica intrahospitalaria con anfotericina B más fluconazol 800 mg día oral durante 2 semanas, seguido de fluconazol oral. El paciente egresó del centro hospitalario con mejoría de la distensión abdominal, y se indicó seguimiento por consulta externa. El paciente no ha acudido a nueva revisión endoscópica hasta el momento de la publicación de este artículo.
DISCUSIÓN
Reportamos un caso de infección esofágica, gástrica y duodenal por criptococosis en paciente conocido con diagnóstico de SIDA C3, como hallazgo de criptococosis diseminada.
NATURALEZA DE LA INFECCIÓN. PREDISPOSICIONES
Hace más de un siglo que el cryptococcus fue descrito por primera vez, en 1894, pero solo en los últimos 30 años los investigadores comenzaron a entender este organismo complejo y devastador. Por otra parte, a pesar del tratamiento actual, los pacientes siguen muriendo de criptococosis en el mundo (1).
A pesar de que el uso extenso de la terapia antiretroviral ha disminuido la incidencia de criptococosis en países desarrollados, la incidencia y la mortalidad son muy altas en áreas donde los casos de VIH no controlados persisten, y el acceso a terapia antirretroviral es limitado. Está estimado que el número de casos de pacientes con criptococosis y VIH es de aproximadamente un millón de casos anuales a nivel mundial (2).
Se conoce que a pesar del cuidado médico intensivo y la disponibilidad de terapia antirretroviral, la enfermedad tiene altas tasas de mortalidad, por ejemplo, criptocococis meníngea está relacionada con una mortalidad a 3 meses de 20%. La mortalidad está estimada a 100% en el periodo de 2 semanas posterior a la consulta, en pacientes que no reciban terapia antifúngica (2).
El Cryptococcus neoformans es un organismo ubicuo que se encuentra una reserva natural en suelos ricos en excrementos de aves. La defensa natural contra este hongo depende principalmente de inmunidad mediada por células, principalmente linfocitos T CD4 juegan un papel central (3).
Cryptococcus neoformans ha sido reconocido como un oportunista micótico fatal en los últimos años, principalmente en estados de inmunosupresión. Aunque es un patógeno principalmente del sistema nervioso central, puede infectar a una gran variedad de órganos (4).
Existen condiciones identificadas que predisponen a los pacientes a la infección primaria con o sin propagación diseminada por cryptococcus neoformans, como son el síndrome de Cushing, trasplante de órganos, leucemias y linfomas, cirrosis y diabetes (3).
Es importante resaltar que también se han reportado casos en grupos heterogéneos de pacientes que reciben altas dosis de esteroides, anticuerpos monoclonales como alentuzumab e infliximab y/o otros agentes inmunosupresores (2).
MECANISMOS FISIOPATOLÓGICOS
Los patógenos oportunistas rompen la línea de defensa del huésped, mientras que los patógenos no oportunistas inducen un defecto fundamental en el sistema inmunológico o eluden los mecanismos normales de defensa para infectar a sus huéspedes (1).
El Cryptococcus neoformans infecta preferentemente individuos inmunocomprometidos. Las células CD4 y CD8 son necesarias para la eliminación efectiva de Cryptococcus en modelos murinos. Esto sugiere que el mismo posee los factores de virulencia para eludir la defensa inicial del sistema inmune. La cápsula de polisacárido es el factor de virulencia de mayor potencia de virulencia del Cryptococcus neoformans (1).
La cápsula se une a moléculas del complemento eficientemente. El Cryptococcus neoformans también afecta el sistema inmunitario innato a través de la producción de antioxidantes como melanina, superóxido dismutasa y manitol que neutralizan moléculas efectoras especificas del sistema inmune innato. Otros factores de virulencia incluyen fosfolipasa, que funciona a través de la desestabilización de las membranas celulares del huésped, ureasa, que altera el pH y proteinasas que degradan las proteínas del huésped (1).
MANIFESTACIONES CLÍNICAS
La infección ocurre a través de la vía respiratoria, y manifestaciones extrapulmonares ocurren como resultado de la diseminación hematógena. Mientras que el sistema nervioso central es el sitio más comúnmente afectado en criptococosis sintomática, han sido reportados una gran variedad de sitios extraneurológicos, incluyendo varias partes del tracto gastrointestinal (3).
La infección por criptococosis es vista en pacientes con menos de 200 CD4 y se manifiesta con hallazgos pulmonares, en el sistema nervioso central y ocular, siendo los infiltrados pulmonares y la meningoencefalitis los más comunes (4).
Cryptococcus neoformans en el agente etiológico más frecuente en meningoencefalitis en pacientes inmunosuprimidos y no inmunosuprimidos. Durante la infección el hongo es observador en forma de levadura y es solo ocasionalmente visto como hifa (formas filamentosas) o pseudohifa (5).
CRIPTOCOCOSIS GASTROINTESTINAL Y OTRAS PATOLOGÍAS DIGESTIVAS
La criptococosis gastrointestinal ha sido reportada como hallazgo aislado como en enfermedad diseminada. Aunque hay una mayor incidencia de la enfermedad, atribuir la clínica gastrointestinal a la criptococosis es extremadamente inusual (4).
En los pacientes con VIH, usualmente Cryptosporium parvum y CMV son los causantes de úlceras gástricas e inflamación, pero otros microorganismos como toxoplasma Gondi, Leishmania donovani, Treponema pallidum, complejo micobacterium avium, Bartonela Henselae y Criptococo neoformans se han visto involucrados (4).
Los pacientes con VIH pueden presentar clínica gastrointestinal asociada a infección por oportunistas caracterizada por náuseas, vómitos, saciedad precoz, anorexia, dolor abdominal y hematemesis. La gastritis por citomegalovirus o el sarcoma gastrointestinal pueden estar asociados a afectación extragástrica (6).
El sarcoma de Kaposi gastrointestinal puede estar asociado con infección por herpes virus tipo 8, y complica la enfermedad cutánea hasta en 50% de los pacientes, principalmente afectando el estómago. La afectación de intestino delgado y colon, ocurre en paciente con inmunodeficiencia muy avanzada. La afectación del intestino delgado usualmente produce distensión, náuseas, dolor cólico, diarrea profusa que puede estar asociada a malabsorción y pérdida de peso (6).
La mayoría de las infecciones oportunistas en VIH ocurren con contaje de CD4 menores de 200. El citomegalovirus es el virus más comúnmente implicado en la afectación del tracto gastrointestinal en estos pacientes. Las infecciones por micobacterias también son frecuentes, y la coinfección se ha visto en más de 40% de los casos. Infecciones por micobacterias se pueden presentar como diarrea y dolor abdominal (7).
Un autor examinó los informes de la autopsia de 24 pacientes diagnosticados con criptococosis pulmonar o diseminada y encontró que un tercio de ellos tenía evidencia de participación gastrointestinal, que afecta, en orden de frecuencia, el colon, esófago, estómago y el intestino delgado. En todos los 8 casos hubo una condición predisponente subyacente de inmunosupresión y en 7 de los 8 hubo participación de varios otros sitios extrapulmonares (8).
LA AFECTACIÓN GASTROINTESTINAL POR CRYPTOCOCCUS NEOFORMANS ES EXTREMADAMENTE RARA
En una serie de 68 pacientes con criptococosis y SIDA como diagnóstico premortem, ninguno tuvo afectación gastrointestinal. En otra serie mayor de 106 pacientes con SIDA y criptocosis, la enfermedad gastrointestinal no fue reportada en ningún paciente (8).
Documentado por Laguna, et al, más de 90% de los pacientes con VIH experimentan síntomas gastrointestinales durante el curso de su enfermedad. Infecciones oportunistas gastrointestinales son más comunes en esófago y en el intestino, siendo menos comunes en el estómago.
También se ha reportado caso de paciente con peritonitis, que fue llevado a laparotomía exploradora, evidenciando perforación yeyunal, revelando las biopsias criptococosis. Este es un caso con clínica de presentación inusual en paciente VIH positivo (7).
Se ha reportado casos de criptococosis gástrico con herpes esofágico, como presentación inicial en paciente con SIDA (4).
En un paciente africano con SIDA que consultó por hematoquecia, se realizó un diagnóstico de ulceración anal criptocócica (3).
HALLAZGOS ENDOSCÓPICOS EN LA CRIPTOCOCOSIS DIGESTIVA Y MÉTODOS DIAGNÓSTICOS
Las lesiones endoscópicas por criptococosis se han presentado como nódulos, úlceras y placas (7). Igualmente se ha descrito que la mucosa puede tener un aspecto amarillento fino granular (8).
Las lesiones gástricas pueden evidenciarse endoscópicamente como pólipos inflamatorios o erosiones no específicas. Las lesiones duodenales se pueden observar como placas blanquecinas múltiples (8).
El diagnóstico de criptococosis gastrointestinal es difícil por escasez del microorganismo, falta del reconocimiento del hongo en las biopsias, ya que presenta positividad de cadenas de mucina (4).
Los hemocultivos en pacientes con enfermedad diseminada son positivos hasta en 50% de los casos (9).
Hay casos reportados de presentación inicial de criptococosis diseminada, como criptococosis gastroduodenal. El compromiso gastrointestinal por Cryptococcus neoformans ha tenido pobres resultados (7).
TRATAMIENTO
La duración total del tratamiento antifúngico para pacientes con criptococcemia o criptococosis con o sin meningoencefalitis en pacientes inmunosuprimidos con VIH, como es el caso de nuestro paciente, está determinado que son 12 meses. La inducción abarca de 4 a 6 semanas con anfotericina B deoxicolato a dosis de 0,7-1 mg/kg/día endovenoso más flucitosina 100 mg/kg diario oral dividido en 4 dosis al menos por 2 semanas, seguido por fluconazol a 6 mg/kg día (400 mg/día) por al menos 8 semanas más. Formulaciones lipídicas pueden sustituir la anfotericina B sobre todo en pacientes con disfunción renal o predisposición a esta (2).
Otra opción de inducción es la anfotericina B más fluconazol 800 mg día durante 2 semanas, seguido de fluconazol solo diario 800 mg/día por al menos 8 semanas (2).
Luego sigue la terapia de consolidación que se trata de fluconazol 400 mg/día por 8 semanas y para la terapia de mantenimiento, se debe completar igual o más de un año con fluconazol 200 mg/día o itraconazol 400 mg/día (2).
La terapia antirretroviral se debe iniciar de 2-10 semanas luego de comenzar el tratamiento antifúngico. Es importante considerar suspender los antirretrovirales si el paciente tiene más de 100 células CD4 y carga viral indetectable o muy baja al menos sostenida durante 3 meses. Se debe reconsiderar reiniciar la terapia antirretroviral en pacientes que disminuyen el nivel de 100 CD4 (2).
A menudo, injustamente ignorado como una publicación de menor categoría, el reporte de un caso es un recurso valioso para compartir recursos educativos y de reflexión de nuestros más desafiantes casos. Informes de casos son también una gran introducción para residentes de Gastroenterología al mundo de la publicación académica. Estos casos informan, educan y promueven el debate y son un humilde recordatorio de que las cosas en la medicina no son siempre como parecen y que las enfermedades no leen los libros de texto (10).
En este caso en particular, no se pensó que el paciente pudiese tener afectación digestiva de la infección micótica, debido a su baja incidencia en la práctica clínica, atribuyéndose hallazgos endoscópicos a otras patologías infecciosas vs. neoplásicas.
Consideramos importante reportar este caso, ya que en Colombia no han sido reportados casos de criptococosis esófago-gastrointestinal. En un trabajo de recolección de casos en 9 años en Colombia, se identificaron 891 (95,7%) casos de neurocriptococosis, 27 (2,9%) de formas pulmonares, 5 (0,5%) de lesiones cutáneas, 2 (0,2%) de ganglionares, 2 (0,2%) de úlceras orofaríngeas y un caso (0,1%) de cada una de las siguientes formas clínicas: peritonitis, lesión hepática, celulitis de los miembros inferiores e infección de las vías urinarias, sin reporte de afectación esófago-gastroduodenal (11). Igualmente, según nuestra búsqueda y conocimiento, no hay casos reportados en América Latina.
Agradecimientos
Servicio de Patología. Hospital Universitario San Ignacio.
REFERENCIAS
1. Shaunna M. Huston, Christopher H. Mody. Cryptococcosis: An Emerging Respiratory Mycosis. Department of Medical Science, University of Calgary, Alberta, Canada. Clinics in Chest Medicine 2009; 30(2): 253-64. [ Links ]
2. Perfect, Jhon et al. Clinical Practice Guidelines for the Management of Cryptococcal Disease: 2010. Update by the Infectious Diseases Society of America IDSA. 2010. [ Links ]
3. Chaitowitz, Mark; Marie-Leen Shaw; Mokoena, Taole R. Gastrointestinal cryptococcosis presenting as spontaneous jejunal perforation in a non-immunocompromised Host. Digestive Diseases and Sciences 2003; 48: 1196-9. [ Links ]
4. Rupashree Sundara, Lakshmi Raoa. Gastric cryptococcal infection as an initial presentation of AIDS: a rare case report). Asian Pacific Journal of Tropical Medicine 2011; 4: 79-80. [ Links ]
5. Xiaorong Lin. Cryptococcus neoformans: Morphogenesis, infection, and evolution. Review Article Infection. Genetics and Evolution 2009; 9: 401-416. [ Links ]
6. Mandell, Douglas, Bennetts. Principles and Practice of Infectious Diseases. 7th ed. 2009. [ Links ]
7. Saha S, Agarwal N, Srivastava A, Kumar A. Perforation peritonitis due to gastrointestinal cryptococcosis as an initial presentation in an AIDS patient. Singapore Med J 2008; 49(11): e305-7. [ Links ]
8. Naga Chalasani, et al. Endoscopic features of gastroduodenal cryptococcosis in AIDS. Gastrointestinal Endoscopy 1997. [ Links ]
9. T Ferry, B Ponceau, JB Gaultier, MA Piens, F Biron, S Picot, C Chidiac, D Peyramond. Disseminated cryptococcosis and histoplasmosis co-infection in a HIV-infected woman. France Journal of Infection 2005; 51(3): 173-176. [ Links ]
10. Bhavesh B Shah. "Just write it up" the art of writing a case report in Gastroenterology. Gastrointestinal Endoscopy 2009; 70(5): 977-979. [ Links ]
11. Lizarazo J, Linares M, et al (Grupo colombiano para el estudio de la criptococosis). Estudio clínico y epidemiológico de la criptococosis en Colombia: resultados de nueve años de la encuesta nacional, 1997-2005. Biomédica 2007; 27: 94-109. [ Links ]











 text in
text in