Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.29 no.4 Bogotá Oct./Dec. 2014
Tratamiento con vitamina E en pacientes con esteatohepatitis no alcohólica
Jhonathan Ferney Vélez M. (1), Gustavo Amador Crespo H. (1), Juan Carlos Restrepo G. MD. Esp. MSc. PhD. (2)
(1) Estudiante de Medicina, Facultad de medicina, Universidad de Antioquia, Medellín, Colombia.
(2) Profesor asociado, Departamento de Medicina Interna y Grupo de Gastrohepatología, Universidad de Antioquia. Hepatólogo, Hospital Pablo Tobón Uribe, Medellín, Colombia. E-mail: jcrestrepo@hptu.org.co
Fecha recibido: 12-02-14 Fecha aceptado: 05-11-14
Resumen
La esteatohepatitis no alcohólica se caracteriza histológicamente por el balonamiento de los hepatocitos, la inflamación lobulillar y la esteatosis. Al sospechar este diagnóstico es importante la exclusión de otras causas de lesión hepática principalmente el consumo excesivo de alcohol; sin embargo, la biopsia es el único método disponible hasta el momento para confirmar el diagnóstico. Para el tratamiento de esta enfermedad, la vitamina E debe ser considerada una terapia de primera línea debido a que en diversos ensayos clínicos se ha observado que aunque sin un impacto significativo en la fibrosis, a dosis de 800 UI día mejora la histología en adultos no diabéticos con NASH confirmado por biopsia. A pesar de los beneficios demostrados con el uso de este medicamento se debe tener en cuenta que no reemplaza los cambios en la dieta y el ejercicio, y que por el contrario, representa un complemento a estas medidas.
Palabras clave
Esteatohepatitis no alcohólica, vitamina E, estrés oxidativo.
INTRODUCCIÓN
La esteatohepatitis no alcohólica se caracteriza histológicamente por el balonamiento de los hepatocitos, inflamación lobulillar y la esteatosis (1, 2). Actualmente esta entidad solo puede ser diagnosticada a través de una biopsia hepática, Gold standard (3, 4), la cual provee información concerniente a la presencia y grado de inflamación, necrosis y fibrosis, importante para establecer un pronóstico (2, 5). Existen pequeñas diferencias microscópicas entre la NASH y la esteatohepatitis alcohólica, lo que hace difícil la diferenciación histológica, por lo que es importante la información obtenida a través de la anamnesis acerca de los hábitos de consumo de bebidas alcohólicas (4).
La NASH hace parte de una entidad patológica mucho más amplia denominada esteatosis hepática no alcohólica (por sus siglas en inglés NAFLD) que incluye en sus estadios tempranos la esteatosis sin inflamación, esteatosis con inflamación leve y por último un estado inflamatorio característico de la NASH, que al progresar produce fibrosis y finalmente cirrosis (1, 2, 5). Todavía no está completamente esclarecido qué sujetos avanzan desde una simple esteatosis hasta el estado inflamatorio. La interacción entre la susceptibilidad genética, los trastornos metabólicos y el estrés oxidativo que esto conlleva son los factores más importantes (6, 7).
La NAFLD es la enfermedad hepática más prevalente a nivel mundial (2, 4,6). La prevalencia de NAFLD y la NASH se estima que es alrededor de 20-30% (8) y de 2-3% respectivamente entre la población general del mundo occidental (4).
Por su función antioxidante se ha recomendado en guías americanas actuales a la vitamina E y concluyendo: La vitamina E administrada en dosis diaria de 800 UI/día mejora la histología hepática en adultos no diabéticos con NASH demostrada por biopsia, esto no debe dejar de un lado la importancia de la intervención en el estilo de vida y la dieta como parte fundamental del tratamiento para pacientes con NASH (9, 10), por lo tanto en el presente artículo se hace una revisión sobre la fisiopatología de la esteatohepatitis no alcohólica con énfasis en el papel de la vitamina E en el tratamiento de los pacientes que padecen esta enfermedad.
FISIOPATOLOGÍA
La patogénesis de la NASH no se encuentra completamente esclarecida, la hipótesis más aceptada propuesta para explicar los acontecimientos que conducen a esteatosis y la subsecuente esteatohepatitis, es la teoría de dos golpes o two-hits. El punto clave en el inicio de esta enfermedad es la sobrecarga lipídica (primer golpe) (11, 12). Factores como el sedentarismo, factores genéticos (4) y el aumento del consumo de calorías hace a los individuos más propensos al desarrollo de la resistencia a la insulina e hiperinsulinemia, conllevando un aumento en la síntesis de lípidos hepática y de la liberación de ácidos grasos libres desde el tejido adiposo, al mantenerse este estado el hígado no es capaz de metabolizar todos los ácidos grasos, tanto los extraídos de la circulación como los producidos por él mismo, llevando finalmente a la esteatosis hepática y al estrés oxidativo (segundo golpe) (4, 5, 13).
El estrés oxidativo es un disbalance a favor de agentes prooxidantes sobre agentes antioxidantes (3). Durante la esteatosis hepática, los hepatocitos entran en un estado hipermetabólico que conlleva a la mayor producción de radicales libres en las organelas celulares (13). Al aumentar la cantidad de ROS en los hepatocitos se incrementa la peroxidación lipídica que es una reacción que proporciona aporte continuo de radicales libres llevando a peroxidación adicional, con efectos potencialmente devastadores (14, 15).
Uno de los mecanismos antioxidantes es el de la vitamina E (tocoferol) que al reaccionar con peróxidos de lípidos los reduce hacia ácidos grasos, lo que forma el radical tocoferoxilo relativamente estable, que persiste suficiente tiempo para pasar por reducción de regreso hacia tocoferol por medio de reacción con la vitamina C en la superficie celular (12). Gracias a esta función se ha considerado el uso de la vitamina E como parte del tratamiento para pacientes con NASH (13, 16).
MANIFESTACIONES Y DIAGNÓSTICO
La NAFLD es un síndrome frecuente que abarca desde la simple esteatosis hasta la esteatohepatitis (NASH) con posterior fibrosis y cirrosis (5). Aunque al momento del diagnóstico la mayoría de los pacientes está asintomático, algunos, especialmente niños pueden quejarse de fatiga y malestar, así como de molestia en el cuadrante superior derecho del abdomen, además, la sospecha sobre su presencia aumenta al encontrar niveles alterados de aminotransferasas o una ecografía abdominal con un hígado brillante; esta enfermedad también debe ser tenida en cuenta durante la evaluación de condiciones asociadas como lo son la obesidad, la diabetes o la dislipidemia (5, 17).
Durante la evaluación diagnóstica se deben excluir otras causas frecuentes de enfermedad hepática, y en última instancia se realiza biopsia que es el único método disponible para confirmar el diagnóstico, además, es importante para definir el pronóstico del paciente (3, 4) (tabla 1). A pesar de su gran valor clínico, la biopsia es costosa y conlleva a un aumento leve en morbilidad y muy raras veces en la mortalidad, por lo cual esta herramienta solo debe ser considerada en pacientes en los cuales se sospecha la presencia de esteatosis hepática no alcohólica que se encuentran en alto riesgo de padecer esteatohepatitis y fibrosis avanzada (obesidad, diabetes mellitus tipo II, dislipidemia y síndrome metabólico), además es vital en los casos de incertidumbre diagnóstica (3, 9).
PAPEL DE LA VITAMINA E EN EL TRATAMIENTO DE LA ESTEATOHEPATITIS NO ALCOHÓLICA
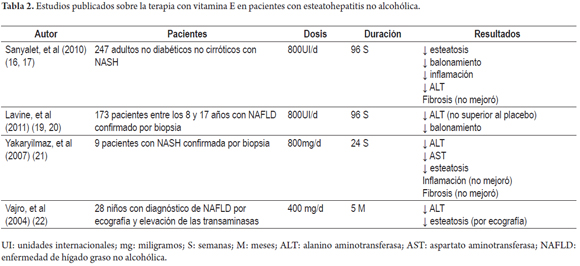
En la actualidad no existe una terapia eficaz para el tratamiento de la esteatohepatitis no alcohólica, sin embargo, teniendo en cuenta el importante papel que juega la vitamina E como factor antioxidante se han realizado diversos ensayos clínicos con el fin de demostrar sus beneficios en la evolución tanto clínica como histopatológica de esta enfermedad (tabla 2).
Entre estos se encuentra el PIVENS, un estudio multicéntrico, doble ciego, controlado con placebo en el cual se evaluó la mejoría histológica en 247 pacientes no diabéticos y sin cirrosis con NASH los cuales fueron asignados aleatoriamente para recibir una dosis diaria de 30 mg de pioglitazona (80 pacientes), vitamina E a dosis de 800 U diarias (84 pacientes) o placebo (83 pacientes) durante 96 semanas (18). En este estudio se encontró que la vitamina E comparada con el placebo tuvo una tasa más alta de mejoría en la esteatohepatitis no alcohólica (43% vs. 19%, P= 0,001), por su parte, la pioglitazona comparada con el placebo no provocó una mejoría estadísticamente significativa (34% vs. 19, P= 0,04), sin embargo, ambos medicamentos se relacionaron con una mejoría en los niveles de aminotransferasas, reducción en la esteatosis e inflamación lobular, pero ninguno causó una mejoría en la fibrosis. Debido a que en este mismo estudio se demostró que una vez suspendido el tratamiento con vitamina E existe un aumento en los niveles de aminotransferasas es probable que sea necesario administrar el tratamiento de forma indefinida. Además, no se encontraron diferencias significativas en cuanto a los efectos adversos de la vitamina E cuando se compara con el placebo (19).
Hoofnagle et al, en una reevaluación del ensayo PIVENS enfocada en la respuesta de la ALT sérica en los pacientes que recibieron vitamina E o placebo, y la asociación de esta respuesta con las características clínicas iniciales, los cambios histológicos y la interacción con los cambios de peso corporal, encontró que los cambios en la ALT fueron más frecuentes entre quienes recibieron vitamina E (48%) que en los que recibieron placebo (16%; p <0,001). Entre el grupo que recibió vitamina E la respuesta en la ALT se asoció con disminución en la actividad de la enfermedad de hígado graso no alcohólica (NAS), pero no hubo mejoría en la fibrosis y después de suspendida la terapia a las 96 semanas, los niveles de ALT aumentaron en el grupo de vitamina E, pero no en el grupo placebo, y los dos grupos de tratamiento tenían niveles de ALT prácticamente idénticos en la semana 120. Estos resultados son similares a los mostrados en la cohorte completa de la publicación principal del ensayo PIVENS. Además, los resultados mostraron que la pérdida de peso (2 kg o más) también se asocia con la respuesta en la ALT, con mejoría en la NAS (<0,001) y en la fibrosis (p <0,02), pero la vitamina E tuvo mayor efecto en la NAS independiente del cambio en el peso corporal. Finalmente cabe resaltar que los efectos de la vitamina E y la pérdida de peso sobre la respuesta en la ALT y la histología son independientes, esto quiere decir que incluso aquellos pacientes que bajen de peso se beneficiarían con la terapia con vitamina E (20).
En otro estudio realizado con 173 pacientes de 8 a 17 años de edad denominado TONIC, un estudio multicéntrico, doble ciego y controlado con placebo en el cual los pacientes fueron asignados aleatoriamente para recibir vitamina E (58 pacientes recibieron 400 IU dos veces al día), metformina (57 pacientes recibieron 500 mg dos veces al día) o placebo (58 pacientes) por 96 semanas (21), se encontró que ningún agente fue superior al placebo para lograr una reducción sostenida de al menos 50% en los niveles basales o un nivel de 40 U/L o menos de alanino aminotransferasa (ALT) durante mediciones llevadas a cabo cada 12 semanas a partir de la semana 48 y hasta la semana 96. Además, en este estudio se encontró que la resolución de la NASH fue significativamente mayor en el grupo de los pacientes tratados con vitamina E, comparado con el grupo que recibió placebo, este resultado fue atribuido a la importante disminución del balonamiento hepatocelular que de forma similar al PIVENS se encontró en los pacientes tratados con vitamina E; sin embargo, en el TONIC, por las diferencias histopatológicas de la NALFD en pacientes pediátricos comparados con adultos no se tomó la mejoría del balonamiento hepatocelular como un resultado primario. En este estudio tampoco se encontró mejoría en la fibrosis (22).
Anterior a estos dos grandes estudios se han realizado otros entre los cuales existen grandes diferencias en cuanto a los resultados primarios evaluados, además han sido realizados sobre poblaciones mucho más pequeñas, con menor tiempo de seguimiento y en algunos de ellos sin ser controlados con placebo.
En el estudio de Yakaryilmaz et al (2007) en nueve pacientes con NASH verificada por biopsia se evaluó el efecto de la vitamina E sobre el receptor gamma de peroxisoma activado por proliferador y la resistencia a la insulina. Antes y después de iniciar la toma de 800 mg de vitamina E diarios durante 24 semanas en estos pacientes se realizó una evaluación hepática tanto bioquímica como histológica. Al final de las 24 semanas se encontró una disminución estadísticamente significativa de los niveles de AST, ALT y de la esteatosis, pero no se encontraron cambios histológicos en cuanto al nivel de inflamación y fibrosis. Ningún paciente experimentó efectos adversos con esta dosis de vitamina E (23).
Vajro, et al (2004) realizaron un estudio en un grupo de 28 niños con edades entre 9,88 (+/- 3,97) para el grupo 1 y 10,7 (+/- 3,45) para el grupo 2, con disfunción hepática relacionada con obesidad, con el fin de evaluar el efecto benéfico de la vitamina E y la pérdida de peso sobre los valores de transaminasas y sobre los cambios ecográficos relacionados con esteatosis. En este estudio se incluyeron aquellos niños que habían presentado hipertransaminasemia crónica (niveles de AST o ALT 1,5 veces por encima el valor normal por más de 6 meses) y signos de esteatosis en la ecografía. Tuvo un diseño simple-ciego, los pacientes fueron asignados aleatoriamente en uno de dos grupos: grupo 1 (placebo + dieta) y grupo 2 (vitamina E + dieta), aunque posteriormente cada grupo se subdividió dependiendo del cumplimiento o no de la terapia, así: grupo 1 en subgrupo 1A para los que cumplieron con la dieta y subgrupo 1B los que incumplieron con la dieta; el grupo 2, en subgrupo 2A para los que cumplieron con la terapia con vitamina E (a su vez este subgrupo se clasificó entre subgrupo 2A1 para los que incumplieron con la dieta y subgrupo 2A2 para los que cumplieron esta); y subgrupo 2B para aquellos que incumplieron la terapia con vitamina E. Se encontró que los pacientes del subgrupo 2A, con una dosis de 400 mg/día, lograron disminución significativa de los valores de ALT llegando hasta la normalización, independiente de la modificación del peso. Por otro lado, aquellos pacientes quienes alcanzaron niveles séricos altos de vitamina E y además perdieron peso, lograron remisión de la esteatosis y todos estos lograron normalización del ALT. Además, se realizó una comparación entre los grupos que solo tuvieron adherencia con la dieta 1A y los que solo cumplieron la terapia con vitamina E (2A1), y se encontró que en ambos grupos los pacientes habían disminuido los niveles de ALT a los 2 meses de seguimiento, y que hubo una mayor disminución en el grupo que solo se sometió a dieta a los 5 meses. Por su parte en el grupo 2A2, aquellos que perdieron peso durante el tratamiento con 400 mg de vitamina E, se observó desaparición de los signo de esteatosis en la ecografía. Estos resultados resaltan la importancia de promover la alimentación saludable como una de las principales intervenciones en los paciente con NASH, aunque también hay que resaltar que muchos pacientes incumplen con los regímenes dietarios llevando al fracaso de la intervención, lo que recalca la importancia del uso de antioxidantes como la vitamina E como una buena alternativa en la terapia de estos pacientes (24).
Kugelmas, et al (2003) en un estudio piloto evaluaron los efectos del paso 1 de la dieta de la American Heart Association, más el ejercicio aeróbico, con o sin administración de vitamina E diariamente, sobre los perfiles de citocinas (TNF alfa, IL-8, IL-6) y los niveles de enzimas hepáticas en 16 pacientes entre los 18 y 65 años de edad con NASH confirmada por biopsia. Este fue un estudio simple ciego en el que los pacientes fueron asignados aleatoriamente para recibir 800 IU de vitamina E al día. Los pacientes que no recibieron vitamina E no recibieron placebo. El ensayo se llevó a cabo durante un periodo de 12 semanas. Los valores de citoquinas en general no disminuyeron significativamente con la pérdida de peso con o sin vitamina E durante el estudio. Las modificaciones del estilo de vida se asociaron con una mejoría en las enzimas hepáticas y del colesterol plasmático en los pacientes con NASH, mientras que la dosis de vitamina E usada en este estudio no mostró beneficio adicional. Este resultado puede deberse al pequeño tamaño de la muestra, al corto tiempo de seguimiento y a la dosis usada de vitamina E (25, 26).
En una revisión publicada en noviembre del 2013 sobre las opciones actualmente disponibles para el tratamiento de pacientes con NASH, si bien se reconoce la recomendación actual del uso de la vitamina E como terapia farmacológica de primera línea en pacientes con NASH confirmada por biopsia, no cirróticos y sin diabetes también se resalta el hecho de que esta terapia solo ha mostrado beneficios significativos en menos de la mitad de los pacientes y por tanto futuras estrategias de tratamiento basadas en las vías patogénicas de la enfermedad pueden ser necesarias para desarrollar un tratamiento efectivo para pacientes con NASH (27).
Ji H-F, et al realizaron un metanálisis con el objetivo evaluar el efecto de la vitamina E sobre la disminución de las aminotransferasas en pacientes con NAFLD, NASH y hepatitis C crónica (CHC). En los cuatro estudios que incluyeron pacientes con NASH y suplementación de vitamina E, entre ellos el TONIC y el PIVENS, se encontró que la vitamina E podría optimizar los niveles de ALT y AST en estos pacientes. Sin embargo, se debe tener en cuenta que este metanálisis tuvo como limitantes la imposibilidad de excluir los efectos de las intervenciones en el estilo de vida, el ejercicio y el uso de otros potenciales antioxidantes, así como factores de riesgo para enfermedad hepática crónica como el consumo de alcohol y el uso drogas; sumado a esto se debe tener en cuenta la heterogeneidad de los estudios, que limita su análisis en conjunto, así como la menor especificidad que tienen las aminotransferasas en comparación con la biopsia al momento de hacer el diagnóstico y evaluación de la enfermedad hepática (28).
Aunque entre los grandes estudios realizados para evaluar el efecto del uso de la vitamina E en pacientes con NASH no se han encontrado diferencias estadísticamente significativas en cuanto a los efectos adversos con el uso a corto plazo cuando es comparada con el placebo o con las otras opciones terapéuticas, existe preocupación sobre los posibles efectos adversos del uso prolongado de esta medicación.
Una revisión sistemática en la cual se incluyeron nueve ensayos clínicos aleatorizados y controlados con placebo con el fin de evaluar el efecto de la suplementación con vitamina E por un tiempo de al menos un año sobre la incidencia total y de cada uno de los subtipos de accidente cerebrovascular (ACV), se encontró que incrementa el riesgo de ACV hemorrágico con un RR de 1,22 (CI 95% de 1 a 1,48), p= 0,045. Debido a los resultados arrojados por esta revisión los investigadores recomendaron evitar el uso indiscriminado de vitamina E por las graves consecuencias que tiene el ACV hemorrágico en morbilidad y mortalidad (29).
En cuanto al riesgo de cáncer de próstata un ensayo clínico aleatorizado y controlado con placebo en el cual se incluyeron 35.533 pacientes seguidos por un tiempo mínimo de siete años se encontró que comparado con el grupo de placebo el grupo que recibió vitamina E a dosis de 400 IU diariamente presentó un incremento significativo en el riesgo de cáncer de próstata (HR 1,17; 99% CI, 1,004-1,36; p= 0,008). Con un incremento absoluto en el riesgo de 1,6 por cada 1.000 personas-año (30).
En otro metanálisis en el cual se revisó la relación dosis respuesta, entre la suplementación con vitamina E y la mortalidad total en adultos se identificó que en pacientes que recibieron dosis altas de esta vitamina (mayor o igual a 400 IU/día) se aumentó la mortalidad por todas las causas. Este metanálisis limitó su búsqueda a estudios aleatorizados y controlados, cuya muestra de pacientes consistía en adultos que recibieron tratamiento con vitamina E como monoterapia o en combinación con otras vitaminas o minerales, excluyendo mujeres embarazadas, con un periodo mínimo de 1 año de tratamiento y seguimiento, sin embargo, los resultados proporcionados por este metanálisis se deben considerar con precaución ya que varios de los estudios analizados poseen un tamaño de muestra pequeño y fueron realizados en pacientes con varias enfermedades crónicas, lo que limita la generalización a la población adulta saludable (31).
CONCLUSIÓN
Aunque actualmente no existe una terapia farmacológica eficaz para pacientes con NASH, la evidencia mostrada por el estudio PIVENS sugiere que es adecuada la administración de vitamina E con el fin de mejorar la histología hepática en pacientes adultos con esteatohepatitis no alcohólica, no cirróticos y sin diabetes; sin embargo, a la fecha se hacen necesarios más estudios que permitan ampliar esta recomendación para pacientes diabéticos o cirróticos con NASH. En estudios llevados a cabo sobre pacientes pediátricos que padecen esta misma enfermedad no se ha encontrado suficiente evidencia que justifique el uso de vitamina E. Además de las medidas anteriores se ha demostrado que la pérdida de peso reduce la esteatosis e inflamación hepática por lo cual se debe recomendar en todos los pacientes la realización de una dieta hipocalórica en conjunto con incremento de la actividad física. En cuanto a los efectos adversos no se han encontrado diferencias estadísticamente significativas con el uso a corto plazo de vitamina E cuando es comparado con placebo o con las otras opciones terapéuticas, sin embargo, no se recomienda el uso indiscriminado por periodos largos de tiempo ya que existe evidencia que sugiere un aumento en el riesgo de padecer cáncer de próstata, ACV hemorrágico y muerte por todas la causas.
REFERENCIAS
1. Abbas AK, Fausto N. Hígado, vesícula biliar y vías biliares. En: Robbins SL, Mitchell RN, Kumar V, Abbas AK, Fausto N. Patología funcional y estructural. 8va Ed. Barcelona: Elsevier; 2012. p. 645-687. [ Links ]
2. Brunt E, Neuschwander-Tetri B, Burt AD. Fatty liver disease: alcoholic and non-alcoholic. En: Burt AD, Ferrell, L Portmann BC. MacSweens Pathology of the Liver. 6th edition. UK: Elservier; 2012. p. 293-359. [ Links ]
3. Corrado RL, Torres DM, Harrison SA. Review of Treatment Options for Nonalcoholic Fatty Liver Disease. Med Clin N Am 2014; 98: 55-72. [ Links ]
4. Koek GH, Liedorp PR, Bast A. The role of oxidative stress in non-alcoholic steatohepatitis. Clinica Chimica Acta 2011; 412: 1297-1305. [ Links ]
5. Cortez-Pinto H, Ermelinda Camilo M. Non-alcoholic fatty liver disease/non-alcoholic steatohepatitis (NAFLD/NASH): diagnosis and clinical course. Best Practice & Research Clinical Gastroenterology 2004; 18(6): 1089-104. [ Links ]
6. Mishra A, Younossi ZM. Epidemiology and Natural History of Non-alcoholic Fatty Liver Disease. Journal of Clinical and Experimental Hepatology 2012; 2(2): 135-44. [ Links ]
7. Rolo AP, Teodoro JS, Palmeira CM. Role of oxidative stress in the pathogenesis of nonalcoholic steatohepatitis. Free Radic Biol Med 2012; 52(1): 59-69. [ Links ]
8. Machado MV, Cortez-Pinto H. Non-invasive diagnosis of non-alcoholic fatty liver disease. A critical appraisal. Journal of Hepatology 2013; 58(5): 1007-19. [ Links ]
9. Chalasani N, et al. The Diagnosis and Management of Non-Alcoholic Fatty Liver Disease: Practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology 2012; 55. [ Links ]
10. Mazzella N, Ricciardi LR, Mazzotti A, Marchesini G. The Role of Medications for the Management of Patients with NAFLD. Clin Liver Dis 2014; 18: 73-89. [ Links ]
11. Chunga MY, Yeunga SF, Parka HJ, Volekb JS, Brunoa RS. Dietary α- and γ-tocopherol supplementation attenuates lipopolysaccharide-induced oxidative stress and inflammatory-related responses in an obese mouse model of nonalcoholic steatohepatitis. Journal of Nutritional Biochemistry 2010; 21: 1200-1206. [ Links ]
12. Day CP, James OF. Steatohepatitis: A tale of two hits? Gastroenterology 1998; 114: 842-4. [ Links ]
13. Harper HA, Murray RK, Rodwell VW, Bender DA. Bioquímica ilustrada, 28 ed. México: McGraw-Hill Interamericana; 2010. p. 484-485. [ Links ]
14. Neuschwander-Tetri BA. Hepatic lipotoxicity and the pathogenesis of nonalcoholic steatohepatitis: the central role of nontriglyceride fatty acid metabolites. Hepatology 2010; 52(2): 774-88. [ Links ]
15. Le T, Loomba R. Management of Non-alcoholic Fatty Liver Disease and Steatohepatitis. Journal of Clinical and Experimental Hepatology 2012; 2: 156-173. [ Links ]
16. Verdam FJ, Dallinga JW, Driessen, de Jonge C, Moonen E, van Berkel J, Luijk J, Bouvy ND, Buurman AW, Rensen SS, Greve JW. Non-alcoholic steatohepatitis: A non-invasive diagnosis by analysis of exhaled breath. Journal of Hepatology 2013; 58: 543-548. [ Links ]
17. Palmentieri B, de Sio I, La Mura V, et al. The role of bright liver echo pattern on ultrasound B-mod examination in the diagnosis of liver steatosis. Dig Liver Dis 2006; 38: 485-9. [ Links ]
18. Sanyal AJ, et al. Pioglitazone versus vitamin E versus placebo for the treatment of non-diabetic patients with non-alcoholic steatohepatitis: PIVENS trial design. Contemp Clin Trials 2009; 30(1): 88-96. [ Links ]
19. Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, Diehl AM, Bass NM, et al. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med 2010; 362(18): 1675-85. [ Links ]
20. Hoofnagle JH, Van Natta ML, Kleiner DE, Clark JM, Kowdley KV, Loomba R, et al. Vitamin E and changes in serum alanine aminotransferase levels in patients with non-alcoholic steatohepatitis. Aliment Pharmacol Ther 2013; 38(2):134-43. [ Links ]
21. Lavine JE, Schwimmer JB, Molleston JP, Scheimann AO, Murray KF, Abrams SH, et al. Treatment of nonalcoholic fatty liver disease in children: TONIC trial design. Contemp Clin Trials 2010; 31(1): 62-70. [ Links ]
22. Lavine JE, Schwimmer JB, Van Natta ML, et al. Effect of vitamin e or metformin for treatment of nonalcoholic fatty liver disease in children and adolescents: The tonic randomized controlled trial. JAMA 2011; 305(16): 1659-68. [ Links ]
23. Yakaryilmaz F, Guliter S, Savas B, Erdem O, Ersoy R, Erden E, et al. Effects of vitamin E treatment on peroxisome proliferator-activated receptor-alpha expression and insulin resistance in patients with non-alcoholic steatohepatitis: results of a pilot study. Intern Med J 2007; 37(4): 229-35. [ Links ]
24. Vajro P, Mandato C, Franzese A, Ciccimarra E, Lucariello S, Savoia M, et al. Vitamin E treatment in pediatric obesity-related liver disease: a randomized study. J Pediatr Gastroenterol Nutr 2004; 38(1): 48-55 [ Links ]
25. Papastergiou V, et al. Nine scoring models for short-term mortality in alcoholic hepatitis: cross-validation in a biopsy-proven cohort. Aliment Pharmacol Ther 2014; 39: 721-732. [ Links ]
26. Kugelmas M, Hill DB, Vivian B, Marsano L, McClain CJ. Cytokines and NASH: A pilot study of the effects of lifestyle modification and vitamin E. Hepatology 2003; 38(2): 413-9. [ Links ]
27. Younossi ZM, Reyes MJ, Mishra MA, Mehta R, Henry L. Systematic review with meta-analysis: non-alcoholic steatohepatitis - a case for personalized treatment based on pathogenic targets. Aliment Pharmacol Ther2014; 39: 3-14. [ Links ]
28. Ji HF, et al. Effect of vitamin E supplementation on aminotransferase levels in patients with NAFLD, NASH, and CHC: Results from a meta-analysis. Nutrition 2014; 1-6. [ Links ]
29. Markus S, Robert JG, Pamela MR, Christophe T, Tobias K. Effects of vitamin E on stroke subtypes: meta-analysis of randomised controlled trials. BMJ 2010; 341. [ Links ]
30. Klein EA, Thompson IM, Tangen CM, et al. Vitamin e and the risk of prostate cancer: The selenium and vitamin e cancer prevention trial (select). JAMA 2011; 306(14): 1549-56. [ Links ]
31. Miller ER, 3rd, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LJ, Guallar E. Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality. Ann Intern Med 2005; 142(1): 37-46. [ Links ]











 text in
text in