Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.30 no.1 Bogotá Jan./Mar. 2015
Erradicación del Helicobacter pylori: encuesta realizada por la Asociación Colombiana de Gastroenterología
Martín Gómez MD. (1), Oscar Ruíz MD. (2), David Páramo Hernández MD. (3), Rosario Albis MD. (4), Luis Carlos Sabbagh MD. (5)
(1) Internista, Gastroenterólogo, Hospital El Tunal. Profesor asociado de gastroenterología, Universidad Nacional de Colombia. Bogotá, Colombia.
(2) Internista, Gastroenterólogo, Hospital de Occidente de Kennedy. Bogotá, Colombia.
(3) Gastroenterólogo, Epidemiólogo Clínico, Hospital Santa Clara. Universidad El Bosque. Bogotá, Colombia.
(4) Cirujana General. Cirugía gastrointestinal INC, Gastroenterología, Clínica Colsánitas. Bogotá, Colombia.
(5) Internista, Gastroenterólogo. Jefe Unidad de Gastroenterología, Clínica Colsánitas. Presidente ACG. Bogotá, Colombia.
Fecha recibido: 30-07-14 Fecha aceptado: 02-02-15
Resumen
El objetivo de este estudio es presentar los resultados de una encuesta enviada por Internet para conocer cuáles son las estrategias y esquemas utilizados por los miembros de la Asociación Colombiana de Gastroenterología (ACG) para la erradicación y diagnóstico de la infección por Helicobacter pylori a la luz del Consenso de Maastricht IV. Se tomó información de manera prospectiva entre diciembre de 2013 y mayo de 2014, teniendo como herramienta de recolección un cuestionario virtual disponible en la página oficial de Internet de la ACG.
La encuesta fue respondida por 114 médicos, de los cuales 60 (52%) fueron internistas y gastroenterólogos ubicados en las principales ciudades del país. Los resultados mostraron una adherencia del 61% (n = 71) de los encuestados a las recomendaciones de Maastricht para el esquema de erradicación de primera línea, y para la segunda línea la adherencia es del 66% (n = 76). Otro aspecto de la encuesta para destacar, y que está en contraste con las recomendaciones de Maastricht, es el hallazgo de que la prueba diagnóstica predilecta de los encuestados para evaluar la erradicación (antígenos fecales monoclonales o test de urea en aliento) fue la endoscopia digestiva alta más biopsia (Giemsa), siendo la escogida por el 63% (n = 72) probablemente por su disponibilidad y costo en nuestro país.
Los resultados de la encuesta muestran cuáles son los esquemas de tratamiento preferidos, por los profesionales que contestaron la misma, para la erradicación del Helicobacter pylori; esto permitió evaluar la aceptación y adherencia de las recomendaciones sobre los esquemas de tratamiento del Consenso, aunque llama la atención, en contraste, cómo el seguimiento de la erradicación se realiza mediante endoscopia.
Palabras clave
Encuesta, Helicobacter pylori, Consenso de Maastricht IV.
INTRODUCCIÓN
El Helicobacter pylori (H. pylori) es el microorganismo responsable de la infección bacteriana crónica más frecuente en todo el mundo. Estudios que incluyen el análisis de secuencias genéticas sugieren que los seres humanos han sido infectados con H. pylori desde hace unos 58000 años (1); fue observado por primera vez hace más de 100 años (2), pero la verdadera implicación de estas bacterias y su relación con múltiples patologías se estableció plenamente hasta 1982, cuando Marshall y Warren identificaron y posteriormente cultivaron este microorganismo llamándolo inicialmente Campylobacter pyloridis, después reclasificado como Helicobacter pylori (3-5).
La infección causada por este microorganismo en todos los infectados produce gastritis crónica, pero solo el 20% de ellos tendrá alguna enfermedad clínica (6). Esta infección crónica afecta a casi la mitad de la población mundial; en los países en desarrollo su prevalencia es tan alta como del 90% mientras que en los países desarrollados, con excepción de Japón, la prevalencia es inferior al 40% (7, 9). En nuestra población, las tasas de infección por H. pylori en adultos examinados por evaluación histopatológica y métodos serológicos va del 70% al 78% (8-12).
Con base en la evidencia actual se conoce que este microorganismo tiene una relación causal con la gastritis crónica y con las úlceras gastroduodenales con un riesgo de desarrollo reportado del 1%-10% en pacientes infectados, al tiempo que posee una relación asociativa en patologías como el adenocarcinoma gástrico no cardial (riesgo en pacientes infectados del 0,1%-3%) y la dispepsia funcional (riesgo en pacientes infectados del 1%) (6, 13-18). También se ha propuesto una relación causal con el linfoma del tejido linfoide asociado con mucosas (linfoma de células B extranodal de zona marginal [MALT]) con un riesgo de desarrollo reportado del <0,01% en pacientes infectados. Los principales factores de riesgo informados para adquirir la infección están relacionados con condiciones de vida deficientes (mayor número de hermanos, acceso a educación, hacinamiento, acceso a agua potable) (19-22), aunque también se ha visto asociación entre una mayor tasa de infección y factores genéticos como la etnicidad, siendo más común en afroamericanos e indígenas (23, 24).
En Colombia, el cáncer gástrico es la segunda causa de esta enfermedad en hombres y la cuarta en mujeres, y es la principal causa de muerte por cáncer con una incidencia de 20,7 x 100000 habitantes entre 1995-1999, es decir, somos una población de alto riesgo (25). En un ensayo aleatorizado en Shandong, China, la erradicación de H. pylori con el uso de amoxicilina y omeprazol disminuyó la incidencia de cáncer gástrico en un 39% durante un periodo 15 años (26), lo cual confirma hallazgos descritos en otros estudios (27-32); también se ha demostrado que reduce su recurrencia (33). Con la evidencia disponible, el Consenso de la Conferencia de Cáncer Gástrico recomienda la detección de H. pylori y el tratamiento en personas asintomáticas en poblaciones de alto riesgo con el fin de prevenir el cáncer gástrico (poblaciones con incidencia de cáncer gástrico mayor a 20/100000 habitantes) (34), lo cual sugiere que nuestro país podría acogerse a esta recomendación.
Al tener en cuenta lo descrito, la erradicación del H. pylori no solo es útil para el tratamiento de la úlcera gástrica/duodenal sino también para el tratamiento y prevención de enfermedades asociadas con este microorganismo, como cáncer gástrico, así como para la disminución de la propagación de esta infección (9, 26, 35). Sin embargo, el éxito de estos tratamientos está comprometido por el aumento de la resistencia antimicrobiana exhibida por el H. pylori (36, 37).
Gracias a la marcada importancia de esta infección y a la necesidad de tratamientos efectivos para su erradicación, a nivel mundial se realizan reuniones de consenso, siendo el de Maastricht el de mayor influencia; éste fue revisado por última vez en 2012 en su versión IV (38). Es crucial que el personal médico de nuestro país conozca las diferentes estrategias de diagnóstico y de erradicación (39).
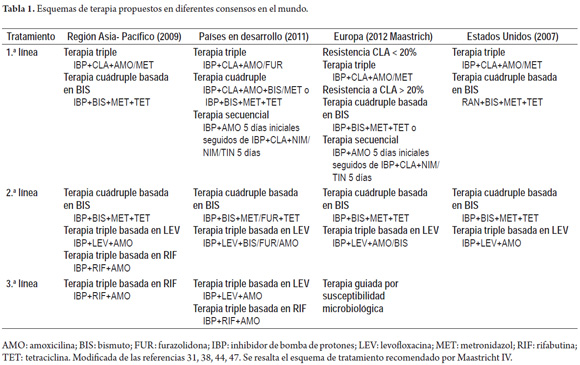
El propósito del presente estudio es conocer mediante una encuesta cuáles son las estrategias y esquemas actualmente utilizados por nuestros colegas y asociados para la erradicación y diagnóstico del H. pylori comparado con lo propuesto por Maastricht IV, el consenso más reciente que proporciona recomendaciones sobre la base de la mejor evidencia actual. Las encuestas científicas ayudarán a conocer las variaciones en la práctica del ejercicio de la gastroenterología entre los asociados y darán un marco para identificar las áreas que necesitan mejorar en futuras investigaciones y congresos. Ver Tabla 1.
MÉTODOS
El presente es un estudio observacional de tipo transversal en el que se tomó información de manera prospectiva entre diciembre de 2013 y mayo de 2014, teniendo como herramienta de recolección de datos un cuestionario virtual disponible en la página oficial de Internet de la Asociación Colombiana de Gastroenterología (www.gastrocol.com) en la URL goo.gl/CNsQak, el cual fue respondido de manera anónima y voluntaria por médicos generales, internistas, internistas y gastroenterólogos, cirujanos y gastroenterólogos, cirujanos gastrointestinales, y cirujanos coloproctólogos de las diferentes regiones de nuestro país donde se dispone de Internet.
ANÁLISIS ESTADÍSTICO
Los registros de las encuestas fueron almacenados en tablas de datos de Google Drive y luego fueron exportados a tablas de Excel, desde donde se practica el análisis estadístico. Después, las variables fueron codificadas como cualitativas o cuantitativas, y éstas a su vez se catalogaron como cualitativas categóricas, ordinales o nominales, y las variables cuantitativas como discretas o continuas. Para las variables cualitativas categóricas se efectuó estadística descriptiva mediante frecuencias absolutas y relativas, y para las cuantitativas numéricas se calcularon medidas de tendencia central como promedios o mediana. Las tablas de resultados son presentadas con su respectiva frecuencia relativa.
RESULTADOS
Durante el periodo de publicación, el cuestionario fue respondido por un total de 114 profesionales, con una distribución según la especialidad de: médicos generales 8,8% (n = 10), médicos internistas 0,9% (n = 1), médicos internistas y gastroenterólogos 52,6% (n = 60), médicos cirujanos generales 1,8% (n = 2), médicos cirujanos gastrointestinales 12,3% (n = 14), médicos cirujanos y gastroenterólogos 19,2% (n = 22), médicos cirujanos coloproctólogos 1,8% (n = 2), otros 2,6% (n = 3), los cuales estaban distribuidos principalmente en 14 ciudades de Colombia destacándose Bogotá 52% (59), Medellín 7% (n = 8), Bucaramanga 6% (n = 7), Cali 5% (n = 6), Barranquilla 4% (n = 5), Manizales 4,5% (5).
En cuanto a las respuestas a preguntas específicas:
1. ¿Está de acuerdo con la estrategia de serología positiva y tratamiento en Colombia?
Sí 24% (n = 27); no 76% (n = 87)
2. Está de acuerdo con el uso de tratamiento de erradicación en:
a. Dispepsia funcional: sí 58% (n = 66); no 42% (n = 48)
b. Enfermedad por reflujo gastroesofágico:
sí 17% (n = 19); no 83% (n = 95)
c. En pacientes con tratamiento crónico (>4 semanas) con AINES no selectivos, incluyendo bajas dosis de ácido acetil salicílico:
sí 52% (n = 59); no 48% (n = 55)
d. En pacientes que reciben tratamiento crónico (>8 semanas) con inhibidor de la bomba de protones:
sí 48% (n = 55); no 52% (n = 59)
e. En pacientes con diagnóstico histológico de metaplasia intestinal gástrica: sí 85% (n = 97); no 15% (n = 17)
f. Tratamiento de primera línea para pacientes con diagnóstico inmunohistológico de linfoma de bajo grado de la zona marginal gástrico (MALT): sí 92% (n = 105); no 8% (n = 9)
g. Diagnóstico confirmado de anemia por deficiencia de hierro: sí 66% (n = 75); no 34% (n = 39)
h. Diagnóstico confirmado de púrpura trombo-citopénica idiopática: sí 68% (n = 78); no 32% (n = 36)
i. Diagnóstico confirmado de anemia por déficit de vitamina B12: sí 58% (n = 66); no 42% (n = 48)
j. Diagnóstico confirmado de asma: sí 19% (n = 22); no 81% (n = 92)
k. Diagnóstico confirmado de atopia: sí 24% (n = 27); no 76% (n = 87)
l. Diagnóstico confirmado de obesidad mórbida: sí 39% (n = 45); no 61% (n = 69)
m. En pacientes con sangrado gastrointestinal por úlcera péptica: sí 73% (n = 83); no 27% (n = 31).
3. ¿Cree usted que el aislamiento de antígenos fecales (monoclonales) para detección de H. pylori tiene un rendimiento equiparable al test de urea en aliento?
Sí 71% (n = 81); no 29% (n = 33)
4. ¿Cuál es la combinación de medicamentos de primera línea de erradicación de H. pylori que utiliza habitualmente? Véase tabla 2.
Al comparar las respuestas de los encuestados con las recomendaciones del Consenso de Maastricht para el esquema de erradicación del H. pylori en primera línea, los 2 esquemas (amoxicilina, claritromicina, IBP: 67 [59%], y metronidazol, claritromicina, IBP: 2 [2%]) totalizan una adherencia del 61% (71).
5. ¿Cuál es el la combinación de medicamentos que utiliza como segunda línea para la erradicación de H. pylori? Véase tabla 3.
Cuando se comparan las respuestas de los encuestados con las recomendaciones del Consenso de Maastricht para el esquema de erradicación del H. pylori en segunda línea, los 2 esquemas (cuádruple terapia con bismuto: 21 [18%], y triple terapia con levofloxacina: 55 [48%]) totalizan una adherencia del 76% (66).
6. ¿Cómo utiliza el IBP en el esquema de erradicación?
Única dosis al día 15% (n = 17)
Dosis doble al día 84% (n = 96)
Otro 1% (n = 1)
7. ¿Cuál es periodo de tiempo por el cual usted formula la terapia de erradicación de H. pylori?
7 días 7% (n = 8)
10 - 14 días 93% (n = 106)
8. ¿Cuándo indica usted la realización de cultivo de H. pylori?
Antes de iniciar el tratamiento de erradicación de primera línea: 7% (n = 8)
Posterior a falla terapéutica de tratamiento de primera línea: 7% (n = 8)
Posterior a falla terapéutica de tratamiento de segunda línea: 73% (n = 83)
Otro: (n = 15)
9. ¿En qué pacientes usted realiza confirmación de la erradicación de H. pylori?
El porcentaje y número representado fue la respuesta sí:
Úlcera gástrica68% (n = 77)
Úlcera duodenal 58% (n = 66)
Linfoma gástrico 80% (n = 92)
Cáncer gástrico temprano 71% (n = 81)
Dispepsia 11% (n = 13)
ERGE 6% (n = 7)
Esófago de Barrett 7% (n = 8)
Otro 8% (n = 9)
10. ¿Cuándo realiza seguimiento de efectividad de erradicación?
Periodo de tiempo transcurrido desde el día final del esquema:
2 semanas 1% (n = 1)
3 semanas 2% (n = 2)
4 semanas 19% (n = 22)
6 semanas 13% (n = 15)
8 semanas 57% (n = 65)
Otro 8% (n = 9)
11. ¿Qué prueba diagnóstica utiliza para la realización de seguimiento de erradicación?
Endoscopia digestiva alta más biopsia (Giemsa) 63% (n = 72)
Antígenos fecales monoclonales 11% (n = 13)
Test de urea en aliento 19% (n = 22)
Serología (IgG) 3% (n = 3)
Otro 4% (n = 4)
12. ¿Ha tenido pacientes con resistencia al tratamiento para H. Pylori?
No 11% (n = 12)
1 tratamiento fallido 27% (n = 31)
2 tratamientos fallidos 37% (n = 42)
3 tratamientos fallidos 8% (n = 9)
Más de 3 tratamientos fallidos 18% (n = 20)
DISCUSIÓN
El estudio se realizó mediante una encuesta a través del portal en Internet de la ACG y fue contestada por 114 médicos, de los cuales 60 (52%) fueron internistas y gastroenterólogos ubicados en las principales ciudades del país. Si tenemos en cuenta que la Asociación está compuesta por 310 miembros, el porcentaje de respuesta fue del 36%, lo cual es muy significativo si se tienen en cuenta estudios similares que utilizan esta herramienta de recolección de los datos.
Es de destacar, los resultados de una adherencia del 61% (n = 71) de los encuestados a las recomendaciones del Consenso de Maastricht para el esquema de erradicación del H. pylori en primera línea; y para la segunda línea la adherencia es del 66% (n = 76). Sin embargo, la adherencia a Maastricht no representa necesariamente una garantía de eficacia de erradicación adecuada, y a pesar de que la encuesta explora parcialmente aspectos de eficacia y resistencia de los esquemas utilizados, surgen cuestionamientos sobre estos 2 aspectos. Como regla primordial, se deben prescribir regímenes terapéuticos que tengan una tasa de erradicación ≥90% o, preferiblemente, ≥95% a nivel local. En caso tal de no existir ningún régimen a disposición con una tasa de erradicación superior al 90% se debe utilizar el régimen más eficaz disponible localmente (40, 41). Al tener en cuenta que la base principal de la mayoría de estos esquemas tiene claritromicina y metronidazol, la resistencia exhibida a estos es de resaltar ya que son antibióticos ampliamente utilizados como terapia empírica para distintos tipos de infecciones diferentes a la causada por H. pylori y están inmersos en la terapia de primera línea propuesta en los diferentes consensos internacionales, y a pesar del aumento de la dosis y la prolongación del tratamiento, la tasa de erradicación no ha podido ser superada (26, 35, 42, 43). Recientemente, una revisión sistemática demostró que las prevalencias de resistencia primaria a los antimicrobianos en adultos latinoamericanos fueron de 12% para claritromicina (n = 35 estudios), 53% para metronidazol (n = 34), 4% para amoxicilina (n = 28), 6% para tetraciclina (n = 20), 3% de furazolidona (n = 6), 15% para las fluoroquinolonas (n = 5), y 8% para resistencia dual de claritromicina y metronidazol (n = 10). Estas prevalencias de resistencia son variables significativamente según el país, lo que conduce a que el esquema de tratamiento de primera línea anti-H. pylori sea ineficaz (44, 45). La exploración a futuro de nuevos esquemas terapéuticos eficaces a nivel local constituye un reto de investigación para la región.
Finalmente, otro aspecto para destacar de la encuesta, y en contraste con las recomendaciones de Maastricht, es que la prueba diagnóstica predilecta de los encuestados para evaluar la erradicación (antígenos fecales monoclonales o test de urea en aliento) fue la endoscopia digestiva alta más biopsia (Giemsa) con un 63% (n = 72), probablemente por su disponibilidad y costo en nuestro país.
En un estudio similar realizado por uno de los autores (46) se encontró que, para ese entonces, en la comunidad médica colombiana existían importantes dificultades para la erradicación de H. pylori. La encuesta realizada hace 5 años tuvo en cuenta una población más amplia al incluir médicos generales, internistas y gastroenterólogos, y el porcentaje de médicos de práctica general fue del 68% (31% en nuestra encuesta), encontrando una amplia gama de esquemas de tratamiento utilizados (41 en total). Llama la atención en esa encuesta que más de la mitad de los médicos utilizaban dentro de sus esquemas metronidazol y usualmente las terapias eran menores a 7 días, además, indicaciones tan claras como la erradicación en úlcera péptica eran seguidas solo por el 30%, lo cual podría sugerir un mejoramiento en la educación del cuerpo médico o un incremento en su actualización con respecto al manejo de la infección (45).
No se tienen otros estudios en nuestra población, sin embargo a nivel mundial se han hecho estudios similares en Alemania, donde se evaluaron médicos familiares y gastroenterólogos, y se encontró que los gastroenterólogos trataban la infección por H. pylori identificando mejor la relación causal entre la infección y la enfermedad asociada, mientras que los médicos familiares mostraron una menor discriminación (47). En Israel también se evaluó a médicos de atención primaria y se encontró que no tenían claro el diagnóstico, el tratamiento y la relación directa con algunas patologías (48); y recientemente en Irán, en donde se evalúo una población de médicos generales e internistas, teniendo mejores resultados los internistas (49), lo cual es congruente con lo encontrado en nuestro país. Se debe tener cuenta que la encuesta fue realizada en miembros de la Asociación Colombiana de Gastroenterología (personal médico con un mayor grado de especialización), además que el conocimiento médico sobre la infección, los antibióticos y los esquemas de tratamiento adecuados ha aumentado gracias a la facilidad en el acceso a la información disponible y actualizada (incluyendo el Maastricht IV) y a una mayor conciencia sobre la importancia del conocimiento de este tópico en nuestros profesionales.
De acuerdo con los propósitos de la encuesta, el estudio ha permitido conocer cuál es la tendencia en el manejo para la erradicación del H. pylori en nuestros profesionales y permitió establecer cómo hay una aceptación y adherencia mayoritaria de las recomendaciones sobre los esquemas de tratamiento del Consenso, aunque se destaca en contraste cómo el seguimiento de la erradicación se realiza mediante endoscopia.
REFERENCIAS
1. Goodwin CS, Worsley BW. Microbiology of Helicobacter pylori. Gastroenterol Clin North Am 1993;22:5-19. [ Links ]
2. Marshall BJ. History of the discovery of C. pylori. In: Campylobacter Pylori in Gastritis and Peptic Ulcer Disease, Blaser MJ (Ed), Igaku-Shoin, New York 1989. p7. [ Links ]
3. Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet 1984;1:1311. [ Links ]
4. Oleastro M, Ménard A. The role of Helicobacter pylori Outer membrane proteins in adherence and pathogenesis. biology. 2013;2:1110-34. [ Links ]
5. Costa F, D'Elios M. Management of Helicobacter pylori infection. Anti Infect Ther 2010;8:887-92. [ Links ]
6. Otero W, Trespalacios A, Otero E. Helicobacter pylori: Current treatment. An important challenge for gastroenterology. Rev Col Gastroenterol 2009;24:280-92. [ Links ]
7. Trespalacios A, Otero W, Mercado M. Helicobacter pylori resistance to metronidazole, clarithromycin and amoxicillin in Colombian patients. Rev Col Gastroenterol 2010;25:31-8. [ Links ]
8. McColl KE. Helicobacter pylori infection. N Engl J Med 2010;362:1597-604. [ Links ]
9. Watari J, Chen N, Amenta PS, Fukui H, Oshima T, Tomita T, et al. Helicobacter pylori associated chronic gastritis, clinical syndromes, precancerous lesions, and pathogenesis of gastric cancer development. World J Gastroenterol 2014;20:5461-73. [ Links ]
10. Garza-González E, Pérez-Pérez GI, Maldonado-Garza HJ, Bosques-Padilla FJ. A review of Helicobacter pylori diagnosis, treatment, and methods to detect eradication. World J Gastroenterol 2014;20:1438-49. [ Links ]
11. Gutiérrez O, Aponte D, Páramo D, Sabbag LC, Angel LA, Cardona H, et al. Seroprevalencia y factores de riesgo asociados con la infección por Helicobacter pylori en niños. Rev Col Gastroenterol 2001;16:19-22. [ Links ]
12. Bravo LE, Cortés A, Carrascal E, Jaramillo R, García LS, Bravo PE, et al. Helicobacter pylori: patología y prevalencia en biopsias gástricas en Colombia. Col Med 2003;34:124-31. [ Links ]
13. Banic M, Franceschi F, Babić Z, Gasbarrini A. Extragastric manifestations of Helicobacter pylori infection. Helicobacter. 2012;17(Suppl 1):49-55. [ Links ]
14. Chen BF, Xu X, Deng Y, Ma SC, Tang LQ, Zhang SB, et al. Relationship between Helicobacter pylori infection and serum interleukin-18 in patients with carotid atherosclerosis. Helicobacter. 2013;18:124-8. [ Links ]
15. Bang CS, Baik GH. Attempts to enhance the eradication rate of Helicobacter pylori infection. World J Gastroenterol 2014;20:5252-62. [ Links ]
16. Malfertheiner P, Venerito M,. Selgrad M. Helicobacter pylori infection: selected aspects in clinical Management. Curr Opin Gastroenterol 2013;29:669-75. [ Links ]
17. O'Connor A, Molina-Infante J, Gisbert JP, O'Morain C. Treatment of Helicobacter pylori infection 2013. Helicobacter 2013;18(Suppl 1):58-65. [ Links ]
18. Graham DY, Fischbach L. Helicobacter pylori treatment in the era of increasing antibiotic resistance. Gut 2010;59:1143-53. [ Links ]
19. Goh KL, Chan WK, Shiota S, Yamaoka Y. Epidemiology of Helicobacter pylori infection and public health implications. Helicobacter 2011;16(Suppl 1):1-9. [ Links ]
20. Dattoli VC, Veiga RV, da Cunha SS, Pontes-de-Carvalho LC, Barreto ML, Alcântara-Neves NM. Seroprevalence and potential risk factors for Helicobacter pylori infection in Brazilian children. Helicobacter. 2010;15:273-8. [ Links ]
21. Fialho AM, Braga AB, Braga Neto MB, Carneiro JG, Rocha AM, Rodrigues MN, et al. Younger siblings play a major role in Helicobacter pylori transmission among children from a low-income community in the Northeast of Brazil. Helicobacter 2010;15:491-6. [ Links ]
22. Trebel K, Rolle-Kampczyk U, Richter M, Kindler A, Richter T, Schlink U. A rigorous small area modelling-study for the Helicobacter pylori epidemiology. Sci Total Environ 2010;408:3931-42. [ Links ]
23. Epplein M, Signorello LB, Zheng W, Peek RM Jr, Michel A, Williams SM, et al. Race, African ancestry, and Helicobacter pylori infection in a low-income United States population. Cancer Epidemiol Biomarkers Prev 2011;20:826-34. [ Links ]
24. Arnold M, Moore SP, Hassler S, Ellison-Loschmann L, Forman D, Bray F. The burden of stomach cancer in indigenous populations: A systematic review and global assessment Gut. 2014;63:64-71. [ Links ]
25. Gómez M, Otero W, Caminos JE. Gastric cancer in young patients in Colombia. Rev Col Gastroenterol 2012;27:166-72. [ Links ]
26. Asaka M, Kato M, Takahashi S, Fukuda Y, Sugiyama T, Ota H, et al. Guidelines for the management of Helicobacter pylori infection in Japan: 2009 revised edition. Helicobacter 2010;15:1-20. [ Links ]
27. Ma JL, Zhang L, Brown LM, Li JY, Shen L, Pan KF, et al. Fifteen-year effects of Helicobacter pylori, garlic, and vitamin treatments on gastric cancer incidence and mortality. J Natl Cancer Inst 2012;104:488-92. [ Links ]
28. Wong BC, Lam SK, Wong WM, Chen JS, Zheng TT, Feng RE, et al. China Gastric Cancer Study Group. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: A randomized controlled trial. JAMA 2004;291:187-94. [ Links ]
29. Fuccio L, Zagari RM, Eusebi LH, Laterza L, Cennamo V, Ceroni L, et al. Meta-analysis: Can Helicobacter pylori eradication treatment reduce the risk for gastric cancer? Ann Intern Med 2009;151:121-28. [ Links ]
30. Osborn JF, Cattaruzza MS, Ferri AM, De Angelis F, Renzi D, Marani A, et al. How long will it take to reduce gastric cancer incidence by eradicating Helicobacter pylori infection? Cancer Prev Res (Phila) 2013;6:695-700. [ Links ]
31. Shiota S, Yamaoka Y. Management of Helicobacter pylori. Med Rep 2010;15:2. pii:20. [ Links ]
32. Bae SE, Jung HY, Kang J, Park YS, Baek S, Jung JH, et al. Effect of Helicobacter pylori eradication on metachronous recurrence after endoscopic resection of gastric neoplasm. Am J Gastroenterol 2014;109:60-7. [ Links ]
33. Bang CS, Baik GH. Attempts to enhance the eradication rate of Helicobacter pylori infection. World J Gastroenterol 2014;20:5252-62. [ Links ]
34. Lansdorp-Vogelaar L, Sharp L. Cost-effectiveness of screening and treating Helicobacter pylori for gastric cancer prevention. Best Pract Res Clin Gastroenterol 2013;27:933-47. [ Links ]
35. Yang JC, Lu CW, Lin CJ. Treatment of Helicobacter pylori infection: Currentstatus and future concepts. World J Gastroenterol 2014;14;20:5283-93. [ Links ]
36. Megraud F, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, et al. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption. Gut 2013;62:34-42. [ Links ]
37. Wu TS, Hu HM, Kuo FC, Kuo CH. Eradication of Helicobacter pylori infection. Kaohsiung J Med Scienc 2014;30:167e1-72. [ Links ]
38. Malfertheiner P, Megraud F, O'Morain CA, Atherton J, Axon AT, Bazzoli F, et al. Management of Helicobacter pylori infection the Maastricht IV/Florence Consensus Report. Gut 2012;61:646-64. [ Links ]
39. Otero Regino W. La importancia de cultivar Helicobacter pylori. Rev Col Gastroenterol 2013;28:87-92. [ Links ]
40. Rimbara E, Fischbach LA, Graham DY. Optimal therapy for Helicobacter pylori infections. Nat Rev Gastroenterol Hepatol 2011;8:79-88. [ Links ]
41. Graham DY, Fischbach L. Helicobacter pylori treatment in the era of increasing antibiotic resistance. Gut 2010;59:1143-53. [ Links ]
42. Hunt RH, Xiao SD, Megraud F, Leon-Barua R, Bazzoli F, van der Merwe S, et al. Helicobacter pylori in developing countries. World Gastroenterology Organisation Global Guideline. J Gastrointestin Liver Dis 2011;20:299-304. [ Links ]
43. Chey WD, Wong BC. American College of Gastroenterology guideline on the management of Helicobacter pylori infection. Am J Gastroenterol 2007;102:1808-25. [ Links ]
44. Camargo MC, García A, Riquelme A, Otero W, Camargo CA, Hernández-García T, et al. The problem of Helicobacter pylori resistance to antibiotics: A systematic review in Latin America. Am J Gastroenterol 2014;109:485-95. [ Links ]
45. Chuah SK, Tsay FW, Hsu PI, Wu DC. A new look at anti-Helicobacter pylori therapy. World J Gastroenterol. 2011;17:3971e5. [ Links ]
46. Gómez M, Otero W, Gutiérrez O. Tratamiento de la infección gástrica con Helicobacter pylori: encuesta a un grupo de médicos generales y especialistas en Colombia/Treatmet of gastric infection with H. pylori. Acta Med Col 2011;26: 273-9. [ Links ]
47. Breuer T, Sudhop T, Goodman KJ. How do practicing clinicians manage Helicobacter pylori-related gastrointestinal diseases in Germany? Helicobacter. 1998;1:1-8. [ Links ]
48. Shirin H, Birkenfeld S, Shevah O, Levine A, Epstein J, Boaz M, et al. Application of Maastricht 2-2000 Guidelines for the Management of Helicobacter pylori Among Specialists and Primary Care Physicians in Israel: Are We Missing the Malignant Potential of Helicobacter pylori? J Clinic Gastroenterol 2004;4:322-5. [ Links ]
49. Ghanaei FM, Joukar F, Soati M, Gharib S, et al. Knowledge and Practice of General Practitioners and Internists about Helicobacter pylori infection in Guilan, Iran. Middle East J Diges Diseases 2011;3:119-25. [ Links ]











 text in
text in