Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista colombiana de Gastroenterología
versão impressa ISSN 0120-9957
Rev Col Gastroenterol vol.30 no.1 Bogotá jan./mar. 2015
Estenosis esofágica por Histoplasma: manejo con prótesis metálica autoexpandible
René Marcelo Escobar P. MD. (1), Mónica Restrepo J, MD. (2)
(1) Especialista en Cirugía Gastrointestinal y Endoscopia Digestiva. Hospital Universitario San Vicente Fundación, Medellín, Colombia. Correo electrónico: remar_med@hotmail.com
(2) Residente Segundo Año Cirugía General. Universidad de Antioquia, Medellín, Colombia. Correo electrónico: monica626_1@hotmail.com
Fecha recibido: 03-05-14 Fecha aceptado: 02-02-15
Resumen
Las estenosis esofágicas benignas son una causa común de consulta en los servicios de endoscopia y gastroenterología. Usualmente, dada su naturaleza no neoplásica, estas se han manejado con dilataciones endoscópicas a repetición, incómodas y costosas para el paciente, dada su constante repetición; además de tener siempre el riesgo de perforación esofágica en cada sesión. El uso de prótesis esofágicas para manejo de las estenosis esofágicas benignas viene en progresivo aumento con resultados prometedores para varias de las etiologías de este tipo de obstrucciones. Presentamos el caso de una estenosis esofágica benigna secundaria a infección por Histoplasma capsulatum, manejada con una prótesis metálica totalmente cubierta con resolución completa de la obstrucción.
Palabras clave
Histoplasma capsulatum, estenosis esofágica benigna, prótesis esofágica.
INTRODUCCIÓN
Las infecciones esofágicas por gérmenes oportunistas han aumentado su frecuencia debido al incremento en el número de pacientes con algún grado de inmunosupresión. La más frecuente es la infección por Candida albicans, aunque otros hongos reportados como causantes de infección son Aspergillus, Histoplasma y Blastomyces, que deben ser considerados en pacientes con mayor grado de inmunosupresión o que no respondan al tratamiento antibiótico.
Después de este tipo de infecciones, se han reportado varios casos de estenosis esofágicas manejados usualmente con dilataciones endoscópicas seriadas y/o cirugía. El advenimiento de prótesis esofágicas ha logrado evitar las complicaciones de las dilataciones seriadas con resultados satisfactorios en estenosis esofágicas malignas; sin embargo, en las estenosis benignas aún falta demostrar de manera convincente sus grandes ventajas.
DESCRIPCIÓN DEL CASO CLÍNICO
Paciente de 24 años de edad, residente del área rural del departamento de Antioquia, Colombia, quien consultó al Hospital Universitario San Vicente Fundación de Medellín (Colombia) por cuadro clínico de 2 meses de evolución de astenia, adinamia y hemiparesia izquierda, asociado con pérdida de peso, diaforesis nocturna, fiebre, deposiciones diarreicas, incontinencia urinaria y dolor abdominal en epigastrio. En los 8 días previos presentó pérdida del apetito, lesiones blanquecinas en la boca, odinofagia, lesiones hiperpigmentadas en el brazo izquierdo e hipopigmentadas en las piernas.
Antecedentes personales
Consumo de canabinoides y tabaquismo desde los 14 años de edad, relaciones heterosexuales con 3 parejas desde que inició actividad sexual, sin uso de preservativo. Trauma craneoencefálico y sobredosis de fármacos, hace 2 años.
El examen físico fue estable hemodinámicamente, febril, caquéctico, con adenopatías en cuello, axila derecha y en fosas poplíteas. Cavidad oral con lesiones blanquecinas compatibles con Muguet. Pulmones con crépitos generalizados. A la evaluación neurológica, el paciente reveló desorientación en lugar, brazo izquierdo hipertónico y espástico, con músculos hipertróficos en las cuatro extremidades. Movimientos de la cara simétricos con disminución de la fuerza al lado izquierdo, al igual que en extremidades. Lesiones redondeadas e hiperpigmentadas de 0,5 cm en brazo y mano izquierdos. Lesiones ulceradas en el pene. Condilomas planos en la región anal.
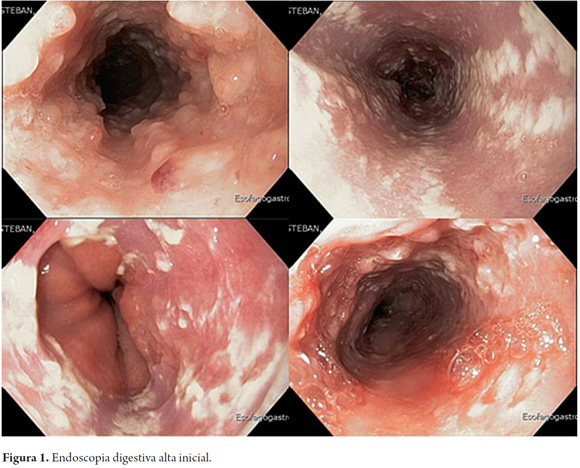
Se realizó endoscopia (figura 1) que reportó mucosa esofágica del tercio superior y medio con severa inflamación circunferencial, presencia de úlceras de 3 y 6 mm con fibrina y pseudopólipos inflamatorios, friabilidad y sangrado fácil. En el tercio distal se observan lesiones algodonosas que no desprenden con el lavado ni son compatibles con Candida. Se tomaron muestras de las lesiones mencionadas para patología y microbiología.
Se hizo diagnóstico de sida de novo con 67 400 copias del virus y 73 CD4 con neurosífilis y candidiasis oral y esofágica. Las biopsias y los cultivos de esófago y colon reportaron compromiso por Histoplasma capsulatum. Inició tratamiento antirretroviral y fluconazol, aunque requirió cambio a anfotericina B por toxicidad hepática.
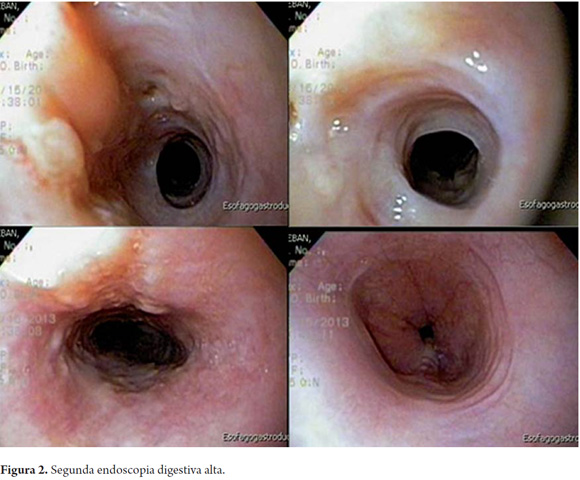
A los 15 días de inicio del tratamiento presentó disfagia y fiebre elevada por lo que se realizó nueva endoscopia (figura 2), que reportó: mucosa esofágica con mejoría completa de las lesiones (aunque revisando las imágenes de dicha endoscopia, ya parece haber estenosis). Se dio de alta con tratamiento antimicótico ambulatorio con voriconazol oral. Veinte días después, reingresa por disfagia progresiva hasta líquidos y sialorrea.
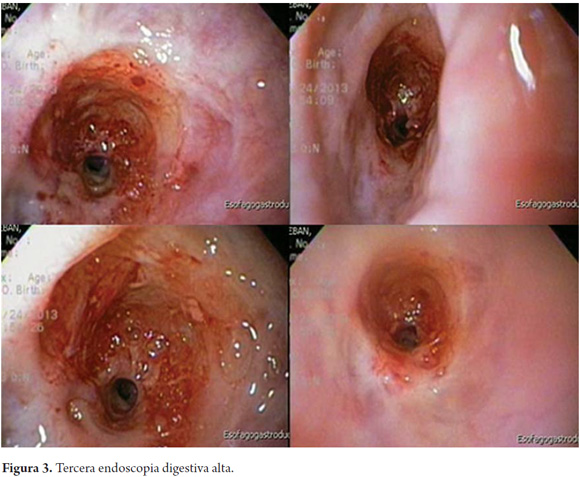
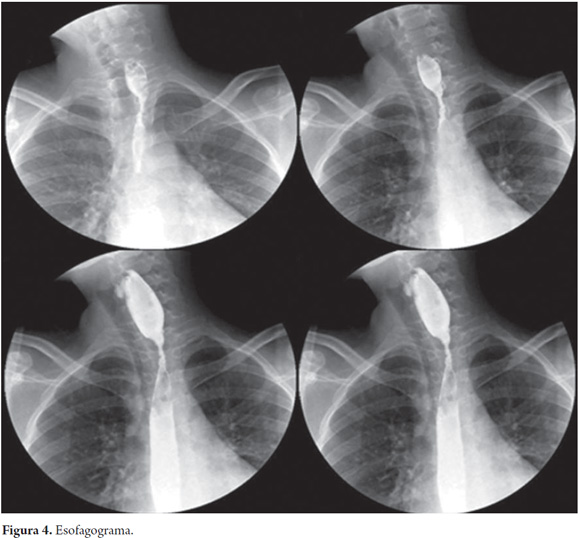
Se realizó endoscopia (figura 3) y a los 20 cm de la arcada dentaria se observó una disminución marcada de la luz en forma concéntrica con un diámetro de 5 mm, lo que imposibilitó el avance del endoscopio, con área circundante a la estenosis de aspecto fibroso. Se realizó esofagograma que confirma estenosis esofágica de aproximadamente 3 cm de longitud sin dilatación preestenótica (figura 4).
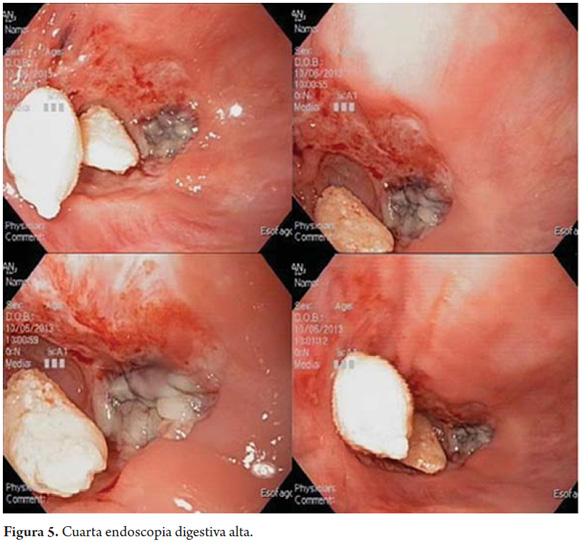
El paciente es dado de alta con dieta supraglótica y orden para manejo ambulatorio con dilataciones endoscópicas y tratamiento antimicótico. Sin embargo, reingresa nuevamente a los 6 días del egreso por disfagia severa. Se realizó endoscopia (figura 5) y a los 19 cm de la arcada dentaria se encontró una estenosis concéntrica, puntiforme, no franqueable del esófago, con un área necrótica en la pared lateral derecha y una gran cantidad de nódulos entre 2 y 4 mm en el resto de la circunferencia de la estenosis, los cuales se sobreponen a una mucosa ulcerada.
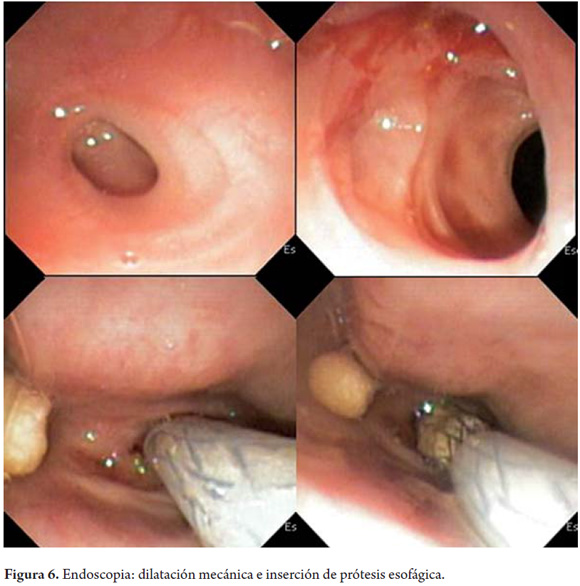
En ese momento se decidió no realizar ninguna dilatación endoscópica y se llevó a cabo una gastrostomía abierta para garantizar una vía oral adecuada y vigilar la evolución del área necrótica en el esófago. Se realizó endoscopia de control a los 20 días (figura 6) y se encontró estenosis concéntrica puntiforme del esófago, de unos 3 mm de diámetro, la cual tiene una mucosa eritematosa y resolución completa del área necrótica. Bajo guía endoscópica y con fluoroscopia se inyectó medio de contraste que permitió observar la estenosis de +/-3 cm de longitud.
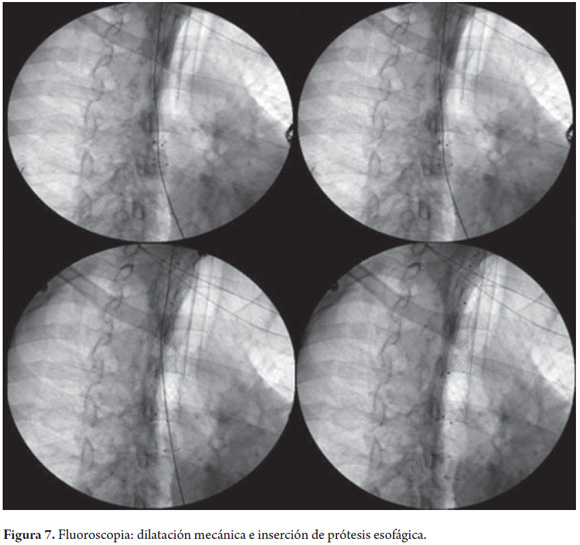
Asimismo se realizaron dilataciones con bujías de Savary Miller de 5, 7 y 9 mm. Con endoscopio neonatal se logró franquear la estenosis sin problemas que permitió observar un esófago medio y distal de calibre y mucosa normal. Finalmente, se liberó prótesis esofágica metálica autoexpandible totalmente cubierta de 8 cm x 16 mm (TecnoStent, Medellín, Colombia) sin complicación (figura 7). El paciente toleró de manera adecuada la alimentación por vía oral, se le retiro la sonda de gastrostomía y continuó con el tratamiento antimicótico y antirretroviral.
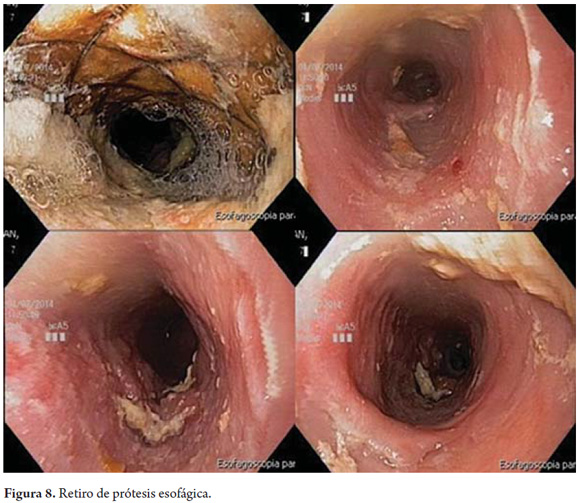
5 meses después se realizó endoscopia digestiva alta (figura 8) en la que se observó a los 17 cm de la AD el borde proximal de la prótesis esofágica, la cual se encuentra bien expandida, con escasos restos alimentarios adheridos a la pared interior. Se avanzó sin inconveniente hasta el esófago distal, que tenía un aspecto normal. Se retiró la prótesis con facilidad y sin complicación. En la revisión endoscópica se evidenció esófago de calibre uniforme en toda su extensión sin evidencia de estenosis. En el área cubierta por la prótesis, se observaron cambios propios del engrosamiento mucoso secundario a la presencia del cuerpo extraño. No se evidencian hallazgos de infección micótica o viral activa. El esófago insufla adecuadamente, por lo cual no hubo sospecha de perforación.
El paciente continuó recibiendo alimentación normal por vía oral y siguió con el tratamiento antirretroviral y antimicótico programado para 12 meses de duración.
DISCUSIÓN
Las infecciones esofágicas por gérmenes oportunistas, especialmente Candida albicans, herpes simple, citomegalovirus y otros hongos, han aumentado su frecuencia a medida que lo ha hecho el número de pacientes inmunodeprimidos, a consecuencia de la infección por el virus de inmunodeficiencia humana u otros tratamientos inmunosupresores, siendo la candidiasis la de mayor número de casos (1-3).
En el 50% de los casos, las infecciones micóticas del esófago evolucionan de forma asintomática. Cuando generan algún tipo de problema, los síntomas más frecuentes son odinofagia de inicio brusco con o sin disfagia, muguet orofaríngeo, dolor retroesternal, náuseas, pirosis, hemorragia digestiva y, con mucha menor frecuencia, fiebre, sepsis, formación de abscesos y obstrucción esofágica. En los pacientes inmunosuprimidos no es infrecuente encontrar varios órganos comprometidos por la misma infección micótica (4-6).
Para el diagnóstico, debe existir una clínica compatible que puede estar asociada con la presencia de lesiones en la cavidad oral y unos hallazgos en la endoscopia (7) que permitan hacer la graduación de las lesiones según la gravedad de estas. Específicamente, para la candidiasis, se usa una clásica graduación en:
a. Placas blanquecinas menores de 2 mm, escasas, sin úlceras
b. Placas blanquecinas mayores de 2 mm, múltiples, sin úlceras
c. Placas confluyentes, lineales, con ulceraciones
d. Similar al anterior, con estenosis asociada
Otros hongos que también han sido reportados como causantes son Aspergillus, Histoplasma, Blastomyces y otras especies de Candida. Usualmente estos afectan a pacientes con mayor grado de inmunosupresión. El Aspergillus afecta fundamentalmente al pulmón y, en pacientes muy inmunodeprimidos, puede afectar directamente o por contigüidad al esófago y otros órganos vecinos. Debe considerarse en casos de esofagitis asumidas como candidiásicas que no responden al tratamiento. El Histoplasma y el Blastomyces afectan usualmente a los ganglios mediastínicos y, por continuidad, al esófago, lo cual podría derivar en disfagia por compresión. Sin embargo, existen casos de histoplasmosis diseminadas con compromiso primario del esófago.
Para una completa certeza diagnóstica, se debe llevar a cabo el estudio histológico y microbiológico del esófago, obtenido mediante biopsias o cepillado dirigidos por endoscopia o incluso a ciegas. Para el diagnóstico es necesario que el hongo se encuentre en forma de hifas o levaduras y esté mezclado con células epiteliales que causen reacción inflamatoria. Es importante mencionar que el rendimiento de la citología es bastante adecuado y que el cultivo del cepillado o de la biopsia tiene un alto porcentaje de positividades (8), aunque, en ocasiones, no permite diferenciar entre flora normal o colonización e infección, por lo que todo debe analizarse en el contexto de cada paciente.
El tratamiento en pacientes con inmunidad relativamente conservada incluye antimicóticos no absorbibles como nistatina o clotrimazol. En pacientes con infección por VIH se usan antimicóticos absorbibles administrados por vía oral: fluconazol, ketoconazol, voriconazol y, si la deglución es imposible, puede usarse fluconazol o anfotericina B por vía parenteral.
Como profilaxis de las recidivas puede usarse fluconazol, ketoconazol o anfotericina B oral. En pacientes neutropénicos, el riesgo de diseminación es alto, por lo que debe instaurarse una terapia agresiva con antimicóticos por vía parenteral como anfotericina B con precisa monitorización de la función renal. En casos extremos, puede asociarse con 5-fluorocitosina (1-6). En la literatura se han reportado múltiples casos de estenosis esofágica secundaria a infecciones micóticas con diferentes desenlaces y diferentes opciones de tratamiento farmacológico (9-17).
El manejo de las estenosis esofágicas benignas comporta cambios importantes en los últimos años. Es lógico pensar que, en la estenosis causada por un agente infeccioso, el tratamiento básico sea la erradicación de la infección con el tratamiento farmacológico por el tiempo que esté indicado. Sin embargo, dado que estos pacientes inmunosuprimidos cursan con disfagia y posterior desnutrición, la conducta usual con esta complicación es mantener al paciente en un programa de dilataciones mecánicas o neumáticas hasta lograr el objetivo en el que el paciente retorne a la vía oral normal después de algunos meses. Se reserva el manejo quirúrgico para los casos que no tuvieron mejoría con las dilataciones o tuvieron perforación durante su realización.
Con el advenimiento de las prótesis esofágicas cubiertas, un gran número de pacientes, cada vez mayor, con estenosis esofágicas benignas de origen péptico, actínico e infeccioso, ha sido manejado de manera satisfactoria evitando la necesidad de dilataciones periódicas y de grandes cirugías (18, 19).
El caso clínico que presentamos incluye una histoplasmosis diseminada en un paciente VIH positivo con sida en estadio clínico C3. En la literatura publicada en PubMed se encontraron solo dos casos de estenosis esofágicas secundarias al compromiso infeccioso por este germen (20, 21).
En particular, el hecho de tener un área necrótica puntual, justo al lado de la estenosis, fue lo que motivó a no realizar las dilataciones endoscópicas usuales y a insertar una prótesis esofágica cubierta. El resultado definitivo fue satisfactorio y se logró el retorno rápido del paciente a una dieta normal e, igualmente, de manera rápida, se le retiró la sonda de gastrostomía. Cinco meses después de la inserción de la prótesis, la estenosis estuvo totalmente resuelta y el paciente continúo recibiendo el tratamiento antimicótico ordenado 18-19).
En conclusión, podemos mencionar que las prótesis esofágicas cubiertas tienen un papel cada vez mayor y más determinante en el manejo de las estenosis benignas del esófago y que, usadas mucho más temprano en la evolución de los pacientes, favorecen e incluso garantizan una más rápida solución a los problemas clínicos, a la vez que disminuyen la tasa de complicaciones de las sesiones repetidas de dilatación (22, 23).
REFERENCIAS
1. Barros C, Berenguer J, Gutiérrez F. Treatment of opportunistic infections in adolescent and adult patients infected by the human immunodeficiency virus during the era of highly active retroviral therapy. Guidelines of the AIDS Study Group (GESIDA)/National AIDS Plan. Enferm Infecc Microbiol Clin 2008;26:356-79. [ Links ]
2. Böhme A, Ruhnke M, Buchheidt D, et al. Treatment of fungal infections in hematology and oncology. Ann Hematol 2003;82(Suppl 2):S133-40. [ Links ]
3. San Juan R, Aguado J, Lumbreras C. Incidence, clinical characteristics, and risk factors of late infection in solid organ transplant recipients: data from the RESISTRA Study Group. Am J Transplant 2007;7:964-71. [ Links ]
4. Slavin M, Szer J, Grigg A. Guidelines for the use of antifungal agents in the treatment of invasive Candida and mould infections. Intern Med J 2004;34:192-200. [ Links ]
5. Vazquez J. Optimal management of oropharyngeal and esophageal candidiasis in patients living with VIH infection. HIV/AIDS Research Palliative Care 2010;2:89-101. [ Links ]
6. Corti M, Villafañe M. The compromise of esophagus in HIV/AIDS diseases. Acta Gastroenterol Latinoam 2003;33(4):211-20. [ Links ]
7. Werneck-Silva A, Bedin I. Role of upper endoscopy in diagnosing opportunistic infections in human immunodeficiency virus-infected patients. World J Gastroenterol 2009;15:1050-6. [ Links ]
8. Wilcox C, Rodgers W, Lanzeby A. Prospective comparison of brush cytology, viral culture, and histology for the diagnosis of ulcerative esophagitis in AIDS. Clin Gastroenterol Hepatol 2004;2:564-7. [ Links ]
9. Chandrasekhara V, Zhang L, Floyd B, Kochman M. A rare cause of esophageal strictures: Actinomyces. Gastrointest Endosc 201275(5):1111-2. [ Links ]
10. Hyun J, Chun H, Keum B, Seo Y, Kim Y, Jeen Y, et al. Candida esophagitis complicated by esophageal stricture. Endoscopy 2010;42(Suppl 2):E180-1. [ Links ]
11. Dahl C, Fuursted K, Schrøder H. A paediatric case of Candida pericarditis and eosophagus stricture during treatment for acute lymphatic leukaemia. Actal Oncol 2007;46(6):859-61. [ Links ]
12. Sion M, Armenaka M, Georgiadis I, Paraskevopoulos G, Nikolaidis I. Aspergillus fumigatus abscesses of the thyroid with obstruction of the esophagus. Thyroid 2004;14(9):786-8. [ Links ]
13. Lingelbach A, Seidl H, Frimberger E, Traidl-Hoffmann C, Ring J, Hoffmann H. Chronic mucocutaneous candidiasis with severe esophageal stricture. Mycoses 2003;46(Suppl 1):15-8. [ Links ]
14. Kim B, Cho S, Rha S, Choi H, Choi K, Cha S, et al. Esophagomediastinal fistula and esophageal stricture as a complication of esophageal candidiasis: a case report. Gastrointest Endosc 2000;52(6):772-5. [ Links ]
15. Diotallevi P, Lacopini G, Montella F, Lauria F, Simili C. Candida esophageal stenosis in an HIV+ patient. Diagnostic imaging and palliative treatment with balloon catheter. Radiol Med 1996;92(1-2):159-61. [ Links ]
16. Kimura H, Kurachi M, Tsukioka Y, Minani M, Itou M, Fujii H, et al. Esophageal stricture secondary to candidiasis without underlying disease. J Gastroenterol 1995;30(4):508-11. [ Links ]
17. Simon G, Rákóczy G, Galgóczy J, Verebély T, Bókay J. Acremonium kiliense in oesophagus stenosis. Mycoses 1991;34(5-6):257-60. [ Links ]
18. Dua K. Expandable stents for benign esophageal disease. Gastrointest Endosc Clin N Am 2011;21(3):359-76. [ Links ]
19. Hirdes M, Vleggaar F, Siersema P. Stent placement for esophageal strictures: an update. Expert Rev Med Devices 2011;8(6):733-55. [ Links ]
20. Hull P. Systemic histoplasmosis with oesophageal obstruction due to Histoplasma granulomas. Successful treatment with rifampicin and amphotericin B. S Afr Med J 1979;14;55(16):639-40. [ Links ]
21. Marshall J, Singh R, Demmy T, Bickel J, Everett E. Mediastinal histoplasmosis presenting with esophageal involvement and dysphagia: case study. Dysphagia 1995;10(1):53-8. [ Links ]
22. Wilson J, Louie B, Farivar A, Vallières E, Aye R. Fully covered self-expanding metal stents are effective for benign esophagogastric disruptions and strictures. J Gastrointest Surg 2013;17(12):2045-50. [ Links ]
23. Van Halsema E, Wong K, Baron T, Siersema P, Vleggaar F, Ginsberg G, et al. Safety of endoscopic removal of self-expandable stents after treatment of benign esophageal diseases. Gastrointest Endosc 2013;77(1):18-28. [ Links ]











 texto em
texto em