Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.30 no.2 Bogotá Apr./June 2015
Patogenia, diagnóstico y tratamiento de la disfunción renal en cirrosis
Rolando José Ortega Quiroz MD. (1), Luis Gonzalo Guevara Casallas MD. (2), Jaime Holguín Rojas M. (3), Adalgiza Reyes Romero MD. MSc. (4), Jhon Edinson Prieto Ortiz MD. (5)
(1) Medicina Interna, Gastroenterología, Hepatología Clínica. Research Fellow, Instituto de Investigaciones Biomédicas "August Pi i Sunier", Universidad de Barcelona. Director, División de Hepatología, Clínica General del Norte, Barranquilla, Colombia. Instituto de Investigaciones Biomédicas, Facultad de Ciencias de la Salud, Universidad de San Buenaventura. Cartagena, Colombia. Correo electrónico: rolandoortegaquiroz@gmail.com.
(2) Medicina Interna, Gastroenterología, Hepatología Clínica. Director, Gastroenterología y Hepatología Clínica, Hospital Universitario San Vicente de Paúl. Medellín, Colombia.
(3) Medicina Interna, Hepatología Clínica. Profesor Universidad del Valle. Director, División de Hepatología, Clínica Imbanaco. Cali, Colombia.
(4) Fellow de Cirugía Hepática y Trasplante. Hospital Cliníc, Universidad de Barcelona.
(5) Medicina Interna, Gastroenterología, Hepatología Clínica. Hepatólogo, Organización Sanitas. Profesor, Fundación Universitaria Sanitas. Bogotá, Colombia.
Fecha recibido: 17-07-14 Fecha aceptado: 06-04-15
Resumen
Los pacientes con cirrosis hepática son susceptibles a presentar un deterioro de la función renal que puede ser de naturaleza funcional y/o estructural. La insuficiencia renal aguda (IRA) prerrenal representa la forma más frecuente en el 68% de los casos, e incluye un tipo especial de insuficiencia renal funcional conocida como síndrome hepatorrenal (SHR). La creatinina sérica permanece como el mejor biomarcador de IRA en cirrosis a pesar de sus reconocidas limitaciones. La diferenciación entre necrosis tubular aguda (NTA) y SHR se puede establecer con el uso de biomarcadores urinarios como la uNGAL. Los factores de riesgo de IRA en cirrosis incluyen las infecciones bacterianas, la hemorragia digestiva, las pérdidas de líquidos gastrointestinales y renales, la paracentesis sin albúmina y los agentes nefrotóxicos, entre otros. Los nuevos criterios por estadios de la AKI-IAC para el diagnóstico de IRA en cirrosis, que inician por un aumento de la creatinina sérica ≥0,3 mg/dL en menos de 48 horas, mejoran el pronóstico de los pacientes al permitir una intervención más temprana. El diagnóstico del SHR se establece al excluir las causas de azoemia prerrenal, NTA y expandir el volumen con albúmina. El uso de vasoconstrictores esplácnicos, como la terlipresina junto con la albúmina, permite revertir hasta el 40% de los casos de SHR. El trasplante hepático representa el tratamiento definitivo en pacientes con SHR.
Palabras clave
Insuficiencia renal aguda, infecciones, síndrome hepatorrenal, vasoconstrictores esplácnicos, albúmina.
INTRODUCCIÓN Y GENERALIDADES
La cirrosis representa el estadio más avanzado de la enfermedad hepática crónica y se caracteriza por un proceso fibrótico difuso, formación de nódulos y microtrombosis que ocasionan en conjunto cambios en la arquitectura hepática. Constituye la quinta causa de mortalidad en el Reino Unido, la duodécima causa de mortalidad en Estados Unidos y la sexta causa de mortalidad global. Sin embargo, hasta un 40% de los casos puede ser diagnosticado en fases tempranas en las que la enfermedad se encuentra compensada y las intervenciones farmacológicas permiten mejorar su expectativa de vida (1, 2).
Los pacientes con cirrosis hepática pueden presentar complicaciones importantes en el curso de la enfermedad tales como sangrado variceal, ascitis, infecciones, encefalopatía hepática y hepatocarcinoma (3, 4). Su aparición afecta la sobrevida y permite definir cinco estadios pronósticos: el estadio 1, con ausencia de várices, y el estadio 2, con presencia de várices (corresponden a una cirrosis compensada), tienen mortalidad a 1 año del 1% y 3,4%, respectivamente. El estadio 3, con aparición de ascitis, y el estadio 4, con sangrado variceal (corresponden a una cirrosis descompensada), tienen mortalidad del 20% y 57% a 1 año, respectivamente (5). El estadio 5 se relaciona con las infecciones bacterianas, cuya mortalidad alcanza un 63% al año (6).
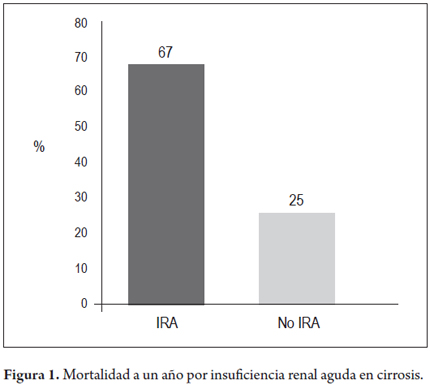
La disfunción renal representa una complicación común de la cirrosis hepática descompensada, con importantes implicaciones en la morbilidad y en la mortalidad. Durante la hospitalización, los pacientes con insuficiencia renal aguda (IRA) presentan con más frecuencia insuficiencia respiratoria, deterioro cardiovascular y un mayor tiempo de estancia en la unidad de cuidados intensivos (UCI) (7). Un estudio reciente, con 5969 pacientes (1827 con insuficiencia renal y 4142 sin insuficiencia renal), confirmó que los cirróticos con insuficiencia renal tienen una mortalidad global del 67% (58% a 1 mes y 63% a 12 meses), por lo que se constituye como la complicación más severa de esta enfermedad (figura 1) (8). La insuficiencia renal pretrasplante constituye un fuerte predictor independiente de mortalidad en los siguientes 12 meses después del trasplante (9). La etiología de la insuficiencia renal en la cirrosis puede ser de naturaleza funcional y/o estructural. El espectro de lesiones renales estructurales ha sido estudiado por histopatología utilizando biopsias transyugulares, donde se observan alteraciones glomerulares (nefropatía mesangial por IgA, glomerulonefritis), no glomerulares (nefritis tubulointersticial crónica y aguda, endarteritis fibrosa) y cambios relacionados con nefropatía diabética (10, 11). Es posible identificar una serie de condiciones renales asociadas con enfermedades hepáticas que tienen implicaciones en la presentación clínica y en su evolución (12, 13). Las más importantes se mencionan en la tabla 1.
La IRA puede presentarse hasta en un 20% de los pacientes cirróticos hospitalizados. La causa más común es prerrenal por hipoperfusión en un 68% de los casos, de los cuales el 45% mejora con la expansión de volumen, lo que representa una verdadera azoemia prerrenal, y un 23% no mejora, lo que corresponde a los pacientes con síndrome hepatorrenal (SHR). La insuficiencia renal intrínseca (necrosis tubular aguda [NTA] y glomerulonefritis) representa un 32% y la posrenal, menos del 1% (14-16).
El SHR es un tipo de insuficiencia prerrenal funcional severa (23% de los casos de insuficiencia prerrenal) y potencialmente fatal que ocurre en pacientes con cirrosis avanzada. Se caracteriza por un rápido deterioro de la función renal en el contexto de cambios en la hemodinámica sistémica, manifestados por vasodilatación en el lecho vascular esplácnico, disminución de la presión arterial, un gasto cardíaco insuficiente, liberación de vasoconstrictores e isquemia renal (17, 18).
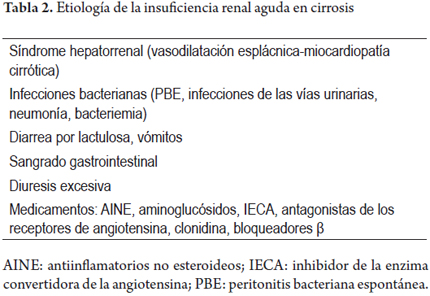
Las principales causas de IRA en los pacientes con cirrosis pueden apreciarse en la tabla 2.
La etiología de la insuficiencia renal en la cirrosis tiene implicaciones pronósticas, tal y como ha sido demostrado en un estudio reciente que incluyó 463 pacientes, de los cuales el 46% estaba relacionado con infecciones; 32%, con hipovolemia; 13%, con SHR; y 9%, con nefropatía parenquimatosa. La probabilidad de sobrevida a 3 meses fue del 73% en nefropatía parenquimatosa; 46%, para IRA por hipovolemia; 31%, en IRA por infecciones; y 15%, en pacientes con SHR (19).
Diagnóstico de insuficiencia renal aguda en cirrosis
La creatinina sérica (sCr) es el método más simple y ampliamente utilizado como biomarcador de la función renal en la población general. Su inclusión en la escala MELD, junto con la bilirrubina y el INR, hacen de la creatinina un marcador muy importante en cirrosis, lo que resalta el significado pronóstico de las interacciones entre la función hepática y la función renal. Sin embargo, la creatinina debe ser interpretada con precaución ya que tiende a sobrestimar la función renal en los cirróticos. Lo anterior se relaciona con el hecho de que los pacientes con cirrosis pueden tener valores falsamente reducidos de creatinina debido a una combinación de factores como una baja ingesta proteica, la pérdida de masa muscular con disminución de la síntesis de creatina, un mayor volumen de distribución por ascitis y finalmente la interferencia en los ensayos de creatinina en presencia de una elevación de la bilirrubina. Las ecuaciones basadas en la creatinina para calcular el filtrado glomerular, como la de Cockcroft, el MDRD y el CKD-EPI, son inseguras en cirrosis y tienden a sobrestimar el valor real, lo cual estaría también en relación con variaciones relacionadas con la edad, el peso y la raza incluidas en estas fórmulas. La medición del aclaramiento de marcadores exógenos como la inulina (estándar de oro ya que la inulina es filtrada por los glomérulos y no es secretada, reabsorbida, metabolizada o sintetizada por los riñones) requiere infusión continua y recolección durante varias horas de orina, lo que la hacen poco práctica. Las sustancias radiolábiles (Cr-EDTA, Tc-DPTA, I-iotalamato) y no radioactivas (iohexol, iotalamato) se administran en dosis única y no requieren recolección de orina, aunque no han sido probadas ampliamente en cirrosis. La cistatina C es una proteína de bajo peso molecular producida a una tasa constante en todas las células nucleadas; se elimina exclusivamente por filtración glomerular después de lo cual es reabsorbida y catabolizada por las células tubulares renales. A diferencia de la creatinina, no está influenciada por la edad, el sexo, la masa muscular y el nivel de bilirrubina. Un cut-off de 1,25 mg/dL es similar para el diagnóstico de IRA en cirróticos y no cirróticos. Sin embargo, el costo es más alto comparado con la creatinina, requiere mayor estandarización, está influenciada por infecciones y por medicamentos como corticoides, inhibidores de la enzima convertidora de la angiotensina (IECA) e inhibidores de la calcineurina (20, 21).
La diferenciación entre una NTA y el SHR se dificulta por la poca especificidad de los marcadores clásicos de daño tubular, como el sodio urinario, la fracción de excreción de sodio, la presencia de cilindros y/o células epiteliales tubulares. Debido a lo anterior, se han ensayado diferentes biomarcadores urinarios tales como la molécula de daño renal (KIM-1), la proteína ligadora de ácidos grasos de tipo cardíaco (H-FABP), la interleucina 18 (IL-18) y la lipocalina asociada con la gelatinasa de neutrófilos (uNGAL). Esta última es una proteína de 25 kDa que puede expresarse en varios tejidos y aumenta rápidamente en la orina de pacientes con IRA. Al requerir condiciones de conservación y depósito más fáciles en comparación con los demás biomarcadores, podría ser confiablemente incorporada en la práctica clínica. Debe tenerse en cuenta que las infecciones de vías urinarias pueden dar valores falsamente elevados (22, 23). La uNGAL ha sido evaluada en estudios de pacientes con cirrosis, lo que permite diferenciar entre NTA (valores mayores de 400 µg/g creatinina) y SHR tipo 1 (70-100 µg/g creatinina). Los pacientes con SHR tipo 1 e infecciones bacterianas tienen valores más elevados de uNGAL en comparación con aquellos sin infecciones. Los pacientes con SHR tipo 2 (estable) y los pacientes con azoemia prerrenal tienen valores similares de uNGAL muy por debajo de los dos grupos anteriores (20 µg/g creatinina) (24). Los niveles de uNGAL en el rango de SHR son predictores independientes de mortalidad (25). La incorporación de los biomarcadores de NTA en la práctica clínica tiene el potencial de permitir guiar el tratamiento al establecer el diagnóstico en los pacientes con lesión estructural subyacente. Más estudios son necesarios en pacientes con SHR (26).
FISIOPATOGENIA DE LA INSUFICIENCIA RENAL FUNCIONAL EN CIRROSIS
La naturaleza funcional del SHR ha sido establecida por la ausencia de cambios estructurales significativos a nivel de la histología renal, la normalización o mejoría de la función renal después del trasplante y la reversibilidad con el tratamiento farmacológico. En los pacientes con cirrosis se produce un estado circulatorio hiperdinámico que se caracteriza por un aumento del gasto cardíaco, un incremento de la frecuencia cardíaca y una disminución de las resistencias vasculares sistémicas. La principal causa de la disminución de la función renal que conduce al SHR es una alteración de la función circulatoria ocasionada por una vasodilatación en el lecho esplácnico secundaria a la hipertensión portal. Lo anterior se relaciona con una producción masiva de óxido nítrico (shear stress), endocanabinoides y monóxido de carbono. A medida que avanza la cirrosis se produce una translocación de productos bacterianos a los ganglios linfáticos mesentéricos que ocasiona una respuesta inflamatoria con liberación de citocinas que favorecen la vasodilatación esplácnica y sistémica (27-29).
En estadios tempranos de la cirrosis, cuando la hipertensión portal es moderada, se produce un aumento del gasto cardíaco que compensa la disminución de las resistencias vasculares sistémicas, lo que permite que la presión arterial y el volumen circulante efectivo se mantengan dentro de límites normales. A medida que avanza la cirrosis, la vasodilatación esplácnica aumenta notoriamente en respuesta a una mayor translocación bacteriana con liberación masiva de sustancias vasodilatadoras, neoangiogénesis en las arterias mesentéricas y una disminución en la respuesta a los vasoconstrictores (30, 31). Lo anterior ocasiona una disminución severa del volumen circulante efectivo que no puede ser compensada por un aumento del gasto cardíaco, el cual podría estar incluso disminuido por una respuesta contráctil reducida ante el estrés, fenómeno conocido como miocardiopatía cirrótica (32). En esta fase, la presión arterial se mantiene por la activación de sistemas vasoconstrictores neurohormonales, estimulados por barorreceptores en la circulación central. El sistema renina-angiotensina-aldosterona, el sistema nervioso simpático y la hipersecreción no osmótica de ADH mantienen la presión arterial aunque tienen efectos deletéreos sobre la función renal, como la retención de sodio, que produce ascitis y edemas, la retención de agua libre, que ocasiona hiponatremia hipervolémica, y la vasoconstricción de la circulación renal, que reduce el flujo sanguíneo, el filtrado glomerular y conduce a insuficiencia renal. En respuesta a la vasoconstricción renal, inicialmente se produce la liberación intrarrenal de vasodilatadores como la adenosina, la kalikreínas y las prostaglandinas, lo que hace a estos pacientes muy sensibles a los antiinflamatorios no esteroideos (AINE). Ulteriormente la hipoperfusión renal sostenida conduce a la liberación intrarrenal de sustancias vasoconstrictoras como el tromboxano A2, los leucotrienos, los F2-isoprostanos y la endotelina 1, perpetuándose así el daño renal. Otros lechos extrarrenales como el hepático, el cerebral y los suprarrenales permanecen también vasoconstreñidos, lo que se manifiesta con un aumento de la presión portal, encefalopatía e insuficiencia suprarrenal (33, 34).
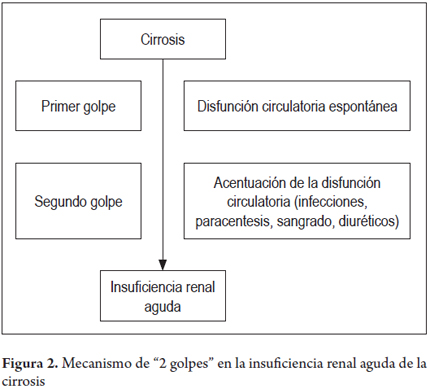
Los pacientes cirróticos con disfunción circulatoria espontánea (primer golpe), manifestada por una hipovolemia efectiva, aumento de la actividad de los sistemas vasoconstrictores y una respuesta inflamatoria sistémica, son más susceptibles a una NTA y a SHR relacionado con factores desencadenantes (segundo golpe) tales como infecciones bacterianas, hemorragia digestiva, hipovolemia (pérdidas gastrointestinales por diarrea o renales por diuresis excesiva), paracentesis mayor de 5 litros sin reposición de albúmina, hepatitis alcohólica y agentes nefrotóxicos (figura 2) (35-37).
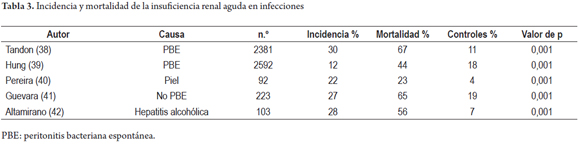
Diferentes estudios han demostrado que las infecciones en pacientes cirróticos pueden ocasionar una elevada incidencia de IRA que alcanza hasta un 30%, con una mortalidad entre un 23% y un 67% (38-41). La hepatitis alcohólica puede ocasionar insuficiencia renal en un 28% de los casos con una mortalidad del 56% (véase tabla 3) (42).
NUEVAS DEFINICIONES DE INSUFICIENCIA RENAL AGUDA EN CIRROSIS
La definición de IRA en cirrosis con un punto de corte estático de 1,5 mg/dL probablemente no sea la más adecuada, debido a que se relaciona con un deterioro muy severo del filtrado glomerular (<30 mL/min). Además, no tiene en cuenta los cambios dinámicos de la creatinina que se suceden en los días o semanas previas y que podrían resultar necesarios para diferenciar entre una IRA y una insuficiencia renal crónica y permitir así una terapia eficaz temprana (43-45).
Recientemente un grupo de expertos ha propuesto que la IRA en cirrosis sea definida utilizando una combinación de los criterios de la Acute Kidney Injury Network (AKIN) y los criterios RIFLE de la Acute Dyalisis Quality Initiative group (ADQI) (46-48). Con base en lo anterior, una nueva definición de IRA en cirrosis (AKI-IAC representan las siglas en inglés de acute kidney injury e International Ascites Club) ha sido recientemente publicada (49, 50). En ella se utiliza una parte de los criterios de la AKIN, como un aumento de la creatinina sérica ≥0,3 mg/dL en las primeras 48 horas o ≥50% del basal, junto con parte de los criterios de la ADQI, definidos por un aumento de la creatinina sérica ≥50% en una semana. La principal diferencia con los anteriores criterios viene dada por el abandono del nivel de creatinina ≥1,5 mg/dL para el diagnóstico de IRA (33). Adicionalmente se ha propuesto la implementación de un sistema de estatificación (estadios 1, 2 y 3) basado en el cambio de la creatinina en el tiempo y tomando arbitrariamente una semana para evaluar la progresión o la regresión de los estadios. Se ha optado por eliminar de la definición la disminución del gasto urinario, debido a que los pacientes cirróticos con ascitis son frecuentemente oligúricos, presentan una ávida retención de sodio con un filtrado glomerular normal y pueden tener un aumento del volumen urinario relacionado con el uso de diuréticos (49, 50) (véase tabla 4).
Un discreto aumento de la creatinina ≥0,3 mg/dL en menos de 48 horas podría ocasionar un incremento importante en la mortalidad y diferentes estudios recientes han demostrado que la implementación de los criterios de AKI-IAC en cirrosis se convierte en un buen predictor de mortalidad hospitalaria. Los pacientes con IRA que cumplan estos criterios tienen una mortalidad del 52,7% versus 29,9% en aquellos sin IRA (51). Para cada estadio de la clasificación de AKI-IAC, la mortalidad es mayor a medida que esta aumenta. Los pacientes sin insuficiencia renal tienen mortalidad del 3,8%; en estadio 1, del 13,5%; en estadio 2, del 37,8%; y en estadio 3, del 43,2% (52). Dentro de los pacientes con cirrosis e IRA irreversible, la mortalidad es 10 veces mayor a 30 días en comparación con los pacientes cirróticos sin insuficiencia renal, con mayores requerimientos de UCI, ventilación mecánica y estancia hospitalaria (53). Los pacientes que desarrollan IRA durante la hospitalización tienen una mayor mortalidad que aquellos que ingresan con insuficiencia renal, así como es mayor la mortalidad en los que aumentan su estadio de la clasificación de AKI-IAC durante la hospitalización (54). Aun pequeños incrementos en los niveles de creatinina por debajo de 1,5 mg podrían tener potencialmente efectos deletéreos en el curso de la enfermedad en pacientes con cirrosis descompensada (55).
Sin embargo, a pesar de que un valor más bajo de aumento en la sCr permite un diagnóstico precoz de la IRA en cirrosis, no se ha demostrado en forma clara que mejore la predicción de la mortalidad en estos pacientes en relación con el punto de corte actual de 1,5 mg/dL y determine la necesidad de un inicio temprano de intervenciones farmacológicas. Al menos en dos estudios, los pacientes con cirrosis y creatinina sérica menor de 1,5 mg/dL tienen una menor mortalidad en comparación con aquellos que alcanzan valores superiores a este nivel (56, 57). Con base en lo anterior, los pacientes con IRA en estadio 1 pueden dividirse en dos grupos: estadio 1-A, representado por aquellos que alcanzan un pico de creatinina <1,5 mg/dL, cuya mortalidad a corto plazo podría ser similar a los pacientes sin IRA, inclusive experimentando en forma frecuente regresión; y el estadio 1-B, que hace referencia a los pacientes que alcanzan un pico de creatinina ≥1,5 mg/dL y cuya mortalidad a corto plazo es mayor que la correspondiente a los pacientes sin IRA (49,50). Debido a que pequeños incrementos en la creatinina podrían resultar potencialmente deletéreos en el pronóstico de los pacientes con cirrosis descompensada, es posible que en un futuro cercano nuevos estudios confirmen que deba modificarse la definición actual del síndrome hepatorrenal tipo 1 disminuyendo el valor final de 2,5 mg/dL para iniciar tratamiento con vasoconstrictores y albúmina (58-60).
NUEVA DEFINICIÓN DE SÍNDROME HEPATORRENAL
La incidencia del SHR en pacientes con cirrosis avanzada en series realizadas hacia la década de 1990 va desde 18% a 1 año hasta 39% a 5 años (17). Estudios más recientes muestran en una serie de 263 pacientes en España una probabilidad del 23,6% a 12 meses de desarrollar insuficiencia renal funcional con una mortalidad del 50% (61). Otra serie en Italia, que incluyó 253 pacientes, muestra una prevalencia de SHR del 45,8% (30% tipo 1 y 15,8% tipo 2), con una mortalidad a 3 meses del 80% (62).
La definición y criterios diagnósticos del SHR fueron establecidos en el año de 1996 con base en tres conceptos (63):
1. Insuficiencia renal funcional ocasionada por una notoria vasoconstricción arteriolar intrarrenal.
2. Ocurrencia en pacientes con disfunción circulatoria sistémica ocasionada por vasodilatación extrarrenal.
3. La expansión del volumen plasmático no mejora la insuficiencia renal.
En el año 2007, se adicionaron cuatro nuevos conceptos (64):
- La vasodilatación extrarrenal ocurre principalmente en la circulación esplácnica, mientras que otros lechos permanecen vasoconstreñidos.
- El gasto cardíaco puede estar bajo, normal o alto, aunque es insuficiente para las necesidades del paciente en relación con la disminución de las resistencias vasculares periféricas.
- El factor desencadenante más frecuente son las infecciones bacterianas, principalmente la peritonitis bacteriana espontánea.
- La función renal revierte con el tratamiento médico y se asocia con mejoría en la sobrevida.
Con base en las nuevas definiciones de IRA presentadas por la AKI-IAC, se han redefinido los criterios diagnósticos del SHR. El SHR tipo 1, definido previamente por un aumento de la creatinina mayor del 100% en 2 semanas y con un valor final >2,5 mg/dL, corresponde a una verdadera forma de IRA estadio 2 o 3. El SHR tipo 2, definido previamente por una aumento estable en la creatinina >1,5 mg/dl en el curso de meses, corresponde en los nuevos criterios a una forma de deterioro renal crónico en el paciente cirrótico, caracterizada por un filtrado glomerular menor de 60 mL/min por más de 3 meses (46). Estas nuevas definiciones se relacionan a su vez con el tipo de intervención terapéutica a seguir. La creatinina basal resalta como un aspecto muy importante y se recomienda utilizar la más cercana en los 7 días previos a la admisión, y si no está disponible se puede utilizar el último valor en los 3 meses previos a la admisión. Puede diagnosticarse IRA adquirida en la comunidad en caso de un aumento de la creatinina ≥50% sobre el último valor disponible. En pacientes con una creatinina ≥1,5 mg/dL al ingreso hospitalario y en presencia de un factor de riesgo identificable (por ejemplo, infección bacteriana) debe asumirse que la insuficiencia renal representa una IRA (49, 50). Los criterios revisados de SHR pueden apreciarse en la tabla 5.
EVALUACIÓN Y MEDIDAS GENERALES
Una vez que se establece el diagnóstico de una IRA estadio 1 de AKI-IAC con un aumento de la creatinina ≥0,3 mg en menos de 48 horas, el manejo dependerá de la identificación y modificación de una posible causa. Debe hacerse una historia clínica detallada para evaluar factores precipitantes como infecciones, sangrado gastrointestinal, hipovolemia por pérdida de volumen y exposición a agentes nefrotóxicos. A continuación se presentan algunas recomendaciones importantes a seguir:
Estadio 1 de AKI-IAC (aumento de la sCr ≥0,3 mg/dL o un aumento ≥1,5 a 2 veces del basal)
- Suspenda todos los medicamentos que ocasionen pérdida de volumen (lactulosa, diuréticos) y vasodilatación (IECA, antagonista de los receptores de angiotensina, clonidina) y que se relacionen con vasoconstricción renal (AINE) y nefrotoxicidad (aminoglucósidos, contrastes iodados).
- Establezca la presencia de infecciones realizando hemocultivos, urocultivo, radiografía de tórax, paracentesis con recuento de neutrófilos y cultivo de ascitis en frasco de hemocultivo a la cabecera.
- Ante la sospecha de hipovolemia, debe iniciarse expansión de volumen con cristaloides o coloides o glóbulos rojos empacados en presencia de sangrado gastrointestinal.
Estadio 2 y 3 de AKI-IAC (aumento de la sCr ≥2 a 3 veces del basal)
- En pacientes que no respondan a las medidas previas, incluida la interrupción de diuréticos si no ha sido realizada previamente, debe iniciarse la expansión de volumen plasmático con albúmina 1g/kg/día hasta un máximo de 100 g durante 2 días. En pacientes que no respondan debe hacerse un diagnóstico diferencial entre SHR-IRA, IRA intrínseca (NTA-IRA) e IRA posrenal.
- Cuando se sospecha una NTA por choque (séptico o hipovolémico), o existe evidencia de exposición a nefrotoxinas, debe evaluarse el inicio temprano de la terapia de reemplazo renal.
- En pacientes sin evidencia de choque que no respondan a las medidas generales y a la expansión de volumen con albúmina, deben evaluarse biomarcadores urinarios de daño tubular como la uNGAL a fin de diferenciar NTA (valores altos), azoemia prerrenal (valores bajos) o SHR (valores intermedios) (35, 37, 49, 50, 65).
PREVENCIÓN DEL SÍNDROME HEPATORRENAL
Debido a la severidad y a la elevada mortalidad del SHR, la prevención de su aparición se convierte en una prioridad en pacientes con cirrosis. Al menos 6 escenarios favorecen las siguientes intervenciones (33-36, 63):
1. El riesgo de SHR alcanza un 30% en pacientes con peritonitis bacteriana espontánea. La administración de albúmina en 1,5 g/kg el primer día y en 1 g/kg al tercer día disminuye esta complicación así como su mortalidad de un 30% a un 10%. Se recomienda principalmente en pacientes con creatinina ≥1,0 mg/dL, BUN ≥30 mg/dL y bilirrubina ≥4mg/dL.
2. En pacientes con cirrosis y ascitis con una baja concentración de proteínas <1,5 g en el líquido ascítico, cirrosis avanzada con Child ≥10, bilirrubinas >3 mg/dL, disfunción renal con creatinina >1,2 mg/dL y sodio <130 mEe/L, el uso de norfloxacino 400 mg día por vía oral (VO) hasta el trasplante disminuye el SHR desde un 41% hasta a un 28%.
3. La pentoxifilina en 400 mg/8 horas por 28 días en pacientes con hepatitis alcohólica disminuye el SHR desde un 35% hasta un 8%.
4. La paracentesis total mayor de 5 litros, con expansión de albúmina 8 g/L, disminuye el riesgo de disfunción circulatoria desde un 72% hasta un 17% y el riesgo de IRA.
5. El uso de antibióticos durante 7 días en pacientes con hemorragia digestiva variceal disminuye el riesgo de resangrado, IRA y mortalidad (24% versus 15%).
6. Recientemente se ha demostrado que el uso de bloqueadores β en pacientes con cirrosis y peritonitis bacteriana espontánea aumenta el riesgo de SHR (24% versus 11%) y disminuye la sobrevida libre de trasplante. Por esta razón, se recomienda suspender estos medicamentos en este tipo de pacientes, así como en los que tienen ascitis refractaria (66).
TRATAMIENTO DEL SÍNDROME HEPATORRENAL
Paracentesis de gran volumen
La paracentesis total (movilización completa de ascitis) constituye un tratamiento rápido, seguro y efectivo para la ascitis refractaria que representa una manifestación frecuente del SHR. Hasta un 70% de los pacientes puede presentar disfunción circulatoria, que resulta de una exacerbación de la vasodilatación esplácnica, cuando son removidos más de 5 litros y que puede ser prevenida con la expansión con albúmina (8 g/L de ascitis removida) (67). El uso de TIPS ha sido evaluado en seis ensayos aleatorizados controlados comparado con la paracentesis y las conclusiones son que facilita el control de la ascitis, disminuye el riesgo de SHR y mejora la sobrevida libre de trasplante. Sin embargo, aumenta el riesgo de encefalopatía severa por lo que se requieren estudios adicionales para evaluar su beneficio real en la práctica diaria (68, 69). Recientemente se ha incorporado al armamentario terapéutico de la ascitis refractaria el uso de un sistema automatizado con una bomba de bajo flujo que consiste en un catéter intraperitoneal conectado a una fuente de poder implantada a nivel subcutáneo, que se conecta a su vez con un segundo catéter que drena hacia la vejiga. Literalmente los pacientes orinan la ascitis, y el sistema emplea un juego de sensores que impide la caída de la presión abdominal y/o el aumento de la presión intravesical. Una proporción significativa de los pacientes debe ser reintervenida por complicaciones, incluidas colonización bacteriana, bacteriemia, peritonitis plástica y muerte. La prótesis debe ser retirada previamente al trasplante debido a que puede ser una fuente potencial de complicaciones (70).
Vasoconstrictores y albúmina
El uso de vasoconstrictores representa una paradoja en el tratamiento de los pacientes con vasoconstricción renal severa. La razón es su efecto sobre la circulación esplácnica donde revierte el estado de hipovolemia efectiva, relacionado con una disminución del volumen circulante efectivo secundario a una notoria vasodilatación a este nivel. De esta manera, los vasoconstrictores inactivan los sistemas neurohumorales que ocasionan la vasoconstricción renal con mejoría del flujo plasmático y la filtración glomerular (71).
La terlipresina es un agonista de la vasopresina (triglicil-lisina vasopresina) con actividad vasoconstrictora sobre los receptores V1 en el lecho esplácnico (72, 73). Su uso en pacientes con SHR ha demostrado ser eficaz en un 40% a 60% de los estudios no controlados, con el empleo del criterio de un aumento ≥100% de la sCr en 2 semanas hasta un valor final mayor de 2,5 mg/dL (74). Los beneficios se han confirmado en dos ensayos aleatorizados y controlados, donde se consiguió revertir el SHR en un 40% de los pacientes, alcanzando así una respuesta completa con disminución de la creatinina a menos de 1,5 mg/dL en un promedio de 7 días. En los respondedores se apreció una mejoría en la sobrevida y no se presentaron efectos adversos graves (75, 76). Los factores predictivos de respuesta fueron un nivel de creatinina antes del tratamiento menor de 5 mg/dL, una bilirrubina basal menor de 10 mg/dL y un aumento de la presión arterial media de 5 mm Hg en las primeras 72 horas (77-80). Hubo recurrencia hasta en un 15% de los pacientes, que pudo ser tratada con un nuevo curso de terlipresina. Tres metaanálisis de estudios controlados han puesto en evidencia que la combinación de terlipresina y albúmina es capaz de revertir el SHR con mejoría de la sobrevida a corto plazo (81-83). Las guías europeas recomiendan el uso de la terlipresina asociado con albúmina como primera línea de tratamiento en pacientes con SHR (84). La adición de albúmina a la terlipresina aumenta tres veces la respuesta comparada con la terlipresina (85). Esto puede ser explicado por el efecto expansor de volumen (aumenta la presión oncótica) y la acción antioxidante y antiinflamatoria de la albúmina, que puede contribuir a mejorar la disfunción endotelial (86). En pacientes con SHR asociado con infecciones, el tratamiento antibiótico no lo revierte en el 67% de los casos y se asocia con una mortalidad elevada (87). El uso temprano de la combinación de terlipresina y albúmina se asocia con una notoria mejoría en la presión arterial, y en el 67% de los pacientes la supresión de los sistemas vasoconstrictores se relaciona con un buen perfil de seguridad (88).
En Estados Unidos el uso de terlipresina no está aprobado por la FDA, de modo que la terapia de elección es la combinación de midrodina (agonista adrenérgico α), dosis de 7,5-12,5 mg cada 8 horas, octreotida (agonista de la somatostatina), 100-200 µg por vía subcutánea cada 8 horas, y albúmina (31). Un reciente estudio multicéntrico que comparó la terlipresina y albúmina versus midrodina-octreotida y albúmina demostró una mayor eficacia de la combinación terlipresina y albúmina para recuperar la función renal (70,4% versus 28,6%), con mejoría en la sobrevida relacionada con la reversión de la insuficiencia renal y un bajo MELD basal (89).
La noradrenalina es un agonista adrenérgico que ha demostrado su utilidad para el tratamiento en el SHR tipo 1. Después del estudio piloto inicial donde alcanzó una respuesta en el 83% de los pacientes, tres estudios con un pequeño número de pacientes y que compararon la noradrenalina con la terlipresina muestran una respuesta que oscila entre un 40% y un 50% (90-93). En la tabla 6 se especifican las recomendaciones sobre el uso de vasoconstrictores y albúmina en pacientes con SHR. Queda por evaluar en nuevos estudios la posibilidad del inicio de tratamiento con vasoconstrictores y albúmina a un nivel menor de 2,5 mg/dL, teniendo en cuenta que cuanto más alta sea la sCr, menor será la posibilidad de respuesta. De acuerdo con los nuevos criterios propuestos por la AKI-IAC, cuando una IRA es clasificada al ingreso o alcanza un estadio 2 y 3, a pesar de la medidas terapéuticas iniciales en presencia de los criterios restantes de SHR, debe iniciarse la combinación de vasoconstrictores y albúmina independientemente del valor final de la sCr (49, 50).
Tratamiento no farmacológico
El uso de TIPS ha sido evaluado al menos en 6 estudios con un pequeño número de pacientes incluidos, en donde alcanzó una reversión del SHR en el 50% de los casos, con mejoría a corto plazo de la sobrevida. La combinación con vasoconstrictores mejora la función renal y eventualmente normaliza la creatinina después de varios meses. Sin embargo, la enfermedad avanzada impide el uso de TIPS en un gran porcentaje de pacientes (94). El uso de diálisis de albúmina (MARS y Prometheus) ha sido ensayado en un pequeño número de pacientes con SHR sin obtenerse resultados en la sobrevida que permitan su uso extendido en la práctica clínica, exceptuando los pacientes con MELD >30 (95). La terapia de reemplazo renal solo estaría indicada si no se consigue respuesta con los vasoconstrictores combinados con albúmina en pacientes en lista de trasplante, así como en los casos donde exista sobrecarga de volumen, acidosis metabólica e hiperpotasemia. Su uso por más de 8 semanas representa una indicación para trasplante combinado de hígado-riñón (31, 33, 34, 69).
Trasplante
El trasplante hepático representa la opción definitiva para el tratamiento de los pacientes con SHR, ya que permite resolver la enfermedad hepática y revertir la insuficiencia renal funcional (17, 33, 44). La disfunción renal pretrasplante se puede asociar con una disminución de la sobrevida después del trasplante (96). Los pacientes trasplantados con SHR tienen un notorio beneficio en la sobrevida. No es claro si la combinación de vasoconstrictores con albúmina afecta la sobrevida postrasplante, aunque la terlipresina con la mejoría de la función renal retrasa la necesidad de terapia de reemplazo renal, mejora la sobrevida en los candidatos a trasplante y ayuda a que estos pacientes alcancen a un trasplante (97-99). En pacientes que revierten el SHR podría darse el efecto paradójico que al bajar el puntaje de MELD se retrase el trasplante. La recomendación para estos casos sería mantener el resultado del MELD presente antes del tratamiento farmacológico y priorizar el trasplante teniendo en cuenta el valor específico que tiene el SHR sobre la mortalidad a 3 meses (100).
CONCLUSIONES Y RECOMENDACIONES
La insuficiencia renal aguda (IRA) en pacientes cirróticos tiene serias implicaciones en la evolución clínica y en la mortalidad. Los nuevos criterios de IRA de la AKI-IAC en cirrosis con un aumento de la creatinina ≥0,3 mg/dL en 48 horas deben alertar y permitir el inicio temprano de intervenciones tales como descartar la presencia de infecciones, evaluar las pérdidas de volemia, modificar la dosis de diuréticos, retirar los medicamentos nefrotóxicos y comenzar la expansión de volumen. De no obtenerse respuesta, deben aplicarse los criterios para evaluar la presencia de un síndrome hepatorrenal (SHR), que incluyen la expansión con albúmina durante 2 días, descartar eventos asociados y/o patología orgánica y, según el curso hacia un estadio 2 y 3 de la AKI-IAC, dar inicio a la combinación de vasoconstrictores y albúmina independientemente del valor final de la sCr. Es posible que el nivel de 2,5 mg/dL para confirmar el diagnóstico del tipo más severo de SHR deba ser modificado, lo que permitirá comenzar en forma temprana un tratamiento con mayor posibilidad de reversión de la insuficiencia renal. En cada momento de la evaluación debe investigarse si existe un componente de tipo estructural como la necrosis tubular aguda (NTA) y para ello se debe implementar el uso de biomarcadores como la uNGAL. Finalmente, la IRA en pacientes cirróticos representa un evento muchas veces catastrófico, por lo que es importante su manejo en coordinación con centros de trasplante.
Agradecimiento
A los profesores Vicente Arroyo Pérez y Pere Ginés I Gibert, por sus invaluables aportes y toda una vida de investigación en el campo de la disfunción renal en pacientes con cirrosis.
REFERENCIAS
1. Tsochatzis E, Bosch J, Burroughs A. Liver cirrhosis. Lancet. 2014;383:1749-61. [ Links ]
2. Tsochatzis E, Bosch J, Burroughs A. Prolonging survival in patients with cirrhosis: Old drugs with new indications. Gastroenterology. 2010;139:1813-15. [ Links ]
3. Liou I. Management of end-stage liver disease. Med Clin N Am. 2014;98:119-52. [ Links ]
4. Bruix J, Gores G, Mazzaferro V. Hepatocellular carcinoma: clinical frontiers and perspectives. Gut. 2014;63:844-55. [ Links ]
5. Garcia-Tsao G, Friedman S, Iredale J, Pinzani M. Now there are many (stages) where before was one: In search of a pathophysiological classification of cirrhosis. Hepatology. 2010;51:1445-9. [ Links ]
6. Arvaniti V, D´Amico G, Fede G, Monousou P, Tsochatzis E, Pleguezuelo M, et al. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis. Gastroenterology. 2010;139:1246-56. [ Links ]
7. Du Cheyron D, Bouchet B, Patienti J, Ramakers M, Charbonneau P. The attributable mortality of acute renal failure in critically ill patients with liver cirrhosis. Intensive Care Med. 2005;31:1693-9. [ Links ]
8. Fede G, D´Amico G, Arvaniti V, Tsochatzis E, Germani G, Georgiadi D, et al. Renal failure and cirrhosis: A systematic review of mortality and prognosis. J Hepatol. 2012;56:810-8. [ Links ]
9. Weismuller T, Prokein J, Becker T, Barg-Hock H, Klempnauer J, Manns M, et al. Prediction of survival after liver transplantation by pre-transplant parameters. Scand J Gastroenterol. 2008;43:736-46. [ Links ]
10. Galmus Y, Conti F, Cluzel P, Hill G, Antoine C, Scatton O, et al. Prospective assessment of renal histopathological lesions in patients with end-stage liver disease: Effects on long term renal function after liver transplant. J Hepatol. 2012;57:572-6. [ Links ]
11. Trawale JM, Paradis V, Rautou JM, Francoz C, Escolano S, Sallee M, et al. The spectrum of renal lesions in patients with cirrhosis: a clinicopathological study. Liver Internat. 2009;30:725-32. [ Links ]
12. Wong F. Renal diseases and the liver. Clin Liver Dis. 2011;15:39-53. [ Links ]
13. Hartleb M, Gutkowski K. Kidney in chronic liver disease. World J Gastroenterol. 2012;18:3035-49. [ Links ]
14. Garcia-Tsao G, Parikh Ch, Viola A. Acute kidney injury in cirrhosis. Hepatology. 2008;48:1-14. [ Links ]
15. Angeli P, Merkel C. Pathogenesis and management of hepatorenal syndrome in patients with cirrhosis. J Hepatol. 2008;48:S93-S103. [ Links ]
16. Cárdenas A, Ginés P. A patient with cirrhosis and increasing creatinine level: what is it and what to do? Clin Gastroenterol Hepatol. 2009;7:1287-91. [ Links ]
17. Guevara M, Arroyo V. Hepatorenal syndrome. Expert Opin Pharmacother. 2011;12:1405-17. [ Links ]
18. Kopacova M. Hepatorenal syndrome. World J Gastroenterol. 2012;18:4978-84. [ Links ]
19. Martin-Llahi M, Guevara M, Torre A, Fagundes C, Restuccia T, Gilabert R, et al. Prognostic importance of the cause of renal failure in patients with cirrhosis. Gastroenterology. 2011;140:488-96. [ Links ]
20. Francoz C, Glotz D, Moreau R, Durand F. The evaluation of renal function and disease in patients with cirrhosis. J Hepatol. 2010;52:605-13. [ Links ]
21. Cholongitas E, Shusang V, Marelli L, Nair D, Thomas M, Patch D, et al. Review article. Renal function assessment in cirrhosis difficulties and alternative measurements. Aliment Pharmacol Ther. 2007;26:969-78. [ Links ]
22. Carter J, Lamb E. Evaluating new biomarkers for acute kidney injury: putting the horse before the cart. Am J Kidney Dis. 2014;63:543-6. [ Links ]
23. Qasem A, Farag S, Hamed E, Emara M, Bihery A, Pasha H. Urinary biomarkers of acute kidney injury in patients with liver cirrhosis. Nephrology. 2014;11:1-7. [ Links ]
24. Fagundes C, Pepin MN, Guevara M, Barreto R, Casals G, Sola E, et al. Urinary neutrophil gelatinase-associated lipocalin as biomarker in the differential diagnosis of impairment of kidney function in cirrhosis. J Hepatol. 2012;57:267-73. [ Links ]
25. Verna E, Brown R, Farrand E, Pichardo E, Forster C, Sola-del valle D, et al. Urinary neutrophil gelatinase-associated lipocalin predicts mortality and identifies acute kidney injury in cirrhosis. Dig Dis Sci. 2012;57:2362-70. [ Links ]
26. Belcher J, Sanyal A, Peixoto A, Parazella M, Lim J, Thiessen-Philbrook H, et al. Kidney biomarkers and differential diagnosis of patients with cirrhosis and acute kidney injury. Hepatology. 2014;60:622-32. [ Links ]
27. Guevara M, Ortega R, Ginés P, Rodes J. Pathogenesis of renal vasoconstriction in cirrhosis. En: Ginés P, Arroyo V, Rodes J, Schrier R. Ascites and renal dysfunction in liver disease. 2nd edition. Massachussets: Blackwell Publishing; 2005. p. 329-40. [ Links ]
28. Cárdenas A, Ortega R, Ginés P. The hepatocirculatory syndrome in cirrhosis. En: Arroyo V, Bosch J, Bruix J. Therapy in hepatology. Barcelona: Ars Medica; 2001. p. 33-42. [ Links ]
29. Bolognesi M, Di Pascoli M, Verardo A, Gatta A. Splanchnic vasodilation and hyperdynamic circulatory syndrome in cirrhosis. World J Gastroenterol. 2014;20:2555-63. [ Links ]
30. Wadei H. Hepatorenal syndrome: A critical update. Semin Resp Crit Care Med. 2012;33:55-69. [ Links ]
31. Wong F. Recent advances in our understanding of hepatorenal syndrome. Nat Rev Gastroenterol Hepatol. 2012;9:382-91. [ Links ]
32. Wiese S, Hove J, Brendtsen F, Moller S. Cirrhotic cardiomiopathy: pathogenesis and clinical relevance. Nat Rev Gastroenterol Hepatol. 2014;11:177-86. [ Links ]
33. Ginés P, Schrier R. Renal failure in cirrhosis. N Eng J Med. 2009;361:1279-90. [ Links ]
34. Fagundes C, Ginés P. Hepatorenal syndrome: A severe, but tratable, cause of kidney failure in cirrhosis. Am J kidney Dis. 2012;59:874-85. [ Links ]
35. Laithead J, Hayes P, Ferguson J. Review article: Advances in the management of patients with cirrhosis and portal hypertension-related renal dysfunction. Aliment Pharmacol Ther. 2014;39:699-711. [ Links ]
36. Arroyo V, Fernández J. Management of hepatorenal syndrome in patients with cirrhosis. Nat Rev Nephrol. 2011;7:517-26. [ Links ]
37. Moller S, Krag A, Bendtsen F. Kidney injury in cirrhosis: pathophysiological and therapeutic aspects of hepatorenal syndrome. Liver Internat. 2014;34:1153-63. [ Links ]
38. Tandon P, Garcia-Tsao G. Renal dysfunction is the most important independent predictor of mortality in cirrhotic patients with spontaneous bacterial peritonitis. Clin Gastroenterol Hepatol. 2011;9:260-5. [ Links ]
39. Hung TS, Tsai Ah, Hsieh Y, Tsai Ch, Tseng Ch, Tsai J. Effect of renal impairment on mortality of patients with cirrhosis and spontaneous bacterial peritonitis. Clin Gastroenterol Hepatol. 2012;10:677-81. [ Links ]
40. Pereira G, Guevara M, Fagundes C, Sola E, Rodríguez E, Fernández J, et al. Renal failure and hiponatremia in patients with cirrhosis and skin and soft tissue infections. A retrospective study. J Hepatol. 2012;56:1040-6. [ Links ]
41. Guevara M, Terra C, Nazar A, Sola E, Fernández J, Pavesi M, et al. Albumin for bacterial infections other tan spontaneous bacterial peritonitis. A randomized controlled study. J Hepatol. 2012;57:759-65. [ Links ]
42. Altamirano J, Fagundes C, Dominguez M, Garcia E, Michelena J, Cárdenas A, et al. Acute kidney injury is an early predictor of mortality for patients with alcoholic hepatitis. Clin Gastroenterol Hepatol. 2012;10:65-71. [ Links ]
43. Bellomo R, Kellum J, Ronco C. Acute kidney injury. Lancet. 2012;380:756-66. [ Links ]
44. Lomeire N, Bagga A, Cruz D, Maeseneer J, Endre Z, Kellum J, et al. Acute kidney injury: An increasing global concern. Lancet. 2013;382:170-9. [ Links ]
45. Belcher J, Parikh C, Garcia-Tsao G. Acute kidney injury in patients with cirrhosis: perils and promise. Clin Gastroenterol Hepatol. 2011;11:1550-8. [ Links ]
46. Wong F, Nadim M, Kellum J, Salerno F, Bellomo R, Gerbes A, et al. Working party proposal for revised classification system of renal dysfunction in patients with cirrhosis. Gut. 2011;60:702-9. [ Links ]
47. Mucino-Bermejo J, Carrillo-Esper R, Uribe M, Mendez-Sanchez N. Acute kidney injury in critically ill cirrhotic patients: a review. Ann Hepatol. 2012;11:301-10. [ Links ]
48. Mindiklogu A, Weir M. Current concepts in the diagnosis and classifications of renal dysfunction in cirrhosis. Am J Neprhol. 2013;38:345-54. [ Links ]
49. Angeli P, Gines P, Wong F, Bernardi M, Boyer T, Gerbes A, et al. Diagnosis and management of acute kidney injury in cirrhosis: revised recommendations of the international ascites club. Gut. 2015;64:531-7. [ Links ]
50. Angeli P, Gines P, Wong F, Bernardi M, Boyer T, Gerbes A, et al. Diagnosis and management of acute kidney injury in cirrhosis: revised recommendations of the international ascites club. J Hepatol. 2015;62:968-74. [ Links ]
51. Ribeiro de Carvalho J, Villela-Nogueira C, Luiz R, Guzzo P, Silva Rosa J, Rocha E, et al. Acute kidney injury network criteria as a predictor of hospital mortality in cirrhotic patients with ascites. J Clin Gastroenterol. 2012;46:21-6. [ Links ]
52. Scott R, Austin A, Kolhe N, McIntyre C, Selby N. Acute kidney injury is independently associated with death in patients with cirrhosis. Frontine Gastroenterol. 2013;4:191-7. [ Links ]
53. Wong F, O´Leary J, Reddy K, Patton H, Kamath P, Fallon M, et al. New consensus definition of acute kidney injury accurately predicts 30-day mortality in patients with cirrhosis and infection. Gastroenterology. 2013;145:1280-8. [ Links ]
54. Belcher J, Garcia-Tsao G, Sanyal A, Bhogal H, Lim J, Ansari N, et al. Association of AKI with mortality and complications in hospitalized patients with cirrhosis. Hepatology. 2013;57:753-62. [ Links ]
55. Tsien C, Rabie R, Wong F. Acute kidney injury in decompensated cirrhosis. Gut. 2013;62:131-7. [ Links ]
56. Fagundes C, Barreto R, Guevara M, Garcia E, Sola E, Rodriguez E, et al. A modified acute kidney injury classification for diagnosis and risk stratification of impairment of kidney function in cirrhosis. J Hepatol. 2013;59:474-81. [ Links ]
57. Piano S, Rosi S, Maresio G, Fasolato S, Cavalin M, Romano A, et al. Evaluation of the acute kidney injury network criteria in hospitalized patients with cirrhosis and ascites. J Hepatol. 2013;59:482-9. [ Links ]
58. Arroyo V. Acute kidney injury in cirrhosis: should we change current definitions and diagnostic criteria of renal failure in cirrhosis? J Hepatol. 2013;59:415-7. [ Links ]
59. Schrier R, Shchekochikhin D, Gines P. Renal failure in cirrhosis: Prerenal azotemia, hepatorenal syndrome and acute tubular necrosis. Nephrol Dial Transplant. 2012;27:2625-8. [ Links ]
60. Moore K. Acute injury in cirrhosis: a changing spectrum. Hepatology. 2013;57:435-7. [ Links ]
61. Montoliu S, Balleste B, Planas R, Álvarez M, Rivera M, Miquel M, et al. Incidence and prognosis of different types of functional renal failure in cirrhotic patients with ascites. Clin Gastroenterol Hepatol. 2010;8:616-22. [ Links ]
62. Salerno F, Cazzaniga M, Merli M, Spinzi G, Saibeni S, Salmi A, et al. Diagnosis, treatment and survival of patients with hepatorenal syndrome: A survey on daily medical practice. J Hepatol. 2011;55:1241-8. [ Links ]
63. Ginés P, Guevara M, Arroyo V, Rodes J. Hepatorenal syndrome. Lancet. 2003;362:1819-27. [ Links ]
64. Salerno F, Gerbes A, Ginés P, Wong F, Arroyo V. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Gut. 2007;56:1310-8. [ Links ]
65. Ming Ming Loo N, Fernandez Souza F, Garcia-Tsao G. Non-hemorrhagic acute complications associated with cirrhosis and portal hypertension. Best Pract Res Clin Gastroenterol. 2013;27:665-78. [ Links ]
66. Mandorfer M, Bota S, Schwabl P, Bucsics T, Pfiester N, Kuzik M, et al. Non selective B blockers increase risk for hepatorenal syndrome and death in patients with cirrhosis and spontaneous bacterial peritonitis. Gastroenterology. 2014;146:1680-90. [ Links ]
67. Bernardi M, Caraceni P, Navickis R, Wilkes M. Albumin infusion in patients undergoing large volume paracentesis: A meta-analysis of randomized trials. Hepatology. 2012;55:1172-81. [ Links ]
68. Bai M, Qi X, Yang Z, Yang M, Fan D, Han G. TIPS improves liver transplantation-free survival in cirrhotic patients with refractory ascites: An updated meta-analyses. World J Gastroenterol. 2014;20:2704-14. [ Links ]
69. Bhogal H, Sanyal A. Using transyugular intrahepatic portosystemic shunts for complications of cirrhosis. Clin Gastroenterol Hepatol. 2011;9:936-46. [ Links ]
70. Bellot P, Welker M-W, Soriano G, et al. Automated low flow pump system for the treatment of refractory ascites: A multicenter safety and efficacy study. J Hepatol. 2013;58:922-7. [ Links ]
71. Leung W, Wong F. Hepatorenal syndrome: Do the vasoconstrictors work. Gastroenterol Clin NA. 2011;581-98. [ Links ]
72. Sarin SK, Sharma P. Terlipressin: An asset for hepatologist. Hepatology. 2011;54:724-8. [ Links ]
73. Rajekar H, Chawla Y. Terlipressin in hepatorenal syndrome: Evidence for present indications. J Gastronterol Hepatol. 2011;26:109-14. [ Links ]
74. Davenport A, Ahmad J, Al-Khafaji A, Kellum J, Genyk Y, Nadim M. Medical management of hepatorenal syndrome. Nephrol Dial Transplant. 2012;27:34-41. [ Links ]
75. Sanyal A, Boyer T, Garcia-Tsao G, Regenstein F, Rossaro L, Appenrodt B, et al. A randomized, prospective, double blind, placebo-controlled trial of terlipressin for type 1 hepatorenal syndrome. Gastroenterology. 2008;134:1360-8. [ Links ]
76. Martin-LLahi M, Pepin MN, Guevara M, Díaz F, Torre A, Monescillo A, et al. Terlipressin and albumin vs albumin in patients with cirrhosis and hepatorenal syndrome: a randomized study. Gastroenterology. 2008;134:1352-9. [ Links ]
77. Nazar A, Pereira G, Guevara M, Matin-Llahi M, Pepin MN, Marineli M, et al. Predictors of response to therapy with terlipressin and albumin in patients with cirrhosis and type 1 hepatorenal syndrome. Hepatology. 2010;51:219-26. [ Links ]
78. Boyer T, Sanyal A, Garcia-Tsao G, Blei A, Carl D, Bexon A, et al. Predictors of response to terlipressin plus albumin in hepatorenal syndrome type 1: Relationship of serum creatinine to hemodynamics. J Hepatol. 2011;55:315-21. [ Links ]
79. Velez J, Nietert P. Therapeutic response to vasoconstrictors in hepatorenal syndrome parallels increase in mean arterial pressure: A pooled analysis of clinical trials. Am J Kidney Dis. 2011;58:928-38. [ Links ]
80. Ginés P. Pharmacological management of hepatorenal syndrome: Lessons from non-responders. J Hepatol. 2011;55:268-9. [ Links ]
81. Fabrizi F, Dixit V, Messa P, Martin P. Terlipressin for hepatorenal syndrome: A meta-analisys of randomized trials. Int J Artif Org. 2009;32:133-40. [ Links ]
82. Gluud L, Christensen K, Christensen E, Krag A. systematic review of randomized trials on vasoconstrictors drug for hepatorenal syndrome. Hepatology. 2010;51:576-84. [ Links ]
83. Gluud L, Christensen K, Christensen E, Krag A. Terlipressin for hepatorenal syndrome. Cochcrane Database Library. 2012;9:CD005162. [ Links ]
84. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome. J Hepatol. 2010;53:397-417. [ Links ]
85. Ortega R, Ginés P, Uriz J, Cárdenas A, Calahorra B, De las Heras D, et al. Terlipressin therapy with and without albumin for patients with hepatorenal syndrome: Results of a prospective, non-randomized trial. Hepatology. 2002;36:941-8. [ Links ]
86. Garcia-Martinez R, Caraceni P, Bernardi M, Ginés P, Arroyo V, Jalan R. Albumin: Pathophysiologic basis of its role in the treatment of cirrhosis and its complications. Hepatology. 2013;58:1836-46. [ Links ]
87. Barreto R, Fagundes C, Guevara M, Sola E, Pereira G, Rodríguez E, et al. Type 1 hepatorenal syndrome associated with infections in cirrhosis: Natural history, outcome of kidney function, and survival. Hepatology. 2014;59:1505-13. [ Links ]
88. Rodriguez E, Elia Ch, Sola E, Barreto R, Graupera I, Andrealli A, et al. Terlipressin and albumin for type 1 hepatorenal syndrome associated with sepsis. J Hepatol. 2014;60:955-61. [ Links ]
89. Cavallin M, Kamath P, Merli M, Fasolato S, Toniutto P, Salerno F, et al. Terlipressin plus albumin versus midrodine and octreotide plus albumin in the treatment of hepatorenal syndrome. Hepatology. 2015; doi:101002/hep.27709. [ Links ]
90. Duvoux Ch, Zanditenas D, Hezode Ch, Chauvat A, Monin J, Roudout F, et al. Effects of noradrenalin and albumin in patients with type 1 hepatorenal syndrome: A pilot study. Hepatology. 2002;36:374-80. [ Links ]
91. Alessandria C, Ottobrelli A, Venon W, Todros L, Cerenzia T, Martini S, et al. Noradrenalin vs terlipressin in patients with hepatorenal syndrome: a prospective, randomized, unblinded, pilot study. J Hepatol. 2007;47:499-505. [ Links ]
92. Sharma P, Kumar A, Sharma B, Sarin S. An open label, pilot, randomized controlled trial of noradrenaline vs terlipressin in the treatment of type 1 hepatorenal syndrome and predictors response. Am J Gastroenterol. 2008;103:1689-97. [ Links ]
93. Singh V, Ghosh S, Singh B, Kumar P, Sharma P, Bhalla A, et al. Noradrenaline vs terlipressin in the treatment of hepatorenal syndrome: A randomized study. J Hepatol. 2012;56:1293-8. [ Links ]
94. Rossle M, Gerbes A. TIPS for the treatment of refractory ascites, hepatorenal syndrome and hepatic hydrothorax: A critical update. Gut. 2010;59:988-1000. [ Links ]
95. Kribben A, Gerken G, Haag S, Herget-Rosenthal S, Treichel U, Betz Ch, et al. Effects of fractionated plasma separation and absorption on survival in patients with acute on chronic liver failure. Gastroenterology. 2012;142:782-9. [ Links ]
96. Bahirwani R, Campbell M, Siropaides T, Markmann J, Olthoff K, Shaked A, et al. Transplantation: Impact of pretransplant renal insufficiency. Liver Transplant. 2008;14:665-71. [ Links ]
97. Restuccia T, Ortega R, Guevara M, Ginés P, Alessandria C, Ozdogan O, et al. Effects of treatment of hepatorenal syndrome before transplantation on post-transpantation outcome. A case control study. J Hepatol 2004;40:140-6. [ Links ]
98. Boyer T, Sanyal A, Garcia-Tsao G, Regenstein F, Rossaro L, Appendort B, et al. Impact of liver transplantation on the survival of patients treated for hepatorenal syndrome type 1. Liver Transplant. 2011;17:1328-32. [ Links ]
99. Ginés P. Hepatorenal syndrome, pharmacological therapy and liver transplant. Liver Transplant. 2011;17:1244-6. [ Links ]
100. Angeli P, Ginés P. Hepatorenal syndrome, MELD score, and liver transplantation: An evolving issue with relevant implications for clinical practice. J Hepatol. 2012;57:1135-40. [ Links ]











 text in
text in