Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.30 no.3 Bogotá July/Sept. 2015
Determinación de la prevalencia de hepatitis C mediante la prueba rápida BIOLINE HCV en una población de alto riesgo
Julián David Martínez MD. (1,2), Martín A. Garzón MD. (2), Juan M. Arteaga MD. (1), Geovanny Hernández MD. (2), Camilo Manrique MD. (2), Natán Hormaza MD. (2), Jorge Lizarazo MD. (2), Juan Marulanda MD. (2), Juan C. Molano MD. (2), Mario H. Rey MD. (2), Carolina Salinas MD. (2)
(1) Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia.
(2) Unidad de Gastroenterología, Hospital Universitario de La Samaritana. Bogotá, Colombia.
Fecha recibido: 09-02-15 Fecha aceptado: 21-07-15
Resumen
Introducción: la infección por el virus de la hepatitis C (HCV sus siglas en inglés) es un problema de salud pública en el mundo y la Organización Mundial de la Salud (OMS) calcula en más de 180 millones las personas infectadas. El objetivo del presente estudio es determinar la prevalencia de anti-HCV en pacientes con alto riesgo de infección mediante una prueba rápida con sangre capilar, y la confirmación de la infección por la prueba de PCR en tiempo real.
Método: se incluyeron pacientes atendidos en la Unidad de gastroenterología del Hospital Universitario de La Samaritana de Bogotá D.C, principal centro de referencia del departamento de Cundinamarca y que atiende pacientes de todo el país. Se definieron como factores de riesgo para hepatitis C: antecedentes de transfusiones, hemodiálisis, cirugías mayores (sistema nervioso central [SNC], tórax, abdomen, ortopédicas), drogadicción (farmacodependencia), tatuajes, piercing, acupuntura, presidiarios, trabajadores sexuales, VIH/sida, enfermedades de trasmisión sexual, trabajadores de la salud, pacientes procedentes de la Orinoquía y/o Amazonía, e insuficiencia renal crónica; también se estudiaron pacientes remitidos por alteración del perfil hepático, hígado graso, masas hepáticas, cirrosis excepto por virus C, ascitis, y várices esofagogástricas. Se empleó el estuche comercial SD BIOLINE HCV (Standard Diagnostics, INC. Corea), esta prueba contiene una membrana precubierta con antígenos recombinantes del HCV (core, NS3, NS4, NS5); se combina una proteína A coloidal con la muestra de suero y se mueve a lo largo de la membrana cromatográfica formando una línea visible de reacción antígeno-anticuerpo-proteína A, con un alto grado de especificidad y sensibilidad.
Resultados: entre enero y octubre de 2014 se estudiaron 391 pacientes, 161 mujeres (41%) y 230 (59%) hombres; edad promedio de 46,6 años y rango de edad de 14 a 86 años. Se detectaron, por la prueba rápida para hepatitis C, 4 pacientes positivos (3 mujeres y 1 hombre), todos ellos confirmados por la técnica de PCR-RT, lo que da una prevalencia de la infección del 1,02%.
Conclusiones: en este estudio, realizado en una población altamente seleccionada por sus antecedentes y factores de riesgo asociados, el rendimiento de la prueba rápida supera el 1% como capacidad de detección de la enfermedad. Cabe esperar que esta sea la verdadera prevalencia en población seleccionada, sobre la base de los resultados del estudio de 2012 y además, sobre la base de la sensibilidad de la prueba rápida.
Palabras clave
Hepatitis C, prevalencia, prueba rápida.
INTRODUCCIÓN
La infección por el virus de la hepatitis C (HCV, sus siglas en inglés) es un problema de salud pública en el mundo y la Organización Mundial de la Salud (OMS) calcula en más de 180 millones las personas infectadas (1, 2). La infección crónica se establece en el 80% de los infectados, es responsable de un significante número de enfermedades hepáticas crónicas, y se estima que el 27% de las cirrosis y entre el 25% y el 30% de los carcinomas hepatocelulares son ocasionados por este virus, lo que genera 360000 muertes por año a nivel global (3-6). Este impacto de la infección crónica es crítico para el desarrollo de estrategias para el diagnóstico oportuno, manejo y erradicación de la infección por el HCV (6).
Este diagnóstico se realiza por la detección, en el suero de los pacientes, de anticuerpos contra HCV (anti-HCV), basados en antígenos recombinantes de la partícula core y de las regiones NS3, NS4 y NS5. La presencia de estos anticuerpos puede indicar infección aguda o crónica, o infección pasada y curada; múltiples estudios han mostrado sensibilidades de >99% y especificidades entre 80% y 90%; sin embargo, se presentan resultados falsos positivos, especialmente en personas inmunosuprimidas, con enfermedades hematológicas o en mujeres embarazadas (6-9). En todas las personas seropositivas para anti-HCV, debe confirmarse la reactividad mediante pruebas moleculares para determinar la presencia del RNA viral (9-11).
En la última década se han introducido pruebas inmunocromatográficas rápidas (pruebas para realizar en los consultorios) para el diagnóstico de HCV. La ORAQuick HCV Rapid Antibody Test (OraSure Technologies) es una prueba rápida para detectar el anti-HCV en muestras de sangre capilar o venosa (12); la prueba SD BIOLINE HCV es una prueba inmunocromatográfica para la determinación cualitativa de anticuerpos específicos contra HCV en suero o plasma humano y ha demostrado una sensibilidad diagnostica de 100% y especificidad de 99,4% (12). En Estados Unidos, está autorizado el uso de estas pruebas en los consultorios médicos y salas de urgencias, igualmente sucede en Europa y varios países de Asia. En todos los pacientes con pruebas rápidas positivas se debe realizar la reconfirmación con pruebas moleculares para detectar el RNA viral (9, 13).
El objetivo del presente estudio es determinar la prevalencia de anti-HCV en pacientes con algún factor de riesgo para la infección mediante el uso de una prueba rápida con sangre capilar, y la confirmación de la infección por la prueba de PCR en tiempo real.
MATERIALES Y MÉTODOS
Se incluyeron pacientes atendidos en la Unidad de gastroenterología del Hospital Universitario de La Samaritana de Bogotá D.C, principal centro de referencia del departamento de Cundinamarca y que atiende pacientes de todo el país. Se definieron como factores de riesgo para hepatitis C: antecedentes de transfusión de hemoderivados antes de 1994, infección nosocomial (cirugías mayores, procedimientos médicos u odontológicos tales como hemodiálisis, endoscopia, procedimientos radiológicos invasivos), drogadicción (uso de drogas intravenosas o inhaladas), tatuajes, piercing, acupuntura, presidiarios, trabajadores sexuales, VIH/sida, enfermedades de trasmisión sexual, trabajadores de la salud, pacientes procedentes de la Orinoquía y/o Amazonía, e insuficiencia renal crónica. Además, se incluyeron pacientes remitidos por alteración del perfil hepático, hígado graso, masas hepáticas, cirrosis excepto por virus C, ascitis, y várices esofagogástricas.
Se obtuvo consentimiento por escrito y se llenó el formulario con los datos relevantes de la historia clínica de cada uno de los pacientes. Se empleó el estuche comercial SD BIOLINE HCV (Standard Diagnostics, INC. Corea), esta prueba contiene una membrana precubierta con antígenos recombinantes del HCV (core, NS3, NS4, NS5). Una proteína A coloidal se combina con la muestra de suero y se mueve a lo largo de la membrana cromatográfica formando una línea visible de reacción antígeno-anticuerpo-proteína A, con un alto grado de especificidad y sensibilidad.
Previa limpieza con alcohol medicinal, se obtuvo la muestra de sangre capilar del pulpejo de uno de los dedos de la mano no dominante; se colocó una gota de sangre en la cavidad del estuche y se agregaron 4 gotas del reactivo, se esperó que la sangre se difundiera completamente por la ranura del estuche, y el resultado se interpretó de acuerdo con las instrucciones del fabricante: como prueba negativa, la presencia de 1 banda de color dentro de la ventana de resultado, y prueba positiva, la presencia de 2 bandas de color (banda T y banda C) dentro de la misma ventana.
A los pacientes con resultado positivo en la prueba rápida se les practicó la prueba confirmatoria por el método de reacción en cadena de polimerasa en tiempo real (PCR-RT) m2000 Abott Molecular con rango de linealidad de 12 a 100 millones UI/mL.
RESULTADOS
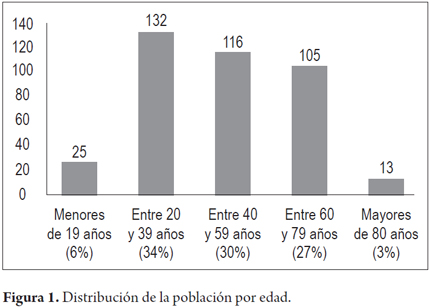
Entre enero y octubre de 2014 se estudiaron 391 pacientes, 161 mujeres (41%) y 230 (59%) hombres; edad promedio de 46,6 años y rango de edad de 14 a 86 años. La distribución por rango de edad de la población estudiada fue: menores de 19 años: 25 (6%), entre 20 y 39 años: 132 (34%), entre 40 y 59 años: 116 (30%), entre 60 y 79 años: 105 (27%), y mayores de 80 años: 13 (3%) (figura 1).
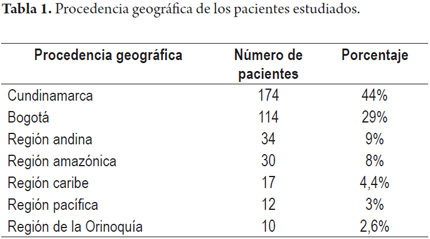
La procedencia geográfica de los pacientes se muestra en la tabla 1.
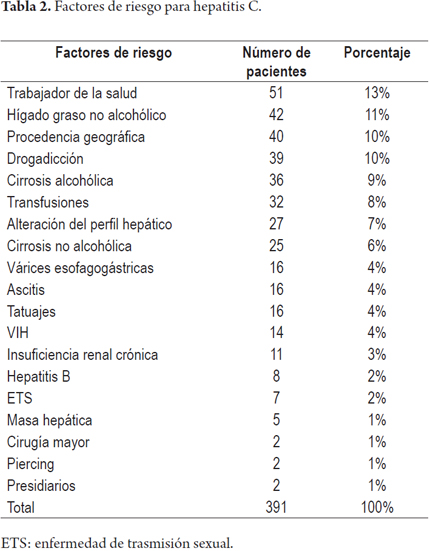
Los diferentes factores de riesgo de los pacientes tamizados para hepatitis C se muestran en la tabla 2.
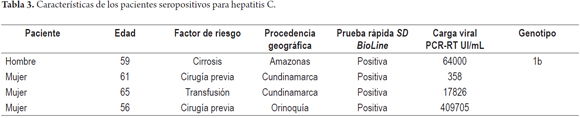
La prueba rápida para hepatitis C detectó 4 pacientes positivos (3 mujeres y 1 hombre), todos ellos confirmados por la técnica de PCR-RT, lo que da una prevalencia de la infección del 1,02%; en la tabla 3 se muestran las características de estos pacientes.
DISCUSIÓN
Los estudios mundiales muestran que los grupos de mayor riesgo para tener la infección por HCV son los individuos que recibieron transfusiones antes del año 1994, los adictos a drogas intravenosas, los pacientes en hemodiálisis, los trabajadores sexuales, los presidiarios, aquellos con piercing o tatuajes y en mucha menor proporción, los trabajadores de la salud (2, 3, 14). Se estima que en Latinoamérica hay 6,8-8,9 millones de adultos que son anti-HCV positivos. Esta región ha sido muy proactiva en el tamizaje de muestras de sus bancos de sangre minimizando así el riesgo de infección de origen transfusional.
El uso de drogas intravenosas no es un gran problema en Latinoamérica, comparado con los Estados Unidos y Europa; esto sugiere que otros factores de riesgo juegan un papel mayor en las nuevas infecciones. Los factores sospechados incluyen infecciones nosocomiales, inadecuados depósitos de agujas, procedimientos odontológicos, tatuajes y otros procedimientos que comprometen contacto con sangre infectada (por ejemplo, procedimientos cosméticos tipo pedicure) (6, 15).
En Colombia, desde el año 1993 (decreto 1571) es obligatorio el análisis para HCV de los diferentes componentes sanguíneos empleados en humanos. En 1995, Beltrán y colaboradores estudiaron 368000 unidades de sangre provenientes de 172 bancos de sangre del país y encontraron que el 1% de estas fueron reactivas para anti-HCV (16). En 1997, Cortés y colaboradores, en un estudio con bancos de sangre del departamento del Valle del Cauca, encontraron que el 0,98% de los donantes de la ciudad de Cali fueron seropositivos para anti-HCV, los donantes de otros municipios mostraron seropositividad del 0,47% (17). En 2002 en nuestro hospital, Farfán y colaboradores encontraron una prevalencia de 0,6% para anti-HCV y de 0,06% por la técnica de PCR en tiempo real en una muestra de 6 009 donantes de sangre (18). Un resultado similar encontraron Bedoya y colaboradores en un trabajo con 65535 donantes de sangre en el departamento de Antioquia, con una prevalencia de anticuerpos contra HCV de 0,6% (19). En 2012, el Informe Nacional de Indicadores de Salud registra que la seropositividad para anti-HCV fue de 0,49% en 746000 unidades de sangre analizadas de los bancos de sangre de Colombia (20). En 2014, Arroyave y colaboradores informaron que en un grupo de 166 personas transfundidas antes de 1994, la prevalencia anti-HCV era 11/166 (6,6%) y en 7/11 de ellos la prueba confirmatoria fue positiva, identificando el genotipo viral 1 en 4 de las muestras. En estos individuos no encontraron factores de riesgo diferentes a las transfusiones (14).
La escasa proporción de pacientes con HCV diagnosticados en etapas tempranas (asintomáticas) de la enfermedad demora el inicio de tratamientos curativos e impacta negativamente los servicios de salud; los enormes costos económicos que ocasionan los pacientes con cirrosis y sus complicaciones, con hepatocarcinomas y los trasplantes de hígado, exceden por mucho los costos de los tratamientos para erradicar el virus. Como se registró previamente, el conocimiento del impacto de la infección crónica es crítico para el desarrollo de estrategias para el diagnóstico oportuno, manejo y erradicación de la infección por el HCV (6), y esto incluye la identificación de individuos con la infección crónica que puedan ser candidatos a terapia antiviral.
Un problema a nivel mundial es que un número significativo de las personas infectadas (>75%) desconocen su estado y frecuentemente es detectado en estadios avanzados de la enfermedad, lo que la ha convertido en la causa más frecuente de trasplante hepático en el mundo (5, 6). Esto es causado, entre otros factores, por la falta de acceso a los servicios de salud, a la realización de pruebas diagnósticas en forma oportuna, y a la falta de conocimiento de la enfermedad en general entre la comunidad médica y la población (15). En Latinoamérica, la tasa de pacientes tratados oscila entre el 0,1%-0,89% de los pacientes diagnosticados (15). Algunos modelos han demostrado que el diagnóstico y tratamiento oportuno de una pequeña proporción de pacientes del total de infectados a nivel mundial puede contribuir significativamente en el control del impacto de la enfermedad (21). La mayor reducción en la morbilidad y mortalidad relacionada el virus C ocurre cuando se combina un diagnóstico y tratamiento oportuno con terapias de alta eficacia; algunos análisis y proyecciones demuestran que con una tasa de tratamiento del 10% de los pacientes infectados es posible lograr la eliminación del virus C (una reducción >90% de las infecciones para el 2030), y además se ha señalado que esta reducción en la morbilidad y mortalidad asociada con el virus se puede lograr con el cambio a terapias con alta respuesta viral sostenida (nuevos medicamentos antivirales de acción directa y terapias libres de interferón con efectividad >90%, menores efectos adversos con menor tiempo de tratamiento). Este impacto ya se ha magnificado en países que tienen una tasa de tratamiento del 2,8%-4,5% como Holanda, Luxemburgo y Noruega (21).
Algunos estudios han mostrado la relación costo/efectividad de programas de detención del HCV con base en la edad y no en las poblaciones de alto riesgo. Recientemente, en Estados Unidos se recomendó el tamizaje para las personas nacidas entre los años 1945 y 1965 (baby boomers), pues diferentes estudios han mostrado una mayor prevalencia de la infección en ellos (22, 23). Del mismo modo, ya se ha registrado que la prevalencia en pacientes anti-HCV positivos aumenta cuando se realiza el tamizaje en pacientes con factores de riesgo (hasta 7%), y cerca de la mitad (47%) de los pacientes detectados son candidatos a tratamiento (24).
Se debe insistir al gremio médico en la imperiosa necesidad de practicar pruebas diagnósticas de HCV en personas con factores de riesgo ya reconocidos, en especial el de transfusiones antes de 1994 y la proveniencia de regiones como la Amazonía y la Orinoquía. Esta última indicación se basa en hallazgos de investigadores de Brasil, que han informado una alta prevalencia de hepatitis C en la cuenca amazónica, tal como informaron Oliveira y colaboradores en una encuesta serológica con 161 indígenas, donde encontraron anti-HCV en el 8,8%, y se determinó RNA viral en sangre en 62,5% de estos (25). Informes del Ministerio de Salud de Brasil muestran mayor prevalencia de anti-HCV en los donantes de sangre de la región amazónica (0,62%) que en aquellos de las regiones central (0,28%) o sur (0,43%) de ese país (26). En Colombia, el estudio de Alvarado-Mora y colaboradores, con 697 habitantes de 4 departamentos (Amazonas, Chocó, Magdalena y San Andrés Islas), mostró mayor prevalencia de anti-HCV en el Amazonas (5,68%) y menor en San Andrés Islas (0,66%) (27).
El presente trabajo demuestra una prevalencia de hepatitis C de alrededor de 1% en la población seleccionada por presentar factores de riesgo. Esta prevalencia es muy semejante a la reportada por Beltrán y colaboradores en 1995 y por Cortés y colaboradores, y es mayor a la reportada previamente por nuestro grupo en banco de sangre (18). En este estudio, realizado en una población altamente seleccionada por sus antecedentes y factores de riesgo asociados, el rendimiento de la prueba rápida supera el 1% como capacidad de detección de la enfermedad. En todos los pacientes detectados por esta prueba rápida se confirmó la presencia de viremia por PCR, y en 1 de ellos se pudo realizar la genotipificación del virus C que correspondió al 1b; esto coincide con informes previos, en los cuales este genotipo es el más prevalente (66%) en los pacientes con HCV en Colombia (28). La no genotipificación en los otros pacientes se debió a limitaciones técnicas y económicas que impidieron realizar con mayor facilidad la determinación del genotipo, información de gran importancia para fines terapéuticos y de pronóstico en estos pacientes.
En conclusión, el diagnóstico temprano y oportuno de los individuos infectados con el virus de la hepatitis C, en conjunto con el acceso a las nuevas terapias libres de interferón y antivirales de acción directa con mayor efectividad y menores efectos adversos, conlleva a una disminución del impacto de la enfermedad, la morbilidad y mortalidad asociada, con disminución en la progresión de la enfermedad y necesidad de trasplante hepático. Los sistemas de salud deben ofrecer programas de tamización para identificar personas infectadas con HCV sin manifestaciones clínicas de la enfermedad. Este tipo de pruebas rápidas puede ofrecer una forma rápida y económica de lograr este objetivo.
Agradecimientos
A Laboratorios Merck Sharp & Dome por facilitar los estuches diagnósticos.
REFERENCIAS
1. Poynar T, Ratzui V, Charlotte F, Gooodmanz M, Mc Hutchinson J, Albrecht J. Rates and risk factors of liver fibrosis progression in patients with chronic hepatitis C. J Hepatol. 2001;34:730-9. [ Links ]
2. World Health Organization: Hepatitis C. 2011. Disponible en: http://ecdc.europa.eu/en/publications/Publications/TER_100914_Hep_B_C%20_EU_neighbourhood.pdf. [ Links ]
3. States M. Global policy report on the prevention and control of viral hepatitisin. WHO Member States. 2013. [ Links ]
4. Perz JF, Armstrong GL, Farrington L, Hutin YJF, Bell BP. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J Hepatol. 2006;45:529-38. [ Links ]
5. Gonzalez S, Davis G. Demographics of hepatitis C virus today. Clin Liver Disease. 2012;1(1):2-5. [ Links ]
6. Corona-Lau C, Muñoz L, Wolpert E, et al. Hepatitis C screening in the general population. Rev Inves Clin. 2015;67:104-8. [ Links ]
7. Liang TJ. Current progress in development of hepatitis C virus vaccines. Nat Med. 2013;19:869-878. [ Links ]
8. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatitis C virus infection. J Hepatol. 2011;55:245-64. [ Links ]
9. Center for Disease Control and Prevention (CDC). Testing for HCV infection: An update of guidance for clinicians and laboratorians. MMWR Morb Mortal Wkly Rep. 2013;62:362-5. [ Links ]
10. Ansaldi F, Orsi A, Sticchi F, Bruzzone B, Icardi G. Hepatitis C virus in the new era: Perspectives in epidemiology, prevention, diagnostics and predictors of response to therapy. World J Gastroenterol. 2014;20(29):9633-52. [ Links ]
11. Cobb B, Heilek G, Vilchez RA. Molecular diagnostics in the management of chronic hepatitis C: Key considerations in the era of new antiviral therapies. BMC Infectious Diseases. 2014;14(Suppl 5):S5-S8. [ Links ]
12. Grakoui A, Wychowski C, Lin C, Feinstone SM, Rice CM. Expression and identification of hepatitis C virus polyprotein cleavage products. J Virol. 1993;67(3):1385-95. [ Links ]
13. Mutimer D, Aghemo A, Diepolder H, Negro F, Robaeys G, Ryder S, et al. EASL Clinical Practice Guidelines: Management of hepatitis C virus infection. J Hepatol. 2014;60:392-420. [ Links ]
14. Arroyave J, Álvarez C, Correa G, Balcázar N, Arbeláez MP, Navas MC. Infección por hepatitis C en individuos transfundidos antes de 1994 en Antioquia, Colombia. Rev Col Gastroenterol. 2014;29(4):383-9. [ Links ]
15. Kershenobich D, Razavi H, Sanchez-Avila JF, et al. Trends and projections of hepatitis C virus epidemiology in Latin America. Liver Inter. 2011;31(2):18-29. [ Links ]
16. Beltrán M, Raad J, Ayala M, Ching R. Tamizaje de enfermedades infecciosas en bancos de sangre, Colombia, 1995. Biomédica. 1997;17:137-42. [ Links ]
17. Cortés AB, Beltrán MDM, Olaya B, Sc M, Hernández M. Riesgo de enfermedades infecciosas transmitidas por transfusión en el Valle del Cauca, Colombia. Colomb Med. 1999;30:13-8. [ Links ]
18. Farfán Y, Garzón M, Rey MH, Molano J, Lizarazo J, Marulanda J. Prevalencia de hepatitis C por reacción en cadena de polimerasa (PCR) en donantes del banco de sangre. Rev Col Gastroenterol. 2007;22(4):308-12. [ Links ]
19. Bedoya JA, Cortés MM, Cortés JA. Seroprevalence of markers of transfusion transmissibble infection in blood bank in Colombia. Rev Saude Publica. 2012;46(6):950-9. [ Links ]
20. Informe Nacional de Indicadores. Red Nacional de Bancos de Sangre y Servicios Transfusionales. Instituto Nacional de Salud; 2012. [ Links ]
21. Gane D, Kershenobich D, Seguin-Devaux C, et al. Strategies to manage hepatitis C virus (HCV) infection disease burden - volume 2. J Viral Hepatitis. 2015;22(Suppl 1):46-73. [ Links ]
22. Smith BD, Beckett GA, Falck-Ytter Y, Holtzman D, Teo CG, Jewett A, et al. Recommendations for the identification of chronic hepatitis C virus infection among persons born during 1945-1965. MMWR Recomm Rep. 2012;61(RR-4):1-32. [ Links ]
23. McGarry LJ, Pawar VS, Panchmatia HR, et al. Economic model of a birth cohort screening program for hepatitis C virus. Hepatology. 2012;55:1344-55. [ Links ]
24. Mallette C, Flynn M, Promrat K. Outcome of screening for hepatitis C virus infection based on risk factors. Am J Gastroenterol. 2008;103:131-7. [ Links ]
25. Oliveira C, Silva C, Kemper F, et al. Hepatitis B and C infection among Brazilian Amazon riperians. Rev Soc Bras Med Trop. 2011;44(5):546-50. [ Links ]
26. Brazil Ministry of Health for capacity on epidemiological surveillance on viral hepatitis. Ministry of Health, Brazilia, Brazil, 2008. Disponible en: http://www.aids.gov.br/sites/default/files/cbve hepatites.pdf. [ Links ]
27. Alvarado-Mora MV, Gutiérrez MF, Gomes-Gouvea M, Azevedo R, Carrilho F, Rebello J. Hepatitis B (HBV), Hepatitis C (HCV) and Hepatitis delta (HDV). Viruses in the Colombian Population - How is the epidemiological situation? PLOS One. 2011;6(4):e18888. [ Links ]
28. di Filippo D, Cortés F, Beltrán M, Arbeláez MP, Jaramillo S, Restrepo JC, et al. Molecular charaterization of hepatitis C virus in multi-transfused Colombian patients. J Virol. 2012;9:242. [ Links ]











 text in
text in