Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.30 no.4 Bogotá Oct./Dec. 2015
Aspectos histopatológicos de la evaluación del donante en trasplante hepático, una aproximación a la consulta intraoperatoria
Histopathological Evaluation of Liver Donors: An Approach to Intraoperative Consultation during Liver Transplantation
Rocío del Pilar López Panqueva MD. (1)
(1) Patóloga, Hospital Universitario Fundación Santa Fe de Bogotá. Departamento de Patología y Laboratorios, Universidad de Los Andes. Bogotá, Colombia.
Fecha recibido: 03-11-15 Fecha aceptado: 17-11-15
Resumen
El éxito de un trasplante hepático en gran parte radica en la selección del candidato óptimo y del mejor órgano. En los últimos años se ha trabajado de forma importante hacia la elaboración de criterios de selección y de asignación basados en la evidencia. La evaluación histopatológica de las biopsias hepáticas desempeña un papel importante en el contexto del trasplante hepático, tanto en la evaluación pretrasplante de órganos considerados como marginales y en el diagnóstico y el tratamiento del paciente que ha recibido un trasplante.
El uso de la biopsia intraoperatoria para evaluar órganos marginales en la evaluación pretrasplante es debatido por unos grupos y apoyado por otros. Por otra parte, los cambios morfológicos que ocurren en el postrasplante como el rechazo agudo celular y el rechazo crónico están muy bien reconocidos y la biopsia hepática sigue siendo considerada el patrón oro para el diagnóstico de estas condiciones, no así la biopsia del posible donante, sin embargo su precisión ha sido cuestionada debido en gran parte a la gran variabilidad y subjetividad, dadas principalmente por las dificultades diagnósticas que plantea esta patología y a la experiencia del patólogo (1). En esta revisión se discutirán los tópicos más importantes y frecuentes, así como algunos que pueden crear problemas de diagnóstico en patología del trasplante, se hará énfasis en las características patológicas y el diagnóstico diferencial. Los temas serán tratados en tres partes, esta primera entrega corresponde a los aspectos relevantes de la biopsia del donante.
Palabras clave
Biopsia hepática, biopsia por congelación, consulta intraoperatoria, donante hepático, evaluación pretrasplante hepático, biopsia del donante, donante marginal.
Abstract
The success of liver transplantation depends largely on the selection of the optimal donor and the best organ. In recent years significant work has been done to develop selection criteria and evidence-based organ assignments.
Histopathological evaluation of liver biopsies plays an important role both in pretransplant evaluation of possibly marginal organs and in the diagnosis and treatment of patients who receive transplants. The use of intraoperative biopsies to evaluate organs found to be marginal in the pretransplant evaluation is opposed by some groups and supported by others. On the other hand, in contrast to the debate about the use of liver biopsies to evaluate donor organs, liver biopsies are still considered to be the "gold standard" for diagnosis of morphological changes such as acute rejection and chronic rejection that occur following transplantation. Nevertheless, the accuracy of biopsies has been questioned due to the variability and subjectivity of these evaluations which is caused primarily by the diagnostic difficulties posed by this disease and by the experience of the pathologist (1). The most important and frequent topics in this area will be discussed in this review. In addition, issues that can cause problems for diagnosing pathologies of the donor organ will be discussed. The article emphasizes pathological features and differential diagnosis. It is organized into three installments. This installment, the first, is about issues relevant aspects to biopsies of the donor organ.
Keywords
Liver biopsy, frozen section, intraoperative consultation, donor liver, pretransplant evaluation, biopsy of donor liver, marginal donor
EVALUACIÓN DEL DONANTE
La biopsia hepática por congelación o intraoperatoria realizada durante la evaluación de un posible donante ha sido muy controversial, es recomendada como rutina por unos grupos y demeritada por otros. Los diferentes centros de trasplante utilizan criterios clínicos y de laboratorio para determinar el uso de un órgano, clásicamente es considerado donante ideal aquel que implica un riesgo muy bajo de mala función inicial o fracaso del injerto, excluye factores adicionales que no afectan directamente este resultado, como son problemas técnicos durante el procedimiento, complicaciones quirúrgicas, o enfermedad recurrente. Este donante es menor de 40 años, con muerte cerebral posterior a un trauma, estable hemodinámicamente al momento del rescate, sin enfermedades de base, hígado sin esteatosis y ausencia de enfermedades transmisibles. Sin embargo, la disminución de la tasa de donación, una mortalidad en lista de espera cercana al 10% y la creciente solicitud de pacientes que necesitan un trasplante hepático ortotópico para el tratamiento de la enfermedad hepática ha llevado a los grupos de trasplante a tener la necesidad de utilizar hígados considerados marginales o a ampliar los criterios de inclusión para posibles donantes utilizando aloinjertos de donantes ancianos, la donación después de la muerte cardíaca o donantes con serologías positivas para la hepatitis B y la hepatitis C y finalmente definir la utilidad de un órgano. Por lo tanto es importante identificar los factores que pueden llevar a la disfunción primaria del injerto, pobre función inicial o pobre supervivencia tardía del injerto, también debemos diferenciar entre un donante ideal y un injerto ideal. Estas razones son suficientes para que estemos familiarizados con los posibles hallazgos histopatológicos, las dificultades que se pueden presentar y sus diagnósticos diferenciales. Así cada grupo transplantador establecerá los pros y contras de esta metodología y decidirá la mejor conducta, para obtener el injerto que minimice al máximo los riesgos para el receptor (2,3).
¿CUÁL ES EL PAPEL DE LA BIOPSIA?
La biopsia por congelación permite al cirujano aclarar la mayoría de las dudas que puedan surgir durante la evaluación del órgano donante. La biopsia intraoperatoria es una evaluación rápida, usualmente en menos de 30 minutos, logra establecer alteraciones de la arquitectura hepática, la presencia de esteatosis evaluando el grado y el tipo de vacuola grasa que está presente en el hígado diferenciando si se trata de macro o microvacuola permite determinar si existe inflamación o la presencia de necrosis de hepatocitos. Es considerada la mejor opción dado que las biopsias fijadas en formol e incluidas en parafina utilizando procesamientos rápidos requieren entre 3 y 4 horas de duración, lo cual prolongaría inaceptablemente el tiempo de isquemia fría. Usualmente la biopsia por congelación logra demostrar las características de lesiones sobreimpuestas que pueden representar contraindicaciones para el trasplante, especialmente en el contexto de donantes de edad avanzada, hemodinámicamente inestables o con algún antecedente que requiera aclaración morfológica, dado que la apariencia del hígado es normal al momento del explante, como por ejemplo si existe el antecedente de abuso de alcohol, hepatitis C, pruebas de función hepática anormales o imágenes no conclusivas. También puede ser útil cuando se identifica un hallazgo inesperado como una lesión nodular intra o extrahepática que contraindique en forma absoluta el trasplante (3).
Desafortunadamente la biopsia por congelación prolonga el proceso de selección, lo que aumenta el tiempo de isquemia fría y el costo del procedimiento; además, si el estudio por congelación no puede ser realizado en el mismo sitio donde se hace el rescate, tiene dificultades en la interpretación atribuidos generalmente a la sobreestimación de la esteatosis (particularmente de microesteatosis) debido al artefacto técnico que producen las gotas muy pequeñas de agua atrapadas en los hepatocitos, producidas durante el tiempo del transporte hasta el laboratorio de patología y por el mismo procedimiento de congelación. Los beneficios de la biopsia deben ser evaluados cuidadosamente teniendo en cuenta todos los factores de riesgo tanto del donante como del posible receptor y de las consideraciones éticas basadas en la justicia, la equidad y la necesidad del trasplante, utilizando un órgano considerado como marginal (4). Los criterios para la aceptación o rechazo de un órgano de donante marginal varían de país a país y en cada centro transplantador, no hay consenso, ni algoritmos estrictos o bien definidos; algunas de las recomendaciones en relación con la biopsia intraoperatoria son las que revisaremos en este artículo.
CONSIDERACIONES GENERALES DE LA BIOPSIA
Es indispensable una comunicación acertada entre el cirujano que realiza el rescate y el patólogo. El conocimiento de la duda que generó el estudio debe ser informado al patólogo, ya que facilita el estudio e interpretación de los hallazgos, en especial el conocimiento de la inspección visual y palpación del hígado durante el procedimiento quirúrgico, aun cuando es bien conocido que es un dato subjetivo y depende de la experiencia del cirujano (4,5).
Tejido ideal
Es recomendable que el tamaño de la biopsia sea una cuña de 1,5 cm x 1,5 cm o una biopsia con aguja trucut de 2,0 cm de longitud por 0,2 cm de diámetro, evitando cicatrices subcapsulares, biopsias superficiales o poco profundas. La biopsia intraoperatoria debe realizarse en el momento del clampeo vascular, tomada del borde anterior e inferior del hígado, al menos de dos sitios diferentes del lóbulo derecho y lóbulo izquierdo, preferiblemente de los segmentos 3 y 6 o 7. Las biopsias tomadas a este nivel eliminan algunos de los artefactos debidos al muestreo por fibrosis subcapsular y porque obtienen parénquima más profundo. Cuando se toma una muestra de masa o lesión, esta debe ir por separado, además debe tomarse la biopsia del parénquima no tumoral para evaluar la posibilidad de enfermedad hepática crónica del hígado asociada o de otros hallazgos que puedan ser contraindicaciones para el trasplante (6,7).
Transporte de la muestra
La muestra debe ser transportada de inmediato, en fresco, en un ambiente seco, con gasa o disponerla en frasco vacío y refrigerada, en un recipiente estéril. No se debe utilizar ningún medio o solución de transporte, tampoco colocar la biopsia en una toalla o gasa húmeda ya que pueden causar que la grasa sea liberada de los hepatocitos dando como resultado una subestimación del grado de esteatosis. También debe evitarse el uso de solución salina porque produce artefactos que dificultan la interpretación del patólogo, por congelación de las goticas de agua en el tejido, la formación de cristales hace que se sobreestime el porcentaje de grasa. Igualmente el secado al aire disminuye rápidamente la cantidad de grasa y compromete la exactitud de la interpretación. Otra técnica útil para evitar artefactos podría ser un proceso de congelación relativamente lento a menos 20 °C y nunca utilizar nitrógeno líquido (4,8).
Procesamiento de la biopsia
Se debe secar suavemente, de ser posible, dividir la muestra en 2, un fragmento se coloca en OCT y se congela en criostato a -26 °C. Realizar cortes a 4 micras y se colorea con hematoxilina-eosina. El control de congelación se fijará después en formol tamponado neutro al 10%, al igual que la otra mitad del tejido para realizar procesamiento de rutina y estudios especiales de histoquímica si son requeridos. Los estudios definitivos en cortes por parafina (control de congelación y fragmento no congelado) son muy importantes para la correlación futura de los hallazgos con lo observado previamente.
Métodos complementarios
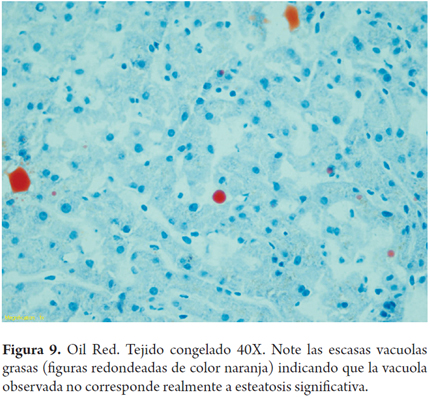
En la evaluación de lípidos al momento de la biopsia por congelación puede ser útil el uso de tinciones para grasa con aceite rojo (Oil Red), es sensible para detectar esteatosis, aumenta la cantidad de grasa observada, pero también produce artificios, hay tinción de sinusoides y presencia de vacuolas extracelulares sobredimensionando la presencia de grasa; además es altamente dependiente de los conocimientos del histotecnólogo y de la falta de disponibilidad de esta técnica en forma rutinaria en los laboratorios de patología (4,8,9).
¿Cuáles son los factores que influyen para el buen resultado de un trasplante?
Existen múltiples factores que aumentan el riesgo de fracaso de un trasplante hepático, unas dependen del donante, del receptor o del momento de la donación o del estado perioperatorio, algunos de los cuales se enumeran en la Tabla 1. Cuando un donante cumple 1 o 2 de estos criterios se considera un donante marginal y cuando cumple 3 o más de ellos es un donante marginal con criterios expandidos. Algunos grupos recomiendan utilizar estos órganos solo en receptores de bajo riesgo (bajo MELD) y altas comorbilidades. Otros estudios han mostrado que características demográficas como la edad, raza, peso y talla del donante así como las características de la muerte del donante son importantes de tener en cuenta para obtener un mejor resultado (10).
Talla, ancho del tórax y peso
Cada 10 cm de disminución de la altura del donante en relación a su posible receptor aumenta el riesgo de pérdida del injerto, igualmente el aumento del índice de masa corporal relacionado con mayor esteatosis. Se utilizan parámetros antropométricos e imagenológicos para estimar el volumen y tamaño más adecuado, en especial con donante vivo-relacionado (11).
Raza
Los hígados de donantes afroamericanos e hispanos tienen aproximadamente 21.5%-30% más de riesgo de fracaso del injerto a 1 año en comparación con los donantes blancos. En algunos estudios esta diferencia no ha sido estadísticamente significativa (12).
Edad
La edad del donante es uno de los factores más estudiados, en las últimas décadas se ha aumentado notoriamente la edad de los donantes. Es claro que esta situación afecta la capacidad regenerativa del hígado, pero se ha demostrado que al minimizar factores como la isquemia fría (idealmente debe ser menor de 8 horas), la hipernatremia y la presencia de esteatosis leve o mínima, los resultados a corto y largo plazo del postrasplante son muy semejantes en donantes menores de 60 años que en los donantes de mayor edad. La recomendación de la mayoría de los grupos es no utilizar donantes mayores de 70 años y en caso de usarlos el donante no debe tener ningún otro factor de riesgo asociado (13,14,15).
Infecciones crónicas
Otro factor que empeora el funcionamiento de los hígados limítrofes o marginales en relación con la edad son los receptores con serología para hepatitis C (HVC) positiva, en los que existe una relación entre la progresión de la fibrosis y la edad avanzada, lo que favorece una recidiva más precoz y la hace más grave, por lo que se recomienda no asignar donantes de edad avanzada a los receptores infectados por el virus de la hepatitis C.
Tiempo de isquemia
El tiempo de isquemia fría mayor de 12 horas produce un crecimiento exponencial en la incidencia de disfunción del injerto cuando se asocia a órganos añosos, cada hora adicional de tiempo de isquemia fría tiene un 1% más de riesgo de pérdida del injerto; por último, la edad aumenta por sí sola otras asociaciones y comorbilidades como la esteatosis macrovesicular (3).
Donación después de la muerte
Se puede utilizar de una manera similar a la de un hígado de un donante >70 años de edad, es decir cuando no exista ningún otro factor de riesgo asociado (10).
ASPECTOS HISTOPATOLÓGICOS MÁS FRECUENTES QUE PUEDEN OBSERVARSE EN EL ESTUDIO INTRAOPERATORIO
Esteatosis
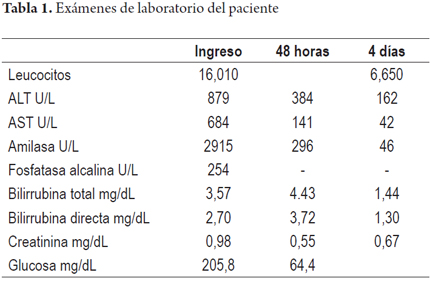
La esteatosis hepática es un factor de riesgo independiente, considerado uno de los criterios más importantes al que se enfrenta el cirujano de rescate cuando lo sospecha por la simple inspección macroscópica al observar un cambio de coloración del hígado que se ve amarillo, aunque existe una pobre correlación entre la evaluación del cirujano y el grado de esteatosis cuando la esteatosis supera el 35%. Aquí es donde la biopsia intraoperatoria o biopsia por congelación ha mostrado su mayor utilidad (3).
Cerca del 25% de los hígados de donantes tienen algún grado de esteatosis especialmente relacionada con sobrepeso, trastornos metabólicos, ingesta de alcohol o drogas; y no hay acuerdo sobre el porcentaje de esteatosis o un punto de corte considerado como aceptable. Este varía en cada unidad de trasplante, tampoco está bien establecido cuál es el efecto de la esteatosis en el postrasplante (7,8). Una revisión sistemática reciente mostró que la esteatosis se asocia con un peor resultado clínico, al aumentar la morbilidad de los receptores y parece estar asociado con una mayor susceptibilidad a la isquemia. La acumulación de grasa en los hepatocitos y el volumen celular aumentado causan un deterioro de la microcirculación hígado, se asocia con una disminución de la capacidad de producción y del almacenamiento de ATP, con un aumento de la peroxidación lipídica y de la liberación del factor de necrosis tumoral-α (16).
Algunas de las razones descritas sobre de la disminución de la supervivencia del injerto cuando existe un porcentaje importante de esteatosis en los injertos incluyen el aumento de las complicaciones durante la cirugía, en especial por la pérdida de sangre intraoperatoria, con una recuperación más lenta de la función sintética y mayor susceptibilidad a la lesión, además potencia las lesiones por isquemia/reperfusión probablemente porque hay deterioro del metabolismo hepático durante la isquemia fría, al aumento del estrés oxidativo en la reperfusión y a la pobre preservación tisular.
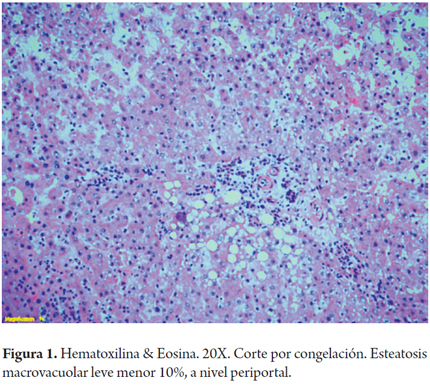
Para utilizar un órgano con tranquilidad con un mínimo impacto en el resultado postrasplante, la mayoría de los grupos acepta en un donante la presencia de esteatosis macrovacuolar leve o menor del 30% (16). Mientras que con esteatosis moderada (mayor del 30% pero menor del 60%), su uso es muy discutido, la incidencia de disfunción primaria puede llegar al 15% y la tasa de la función retardada del injerto se aproxima al 35%. Son más susceptibles de hemorragia y fibrinólisis (3). Los órganos pueden ser utilizados minimizando al máximo otros factores de riesgo; o en ciertas circunstancias, como por ejemplo si el tiempo de isquemia fría ha sido corto y el receptor tiene un MELD bajo. La selección adecuada del receptor y el menor tiempo de isquemia fría son de suma importancia para el uso con éxito de los aloinjertos moderadamente esteatósicos (3,7-9,16).
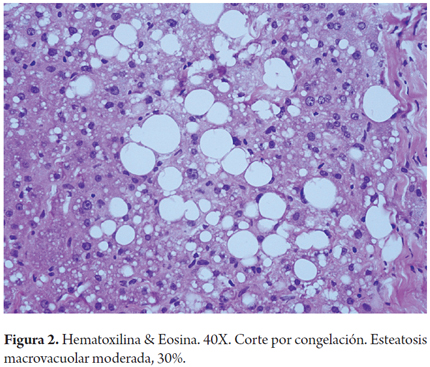
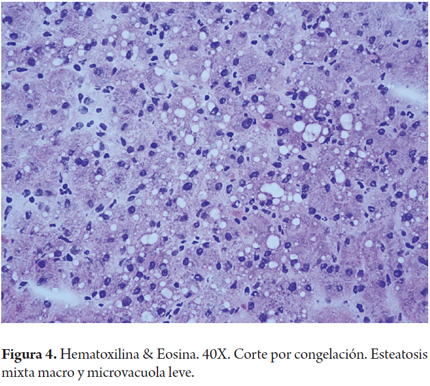
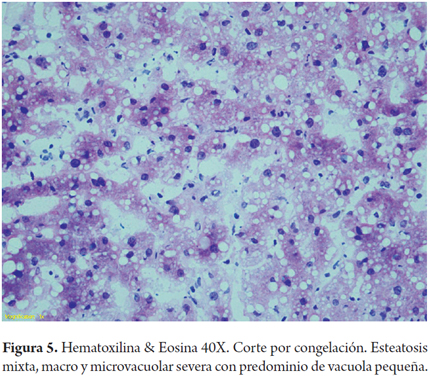
Cuando la esteatosis es severa o mayor del 60% del volumen tisular se tiene un mayor riesgo de disfunción primaria del injerto, existe consenso para descartar estos órganos. Muy pocos grupos la aceptan en condiciones muy específicas como es la inclusión en protocolos de investigación que utilizan soluciones de preservación con tiempos muy cortos de isquemia fría y en receptores altamente seleccionados (3). En las siguientes imágenes se ilustran varios ejemplos (Figuras 1, 2, 3). No es claro en la literatura lo que ocurre cuando existe esteatosis mixta macro y microvesicular, ni el porcentaje permitido de la misma. Aunque muchos realizan una sumatoria total del porcentaje de esteatosis, especificando que es el porcentaje de esteatosis macrovacuolar el que importa para tomar la decisión final de aceptar un órgano (Figuras 4 y 5).
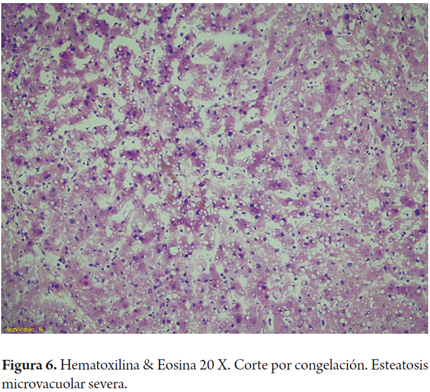
La esteatosis de vacuola pequeña o microvacuolar es de muy rara presentación, esta condición es un hallazgo inusual en hígados considerados "sanos", pero no es infrecuente encontrarlo en las biopsias de donante, sea por artificios, como ya mencionamos, o después de la isquemia caliente. Es aceptado que la esteatosis microvesicular, sin importar el porcentaje en el que está presente, no afecta la sobrevida del injerto ni produce mayor riesgo de disfunción primaria del injerto, excepto en pacientes sometidos a retrasplante (Figura 6) (17,18,19).
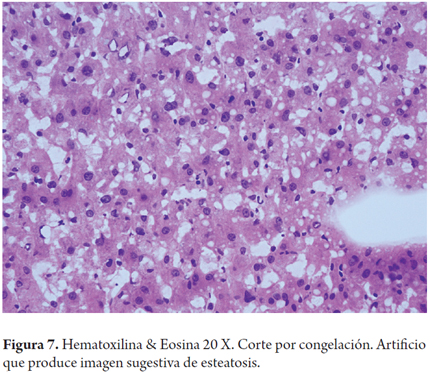
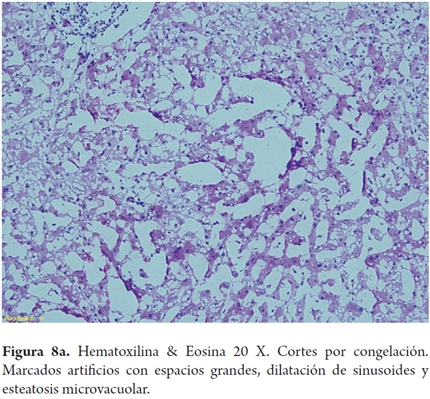
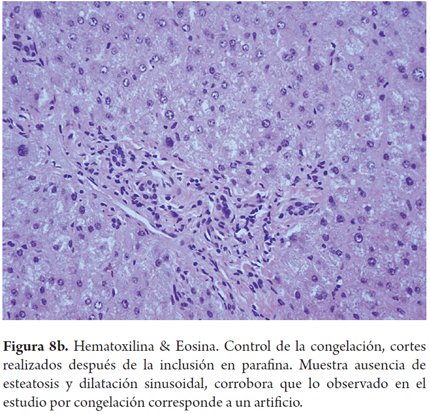
El error más frecuente en la interpretación por parte del patólogo de las biopsias intraoperatorias es la sobreestimación de la esteatosis macrovacuolar, al relacionarla con artefactos por edema, hinchazón y vacuolización del tejido durante el transporte y el procesamiento de la biopsia; esta situación puede tener un impacto clínico significativo en los centros donde los hígados con 30% de esteatosis son descartados. También el proceso de congelación por sí mismo puede producir artefactos de microvacuola o dar una apariencia de severa dilatación sinusoidal. Para mejorar la precisión de la clasificación esteatosis podría utilizarse una tinción auxiliar en estos porcentajes limítrofes, como el Oil Red O (Figuras 7, 8a, 8b y 9) (7).
Infecciones e Inflamación
La historia de hepatitis viral es una contraindicación relativa. Cuando existe un donante positivo para hepatitis C no puede ser utilizado este órgano para un receptor negativo, pero si el receptor está infectado por el virus de la hepatitis C es aceptado un donante igualmente positivo, estos pacientes no tienen más recurrencia postrasplante comparados con los que reciben un órgano no infectado. El beneficiario del trasplante y su familia deben estar informados de esta situación (20). Los receptores con cirrosis por hepatitis B pueden recibir hígados procedentes de donantes con anti-HBc positivo porque van a recibir profilaxis antiviral.
Si existe algún criterio clínico que haga sospechar la posibilidad de actividad o fibrosis en el donante, el papel de la biopsia por congelación es determinar el grado de inflamación o la presencia de alteración arquitectural por fibrosis. La presencia de inflamación de linfocitos, en especial a nivel portal o lobulillar, es un hallazgo frecuentemente observado, en especial cuando un donante ha permanecido varios días en una unidad de cuidados intensivos. Si no está acompañada de otros cambios y si previamente se ha descartado la posibilidad de una hepatitis de etiología viral no es ninguna contraindicación para la donación. Es aceptada una inflamación leve o mínima y fibrosis leve con expansión fibrosa portal (21).
Está muy bien establecido que la muerte cerebral predispone a la infección, debida al deterioro del sistema inmune y a la inestabilidad hemodinámica que favorecen la traslocación bacteriana. Las infecciones bacterianas en el donante no representan por si mismas un factor de riesgo para el fracaso del injerto, ya que la posibilidad de transmisión de una infección bacteriana en el caso de bacteremia en el donante es muy baja y aun cuando la prevalencia de los cultivos de los donantes en la mayoría de las series es alta (cercana al 50%), la velocidad de transmisión se mantiene baja (4%), se recomienda una cuidadosa vigilancia microbiológica del receptor del injerto y adecuada antibioticoterapia, esto minimiza el riesgo. El único predictor significativo de infección en los donantes es una estancia en la UCI de 3 o más días. El papel de la biopsia por congelación es limitado, probablemente en un futuro no tan lejano la evidencia objetiva de una infección en el donante podrá determinarse más fácilmente mediante técnicas de tipificación genómica, desafortunadamente aún no están disponibles en forma amplia en los laboratorios de patología y su aplicación no es tan rápida ni económica como para ser utilizado en forma rutinaria (21,22).
Necrosis
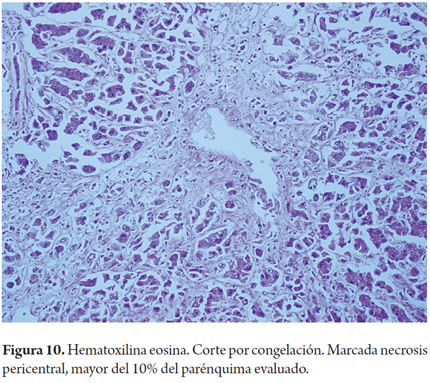
Numerosos eventos pueden producir necrosis en un posible donante, en especial aquellos relacionados con episodios de isquemia como lo es el antecedente de algún episodio de hipovolemia o choque hipovolémico. Los cambios de isquemia con necrosis a nivel pericentral (zona 3) pueden ser evidentes en la biopsia por congelación. Sin embargo, un error frecuente de subinterpretación ocurre cuando el tejido ha sido sumergido en solución salina, esta situación puede causar la distorsión de la morfología, incluyendo la formación de grumos y edema citoplasmático. También puede ocurrir en el momento del trasplante por el aumento del tiempo de isquemia fría, sobre todo en la donación después de la muerte cardíaca. La necrosis pericentral es predictora de falla del injerto. No hay consenso para determinar el porcentaje permitido, un punto de corte aceptable es el 10% de necrosis confluente (Figura 10) (12, 23).
Lesiones tumorales o pseudotumorales
Los receptores de aloinjertos hepáticos tienen un mayor riesgo de tumores de novo, como síndromes linfoproliferativos, cáncer de piel, tumores de las vías respiratorias superiores y del intestino, en especial aquellos con cirrosis alcohólica o por infección con el virus de la hepatitis C. El riesgo de enfermedad transmitida por el donante es muy bajo, siendo inferior al 0,03% y puede ser reducido aun cuando no excluido por completo, con una cuidadosa selección del donante.
En la mayoría de estudios publicados que describen la presencia de tumores en el hígado del donante, estos fueron identificados después a la donación, por metástasis mal interpretadas previa donación como una hemorragia cerebral o un evento cerebrovascular. Los casos de transmisión de cáncer de colon, páncreas, melanoma y coriocarcinoma han sido reportados en estas circunstancias y con pobres resultados dados por muerte o necesidad de retrasplante. Si el donante tiene una conocida historia de cáncer, el riesgo va a depender del tipo de tumor, del tratamiento recibido y del tiempo ocurrido entre el diagnóstico y la donación de órganos, pero en la gran mayoría de los grupos de trasplante el antecedente de una lesión tumoral en el donante es una contraindicación para la donación, exceptuando tumores del sistema nervioso central (SNC) que no hayan tenido alteración de la barrera hematoencefálica; es decir pacientes que no hayan tenido derivaciones de líquido cefalorraquídeo, craneotomía, quimioterapia sistémica ni radioterapia, en estas circunstancias se puede aumentar la probabilidad de metástasis extracraneales. En los tumores del SNC clasificados como grado III o IV por la Organización Mundial de la Salud (OMS) aumenta al 10% la tasa de transmisión, sin embargo no todos los estudios han replicado estos resultados. Un subgrupo de estos donantes podría ser una valiosa fuente de órganos cuando se requiere un trasplante de urgencia, valorando muy juiciosamente el riesgo/beneficio. Una recomendación importante para el cirujano de rescate es realizar un examen completo de la cavidad torácica y abdominal en busca de un cáncer oculto y considerar realizar una autopsia para aquellos donantes con antecedente de cáncer (24,25,26).
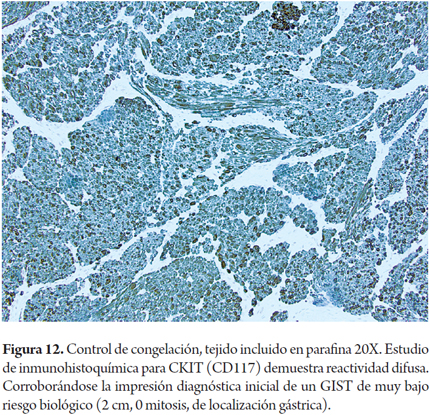
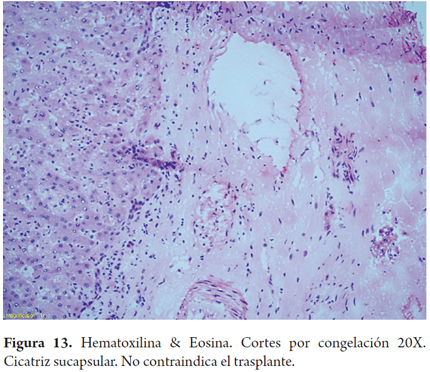
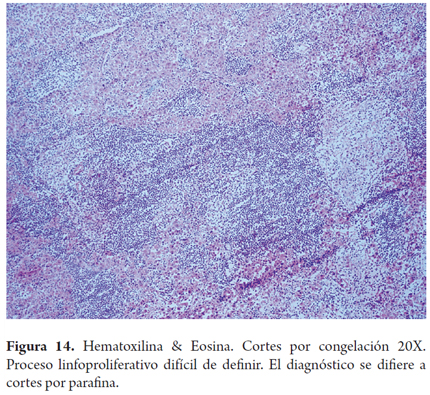
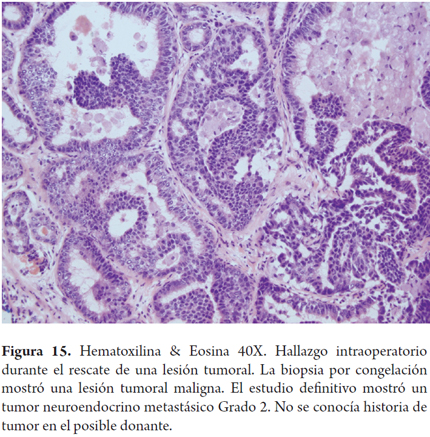
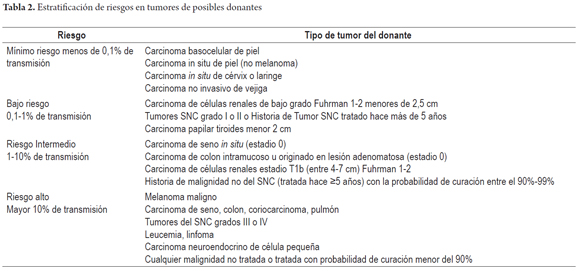
Otros hallazgos como la hiperplasia nodular focal, microhamartomas de vías biliares o complejos de Von Meyenburg, y los granulomas no activos, son encontrados en forma incidental como lesiones subcapsulares pequeñas, blancas y firmes, únicas o múltiples; ninguna de estas son una contraindicación para el trasplante. La hiperplasia nodular puede confundirse para el patólogo con cirrosis, en especial si no conoce el aspecto macroscópico que al cirujano le plantea una lesión tumoral. Si los microhamartomas y los granulomas son múltiples pueden hacer pensar que se trata de metástasis (2). El rol del patólogo en el estudio intraoperatorio es especialmente útil cuando durante la cirugía de rescate se encuentra una masa hepática o de otro órgano, lograr identificar lesiones benignas, cicatriciales, granulomas antiguos inactivos hacen que no se contraindique un trasplante, estas entidades son considerados sin riesgo (Figuras 11, 12 y 13). Las neoplasias hematopoyéticas pueden ser muy difíciles de diagnosticar en biopsias por congelación. Por lo cual cualquier duda de malignidad por parte del patólogo debe ser contraindicación para la donación. No se recomienda el uso de donantes con lesiones tumorales malignas primarias o metastásicas (Figuras 14 y 15) (Tabla 2) (26).
Depósito de pigmentos
- Lipofuscina: es un pigmento fino localizado a nivel pericentral (zona 3), se observa usualmente asociado al envejecimiento. No tiene implicaciones adversas.
- Hierro: cuando observamos pigmento pardo o café fino o grueso puede corresponder a pigmento de hierro, si está localizado en las células de Kupffer es la llamada siderosis secundaria, una causa frecuente es la siderosis postransfusional y no contraindica la donación. Otras condiciones que producen depósitos de hierro son el alcohol, hepatitis C o B observando una siderosis hepatocelular como un pigmento pardo oscuro a nivel periportal; en la sobrecarga de hierro por una hemocromatosis hereditaria el pigmento es severo, con gradiente de densidad portocentral o panlobulillar, inclusive localizado en endotelios y ductos biliares. El problema radica cuando es leve, ya que solo puede ser detectado con coloración de azul de Prusia y en cortes definitivos por parafina. No existen muchos datos en la literatura acerca de lo que puede ocurrir en el postrasplante, ya que el hierro se metaboliza en forma muy rápida llenándose las células de Kupffer y los macrófagos portales de este pigmento. Sin embargo, está demostrada la susceptibilidad del receptor para desarrollar infecciones oportunistas como aspergilosis invasiva, criptococosis, zigomicosis, infecciones bacterianas por Staphylococcus aureus o por Cytomegalovirus de presentación fulminante o con enfermedad diseminada al parecer relacionadas con la sobrecarga de hierro, o por anomalías en la homeostasis del hierro. Por estos motivos se recomienda solo aceptar la siderosis no hemocromatósica leve y moderada (2,27,28).
- Bilis: puede confundirse con la lipofuscina o hierro, cuando está localizada a nivel perivenular, si está acompañada de bilis canalicular y formaciones rosetoides hepatocelulares ayuda a diferenciarlo.
CONCLUSIÓN
Encontrar el equilibrio adecuado entre la evaluación clínica efectiva y objetiva del donante, las variables o factores de riesgo que pueden alterar un órgano donante, lograr minimizar la combinación de edad, el tiempo de isquemia fría, esteatosis y el uso racional, con indicación precisa de una biopsia intraoperatoria para la evaluación histológica del hígado de un posible donante puede proporcionar al equipo de trasplante una información rápida, eficaz y de un adecuado valor predictivo, que debe reflejarse en mejores resultados para el receptor de un trasplante y tal vez a largo plazo reducir los costos para el paciente y para el sistema de salud.
REFERENCIAS
1. Naini BV, Lassman CR. Liver Transplant Pathology. Surgical Pathology Clinics. 2013;6(2):277-93. [ Links ]
2. Melin C, Miick R, Young NA, Ortiz J, Balasubramanian M. Approach to intraoperative consultation for donor liver biopsies. Arch Pathol Lab Med. 2013;137(2):270-4. [ Links ]
3. Durand F, Renz JF, Alkofer B, Burra P, Clavien P-A, Porte RJ, et al. Report of the Paris consensus meeting on expanded criteria donors in liver transplantation. Liver Transpl. 2008;14(12):1694-707. [ Links ]
4. Fiorentino M, Vasuri F, Ravaioli M, et al. Predictive value of frozen-section analysis in the histological assessment of steatosis before liver transplantation.Liver Transpl. 2009;15(12):1821-5. [ Links ]
5. Rey JW, Wirges U, Dienes HP, Fries JW. Hepatic steatosis in organ donors: disparity between surgery and histology? Transplant Proc. 2009;41(6):2557-60. [ Links ]
6. Frankel WL, Tranovich JG, Salter L, Bumgardner G, Baker P. The optimal number of donor biopsy sites to evaluate liver histology for transplantation. Liver Transpl. 2002;8(11):1044-50. [ Links ]
7. D'Alessandro E, Calabrese F, Gringeri E, Valente M. Frozen-section diagnosis in donor livers: error rate estimation of steatosis degree. Transplant Proc. 2010;42(6):2226-8. [ Links ]
8. Heller B, Peters S. Assessment of liver transplant donor biopsies for steatosis using frozen section: accuracy and possible impact on transplantation. J Clin Med Res. 2011;3(4):191-4. [ Links ]
9. Marsman H, Matsushita T, Dierkhising R, Kremers W, Rosen C, Burgart L, et al. Assessment of donor liver steatosis: pathologist or automated software? Hum Pathol. 2004;35(4):430-5. [ Links ]
10. Spitzer AL, Lao OB, Dick AAS, Bakthavatsalam R, Halldorson JB, Yeh MM, et al. The biopsied donor liver: incorporating macrosteatosis into high-risk donor assessment. Liver Transpl. 2010;16(7):874-84. [ Links ]
11. Kokudo T, Hasegawa K, Uldry E, Matsuyama Y, Kaneko J, Akamatsu N, et al. A new formula for calculating standard liver volume for living donor liver transplantation without using body weight. J Hepatol. 2015;63(4):848-54. [ Links ]
12. Nobel YR, Forde KA, Wood L, Cartiera K, Munoz-Abraham AS, Yoo PS, et al. Racial and ethnic disparities in access to and utilization of living donor liver transplants. Liver Transpl. 2015;21(7):904-13. [ Links ]
13. Ravaioli M, Grazi GL, Cescon M, Cucchetti A, Ercolani G, Fiorentino M, et al. Liver transplantations with donors aged 60 years and above: the low liver damage strategy. Transpl Int. 2009;22(4):423-33. [ Links ]
14. Busuttil RW, Tanaka K. The utility of marginal donors in liver transplantation. Liver Transpl. 2003;9(7):651-63. [ Links ]
15. Taub R. Liver regeneration: from myth to mechanism. Nat Rev Mol Cell Biol. 2004;5(10):836-47. [ Links ]
16. Chu MJJ, Dare AJ, Phillips ARJ, Bartlett ASJR. Donor Hepatic Steatosis and Outcome After Liver Transplantation: a Systematic Review. J Gastrointest Surg. 2015;19(9):1713-24. [ Links ]
17. Adani GL, Baccarani U, Sainz-Barriga M, Lorenzin D, Bresadola V, Risaliti A, et al. The role of hepatic biopsy to detect macrovacuolar steatosis during liver procurement. Transplant Proc. 2006;38(5):1404-6. [ Links ]
18. Crowley H, Lewis WD, Gordon F, Jenkins R, Khettry U. Steatosis in donor and transplant liver biopsies. Hum Pathol. 2000;31(10):1209-13. [ Links ]
19. Doyle MBM, Vachharajani N, Wellen JR, Anderson CD, Lowell JA, Shenoy S, et al. Short- and long-term outcomes after steatotic liver transplantation. Arch Surg. 2010;145(7):653-60. [ Links ]
20. Velidedeoglu E, Desai NM, Campos L, Olthoff KM, Shaked A, Nunes F, et al. The outcome of liver grafts procured from hepatitis C-positive donors. Transplantation. 2002;73(4):582-7. [ Links ]
21. Cerutti E, Stratta C, Romagnoli R, Serra R, Lepore M, Fop F, et al. Bacterial- and fungal-positive cultures in organ donors: clinical impact in liver transplantation. Liver Transpl. 2006;12(8):1253-9. [ Links ]
22. Lumbreras C, Sanz F, González A, Pérez G, Ramos MJ, Aguado JM, et al. Clinical significance of donor-unrecognized bacteremia in the outcome of solid-organ transplant recipients. Clin Infect Dis. 2001;33(5):722-6. [ Links ]
23. Abraham S, Furth EE. Quantitative evaluation of histological features in «time-zero» liver allograft biopsies as predictors of rejection or graft failure: receiver-operating characteristic analysis application. Hum Pathol. 1996;27(10):1077-84. [ Links ]
24. Detry O. Liver graft procurement in donors with central nervous system cancers. Liver Transpl. 2010;16(7):914-5. [ Links ]
25. Desai R, Neuberger J. Donor transmitted and de novo cancer after liver transplantation. World J Gastroenterol. 2014;20(20):6170-9. [ Links ]
26. Nalesnik MA, Woodle ES, Dimaio JM, Vasudev B, Teperman LW, Covington S, et al. Donor-transmitted malignancies in organ transplantation: assessment of clinical risk. Am J Transplant. 2011;11(6):1140-7. [ Links ]
27. Singh N, Sun H-Y. Iron overload and unique susceptibility of liver transplant recipients to disseminated disease due to opportunistic pathogens. Liver Transpl. 2008;14(9):1249-55. [ Links ]
28. Singh N, Wannstedt C, Keyes L, Mayher D, Tickerhoof L, Akoad M, et al. Hepatic iron content and the risk of Staphylococcus aureus bacteremia in liver transplant recipients. Prog Transplant. 2007;17(4):332-6. [ Links ]











 text in
text in