Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.30 supl.1 Bogotá Dec. 2015
Guía de práctica clínica para el uso de ultrasonido endoscópico en pancreatitis crónica, lesiones quísticas y sólidas del páncreas en adultos
Clinical practice guideline for the use of endoscopic ultrasound in chronic pancreatitis, solid and cystic lesions of pancreas in adults
Luis Sabbagh, MD,1 Diego Aponte, MD, 2 Raúl Cañadas, MD,3 Marcela Torres Amaya, QF,4 Eligio Álvarez, MD,5 Robin G. Prieto, MD,6 Viviana Parra, MD,6 Fanny Acero, MD,6 Rodrigo Pardo, MD,7 William Otero R., MD.8
1 Presidente de la Organización Panamericana de Gastroenterología, presidente de la Asociación Colombiana de Gastroenterología, expresidente de la Asociación Colombiana de Endoscopia Digestiva (ACED), director de posgrado de gastroenterología en la Fundación Universitaria Sánitas. Bogotá-Colombia.
2 Expresidente de la ACED, coordinador de posgrado en gastroenterología, Fundación Universitaria Sánitas y miembro del Comité Internacional del Train The Trainers de la Organización Mundial de Gastroenterología (OMG). Bogotá-Colombia.
3 Primer vicepresidente de la ACED, jefe de la unidad de gastroenterología y endoscopia digestiva, Clínica de Marly. Profesor asociado del departamento de Gastroenterología del Hospital San Ignacio. Bogotá-Colombia.
4 Gerente editorial del grupo Cochrane de Infecciones Transmisión Sexual. Bogotá-Colombia.
5 Residente de gastroenterología y endoscopia digestiva, Fundación Universitaria Sánitas. Residente de ecoendoscopia en el Centro de Entrenamiento de la OMG. Bogotá-Colombia.
6 Residente de gastroenterología y endoscopia digestiva, Fundación Universitaria Sánitas. Bogotá-Colombia.
7 Director Instituto de Investigaciones Clínicas, facultad de Medicina, Universidad Nacional de Colombia. Bogotá-Colombia.
8 Profesor titular de medicina, Coordinador de Gastroenterología, Universidad Nacional de Colombia. Ex-presidente Asociación Colombiana de Gastroenterología, Ex-presidente Asociación Colombiana de Endoscopia Digestiva. Miembro honorario Sociedad Dominicana de Gastroenterología. Miembro Honorario Sociedad Venezolana de Endoscopia Digestiva, Gastroenterólogo, Clínica Fundadores.
Resumen
Objetivo: brindar una guía de práctica clínica con la evidencia más reciente para el uso de ultrasonido endoscópico en pancreatitis crónica y lesiones quísticas y sólidas en adultos, la cual está dirigida a pacientes, personal asistencial, administrativo y entes gubernamentales de los servicios de atención en Colombia.
Materiales y métodos: esta guía fue desarrollada por un equipo multidisciplinario con apoyo de la Asociación Colombiana de Gastroenterología, el Grupo Cochrane ITS y el Instituto de Investigaciones Clínicas de la Universidad Nacional de Colombia. Se desarrollaron preguntas clínicas relevantes y se realizó la búsqueda de guías nacionales e internacionales en bases de datos especializadas. Las guías existentes fueron evaluadas en términos de calidad y aplicabilidad; ninguna de ellas cumplió con el criterio de adaptación, por lo que se decidió construir una guía de novo. El Grupo Cochrane realizó la búsqueda sistemática de la literatura. Las tablas de evidencia y recomendaciones fueron realizadas con base en la metodología GRADE. Las recomendaciones de la guía fueron socializadas en una reunión de expertos con entes gubernamentales y pacientes.
Resultados: se desarrolló una guía de práctica clínica basada en la evidencia para el uso del ultrasonido endoscópico en pancreatitis crónica y lesiones quísticas y sólidas en adultos en Colombia, con recomendaciones específicas para la utilización de USE.
Conclusiones: el adecuado uso del ultrasonido endoscópico permitirá el diagnóstico oportuno de lesiones del páncreas en pacientes colombianos, lo que llevará a mejorar su pronóstico.
Palabras claves
Guía de práctica clínica, lesiones pancreáticas, ultrasonido endoscópico.
Abstract
Objective: To provide an evidence-based clinical practice guideline for the use of endoscopic ultrasound in chronic pancreatitis, solid and cystic lesions of pancreas in adults which can be used by patients, caregivers, administrative and government bodies at all levels of care in Colombia.
Materials and Methods: This guide was developed by a multidisciplinary team with the support of the Colombian Association of Gastroenterology, Cochrane STI Group and Clinical Research Institute of the Universidad Nacional de Colombia. Relevant clinical questions were developed and the search for national and international guidelines in databases was performed. Existing guidelines were evaluated for quality and applicability. None of the guidelines met the criteria for adaptation, so the group decided to develop a de novo guideline. Systematic literature searches were conducted by the Cochrane Group. The tables of evidence and recommendations were made based on the GRADE methodology. The recommendations of the guide were socialized in a meeting of experts with government agencies and patients.
Results: An evidence-based Clinical Practice Guidelines for the screening of colorectal cancer was developed for the Colombian context.
Conclusions: The opportune detection of colon cancer would have an impact of the disease in Colombia.
Keywords
Lesions of pancreas, endoscopic ultrasound, clinical practice guideline (DeCS).
ALCANCE
Esta guía de práctica clínica (GPC) está dirigida al personal médico asistencial, tanto clínico como quirúrgico, que brinda cuidado a los pacientes con enfermedades pancreáticas en los diferentes niveles de atención en salud: médicos generales, médicos familiares, internistas, cirujanos y gastroenterólogos. La guía aclara la utilidad del ultrasonido endoscópico en el estudio de patologías del páncreas, principalmente pancreatitis crónica, lesiones quísticas y masas sólidas.
La guía está dirigida a la población mayor de 18 años, sin importar el régimen de aseguramiento al que pertenezca el paciente o si se encuentra asegurado o no, con diagnóstico o sospecha de masas sólidas, masas quísticas del páncreas y/o pancreatitis crónica. La guía no toma en consideración pacientes con alteraciones anatómicas congénitas o adquiridas (cirugías) que no permiten la realización del procedimiento o pacientes con comorbilidades severas que contraindiquen el examen.
INTRODUCCIÓN Y JUSTIFICACIÓN
El ultrasonido endoscópico (USE), denominado también como ecoendoscopia o endosonografía, es una técnica en la que se acopla al endoscopio una sonda ecográfica; por esta razón, es un examen que combina la imagen endoscópica con la ecográfica para evaluar lesiones localizadas tanto en la pared del tracto gastrointestinal como en las estructuras adyacentes a este (1).
El USE apareció en el mundo hace más de 30 años y desde entonces ha evolucionado muy rápidamente, hasta el punto en que logró posicionarse en los diferentes protocolos de estudio y manejo de múltiples patologías del tracto gastrointestinal dado su excelente rendimiento diagnóstico; además, brinda la posibilidad de lograr diagnósticos histológicos y permite tratamientos definitivos por medio del intervencionismo, lo que ha provocado cambios en el tratamiento médico y quirúrgico de diferentes patologías del tracto gastrointestinal, principalmente en el manejo de patologías del páncreas (2). Esto se ha logrado en países como Francia, Japón, Estados Unidos, España y Alemania; sin embargo, su desarrollo ha sido más lento en otros países incluyendo el nuestro, en el que solo existe en algunos centros de referencia debido a que es una técnica que requiere entrenamiento con una curva de aprendizaje muy larga (3).
En el año 2012 se diagnosticaron 337872 nuevos casos de cáncer de páncreas en todo el mundo, representando el 2,4% de las enfermedades oncológicas, y constituye la cuarta a quinta causa de muerte por cáncer. El 80% a 90% de los tumores pancreáticos son hallados en estadios avanzados y una vez diagnosticados, la sobrevida en 5 años es menor al 5%. En consecuencia, el diagnóstico temprano, la certeza diagnóstica y la correcta estadificación de las neoplasias malignas son determinantes para decisiones terapéuticas y para el pronóstico de los pacientes con neoplasias del páncreas. El USE ha demostrado ser una herramienta útil para estos 3 tópicos (diagnóstico temprano, diagnóstico diferencial y estadificación) (4).
En la actualidad, el desarrollo de diferentes herramientas diagnósticas, como la tomografía computarizada y la resonancia magnética para el estudio del páncreas, ha contribuido a que aumente el número de hallazgos patológicos que antes eran indetectables; esto ha hecho que el ultrasonido endoscópico se convirtiera en una herramienta necesaria y de primera mano por su gran utilidad para aclarar la etiología de estas patologías (5).
La presente guía pretende familiarizar y aclarar conceptos con respecto a esta herramienta diagnóstica que puede estar subutilizada en nuestro medio por falta de conocimiento acerca de sus beneficios, logrando un mejor estudio y manejo de las patologías del páncreas en nuestro país.
MATERIALES Y MÉTODOS
El Grupo Desarrollador de la Guía (GDG) planeó una metodología rápida. Para mayor información, la versión larga de la guía se encuentra en http://www.gastrocol.com/. El GDG contó con la participación de expertos temáticos en gastroenterología, endoscopia, medicina interna, nutrición, química farmacéutica, salud pública y diseño de políticas; recibió apoyo por parte de la Asociación Colombiana de Gastroenterología, el Instituto de Investigaciones Clínicas de la Universidad Nacional de Colombia y el Grupo Cochrane STI, este último realizó la búsqueda sistemática de la literatura y la consecución de los artículos de estudios primarios.
El GDG realizó una búsqueda sistemática de la literatura con el objeto de identificar todas las GPC nacionales e internacionales que abordaran el uso del USE en pancreatitis crónica y lesiones quísticas y sólidas del páncreas en adultos. Se evaluó la calidad de las GPC recuperadas con el instrumento AGREE II (6); una vez se obtuvo la calidad global de cada guía, se construyó una matriz de decisión que considera el tipo de guía, fecha de publicación, concordancia de los objetivos y alcance de la misma. Con base en los resultados de la matriz, se consideró que la guía sería desarrollada de novo.
Todas las preguntas a desarrollar se estructuraron en formato PICO (población, intervención, comparación y desenlaces). El primer paso fue la búsqueda metódica de revisiones sistemáticas publicadas de las bases de datos especializadas hasta mayo de 2015.
Las revisiones sistemáticas (RS) identificadas fueron evaluadas con la herramienta AMSTAR (7). En caso de no identificar revisiones sistemáticas de alta calidad, se procedió a la evaluación de estudios primarios utilizando la herramienta de riesgo de sesgos de Cochrane (8). La síntesis de los estudios seleccionados se realizó a través de la construcción de los perfiles de evidencia en www.guidleinedevelopment.org y los niveles de evidencia fueron graduados según la clasificación GRADE (alta, moderada, baja y muy baja) (9).
NIVEL DE EVIDENCIA
Calidad Global de la evidencia GRADE
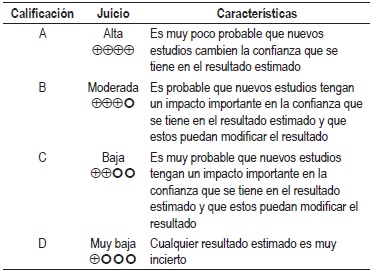
La graduación de la fuerza y dirección de cada recomendación se determinó con base en el nivel de evidencia y otras consideraciones adicionales que fueron revisadas en pleno por el GDG, el ente gestor y los grupos de interés. Este ejercicio se desarrolló mediante la construcción de una mesa de trabajo que generó la fuerza de la recomendación de acuerdo con:
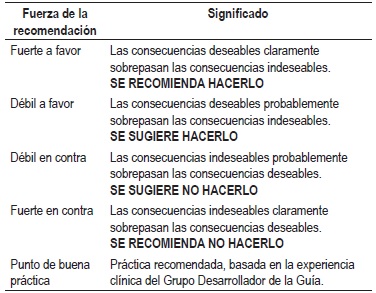
Las recomendaciones de la guía fueron socializadas en una reunión de expertos, entes gubernamentales y pacientes.
RECOMENDACIONES GENERALES
Pregunta 1: ¿cuál es la utilidad diagnóstica del USE en la identificación de lesiones sólidas malignas del páncreas?
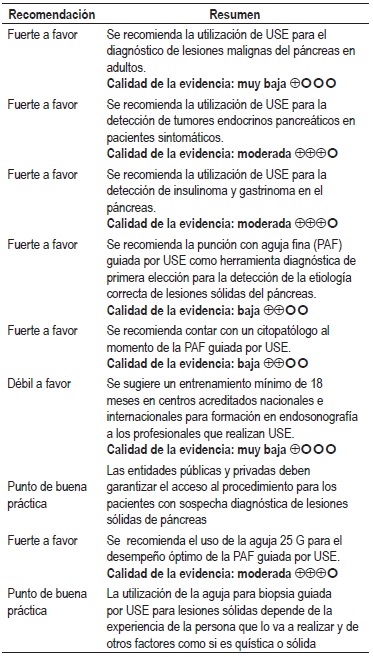
Se encontró una RS del 2014 que incluyó 10 estudios con 669 pacientes, esta evaluó la precisión para el diagnóstico de neoplasias pancreáticas del USE, colangiopancreatografía retrograda endoscópica (CPRE) y la CPRE con la USE comparada con histopatología y/o seguimiento clínico o imagenológico. El estudio concluye que tiene mayor eficacia el diagnóstico de las masas pancreáticas cuando se combina CPRE con USE comparado con USE o CPRE solo; al equiparar directamente USE con CPRE, el primero tiene un desempeño estadísticamente mayor que CPRE (10). Calidad de la evidencia: muy baja.
Se identificó una RS del 2013 que evaluó la utilidad del USE para el diagnóstico de tumores neuroendocrinos pancreáticos comparado con histopatología y/o seguimiento de al menos 6 meses; la RS incluyó 13 estudios con un total de 456 pacientes. En general, USE tiene sensibilidad de 87,2% (IC 95% con rango de 82,2-91,2), especificidad de 98,0% (IC 95% con rango de 94,3-99,6), LR + de 11,1 (IC 95% con rango de 5,4-22,8), LR de 0,17 (IC 95% con rango de 0,1-0,24) y ORD de 94,7 (IC 95% con rango de 37,9-236,1) (11).
Esta misma RS evaluó la utilidad de USE en insulinoma pancreático con 9 estudios (242 pacientes) y encontró sensibilidad de 87,5% (IC 95% con rango de 81,2-92,3), especificidad de 97,4% (IC 95% con rango de 90,8–99,7) y ORD de 67,6 (IC 95% con rango de 22,7–200,9) (11). Para la evaluación de la utilidad de USE en gastrinoma pancreático utilizaron 5 estudios con 122 pacientes y se encontró sensibilidad de 84,5% (IC 95% con rango de 72,6-92,7), especificidad de 95,3% (IC 95% con rango de 86,9–99,0) y ORD de 57,3 (IC 95% con rango de 15,1 – 217,2) (11). Calidad de la evidencia: moderada.
Se revisó un metaanálisis del 2013 que incluyó 41 estudios (4766 pacientes) en los que se evaluó el rol de la biopsia aspirativa con aguja fina (BACAF) guiada por USE para el diagnóstico de la etiología correcta de las lesiones sólidas del páncreas comparada con cirugía o un apropiado seguimiento. Se encontró sensibilidad de 86,8% (IC 95% con rango de 85,5-87,9) y especificidad de 95,8% (IC 95% con rango de 94,6-96,7), con RL + de 15,2 (IC 95% con rango de 8,5-27,3) y RL negativo de 0,17 (IC 95% con rango de 0,13-0,21); el RR diagnóstico es de 0,17 (IC 95% con rango de 0,13-0,21). La calidad de los estudios incluidos fue baja de acuerdo con la herramienta QUADAS (5/14). Entre las limitaciones de este estudio está la pequeña cantidad de la muestra, con solo 2 que tienen más de 500 pacientes. Se explicó la baja sensibilidad en los estudios (74%) por un aumento en el número de pacientes con pancreatitis crónica (12).
Se revisó un metaanálisis que incluyó 15 estudios (1860 pacientes) en los que se evaluó el papel de la BACAF guiada por USE para el estudio de las lesiones sólidas del páncreas confirmadas por histopatología, y se encontró sensibilidad de 92% (IC 95% con rango de 91-93) y especificidad de 96% (IC 95% con rango de 93%-98%), con RL + de 14,24 (IC 95% con rango de 7,78-26,07) y RL negativo de 0,09 (IC 95% con rango de 0,07-0,13); el área bajo la curva fue de 0,974. Cuando se analizó por subgrupos se evidenció que al realizar el procedimiento con evaluación rápida en el sitio (ROSE), la sensibilidad aumenta a 95%. Las complicaciones reportadas son pancreatitis, infección, sangrado y riesgo de diseminación; los estudios incluidos tenían sesgo de verificación, sesgo de reporte, confirmación y detección. El estudio concluye que la PAF guiada por ecoendoscopia es una prueba muy útil para la realización del diagnóstico en masas de páncreas (13).
Se estudió un metaanálisis del año 2013 donde se revisaron 34 artículos (3644 pacientes) en los que se evaluó el BACAF-USE para masas sólidas del páncreas comparado con los resultados clínicos y/o histopatológicos, y se encontró sensibilidad del 88,6% (IC 95% con rango de 87,2-89,9), y especificidad de 99,3% (IC 95% con rango de 98,7%-99,7%), LR + de 33,46 (IC 95% con rango de 20,76-53,91) y LR negativo de 0,11 (IC 95% con rango de 0,08-0,16). El RR diagnóstico fue de 383,64 (IC 95% con rango de 219,66–684,09). La variable "presencia de un citopatólogo en el sitio" mostró en la metarregresión una asociación significativa con el desempeño del BACAF-USE (p: 0,001). La calidad global de los estudios incluidos fue baja debido a la presencia del sesgo de verificación diferencial y parcial, y el sesgo de incorporación, así como la no declaración del tiempo transcurrido entre las 2 pruebas. Esta RS tiene como limitantes la heterogeneidad de los estudios, principalmente en el número de países realizados y la presencia o no de pancreatitis crónica (14).
La Asociación Americana de Endoscopia Gastrointestinal y la Sociedad Británica de Gastroenterología recomiendan que la USE sea ejecutada por personal con entrenamiento adecuado dado que existen riesgos para los pacientes debido a la inconsistencia del mismo; por lo tanto, han diseñado unos lineamientos para estandarizar el entrenamiento, el cual debe durar como mínimo 18 meses (15).
Pregunta 2: ¿cuál es la utilidad del USE con contraste y/o elastografía para el diagnóstico diferencial del adenocarcinoma de páncreas?
Se realizó una RS que incluyó 12 estudios con un total de 1139 pacientes y evaluó la precisión de la ecoendoscopia con realce para evaluar las diferentes masas pancreáticas comparada con la histología de muestras de BACAF-USE, histopatología de muestras quirúrgicas y/o seguimiento de 6 meses. En general, encontró que existe una sensibilidad de diagnósticos diferenciales de adenocarcinoma cuando se utiliza el medio de contraste de 94% (IC 95% con rango de 91-95), especificidad de 89% (IC 95% con rango de 0,85-0,92), LR+ de 8,09 (IC 95% con rango de 4,47-14,64) y LR negativo de 0,08 (IC 95% con rango de 0,06-0,10); el área bajo la curva fue de 0,9745. No se reportan complicaciones. Se encuentra como limitación el pequeño número de estudios; además, se presentó alta heterogeneidad en sensibilidad pero no en especificidad. Se concluye que el USE con contraste permite realizar un diagnóstico diferencial con masas pancreáticas (16, 17).
Pregunta 3: ¿cuál es la utilidad de la citología por PAF para diferenciar entre neoplasias quísticas benignas y malignas?
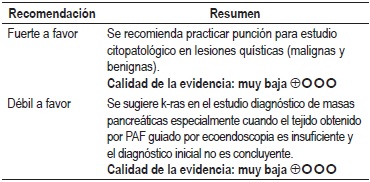
La revisión desarrollada para la Guía Italiana para el diagnóstico y seguimiento de neoplasmas pancreáticos de la Asociación Italiana de Gastroenterólogos Hospitalarios y Endoscopistas (AIGO) identificó 3 estudios observacionales de calidad baja. Se encontró que se reporta sensibilidad de entre 22% y 85% para la capacidad diagnóstica de la citología en la detección de lesiones malignas y especificidad de 98%, PPP de 100% y VPN entre 47% y 95%. También se reportó exactitud diagnóstica de entre el 85%–90%; la exactitud depende de la experiencia del patólogo, los factores relacionados con el procedimiento y la habilidad del ecoendoscopista (18).
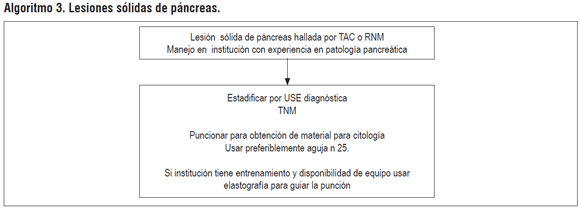
Pregunta 4: ¿cuál es la utilidad del USE en la estadificación de lesiones malignas sólidas del páncreas?
Se identificó una RS del 2013 que incluyó 29 estudios con un total de 1330 pacientes y evaluó la precisión del ultrasonido endoscópico para determinar la estadificación del cáncer de páncreas comparado con histopatología y seguimiento, así como la comparación entre USE y TAC. Se evaluó estadificación nodal, estadificación vascular y resecabilidad:
- Para estadificación nodal con USE se obtuvo sensibilidad de 69%, IC 95% (51%-82%), especificidad de 81%, IC 95% (70-89), VPP de 81%, IC 95% (72-88) y VPN de 65%, IC 95% (56-73).
- Para estadificación vascular se obtuvo sensibilidad de 85%, IC 95% (76%-91%), especificidad de 91%, IC 95% (85-94), VPP y VPN de 87%, IC 95% (81-92).
- Para resecabilidad se obtuvo sensibilidad de 90%, IC 95% (71-97), especificidad de 86%, IC 95% (63-96), VPP de 85%, IC 95% (66-94) y VPN de 90%, IC 95% (78-96).
- La tomografía mostró una menor sensibilidad para la estadificación nodal (24%, IC 95% con rango de 1%-34%) e invasión vascular (58%, IC 95% con rango de 45-69) comparado con USE (p <0,05).
Se concluye que el ultrasonido endoscópico tiene mayor precisión diagnóstica comparado con la TAC. La calidad de la evidencia fue muy baja por limitaciones importantes en el riesgo de sesgos y en inconsistencia e imprecisión. Solo 9 estudios reportaron una determinación sin sesgos en la resecabilidad (19, 20).
Pregunta 5: ¿cuál es el valor de la PAF y del estudio del líquido quístico con BACAF, antígeno carcinoembrionario (ACE) y amilasa en líquido quístico como método diagnóstico en lesiones quísticas del páncreas?

Se revisó un metaanálisis (2013) con puntaje AMSTAR 9/11, que incluyó 8 artículos (504 pacientes) en los que se evaluó la utilidad de los niveles de ACE para diferenciar entre una lesión maligna de una benigna comparado con el diagnóstico histopatológico. Se postula que los niveles de ACE superiores a 192 ng/mL tienen una exactitud del 80% para diferenciar entre mucinoso y no mucinoso; el análisis reportó sensibilidad de 63% (IC 95% con rango de 56-70) y especificidad de 63% (IC 95% con rango de 58%-69%). El LR + fue de 1,89 (IC 95% con rango de 1,13-3,16), el LR negativo fue de 0,62 (IC 95% con rango de 0,40-0,97), y el RR diagnóstico fue de 3,84 (IC 95% con rango de 1,37-10,75). Se presentó una heterogeneidad con un I2 de 76%
La calidad de los estudios cumple los criterios de la herramienta QUADAS entre 60% y 100%. Una de las limitantes de este metaanálisis fue la alta heterogeneidad entre los estudios debido a los tamaños de la población estudiada, la forma de tomar y estudiar la muestra obtenida, y la proporción de pacientes con cáncer (21).
Pregunta 6: ¿cuál es la seguridad del USE-PAF en pacientes con lesiones pancreáticas?
Se estudió una RS del 2011 con puntaje, la cual tiene como objetivo identificar sistemáticamente la morbilidad y mortalidad asociada con el uso de USE-BACAF. Se incluyeron 51 estudios (10941 pacientes) que reportaron complicaciones de USE-BACAF en cualquier órgano, de acuerdo con la indicación, el tipo de aguja y el número de procedimientos.
De forma general, se reportó una tasa de complicaciones de 0,98% y la tasa de mortalidad fue de 0,02%; dolor (34%) y pancreatitis (33%), sangrado (13%), episodios febriles (11%) y perforaciones (2%) fueron las complicaciones más frecuentes. No se encontró suficiente información para hacer análisis por tipo de aguja. La mayoría de las complicaciones fueron reportadas en el páncreas (75% de los estudios), particularmente en procedimientos relacionados con masas y quistes, la mayoría reportados en la cabeza del páncreas. El estudio presenta limitaciones debido a que no se evaluó la calidad de los estudios y las definiciones de las complicaciones variaban entre ellos, lo cual fue una fuente de heterogeneidad y presentó sesgo de publicación, puesto que se encontraron estudios solo en Estados Unidos y Japón (22).
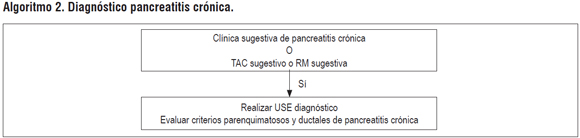
Pregunta 7: ¿cuál es la utilidad del USE para el diagnóstico de pacientes con pancreatitis crónica?

Una revisión sistemática del 2012 evaluó la calidad de la evidencia de USE pancreatobiliar. La RS encontró que USE es sensible para la detección de pancreatitis crónica, pero con especificidad limitada cuando la enfermedad es moderada. Al evaluarlo con pruebas de función pancreática la evidencia no es concluyente para pacientes con enfermedad temprana, pero la combinación de las 2 técnicas alcanza una sensibilidad del 100%. La calidad de los estudios es baja por riesgo de sesgos e imprecisión (23, 24).
Pregunta 8: ¿cuál es la calidad del reporte de USE-PAF con citología atípica en masas sólidas de páncreas?

Un metaanálisis incluyó 23 artículos con 3566 pacientes. La frecuencia de la citología atípica varió de 1% a 14% (media 5,3%; IC 95% con rango de 4,1%-6,9%). El riesgo de malignidad asociada con un diagnóstico atípico varió de 25% a 100% (media 58%; IC 95% con rango de 47%-69%). Se presentó heterogeneidad significativa observada entre los estudios (I2, 62%; p: 0,0004). Se concluye que la tasa de citología atípica del páncreas es similar a la de la tiroides pero el riesgo de malignidad es mayor; existe una heterogeneidad significativa entre los estudios que informaron diagnósticos atípicos (25).
DECLARACIÓN DE CONFLICTOS DE INTERÉS
Los autores declaran no tener conflictos de interés, no estar involucrados como investigadores en ensayos clínicos en curso sobre el tema, y no haber recibido donaciones o beneficios por parte de los grupos interesados en las recomendaciones.
FUENTE DE FINANCIACIÓN
La presente guía fue desarrollada mediante un convenio de extensión entre la Asociación Colombiana de Gastroenterología y la facultad de Medicina de la Universidad Nacional.
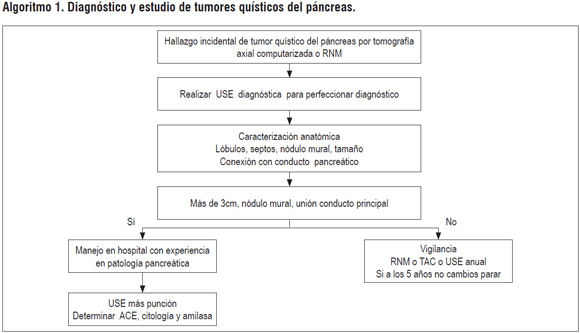
ALGORITMOS GUÍA USE
ALGORITMO 1. DIAGNÓSTICO Y ESTUDIO DE TUMORES QUÍSTICOS DEL PÁNCREAS
ALGORITMO 2. DIAGNÓSTICO PANCREATTIS CRÓNICA
ALGORITMO 3. LESIONES SÓLIDAS DE PÁNCREAS
REFERENCIAS
1. Kenjiro Jasuda, MD. The handbook of endoscopic ultrasonography in digestive tract. First edition. 2000. [ Links ]
2. Robert H. Hawes, Paul Fockens. Endosonography. Saunders elsevier. Third edition. 2015 [ Links ]
3. Teshima Ch, and et al. Endoscopic ultrasound in the diagnosis and treatment of pancreatic disease. World J Gastroenterol. 2014;20(29):9976-9989. [ Links ]
4. American Society for Gastrointestinal Endoscopy. Role of Endoscopic Ultrasonography. Gastrointestinal. Endoscopy 2005;52:852-9. [ Links ]
5. Frank Gress, Thomas Savides. Endoscopic Ultrasonography. Second edition 2009. [ Links ]
6. AGREE C. INSTRUMENTO AGREE II. Instrumento para la evaluación de guías de práctica clínica [en línea] GuíaSalud. 2009. [acceso 15 de mayo de 2015] [ Links ].
7. Shea BJ, Grimshaw JM, Wells GA, Boers M, Andersson N, Hamel C, et al. Development of AMSTAR: A measurement tool to assess the methodological quality of systematic reviews. BMC Med Res Methodol.2007;7(1):10. [ Links ]
8. Higgins JP, Green S. Cochrane handbook for systematic reviews of interventions: Wiley Online Library; 2008. [ Links ]
9. Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: An emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008;336(7650):924-6. [ Links ]
10. Li H, Hu Z, Chen J, Guo X. Comparison of ERCP, EUS, and ERCP combined with EUS in diagnosing pancreatic neoplasms: A systematic review and meta-analysis. Tumor Biol. 2014; 35(9): 8867-8874. [ Links ]
11. Puli S, Kalva N, Bechtold M, Pamulaparthy S, Cashman M, Estes N, Pearl R, Volmar F, Dillon S, Shekleton M, Forcione D. Diagnostic accuracy of endoscopic ultrasound in pancreatic neuroendocrine tumors: A systematic review and meta-analysis. World J Gastroenterol. 2013;19(23):3678-84. [ Links ]
12. Puli S, Bechtold M, Buxbaum J, Eloubeidi M. How good is endoscopic ultrasound-guided fine-needle aspiration in diagnosing the correct etiology for a solid pancreatic mass?: A meta-analysis and systematic review. Pancreas. 2013;42(1):20-6. [ Links ]
13. Chen J, Yang R, Lu Y, Xia Y, Zhou H. Diagnostic accuracy of endoscopic ultrasound-guided fine-needle aspiration for solid pancreatic lesion: A systematic review. J Cancer Res Clin Oncol. 2012;138(9):1433-41. [ Links ]
14. Hébert-Magee S, Bae S, Varadarajulu S, Ramesh J, Frost AR, Eloubeidi MA, Eltoum IA. The presence of a cytopathologist increases the diagnostic accuracy of endoscopic ultrasound-guided fine needle aspiration cytology for pancreatic adenocarcinoma: A meta-analysis. Cytopathology. 2013;24(3):159-71. [ Links ]
15. ASGE training committee et al. Principles of training in GI endoscopy. Gastrointestinal journal. 2012;75(2). [ Links ]
16. Gong T, Hu D, Zhu Q. Contrast-enhanced EUS for differential diagnosis of pancreatic mass lesions: A meta-analysis. Gastrointest Endosc. 2012;76(2):301-9. [ Links ]
17. Piscaglia F, Nolsoe C, Dietrich F, et al. The EFSUMB Guidelines and Recommendations on the Clinical Practice of Contrast Enhanced Ultrasound (CEUS): Update 2011 on non-hepatic applications. Ultraschall in Med. 2012;33:33-59. [ Links ]
18. AISP, AIGO. Italian consensus guidelines for the diagnostic work-up and follow-up of cystic pancreatic neoplasms. Digest Liver Dis. 2014;46:479-493. [ Links ]
19. Nawaz H1, Fan CY, Kloke J, Khalid A, McGrath K, Landsittel D, Papachristou GI. Performance characteristics of endoscopic ultrasound in the staging of pancreatic cancer: A meta-analysis. JOP. 2013;14(5):484-97. [ Links ]
20. Yang R1, Lu M, Qian X, Chen J, Li L, Wang J, Zhang Y. Diagnostic accuracy of EUS and CT of vascular invasion in pancreatic cancer: A systematic review. J Cancer Res Clin Oncol. 2014;140(12):2077-86. [ Links ]
21. Ngamruengphong S, Bartel MJ, Raimondo M. Cyst carcinoembryonic antigen in differentiating pancreatic cysts: A meta-analysis. Dig Liver Dis. 2013;45(11):920-6. [ Links ]
22. Wang KX1, Ben QW, Jin ZD, Du YQ, Zou DW, Liao Z, Li ZS. Assessment of morbidity and mortality associated with EUS-guided FNA: A systematic review. Gastrointest Endosc. 2011;73(2):283-90. [ Links ]
23. Fusaroli P, Kypraios D, Caletti G, Eloubeidi M. Pancreatico-biliary endoscopic ultrasound: A systematic review of the levels of evidence, performance and outcomes. World J Gastroenterol. 2012;18(32):4243-4256. [ Links ]
24. Tang S, Huang G, Liu J, Liu T, Treven L, Song S, Zhang C, Pan L, Zhang T. Usefulness of 18F-FDG PET, combined FDG-PET/CT and EUS in diagnosing primary pancreatic carcinoma: A meta-analysis. Eur J Radiol. 2011;78(1):142-50. [ Links ]
25. Abdelgawwad M. Alston E. Eltoum I. The Frequency and Cancer Risk Associated With the Atypical Cytologic Diagnostic Category in Endoscopic Ultrasound-Guided Fine-Needle Aspiration Specimens of Solid Pancreatic Lesions. A Meta-Analysis and Argument for a Bethesda System for Reporting Cytopathology of the Pancreas. Cancer Cytopathol. 2013;121:620-8. [ Links ]













