Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957
Rev Col Gastroenterol vol.31 no.2 Bogotá abr./jun. 2016
Métodos diagnósticos en hipertensión portal
Diagnostic Methods in Portal Hypertension
Juan Sebastián Pareja Q. (1), Juan Carlos Restrepo G. MD (2)
(1) Estudiante de Medicina, Facultad de medicina, Universidad de Antioquia, Medellín, Colombia.
(2) Profesor Titular, Departamento de Medicina Interna y Grupo de Gastrohepatología, Universidad de Antioquia. Hepatólogo, Hospital Pablo Tobón Uribe, Medellín, Colombia.
Fecha recibido: 15-03-15 Fecha aceptado: 18-04-16
Resumen
La hipertensión portal en el curso natural de las enfermedades hepáticas es una de las complicaciones más frecuentes resultado del aumento de la resistencia vascular hepática que determina el desarrollo de otros sucesos responsables de la mayor mortalidad en pacientes con hepatopatías. En consecuencia, el conocimiento de la fisiopatología de la hipertensión portal y de sus causas representa un factor importante para su adecuado manejo y el de las demás complicaciones relacionadas. Es así como se cuentan con métodos diagnósticos de diferentes tipos para la detección temprana y adecuada de dicha entidad; lo cual, además, corresponde al objetivo de la presente revisión: dar una mirada a los métodos diagnósticos utilizados para la detección de hipertensión portal, disponibles en la actualidad.
Palabras clave
Cirrosis, hipertensión portal, gradiente de presión venosa hepática, elastografía, ARFI, Resonancia magnética, biomarcadores.
Abstract
Portal hypertension is one of the most frequent complications in the natural course of liver disease. It results from increased hepatic vascular resistance and determines the development of other events responsible for increased mortality in patients with liver disease. Consequently, knowledge of the pathophysiology of portal hypertension and its causes is an important factor for handling it and related complications proper. Explanation of the various diagnostic methods for early and appropriate detection is one of the objectives of this review which will take a look at diagnostic methods available and in use for the detection of portal hypertension.
Keywords
Cirrhosis, portal hypertension, hepatic venous pressure gradient, elastography, Acoustic Radiation Force Impulse (ARFI) Imaging, magnetic resonance imaging, biomarkers.
INTRODUCCIÓN
La hipertensión portal es la complicación más frecuente de la cirrosis y la primera causa de mortalidad asociada a dicha patología; recíprocamente, la cirrosis es la principal causa de hipertensión portal y la responsable de un gran número de fallecimientos, es la decimocuarta causa de muerte en todo el mundo. El aumento de la presión portal resulta de la obstrucción del flujo del sistema venoso correspondiente, como consecuencia de enfermedades hepáticas crónicas y trombosis de la vena porta. No obstante, existen otros trastornos de origen no cirrótico que cursan con hipertensión portal, que se explican fundamentalmente por el compromiso vascular del sistema portal. Una vez la hipertensión portal se desarrolla, el compromiso intrahepático influencia los lechos vasculares extrahepáticos que aumentan los valores tensionales, al generar un síndrome de circulación hiperdinámica. En consecuencia a todos los procesos de la dinámica vascular y sanguínea, se desarrollan várices esofágicas y otras complicaciones, que dan razón a la cirrosis hepática como la primera causa de hospitalización, muerte y trasplante hepático en el mundo (1).
Actualmente se encuentran disponibles una serie de métodos diagnósticos para la evaluación de la hipertensión portal que influyen en la evaluación y seguimiento integral de los pacientes con hepatopatías crónicas y que finalmente prometen mejorar el pronóstico y la calidad de vida de ellos. El presente artículo tiene como objetivo revisar los métodos para la medición de la hipertensión portal, actualmente disponibles y descritos en la literatura médica.
DEFINICIÓN
La hipertensión portal es una complicación frecuente de las enfermedades hepáticas crónicas, principalmente la cirrosis, que se define como un aumento en la presión portal determinada por el gradiente de presión portal normal (PPG), que corresponde a la diferencia de presiones entre la vena porta y la vena cava inferior (que oscila entre 1 a 5 mmHg). Valores mayores a 5 mm Hg definen hipertensión portal: característicamente medidas entre 5 a 9 mm Hg representan un estado subclínico de la hipertensión y presiones mayores a 10 mm Hg son clínicamente significativas dado el riesgo de sus consecuencias como várices esofágicas y hemorragia variceal (1,2).
DATOS DEMOGRÁFICOS
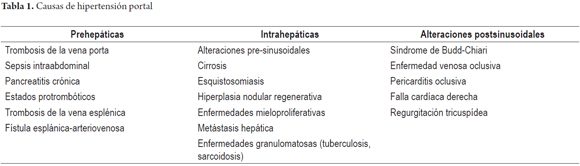
En la enfermedad hepática crónica, la hipertensión portal es una consecuencia común y sumamente importante, dado que conduce al desarrollo de complicaciones, que son causa de un gran número de ingresos hospitalarios, trasplantes y muerte en pacientes con hepatopatías (1,3). La principal causa de hipertensión portal es la cirrosis hepática de origen alcohólica y a causa de infecciones por virus hepatótropos; no obstante, existe una clasificación práctica que permite conocer mejor otras causas no cirróticas, clasificándolas en prehepática, intrahepática (presinusoidal, sinusoidal o postsinusoidal) y poshepática (4).
La mayoría de las muertes causadas por cirrosis son consecuencia de alguna complicación relacionada con la hipertensión portal; la hemorragia por várices gastroesofágicas es la que presenta mayor mortalidad (5). Otras complicaciones relacionadas son la encefalopatía hepática, la ascitis, peritonitis bacteriana espontánea (PBE), síndrome hepatorrenal, gastropatía hipertensiva, hipertensión portopulmonar y síndrome hepatopulmonar; todas ellas responsables de la morbimortalidad y disminución de la calidad de vida de los pacientes con enfermedad hepática crónica (4).
En los pacientes con cirrosis hepática, al menos el 80%, presentan hipertensión portal, de los cuales, cerca del 40% desarrollan várices esofágicas. Factores como el grado de las várices, presencia de signos de sangrado, disminución de la funcionalidad hepática y aumento de la presión portal se correlaciona con la aparición y las tasas de sangrado de origen variceal (rango del 10% al 30% en dos años). Finalmente, es importante considerar que la mortalidad a 6 semanas del sangrado por várices esofágicas es del 12% al 20%; además, en caso de no recibir un tratamiento efectivo, alrededor de dos tercios de estos pacientes pueden presentar recidivas durante los próximos dos años (1).
FISIOPATOLOGÍA DE LA HIPERTENSIÓN PORTAL
La hipertensión portal es un fenómeno local con consecuencias sistémicas que es resultado de una serie de eventos moleculares y celulares, que conllevan al aumento del flujo sanguíneo y resistencia vascular portal. Sus causas han sido ampliamente estudiadas y se han logrado clasificar en razón del sistema hepático comprometido: hipertensión portal prehepática, intrahepático o poshepático (Tabla 1) (6). La cirrosis es la causa más común de hipertensión portal y la principal indicación de trasplante hepático en el mundo (1). En ella, las alteraciones estructurales y funcionales que conducen a una franca disfunción endotelial que aumentan el tono y la resistencia vascular intrahepática explican la aparición de la hipertensión portal. Dichas alteraciones determinan el aumento en un 25% de la resistencia vascular (7,8).
Los cambios en la circulación intra y extrahepática son fundamentales en la fisiopatología de la hipertensión portal. Con respecto al primero, los eventos resultantes de la disfunción endotelial, como las alteraciones de los mecanismos regulatorios vasomotores y la inflamación propia del daño hepático, conducirán al desarrollo de fibrosis y desarrollo de nódulos de regeneración que comprometerán la arquitectura intrahepática 8.
Por otra parte, la disminución en la producción endógena de sustancias vasodilatadoras, especialmente el óxido nítrico (NO), da razón parcialmente del aumento de la resistencia vascular en la hipertensión portal. La caveolina (1), una proteína integral de membrana, se ve involucrada en la inhibición de la actividad de la enzima óxido nítrico sintetasa, encargada de sintetizar el óxido nítrico. Sumado a lo anterior, el poco NO que logra sintetizarse reaccionará con los radicales libres de oxígeno producidos en exceso por la actividad inflamatoria presenta, lo que finalmente produce peroxinitrito y una reducción importante en el número y función del óxido nítrico restante (3). Además, evidencia actual sostiene la existencia de un incremento de vasoconstrictores a expensas de la producción de tromboxano A2 (TXA2) y de la cicloxigenasa-1 (COX-1), que en conjunto con la endotelina amplifican la resistencia vascular hepática (9).
La activación de células hepáticas estelares (HSC) y la ocurrencia de angiogénesis hepática son, por lo demás, factores intrahepáticos responsables de la hipertensión portal. Citocinas como el TGF-β, matriz extracelular y otros factores inflamatorios median la activación de las células estelares a miofibroblastos a través de un aumento en la concentración de moléculas del citoesqueleto. Dicha transformación citológica generará un aumento de la contracción celular, actividad profibrótica y disminución de respuesta a sustancias vasodilatadoras que, en últimas, promoverá la resistencia vascular intrahepática (7,10,11).
En condiciones normales, existen venas colaterales portosistémicas que actúan como parte del sistema venoso abdominal, sin gran repercusión sobre la hemodinámica corporal. No obstante, luego de establecerse la hipertensión portal, la circulación en dichos vasos sanguíneos aumenta de forma anómala por mecanismos compensatorios. De hecho, la presencia de vasos colaterales anormales es un signo clave en el diagnóstico ecográfico de hipertensión portal, con una sensibilidad del 70% al 83%, aproximadamente (12).
Cabe destacar que los mecanismos extrahepáticos que contribuyen a la hipertensión portal son casi idénticos, pero contrarios a los vistos en la circulación intrahepática. Es así que en respuesta a la aparición de la circulación colateral sobreviene un aumento dirigido del flujo esplácnico, que consiste en un aumento de la circulación portal que intenta compensar la disminución en el flujo sanguíneo hepático; lo anterior, en últimas, empeorará la hipertensión portal. Dicho aumento del flujo como medio compensatorio de la circulación colateral es originado por la respuesta endotelial inducida en respuesta al aumento de la presión portal que elevará la actividad de la óxido nítrico sintetasa y consecuentemente los niveles de óxido nítrico en el sistema porta (l7,13).
Para muchos autores, lo anterior se denomina síndrome de circulación hiperdinámica o síndrome de vasodilatación progresiva, dado el componente vasodilatador que favorece el aumento de la circulación sistémica y los cambios vasculares que se observan en las enfermedades hepáticas crónicas que cursan con hipertensión portal (14). Además del óxido nítrico como la principal sustancia relacionada con la vasodilatación esplácnica, algunos autores también han identificado el monóxido de carbono, y sustancias como los endocanabinoides como mediadores de la fisiopatología de la hipertensión portal (14).
Por último, otros mecanismos comprometidos en la vasodilatación esplácnica y sistémica que empeora la hipertensión portal son la hipocontractilidad arterial y el adelgazamiento de las paredes arteriales que cambia la hemodinámica esplácnica a favor de la hipertensión portal; donde la primera condición es consecuencia de la disminución en la producción de moléculas vasoconstrictoras y de la alteración en la actividad neural (atrofia del sistema simpático) (7,13). De esta manera se entiende a la hipertensión portal como el resultado de la interacción de múltiples mecanismos, muchos de ellos descritos y otros tantos aún por describir, y que tiene como causa principal la cirrosis hepática.
MÉTODOS DIAGNÓSTICOS EN HIPERTENSIÓN PORTAL
Actualmente existen diversos métodos diagnósticos para la medición de la presión portal. En términos generales, se puede calcular la presión portal como la diferencia de las presiones de la vena hepática y la vena cava inferior (gradiente de presión portal), que pueden ser determinadas de forma directa o indirecta. Particularmente, la forma directa es un método invasivo en el que se requiere de un cateterismo transhepático o transvenoso y puede acarrear complicaciones como el sangrado intraperitoneal (1). Se enumeran a continuación las diversas formas de medición de la presión portal que se clasifican según sean invasivos o no invasivos.
Métodos invasivos
Gradiente de presión venosa hepática (HVPG)
El gradiente de presión venosa hepática actualmente es reconocido como el método estándar para la medición de la presión portal. No obstante, dado que es un método invasivo y no se encuentra disponible de forma rutinaria, su uso no es frecuente (15). A pesar de lo anterior, El HVPG es una técnica segura y un método que reproduce la medición del gradiente de presión portal; el HVPG representa la diferencia entre la presión venosa hepática en cuña (WHVP) y la presión venosa hepática libre (FHVP) (16). Los aspectos técnicos para el registro de la HVPG consideran el uso de anestesia local, con monitorización de signos vitales y electrocardiograma continuo del paciente.
Inicialmente se localiza la vena yugular, femoral o cubital a las cuales se les introducirá un catéter guiado por control fluoroscópico que alcanzará la vena hepática principal. Localizado allí y a una distancia de entre 2 a 4 cm de la vena cava inferior, el catéter medirá la presión venosa hepática libre. Después, en la misma ubicación se insuflará el balón que tiene el catéter generando una obstrucción del flujo sanguíneo. Dicha obstrucción se confirma inyectando medio de contraste que revela un patrón en cuña. Finalmente, tras alcanzar la estabilidad de la presión dentro de la vena hepática, esta se mide determinando la presión venosa hepática en cuña (1,17). A pesar que el HVPG es el método más comúnmente usado para medir la presión portal, muchos estudios han intentado buscar alternativas que puedan facilitar su medición en procura de encontrar ayudas diagnósticas que igualen o sean más precisas para determinar la presión portal, en comparación a lo obtenido a través del gradiente de presión venosa hepática. No obstante, muchos de estos estudios no han logrado tener un resultado fiable.
El gradiente de presión auricular-hepática (HAPG), un estudio alternativo que utiliza la presión auricular derecha en lugar de la presión venosa hepática libre; es un método diagnóstico que busca medir la presión portal de forma similar al HVPG; no obstante, de forma más eficaz. A este respecto, un estudio que buscaba comparar el valor pronóstico entre el HAPG y el gradiente de presión venosa hepática, el cual fue realizado con una cohorte de 154 pacientes cirróticos con presión portal mayor a 12 mm Hg, demostró que el método que usaba la presión auricular no era viable. Dicho artículo reveló que el valor de la presión de la aurícula derecha siempre fue igual o menor que la reportada por la presión venosa hepática libre (presión auricular derecha basal: 4,9 ± 2,8 mm Hg frente a presión venosa hepática libre basal: 8,1±3,9) consecuentemente la HAPG iba a ser siempre mayor que la HVPG (3,2 mm Hg, IC 95%: 2,8-3,7 mm Hg; p <0,001), con lo que se demostraba que la medición de la presión auricular derecha no es adecuada para calcular el gradiente de presión venosa hepática (17).
El concepto de presión portal clínicamente significativa surge a raíz del conocimiento de que presiones mayores a 10-12 mm Hg son los límites inferiores para el aumento del riesgo de hemorragia variceal. En consecuencia, el HVPG tiene un gran valor pronóstico en hepatopatías crónicas, en especial en la cirrosis; además, es un fuerte predictor de la supervivencia y la aparición de complicaciones asociadas a la hipertensión portal como encefalopatía hepática, ascitis, peritonitis bacteriana espontánea e incluso de para el desarrollo de carcinoma hepatocelular (16). Por otra parte, el HVPG es valorado como un indicador subrogado para la eficacia del tratamiento de la hipertensión portal (18). De hecho, en un estudio observacional realizado entre 2001 y 2010, en 103 pacientes con cirrosis y que habían presentado hemorragia variceal, se demostró que la medición y mantenimiento HVPG ba (<12 mm Hg o con reducciones de su valor inicial >20%) es un elemento útil en la profilaxis de nuevos eventos hemorrágicos asociados a hepatopatías crónicas (19).
Algunos estudios revelan la viabilidad de medir la presión portal a través del gradiente presión venosa hepática. Un estudio retrospectivo publicado en 2013, se buscó en la base de datos de procedimientos realizados por el departamento de radiología intervencionista del Hospital for Sick Children, los niños que fueron sometidos a medición de gradiente venoso hepático entre el año 2000 y 2011. Dentro de los criterios de selección de la información se identificaron historias clínicas de 49 niños (25 niños con edad media de 5,6 a 8,2 años) que señaló lo seguro de la realización de esta técnica en infantes con enfermedades hepáticas graves; pues del total, ninguno de ellos presentó algún tipo de complicación relacionada con el procedimiento (20). En conclusión, el gradiente de presión venosa hepática continúa siendo un marcador fuerte de las enfermedades hepáticas que transcurren con hipertensión portal y es probablemente el mejor de los marcadores pronósticos en la evolución de dichas enfermedades a través del tiempo (16).
Métodos no invasivos
Elastografía transitoria
La elastografía transitoria (TE) es un método diagnóstico en hipertensión portal no invasivo que mide la rigidez hepática a través de ultrasonido; cuenta con buena sensibilidad y especificidad para la evaluación del grado de la fibrosis y cirrosis hepática (estadio F4: sensibilidad del 83% (IC 95%: 79-86) y especificidad del 89% (IC 95%: 87-91); estadio F3: sensibilidad del 82% (IC 95%: 78-86) y especificidad del 86% (IC 95%: 82-89); estadio F2: sensibilidad del 79% (IC 95%: 74-82) y especificidad del 78% (IC 95: 72-83); estadio F1: sensibilidad del 78% (IC 95%: 73-83) y especificidad del 83% (IC 95%: 72-90) (15,21). Dicha técnica se basa en los principios de Hooke que afirman que un material puede ser caracterizado a partir de la deformación que adquiere frente a una presión externa (22).
La técnica para la medición de la rigidez hepática a través de la elastografía transitoria implica una serie de condiciones del paciente y de los instrumentos a utilizar. Dicha medición se realiza en el lóbulo hepático derecho con el paciente en decúbito dorsal y con el brazo derecho en máxima abducción, para luego localizar un área hepática de al menos 6 cm de espesor que se encuentre libre de grandes vasos; donde finalmente se realizarán las pruebas para adquirir los datos del examen. Ahora bien, en orden de conseguir información precisa y confiable, se deben obtener 10 disparos válidos del ultrasonido; de manera que se considera falla de la TE si no se alcanza ningún disparo válido y se define de poco confianza si se presentan menos de 10 disparos válidos (22).
Con respecto de la validez y confiabilidad del uso de la TE para la evaluación de la hipertensión portal se encuentran disponibles varios estudios. Entre enero de 2004 y septiembre 2006 se llevó a cabo un estudio que buscaba evaluar la relación entre la medición de la rigidez hepática y el HVPG en pacientes con cirrosis relacionada con VHC o alcohol, para definir la realización y el mejor punto de corte de la elastografía transitoria para el diagnóstico de hipertensión portal. Estos pacientes debían tener un puntaje Child Pug A y ser simultáneamente sometidos a elastografía transitoria y biopsia hepática. De los 92 pacientes elegibles, la TE fue fuertemente correlacionada con el HVPG (R2 = 0,53, p <0,0001); además, el ROC para la predicción de la hipertensión portal significativa, definida como aquella mayor de 10 mm Hg, fue de 0,84±0,04 con un IC de 95% (23).
Por otra parte, en 2011 se publicó un estudio similar al anterior, realizado entre noviembre de 2005 y octubre de 2006, que buscó comparar la efectividad pronóstica entre el método estándar para la medición de hipertensión portal (HVPG) y la elastografía transitoria. Dicha investigación incluyó 100 pacientes con enfermedad hepática crónica compensada, sin ningún tratamiento antirretroviral o que modificaran su presión portal. Los pacientes fueron seguidos durante dos años o hasta que se descompensara su enfermedad, se les realizara un trasplante hepático o fallecieran. A todos los pacientes se les midió la presión portal por HVPG y se les realizó elastografía transitoria simultáneamente, realizando mediciones secuenciales, una al comienzo del estudio y otras posteriores, que finalizaban cuando los pacientes cumplían las condiciones para terminar su seguimiento. Dicho estudió, reveló la ausencia de una diferencia significativa para la predicción de complicaciones entre ambos métodos diagnósticos. De hecho, cuando consideraron solo complicaciones relacionadas a hipertensión portal, se encontró una precisión similar: un ROC de 0,830 (0,751-0,910) y de 0,845 [0,767-0,823] para HVPG y TE, respectivamente. Lo cual probó que la elastografía transitoria es tan efectiva como el gradiente de presión venosa hepática como predictores de descompensación clínica y de complicaciones relacionadas a la hipertensión portal en pacientes con hepatopatías crónica (24).
A pesar de los buenos resultados de algunos estudios, existen investigaciones que soportan parcialmente la utilidad del uso de TE como método diagnóstico de hipertensión portal en pacientes como cirrosis compensada y patologías particulares como tumores hepáticos. Al respecto, la elastografía transitoria logra ser un método adecuado solo en la mitad de los pacientes con tumores hepáticos con posibilidad de ser resecados (25). Otro estudio, buscaba determinar la correlación entre la TE y la HVPG y evaluar la viabilidad de la elastografía como método para el diagnóstico de hipertensión portal significativa (VHPG >10 mm Hg) en pacientes con coinfección VHC/VIH. Dicho estudio contó con la participación de 38 pacientes que fueron captados durante dos años, 2007 a 2009, que se sometieron a un estudio hepático hemodinámico y a elastografía transitoria simultáneamente como parte de su seguimiento. Se encontró que había una fuerte correlación entre los valores obtenidos con la TE frente a los procedentes del HVPG; sin embargo, se hace énfasis en la necesidad de más estudios dada la poca cantidad de pacientes disponibles para la investigación (26).
A pesar de las ventajas de la elastografía, su aplicabilidad condiciona sus límites. Lo anterior, es consecuencia de que uno de cada cinco TE realizadas no logran ser interpretadas o son difícilmente realizadas, causado principalmente por la obesidad del paciente y la falta de experiencia del operador. Además, dado que el hígado es un órgano envuelto en una cápsula distensible pero no elástica, las anormalidades ocupantes de espacio tal como el edema e inflamación, colestasis y congestión pueden interferir con la medida de la rigidez hepática independientemente de la fibrosis existente (27).
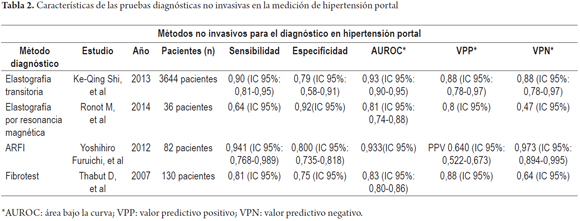
Finalmente, a pesar de los datos que apuestan y que limitan parcialmente el uso de la TE para la hipertensión portal, se han encontrado más estudios a favor de esta técnica que en contra. Al respecto, un metaanálisis realizado en el 2013 que evalúo un total de 18 estudios que incluyeron 3644 pacientes, reveló que la elastografía transitoria es altamente precisa y útil en la detección de hipertensión portal significativa dado que posee una sensibilidad y una especificidad del 90% y 79%, respectivamente. No obstante, dado que requiere valores de presión significativos, cuando la probabilidad pre test de hipertensión portal es mejor del 25% disminuye considerablemente la capacidad diagnóstica de la LE (15).
Elastografía por resonancia magnética
El hígado, dadas sus características funcionales e histológicas, es considerado un sistema bifásico constituido por un tejido sólido y un árbol vascular lleno de fluido. Del 25% al 30% del volumen hepático es sangre y el resto corresponde a tejido hepático propiamente dicho. En consecuencia, las interacciones que ocurren entre ambos tipos de fases tisulares generan una mecánica que puede ser medida y cuantificada por métodos in vivo como la elastografía (28). La elastografía consiste en estimular mecánicamente el tejido a estudiar mediante compresión estática a través de radiación acústica enfocada o vibraciones de baja frecuencia. Las vibraciones de baja frecuencia se exploran a través de la elastografía por resonancia magnética (MRE - Magnetic resonance elastography), la cual evalúa los campos de ondas en dos o tres dimensiones. De hecho, la MRE es la técnica de elastografía más precisa actualmente utilizada para estadificar el grado de fibrosis hepática (29).
La evidencia actual muestra a la elastografía por resonancia magnética como un medio adecuado para la evaluación de la hipertensión portal y su relación con el desarrollo de várices esofágicas (30). Un estudio experimental en un modelo animal buscó hallar la relación entre la MRE esplénica y el gradiente de presión portal venoso. Los animales fueron sometidos a la ligación del conducto biliar común para desarrollar enfermedad colestásica. Se encontró que al desarrollar un estadio F1 de fibrosis hepática, ya había presencia de hipertensión portal (HVPG: 11,0 ± 5,1 mm Hg) y a pesar que la fibrosis aumentará, no ocurría lo mismo con los valores de la presión (HVPG: 11,3 ± 3,2 mm Hg). A su vez, hubo un aumento del 100% de la rigidez esplénica a la cuarta semana de iniciado el experimento, con una estabilización de ella luego de la octava semana. Dicho estudio concluyó que hay una relación temporal entre la hipertensión portal y el desarrollo de fibrosis hepática, de manera que los resultados observados entre la rigidez esplénica identificada con la MRE y el gradiente de presión portal venoso pueden extrapolarse para el diagnóstico y tamización de la hipertensión portal en pacientes con hepatopatías crónicas (31).
Por otra parte, se han realizado estudios que evalúan el grado de fibrosis hepática a través de MRE y su correlación con el desarrollo de hipertensión portal y de várices esofágicas. Entre agosto de 2010 y octubre de 2011, 1358 pacientes con enfermedad hepática crónica o con sospecha de lesiones hepáticas focales y que estuvieron sometidos a imágenes por resonancia magnética, MRE y endoscopia de tracto digestivo superior fueron considerados a participar de un estudio que tenía como objetivo de evaluar la utilidad de la MRE como método no invasivo para predecir la aparición de várices esofágicas. De los 1358, 126 pacientes cumplían con los criterios de inclusión para el estudio y continuaron en el mismo. Se encontró que la media de la rigidez del parénquima hepático medido por MRE se correlacionaba con el grado de várices esofágicas, con un área bajo la curva de 0,859 (p <0,0001, intervalo de confianza (IC) 0,786-0,915) y 0,810 (p <0,0001, IC: 0,730-0,874), para predecir la presencia de várices (independiente del grado) y de várices de alto riesgo (≥II), respectivamente; De manera que la medición por MRE de la rigidez hepática puede ser útil como método no invasivo para identificar várices esofágicas y várices de alto riesgo correlacionando su aparición con el valor de presión portal en pacientes con cirrosis (32).
En 2014 se realizó un estudio que buscó evaluar el valor de la viscoelasticidad hepática y esplénica por medio de elastografía por resonancia magnética para determinar el grado de hipertensión portal y la presencia de várices de alto riesgo de sangrado. Esta investigación contó con 36 pacientes con cirrosis, los cuales fueron sometidos a medición de gradiente de presión venosa hepática, endoscopia de tracto digestivo superior y elastografía por resonancia magnética. Se encontró una relación estadísticamente significativa entre la pérdida de módulo en la resonancia magnética hepática y esplénica con valores de HVPG correspondientes a hipertensión portal grave o mayor de 12 mm Hg (r = 0,44; p= 0,017 y r = 0,5, p = 0,002, respectivamente). De modo que la pérdida de módulo esplénico fue el mejor parámetro para la identificación de hipertensión portal (p = 0,019, AUROC=0,81). Este estudio concluyó que la evaluación del HVPG puede realizarse con MRE hepática y esplénica, dado que la pérdida de módulo esplénico se correlaciona con hipertensión portal grave (33).
Finalmente, otro estudio publicado en 2014, realizado entre noviembre de 2010 y marzo de 2012, con 533 paciente demostró que hay una correlación significativa entre la rigidez hepática y esplénica, además de la longitud de este último y el grado de várices esofágicas (r = 0,46; r = 0,48, y r = 0.36, respectivamente; p= 0,0001). Lo anterior, refuerza el concepto de que la evaluación por MRE de la rigidez hepática y esplénica se asocia con várices esofágicas, que a su vez está íntimamente relacionado con la presencia de hipertensión portal con valores por encima de 10 mm Hg (34).
ARFI (acoustic radiation force impulse imaging)
Es una tecnología de reciente aparición, que provee información sobre la elasticidad de un tejido en tiempo real y que se encuentra incorporado en una unidad convencional de ultrasonido. Se generan pulsos acústicos de aproximadamente 262 µs, con una frecuencia de 2,67 MHz, lo cual genera ondas de corte en el tejido objetivo del estudio. Luego, las velocidades de las ondas de corte en el tejido son medidas en una pequeña área del parénquima en el cual se genera un pequeño desplazamiento (35,36).
Varios estudios han descrito la relación entre los hallazgos de elastografía por ARFI como predictores del grado de hipertensión portal en pacientes con hepatopatías crónicas. Un estudio publicado en 2012 buscaba encontrar la relación entre la rigidez hepática, esplénica y la razón entre estos dos valores (medidos por ARFI) y el diagnóstico de hipertensión portal idiopática. Esta investigación incluyó 82 pacientes, de los cuales 20 eran sanos y los demás padecían de hipertensión portal idiopática (17 pacientes), cirrosis (25 pacientes) y carcinoma hepatocelular (20 pacientes). Se identificó que la razón rigidez hepática/esplénica en los pacientes con cirrosis hepática y carcinoma hepatocelular eran muy bajas; en cambio, en los pacientes con hipertensión portal idiopática era alto (p <0,001). Además, luego de que se comparó a través de una curva ROC la razón rigidez hepático/esplénica entre el grupo de hipertensión portal idiopática frene a los demás grupos, se identificó un área bajo la curva con una sensibilidad de 0,933 a 0,941; especificidad de 0,800 y precisión de 0,839. En consecuencia, la medición de la razón rigidez hepático/esplénica por ARFI, puede ser un método no invasivo con alta sensibilidad y precisión de la hipertensión portal idiopática (37).
Un estudio retrospectivo, publicado en 2015, de 46 pacientes pediátricos con atresia biliar luego de una portoenterostomía, reveló que el grado de rigidez esplénica medida a través de elastografía por ARFI puede ser usado para predecir la severidad de la hipertensión portal en este tipo de pacientes. La razón de tal conclusión es la relación entre los valores de rigidez y diámetro esplénico (r = 0,320, p = 0,043) y el diámetro de la vena porta (r = -0,409, p = 0,009), que a su vez se correlaciona con la presencia de hipertensión portal. Estos hallazgos sugieren que la elastografía por ARFI realizada de manera seriada para la valoración de la rigidez esplénica en pacientes con atresia biliar, puede ser un método no invasivo para la monitorización de la severidad de la hipertensión portal (38).
Por otra parte, un estudio del año 2012 evalúa el ARFI para la valoración de hipertensión portal a través de la correlación entre la elasticidad hepática medida por este método y los índices hemodinámicos evaluados por Doppler. Dicho estudio contó con 154 paciente con cirrosis (91 hombres; 63 mujeres) que fueron sometidos a imagen por ARFI y Doppler hepatoesplénico para determinar la velocidad de la vena porta, índice esplénico y el índice esplenoportal. De ellos, en 47 pacientes se identificaron várices esofágicas en tanto que en 74 no; los demás pacientes no se sometieron a endoscopia de tracto digestivo superior. Del estudio, se encontró un incremento similar entre la velocidad de las ondas de corte y el índice esplénico y portoesplénico (r = 0,409; p = 0,01 y r = 0,451; p = 0,01, respectivamente). Además, en el grupo de pacientes que no tenían várices había correlación entre la velocidad de ondas de corte y los parámetros esplénicos (índice esplénico: r = 0,447, índice portoesplénico: r = 0,552; p = 0,01), en tanto, que en el grupo que sí tenían várices esofágicas, no hubo una correlación entre los valores del ARFI y los índices esplénicos. Por tanto, a pesar del valor limitado del ARFI con respecto al Doppler, por la variabilidad en los datos de este último, la medición de la velocidad de ondas de corte podría ser una herramienta complementaria no invasiva para la predicción de la hipertensión portal (39).
En cuanto al ARFI, existe evidencia que respalda su uso como método diagnóstico y monitoreo de hipertensión portal pero en general su uso no es ampliamente extendido dado los pocos datos que evalúen directamente el ARFI y la hipertensión portal, más allá de compararlo solo con la aparición de várices esofágicas, por tanto, hace falta de más estudios que puedan esclarecer y reforzar el uso de esta técnica para la valoración de la hipertensión portal.
Fibrotest
Numerosos marcadores de fibrosis hepática han sido estudiados para evaluar la hipertensión portal. El fibrotest es un panel de cinco marcadores séricos relacionados por un algoritmo (α2-macroglobulina, apolipoproteina A-1, haptoglobina, γ-glutamiltransferasa, bilirrubina sérica) que se encuentra ampliamente validado en términos de su relación con la hipertensión portal grave y que genera un resultado entre 0 y 135 (40). Sobre el contexto de que el gradiente de presión venosa hepática es el método estándar para la detección de hipertensión portal. En 2007 fue publicado una investigación que durante un período de ocho meses incluyo a pacientes con hepatopatías que se sometieron a biopsia hepática transyugular, medición de HVPG y muestras de sangre con el fin de evaluar la relación entre el fibrotest y la presencia y grado de hipertensión portal, además de determinar si el fibrotest puede diagnosticar la hipertensión portal grave (≥ 12 mm Hg) en pacientes con cirrosis. De un número inicial de 147 participantes, solo 130 hicieron parte del estudio. Del total de pacientes, el 12% presentaron fibrosis leve, 17% fibrosis moderada y el 71% restante fibrosis severa, según estudio histopatológico del hígado. Hubo una importante correlación entre el fibrotest y el HVPG (coeficiente de correlación de Pearson = 0,58; p <0,0001) aunque era más débil en los pacientes cirróticos (coeficiente de correlación de Pearson = 0,24 y p = 0,02). En los pacientes cirróticos, el fibrotest tuvo un valor significativamente mayor cuando la hipertensión portal era más grave (0,87±0,15; p = 0,02). Entre tanto, el AUROC para el fibrotest fue de 0,79±0,07. Sobre los argumentos anteriores, el fibrotest se correlaciona con la presencia y grado de hipertensión portal; aunque su relación es débil en los pacientes con cirrosis, con esta prueba se avanza de manera importante en la detección de dicha complicación en los pacientes con hepatopatías. No obstante, se requiere de otros estudios para confirmar los resultados anteriores, especialmente en los pacientes con cirrosis compensada (40-42). En la Tabla 2 se resumen las características de los métodos diagnósticos no invasivos utilizados para el diagnóstico de la hipertensión portal.
Otros métodos
La idea de encontrar nuevas técnicas diagnósticas que determinen la presión portal en un paciente, que sea precisa, altamente sensible y específica, así como no invasiva continua siendo un reto al que a diario se enfrenta la medicina. Existen diversas investigaciones en procura de encontrar métodos no invasivos, entre ellas un estudio publicado en 2014 que buscó determinar si la medición de biomarcadores inflamatorios junto con parámetros de laboratorio clínico y datos demográficos podía usarse como un paradigma predictivo del HVPG.
Dicho estudio contó con un número de 213 pacientes, en los que se encontró que algunos biomarcadores se relacionaban con el HVPG (IL-1b, IL-1Ra, Fas-R, VCAM-1, TNFb y HSP-70), los cuales mostraban una sensibilidad del 86%, una especificidad de 87% con respecto a la predicción de la presión portal cuando esta era significativamente alta (HVPG > 12 mm Hg). Sin embargo, a pesar de los resultados del estudio aún no se realiza ampliamente la determinación de la presión portal en términos de biomarcadores, dado las limitantes que la medición de dichos marcadores biológicos pueden acarrear (43).
Por otra parte, en 2012 se publicó un artículo que presentaba los resultados de una investigación realizada entre mayo de 2006 y noviembre de 2008. Dicha investigación buscaba evaluar la asociación entre parámetros clínicos y la medición directa de presión venosa portal, para lo cual 40 pacientes con algún tipo de tumor hepático fueron sometidos a determinación de la presión portal a través de punción percutánea transhepática directa; previa toma de muestras sanguíneas con las cuales se pretendían evaluar parámetros de laboratorio y clínicos (edad, conteo plaquetario, AST, ALT, albúmina sérica, bilirrubina sérica, niveles séricos de ácidos biliares, niveles de ácido hialurónico, NH3, actividad de protrombina, ICGR15, APRI) y volumen esplénico. Los resultados demostraron que los valores del área bajo la curva (AUC) más significativos correspondieron a los niveles séricos de ácidos biliares y el volumen esplénicos (AUC 0,792 y 0,926, respectivamente), sugiriendo que dichas mediciones son predictores sensibles de hipertensión portal temprana y avanzada (44).
Sumado al argumento de las amplias posibilidades para el diagnóstico no invasivo de la hipertensión portal, se encuentra un estudio prospectivo realizado en 202 pacientes con hepatopatía crónica y evidencia clínica o de laboratorio consistente con hipertensión portal y cirrosis. A estos pacientes se les realizo a la par evaluaciones del gradiente de presión venosa hepática, exámenes séricos (solos o combinados generando puntajes) y medición de la rigidez hepática. Evaluar la precisión de 6 puntajes séricos diferentes y modelos artificiales de conexión neural y la rigidez hepática medida por elastografía transitoria para el diagnóstico de cirrosis, hipertensión portal significativa y várices esofágicas fue el objetivo del estudio. Los resultados evidenciaron a la elastografía transitoria como el mejor método para el diagnóstico; ahora bien, dentro de los puntajes séricos evaluados (score), se identificaron a la Fibrosis-4 (FIB-4) y al Lok score, como los métodos más precisos en el diagnóstico de cirrosis e hipertensión portal y várices esofágicas, respectivamente (45).
Cabe resaltar que el FIB-4 es un puntaje sérico o examen no invasivo para determinar el grado de fibrosis hepática que se basa en la combinación de valores bioquímicos y edad (46). En 2014, un estudio reveló la asociación entre el puntaje FIB-4 y la presencia de productos de la degradación del colágeno con el estado de fibrosis hepática y la presencia de hipertensión portal. Este estudio contó con 58 pacientes coinfectados por VIH/HCV. Del total de sujetos a 43 se les realizó medición del gradiente de presión venosa hepática como método para evaluar la presión portal y se calculó el puntaje FIB-4 para determinar el estado de fibrosis hepática; además, productos de la degradación de la matriz extracelular fueron medidos por ELISA en sangre periférica. Dentro de los resultados más importantes, se encontró una fuerte correlación entre el índice FIB-4 con los valores arrojados por el HVPG (r: 0,628; p = 0,0000007). Por otra parte, se identificó una fuerte relación entre el producto de degradación de matriz extracelular PRO-C3 y el HVPG (r: 0,0354; p = 0,02). De esta manera, se concluyó que los niveles de PRO-C3 reflejan los niveles de daño hepático, el estado de fibrosis y grado de hipertensión portal en pacientes con coinfección VIH/HCV (47).
El Lok score es un puntaje que combina variables constantes, y valores bioquímicos como el AST, ALT e INR (48). Este es un índice o puntaje que ha sido usado para predecir complicaciones de la cirrosis hepática o la hipertensión portal (49). Dado el uso de puntajes combinados para la evaluación de hipertensión portal y cirrosis, además del pronóstico para desarrollar várices esofágicas, un estudio publicado en febrero de 2015 cuenta con un aval para el uso de dichos puntajes con el fin de diagnosticar las patologías previamente mencionadas. Este estudio pretendía evaluar la combinación del Lok score junto con la rigidez hepática y esplénica para el diagnóstico de alto riesgo de várices esofágicas, relacionadas estrechamente con el valor de la presión portal y compararlo con otros métodos no invasivos disponibles en la actualidad. Este estudio evidenció que cualquiera de los métodos mencionados, Lok score, rigidez hepática y esplénica, seleccionan pacientes con alto riesgo de desarrollar várices esofágicas con precisión moderada; lo que sugiere que se pueden utilizar para evaluar pacientes con un bajo riesgo de desarrollar várices esofágicas (50). En consecuencia con los estudios anteriores, muchas nuevas técnicas no invasivas están siendo desarrolladas para el diagnóstico de hipertensión portal, cirrosis y várices esofágicas, no obstante a los buenos resultados que se han obtenido su uso no es ampliamente difundido en razón a la falta de suficiente evidencia que las soporten y les de validez.
CONCLUSIÓN
La hipertensión portal como principal complicación de las hepatopatías crónicas, entre ellas la cirrosis, es una de las causas más frecuentes de morbimortalidad de los pacientes con estas patologías. Diversos mecanismos moleculares, vasomotores y de flujo sanguíneo están activamente implicados en el desarrollo de la hipertensión portal, muchos de ellos ya descritos, lo cual puede favorecer potencialmente la reducción de sus valores a través de tratamientos enfocados a eliminar o reducir sus efectos en la fisiopatología de la hipertensión portal. Actualmente existen varios métodos diagnósticos que se utilizan para la evaluación inicial y seguimiento de los pacientes con cirrosis e hipertensión portal que aseguran un mejor pronóstico y manejo de la enfermedad. Tales métodos están representados por su estándar de oro, el gradiente de presión venosa hepática, un método que a pesar de ser invasivo continúa siendo el más sensible y específico para la evaluación de la hipertensión portal.
No obstante, la elastografía transitoria como método no invasivo emergen como un método seguro, eficaz, sensible y específico en la evaluación de la hipertensión portal. Sin embargo, la necesidad de valores significativos de la presión portal para evaluar el grado de hipertensión como un método de seguimiento y la falta de más estudios comparativos con el HVPG disminuyen significativamente su aplicación en el día a día médico. Por otro lado, le elastografía por resonancia magnética, el fibrotest y ARFI se postulan como métodos no invasivos que cada vez tienen un mayor sensibilidad y especificidad para la evaluación de la hipertensión portal; no obstante, la disponibilidad de su aplicación y la capacidad de relacionarse en especial con valores graves de hipertensión porta l (> 12 mm Hg) limitan potencialmente su uso cotidiano en la evaluación de pacientes con hepatopatías crónicas.
Finalmente, otros métodos alternativos y característicamente no invasivos como la medición de biomarcadores, el uso de puntajes basados en pruebas sanguíneas así como la evaluación de la rigidez esplénica, han mostrado algún grado de relación con el gradiente de presión venosa para el seguimiento de los pacientes con cirrosis e hipertensión portal. Sin embargo, se requieren más estudios para lograr que estos métodos alcancen la seguridad suficiente como para ser usadas rutinariamente en la evaluación de la hipertensión portal.
Agradecimientos
Los autores agradecen al Proyecto de Sostenibilidad, Vicerrectoría de Investigación, Universidad de Antioquia.
REFERENCIAS
1. Berzigotti A, Seijo S, Reverter E, Bosch J. Assessing portal hypertension in liver diseases. Expert Rev Gastroenterol Hepatol. 2013;7(2):141-55. [ Links ]
2. García Buey L, González Mateos F, Moreno-Otero R. Cirrosis hepática. Medicine - Programa de Formación Médica Continuada Acreditado. 2012;11(11):625-33. [ Links ]
3. Hu LS, George J, Wang JH. Current concepts on the role of nitric oxide in portal hypertension. World J Gastroenterol. 2013;19(11):1707-17. [ Links ]
4. Sarin SK, Khanna R. Non-cirrhotic portal hypertension. Clin Liver Dis. 2014;18(2):451-76. [ Links ]
5. Carey W. Portal hypertension: diagnosis and management with particular reference to variceal hemorrhage. J Dig Dis. 2011;12(1):25-32. [ Links ]
6. Palaniyappan N, Aithal GP. Portal hypertension and ascites. Surgery (Oxford). 2011;29(12):640-6. [ Links ]
7. Iwakiri Y. Pathophysiology of portal hypertension. Clin Liver Dis. 2014;18(2):281-91. [ Links ]
8. Tsochatzis EA, Bosch J, Burroughs AK. Liver cirrhosis. Lancet. 2014;383(9930):1749-61. [ Links ]
9. Bosch J, Abraldes JG, Fernandez M, Garcia-Pagan JC. Hepatic endothelial dysfunction and abnormal angiogenesis: new targets in the treatment of portal hypertension. J Hepatol. 53. England: 2010 European Association for the Study of the Liver. Published by Elsevier B.V; 2010. p. 558-67. [ Links ]
10. Kim MY, Baik SK, Lee SS. Hemodynamic alterations in cirrhosis and portal hypertension. Korean J Hepatol. Korea South. 2010. p. 347-52. [ Links ]
11. Iwakiri Y, Shah V, Rockey DC. Vascular pathobiology in chronic liver disease and cirrhosis - current status and future directions. J Hepatol. 2014;61(4):912-24. [ Links ]
12. Sharma M, Rameshbabu CS. Collateral Pathways in portal hypertension.J Clin Exp Hepatol. 2012;2(4):338-52. [ Links ]
13. Thabut D, Shah V. Intrahepatic angiogenesis and sinusoidal remodeling in chronic liver disease: new targets for the treatment of portal hypertension? J Hepatol. 53. England: 2010 European Association for the Study of the Liver. Published by Elsevier B.V; 2010. p. 976-80. [ Links ]
14. Iwakiri Y, Groszmann RJ. The hyperdynamic circulation of chronic liver diseases: from the patient to the molecule. Hepatology. 2006;43(2 Suppl 1):S121-31. [ Links ]
15. Shi KQ, Fan YC, Pan ZZ, Lin XF, Liu WY, Chen YP, et al. Transient elastography: a meta-analysis of diagnostic accuracy in evaluation of portal hypertension in chronic liver disease. Liver Int. 2013;33(1):62-71. [ Links ]
16. Merkel C, Montagnese S. Hepatic venous pressure gradient measurement in clinical hepatology. Dig Liver Dis. 43. Netherlands: 2011 Editrice Gastroenterologica Italiana S.r.l. Published by Elsevier Ltd; 2011. p. 762-7. [ Links ]
17. La Mura V, Abraldes JG, Berzigotti A, Erice E, Flores-Arroyo A, Garcia-Pagan JC, et al. Right atrial pressure is not adequate to calculate portal pressure gradient in cirrhosis: a clinical-hemodynamic correlation study. Hepatology. 2010;51(6):2108-16. [ Links ]
18. Procopeţ B, Tantau M, Bureau C. Are there any alternative methods to hepatic venous pressure gradient in portal hypertension assessment? J Gastrointestin Liver Dis. 2013;22(1):73-8. [ Links ]
19. Augustin S, González A, Badia L, Millán L, Gelabert A, Romero A, et al. Long-term follow-up of hemodynamic responders to pharmacological therapy after variceal bleeding. Hepatology. 2012;56(2):706-14. [ Links ]
20. Woolfson J, John P, Kamath B, Ng VL, Ling SC. Measurement of hepatic venous pressure gradient is feasible and safe in children. J Pediatr Gastroenterol Nutr. 2013;57(5):634-7. [ Links ]
21. Tsochatzis EA, Gurusamy KS, Ntaoula S, Cholongitas E, Davidson BR, Burroughs AK. Elastography for the diagnosis of severity of fibrosis in chronic liver disease: a meta-analysis of diagnostic accuracy. J Hepatol. 2011;54(4):650-9. [ Links ]
22. Şirli R, Sporea I, Bota S, Raţiu I. Liver elastography for the diagnosis of portal hypertension in patients with liver cirrhosis. Med Ultrason. 2012;14(3):225-30. [ Links ]
23. Lemoine M, Katsahian S, Ziol M, Nahon P, Ganne-Carrie N, Kazemi F, et al. Liver stiffness measurement as a predictive tool of clinically significant portal hypertension in patients with compensated hepatitis C virus or alcohol-related cirrhosis. Aliment Pharmacol Ther. 2008;28(9):1102-10. [ Links ]
24. Robic MA, Procopet B, Métivier S, Péron JM, Selves J, Vinel JP, et al. Liver stiffness accurately predicts portal hypertension related complications in patients with chronic liver disease: a prospective study. J Hepatol. 2011;55(5):1017-24. [ Links ]
25. Llop E, Berzigotti A, Reig M, Erice E, Reverter E, Seijo S, et al. Assessment of portal hypertension by transient elastography in patients with compensated cirrhosis and potentially resectable liver tumors. J Hepatol. 2012;56(1):103-8. [ Links ]
26. Sánchez-Conde M, Miralles P, Bellón JM, Rincón D, Ramírez M, Gutiérrez I, et al. Use of transient elastography (FibroScan®) for the noninvasive assessment of portal hypertension in HIV/HCV-coinfected patients. J Viral Hepat. 2011;18(10):685-91. [ Links ]
27. Castera L. Invasive and non-invasive methods for the assessment of fibrosis and disease progression in chronic liver disease. Best Pract Res Clin Gastroenterol. 2011;25(2):291-303. [ Links ]
28. Hirsch S, Guo J, Reiter R, Schott E, Büning C, Somasundaram R, et al. Towards compression-sensitive magnetic resonance elastography of the liver: sensitivity of harmonic volumetric strain to portal hypertension. J Magn Reson Imaging. 2014;39(2):298-306. [ Links ]
29. Hirsch S, Guo J, Reiter R, Papazoglou S, Kroencke T, Braun J, et al. MR elastography of the liver and the spleen using a piezoelectric driver, single-shot wave-field acquisition, and multifrequency dual parameter reconstruction. Magn Reson Med. 2014;71(1):267-77. [ Links ]
30. Talwalkar JA, Yin M, Venkatesh S, Rossman PJ, Grimm RC, Manduca A, et al. Feasibility of in vivo MR elastographic splenic stiffness measurements in the assessment of portal hypertension. AJR Am J Roentgenol. 2009;193(1):122-7. [ Links ]
31. Nedredal GI, Yin M, McKenzie T, Lillegard J, Luebke-Wheeler J, Talwalkar J, et al. Portal hypertension correlates with splenic stiffness as measured with MR elastography. J Magn Reson Imaging. 2011;34(1):79-87. [ Links ]
32. Sun HY, Lee JM, Han JK, Choi BI. Usefulness of MR elastography for predicting esophageal varices in cirrhotic patients. J Magn Reson Imaging. 2014;39(3):559-66. [ Links ]
33. Ronot M, Lambert S, Elkrief L, Doblas S, Rautou P-E, Castera L, et al. Assessment of portal hypertension and high-risk oesophageal varices with liver and spleen three-dimensional multifrequency MR elastography in liver cirrhosis. Eur Radiol. 2014;24(6):1394-402. [ Links ]
34. Shin SU, Lee J-M, Yu MH, Yoon JH, Han JK, Choi B-I, et al. Prediction of esophageal varices in patients with cirrhosis: usefulness of three-dimensional MR elastography with echo-planar imaging technique. Radiology. 2014;272(1):143-53. [ Links ]
35. Berzigotti A, Ashkenazi E, Reverter E, Abraldes JG, Bosch J. Non-invasive diagnostic and prognostic evaluation of liver cirrhosis and portal hypertension. Dis Markers. 2011;31(3):129-38. [ Links ]
36. Gerstenmaier JF, Gibson RN. Ultrasound in chronic liver disease. Insights Imaging. 2014;5(4):441-55. [ Links ]
37. Furuichi Y, Moriyasu F, Taira J, Sugimoto K, Sano T, Ichimura S, et al. Noninvasive diagnostic method for idiopathic portal hypertension based on measurements of liver and spleen stiffness by ARFI elastography. J Gastroenterol. 2013;48(9):1061-8. [ Links ]
38. Uchida H, Sakamoto S, Kobayashi M, Shigeta T, Matsunami M, Sasaki K, et al. The degree of spleen stiffness measured on acoustic radiation force impulse elastography predicts the severity of portal hypertension in patients with biliary atresia after portoenterostomy. J Pediatr Surg. 2015;50(4):559-64. [ Links ]
39. Han J-Y, Cho JH, Kwon HJ, Nam KJ. Predicting portal hypertension as assessed by acoustic radiation force impulse: correlations with the Doppler ultrasound. Br J Radiol. 2012;85(1016):e404-409. [ Links ]
40. Friedrich-Rust M, Rosenberg W, Parkes J, Herrmann E, Zeuzem S, Sarrazin C. Comparison of ELF, FibroTest and FibroScan for the non-invasive assessment of liver fibrosis. BMC Gastroenterol. 2010;10:103. [ Links ]
41. Thabut D, Imbert-Bismut F, Cazals-Hatem D, Messous D, Muntenau M, Valla DC, et al. Relationship between the Fibrotest and portal hypertension in patients with liver disease. Aliment Pharmacol Ther. 2007;26(3):359-68. [ Links ]
42. Poca M, Puente A, Graupera I, Villanueva C. Prognostic markers in patients with cirrhosis and portal hypertension who have not bled. Dis Markers. 2011;31(3):147-54. [ Links ]
43. Buck M, Garcia-Tsao G, Groszmann RJ, Stalling C, Grace ND, Burroughs AK, et al. Novel inflammatory biomarkers of portal pressure in compensated cirrhosis patients. Hepatology. 2014;59(3):1052-9. [ Links ]
44. Hayashi H, Beppu T, Okabe H, Nitta H, Imai K, Doi K, et al. Combined measurements of serum bile acid level and splenic volume may be useful to noninvasively assess portal venous pressure. J Gastroenterol. 2012;47(12):1336-41. [ Links ]
45. Procopet B, Cristea VM, Robic MA, Grigorescu M, Agachi PS, Metivier S, et al. Serum tests, liver stiffness and artificial neural networks for diagnosing cirrhosis and portal hypertension. Dig Liver Dis. 2015;47(5):411-6. [ Links ]
46. Vallet-Pichard A, Mallet V, Nalpas B, Verkarre V, Nalpas A, Dhalluin-Venier V, et al. FIB-4: an inexpensive and accurate marker of fibrosis in HCV infection. comparison with liver biopsy and fibrotest. Hepatology. 2007;46(1):32-6. [ Links ]
47. Jansen C, Leeming DJ, Mandorfer M, Byrjalsen I, Schierwagen R, Schwabl P, et al. PRO-C3-levels in patients with HIV/HCV-Co-infection reflect fibrosis stage and degree of portal hypertension. PLoS ONE. 2014;9(9):e108544. [ Links ]
48. Hassan EM, Omran DA, El Beshlawey ML, Abdo M, El Askary A. Can transient elastography, Fib-4, Forns Index, and Lok Score predict esophageal varices in HCV-related cirrhotic patients? Gastroenterol Hepatol. 2014;37(2):58-65. [ Links ]
49. Stefanescu H, Procopet B. Noninvasive assessment of portal hypertension in cirrhosis: liver stiffness and beyond. World J Gastroenterol. 2014;20(45):16811-9. [ Links ]
50. Stefanescu H, Radu C, Procopet B, Lupsor-Platon M, Habic A, Tantau M, et al. Non-invasive ménage à trois for the prediction of high-risk varices: stepwise algorithm using lok score, liver and spleen stiffness. Liver Int. febrero de 2015;35(2):317-25. [ Links ]











 texto en
texto en