Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.31 no.3 Bogotá July/Sept. 2016
Síndrome de Budd Chiari: revisión de tema
A Review of Budd Chiari Syndrome
Simón Correa Gaviria MD. (1), Ana Catalina Ramírez MD. (2), Yeinis Paola Espinoza Herrera MD. (2), Juan Carlos Restrepo Gutiérrez MD. (3)
(1) Médico y cirujano de la Universidad de Antioquia. Integrante del Grupo de Gastrohepatología, Universidad de Antioquia. Estudiante de Master of Medical Sciences in Clinical Investigation de Harvard Medical School. Director de Promoción a la Investigación, Instituto de Investigaciones Médicas, Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
(2) Médica y cirujana, Universidad de Antioquia. Integrante del Grupo de Gastrohepatología de la Universidad de Antioquia. Medellín, Colombia.
(3) Médico general, especialista en Medicina interna, subespecialista en Hepatología clínica y trasplante de hígado. Magíster en Trasplante de órganos y tejidos. Doctor en Hepatología. Integrante del Grupo de Gastrohepatología de la Universidad de Antioquia. Médico Internista del Grupo de Hepatología y trasplante de hígado del Hospital Pablo Tobón Uribe. Profesor de la Facultad de Medicina de la Universidad de Antioquia. Medellín, Colombia.
Fecha recibido: 18-05-16 Fecha aceptado: 25-07-16
Resumen
El Síndrome de Budd-Chiari (SBC) es una entidad poco usual; su incidencia se calcula de uno en cien mil. Consiste en una obstrucción completa o parcial del flujo venoso localizada en cualquier lugar desde las pequeñas venas hepáticas hasta la porción suprahepática de la vena cava inferior. De acuerdo con su etiología puede clasificarse en: primario (cuando la obstrucción se debe a una enfermedad venosa), o secundario (cuando se atribuye a una compresión extrínseca o a la invasión por una lesión que se origina fuera de las venas como neoplasias o quistes). En la mayoría de los casos se presenta como un cuadro de inicio súbito de dolor abdominal, ascitis y hepatomegalia, pudiendo ser asintomático. El diagnóstico definitivo se establece por estudios de imagen; si bien deben solicitarse exámenes básicos de laboratorio y estudios de extensión. Las modalidades de imagen incluyen la ultrasonografía Doppler, la tomografía computarizada, la resonancia magnética y la angiografía por sustracción digital, que es considerada el patrón de oro. La primera medida terapéutica que debe emprenderse en estos pacientes es la anticoagulación con heparina de bajo peso molecular, seguida de antagonistas de vitamina K. La mayoría de los pacientes requieren un enfoque multidisciplinario y un tratamiento escalonado que incluye procedimientos radiológicos, como la aplicación de balones y stents y la inserción de shunts portosistémicos transyugulares intrahepáticos (TIPS), procedimientos quirúrgicos de descomprensión y, por último, trasplante hepático.
Palabras clave
Síndrome de Budd-Chiari, Ultrasonografía Doppler, Tomografía, Angiografía de Sustracción Digital, Trasplante de hígado
Abstract
Budd - Chiari Syndrome (BCS) is a rare entity whose incidence is estimated at one in one hundred thousand. It consists of complete or partial obstruction of venous outflow at any location from the small hepatic veins to the hepatic portion of the inferior vena cava. It can be classified according to its etiology into primary BCS when there is venous obstruction and secondary disease when obstruction is attributed to extrinsic compression or invasion due to a lesion outside of the veins such as neoplasms or cysts. In most cases it presents as sudden onset of abdominal pain, ascites and hepatomegaly, but it may be asymptomatic. A definitive diagnosis is established by imaging, but basic laboratory tests and other studies must also be done. Diagnostic imaging techniques include Doppler ultrasonography, computed tomography, magnetic resonance imaging and digital subtraction angiography. The latter is considered to be the gold standard. The first therapeutic measure to be undertaken for these patients is anticoagulation with low molecular weight heparin followed by vitamin K antagonists. Most patients require a multidisciplinary approach and step by step treatment including radiological procedures, balloon enteroscopy, stenting, transjugular intrahepatic portosystemic shunt (TIPS), decompression surgery and finally, liver transplantation.
Keywords
Budd-Chiari syndrome, Doppler ultrasonography, CT scan, Digital Subtraction Angiography, Liver Transplant.
INTRODUCCIÓN
El Síndrome de Budd Chiari (SBC) es una entidad clínica poco frecuente, la cual fue descrita por primera vez en 1845 por Budd y más tarde en 1899 por Chiari, como aquellas manifestaciones clínicas que aparecen por la obstrucción parcial o completa del flujo venoso desde las pequeñas venas hepáticas hasta la porción suprahepática de la vena cava inferior (VCI) (1-4). En el año 2003 se publicó el resultado de un consenso sobre el tema por parte de un panel de expertos, quienes excluyeron de esta definición la obstrucción causada por enfermedades cardíacas o por procesos tumorales, así como el síndrome de obstrucción sinusoidal; de esa manera, definieron la enfermedad como resultado de la obstrucción del flujo venoso hepático, la cual puede localizarse desde las vénulas hepáticas, en cualquier parte del recorrido que realiza la VCI a su llegada a la aurícula derecha (5).
Este síndrome se clasifica en primario o secundario, dependiendo del origen de la lesión obstructiva. Se considera primario si la obstrucción es el resultado de una lesión venosa intraluminal (por ejemplo, una trombosis); y secundario (cuando la obstrucción es debido a una compresión extrínseca al sistema venoso o a una invasión tumoral) (6,7).
EPIDEMIOLOGÍA
La verdadera incidencia del SBC no se conoce, pues son pocos los estudios que hay al respecto (8). Sin embargo, la mayoría de los autores describen una incidencia de un caso por cada cien mil personas en la población general del mundo (9). Esta incidencia varía de acuerdo con el lugar: en Nepal representa la primera causa de hospitalización por enfermedad hepática (EH); mientras que en Japón y en Europa es raro el reporte de casos de pacientes con SBC (10,11). El nivel de la obstrucción del flujo venoso hepático, así como la incidencia por sexo y edad también son diferentes de acuerdo con el área geográfica: en Asia, por lo general, los casos de SBC son secundarios a obstrucción del flujo de la vena cava inferior (VCI) o entre la VCI y las venas hepáticas (VH), y es más frecuente que se presente en pacientes de sexo masculino con edad cercana a los 45 años; mientras que en el resto de países la obstrucción, por lo general, se localiza al nivel de las VH, y en la mayoría de casos descritos se trata de mujeres con una edad promedio de 35 años (10).
ETIOLOGÍA
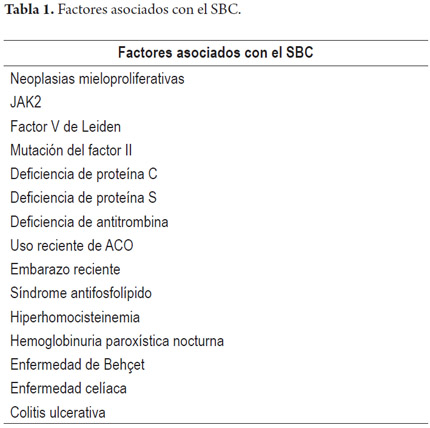
El SBC se divide en primario y secundario. Es primario cuando la causa de la obstrucción del flujo es una enfermedad venosa (por ejemplo, trombosis o flebitis) y es secundario cuando se debe a compresión o invasión de una lesión que se origina fuera de las venas (por ejemplo, neoplasias, abscesos, quistes o hematomas intrahepáticos) (8). El SBC está relacionado con estados protrombóticos, como demuestra la literatura (12, 13, 14). En un estudio realizado por Darwish y colaboradores en el año 2009, se encontró que el 84% de los pacientes con SBC tenía al menos un desorden trombofílico y que el 74% de estos mismos pacientes tenía más de una condición protrombótica, enfermedad mieloproliferativa en la mayoría de los casos (38). Se ha descrito incluso que hasta el 45% a 53% de los pacientes con SBC tiene un trastorno mieloproliferativo oculto o latente (15,16). Janssen y colaboradores concluyen que la mutación del factor V de Leiden y la deficiencia de proteína C son factores de riesgo importantes en el desarrollo del SBC (17).
El uso de anticonceptivos orales combinados (ACO) también se ha asociado al SBC, y se documenta hasta en el 33% de los pacientes con dicha condición (18). Un estudio de casos y controles publicado en 1986 por Valla D. y colaboradores demostró que las pacientes con uso reciente de ACO presentaban un riesgo 2,37 veces mayor de trombosis de las venas hepáticas en comparación con aquellas que no estaban expuestas a estos medicamentos (19). Se ha sugerido que muchos de los pacientes que desarrollan SBC con el uso de ACO o durante la gestación, pueden tener algún tipo de trombofilia subyacente (20, 21). Incluso, se ha relacionado el uso de ACO con la mutación del factor V de Leiden (22). Se ha propuesto que es poco probable que la mutación aislada del factor V de Leiden pueda producir trombosis en ausencia de otros factores protrombóticos congénitos o adquiridos, como lo demuestra un estudio de Deltenre y colaboradores en el que el 70% de los pacientes con SBC que presentaban esta mutación tenían, además, uno o más factores de riesgo asociados, lo que sugiere que esta mutación por sí sola no es suficiente para inducir trombogénesis (23). En este orden de ideas se ha sugerido que, a los pacientes con SBC o enfermedad tromboembólica venosa y portadores de la mutación del factor V de Leiden, se les indique un tamizaje para factores de riesgo adquiridos y hereditarios (24). La policitemia vera también se ha asociado con el SBC (25,26). Otro trastorno hematológico clásicamente asociado con el SBC es la hemoglobinuria paroxística nocturna, aunque hasta ahora no se cuenta con estudios suficientes que respalden una relación fuerte con este síndrome (27,28).
Otras condiciones han sido asociadas con el SBC, entre ellas la colitis ulcerativa, la enfermedad celíaca, las neoplasias hepáticas y la enfermedad de Behçet (29-32) (tabla 1).
PATOGÉNESIS
El evento fisiopatológico inicial en el SBC es la obstrucción del flujo venoso comprendido entre las vénulas hepáticas y el segmento suprahepático de la vena cava inferior. La obstrucción de una sola vena hepática no es suficiente para la manifestación del síndrome, de modo que las dos venas deben estar obstruidas para la presentación clínica de este. La consecuencia de esta obstrucción es una alteración hemodinámica compleja que incluye el aumento de la presión hidrostática capilar portal, que altera los gradientes de presión vascular. Los resultados de estos cambios hemodinámicos son la dilatación sinusoidal y la fuga de líquido al espacio intersticial, la cual pasa a través de la cápsula hepática cuando excede la capacidad de drenaje linfático (30). En conclusión, la presión portal aumenta y la perfusión hepática por esta vía disminuye, produciendo un daño hipóxico celular (33).
Se han descrito cambios crónicos luego de la obstrucción. Pueden observarse fibrosis centrolobular en semanas y regeneración nodular periportal, fibrosis progresiva y cirrosis después de meses (34,35). Se ha postulado que la exposición prolongada a sustancias hepatotrópicas, secundaria a la obstrucción, como hematopoyetinas, glucagón e insulina, en combinación con la pérdida funcional por la lesión tisular, puede ser uno de los mecanismos implicados en la génesis de la hiperplasia nodular regenerativa (36).
PRESENTACIÓN CLÍNICA
Clínicamente, el síndrome de Budd Chiari se presenta en la mayoría de casos como un cuadro de inicio súbito consistente en dolor abdominal, ascitis y hepatomegalia (37). Un estudio realizado por Cheng y colaboradores en el 2013 demuestra que se presentó la ascitis en el 53%, seguida de la distensión abdominal en el 31%, hepatomegalia en el 28% y el dolor abdominal en el 21% de los casos (39). La presentación de los hallazgos clínicos en el SBC es variable, los pacientes pueden presentar sintomatología meses antes del diagnóstico o debutar con una falla hepática aguda que requiera trasplante, la cual a pesar de ser la presentación menos frecuente, es considerada como catastrófica. En cuanto al curso de los síntomas, los dos estudios mostraron que la mitad de los pacientes presentaron la sintomatología descrita un mes antes de la realización del diagnóstico, mientras el 14% los presentó 6 meses antes del mismo (39).
DIAGNÓSTICO
El diagnóstico de este síndrome se basa en los hallazgos clínicos, los antecedentes, las pruebas de función hepática y algunos estudios de imagen (38).
El SBC debe sospecharse en las siguientes situaciones:
1. Ascitis de inicio abrupto con hepatomegalia dolorosa
2. Ascitis masiva con función hepática relativamente conservada
3. Dilatación sinusoidal en biopsia hepática en ausencia de enfermedad cardíaca
4. Falla hepática fulminante asociada a hepatomegalia y ascitis
5. Enfermedad hepática crónica inexplicada
6. Enfermedad hepática asociada con trastorno trombogénico conocido (38).
Laboratorio
Debe determinarse la función hepática por medio de los siguientes estudios de laboratorio: aminotransferasas, bilirrubinas, fosfatasa alcalina (FA), gammaglutamil transferasa (GGT), albúmina, pruebas de coagulación (TP, TPT), conteo de plaquetas. En el SBC, las aminotransferasas usualmente se encuentran aumentadas hasta 5 veces el valor del límite superior, especialmente en las formas agudas y fulminantes. Las bilirrubinas y la fosfatasa alcalina pueden elevarse igualmente; la albúmina sérica puede presentar una disminución moderada (40).
Estudios de imagen
Eco Doppler
Es el estudio de imagen de elección para el SBC; provee información cualitativa acerca de la dirección y el patrón de flujo, con una sensibilidad reportada del 87,5% (41). Una serie de 34 pacientes de Liao y colaboradores reportó una eficacia diagnóstica del 97,1% (42). De acuerdo con el trabajo de Boozari y colaboradores, los hallazgos al eco Doppler pueden clasificarse en específicos e inespecíficos, los primeros incluyen: trombosis, estenosis, cordón fibrótico, entre otros, y los últimos: esplenomegalia, parénquima hepático heterogéneo, colaterales intrahepáticas, hipertrofia del lóbulo caudado, ascitis y colaterales (43).
Debe considerarse el diagnóstico del SBC cuando el flujo de las venas hepáticas está ausente o es retrógrado, o cuando las ondas de flujo de estas venas son planas asociadas con un flujo inverso de la vena cava inferior (44). Una serie de 9 casos publicada por Sakugawa y colaboradores demostró que los hallazgos ultrasonográficos más importantes en el diagnóstico del SBC son, en su orden, oclusión de las venas hepáticas y de la porción juxtacaval (100%), presencia de estructuras venosas intrahepáticas anormales y colaterales (89%), obstrucción segmentaria de la vena cava inferior (77,8%), venas hepáticas inferiores derechas prominentes (55,6%) y membrana obstructiva ecogénica (22,2%) (45).
Tomografía computarizada
En la presentación aguda del SBC se observa un patrón en parches con aumento del realce en la porción central del hígado y disminución del mismo en la zona periférica debido al flujo retrógrado portal. El SBC subagudo y crónico se caracteriza por atrofia hepática con aumento del tamaño del lóbulo caudado y presencia de múltiples colaterales venosas intra y extrahepáticas (46). En el SBC crónico se observan nódulos regenerativos múltiples de tamaño variable entre 0,5 y 4,0 cm de diámetro, hipervasculares. Estos nódulos demuestran un realce intenso y homogéneo en la fase arterial y se mantienen ligeramente hiperatenuados en fase portal (46, 47).
Un estudio realizado por Vilgrain y colaboradores, en el que se obtuvieron 16 imágenes de tomografía computarizada y 20 de resonancia magnética, concluyó que la multiplicidad (más de 10 nódulos) y el tamaño menor de 4 cm son sugestivas de benignidad (48).
Resonancia magnética nuclear (RMN)
En la forma aguda y subaguda del SBC se observan áreas periféricas con intensidad baja de la señal en T1 y alta intensidad en T2. En la forma crónica se observa atrofia difusa y no hay diferencia significativa entre la zona periférica y central en T1 y T2. Los nódulos regenerativos son iso o hipointensos en T2 e hiperintesos en T1 (46, 49). La RMN delinea con exactitud el trayecto de la vena cava inferior y las venas hepáticas y es útil en la evaluación de la extensión de las obstrucciones membranosas o trombóticas, y de colaterales (40).
Venografía hepática, venografía por tomografía computarizada (VTC) y venografía por resonancia magnética (VRM)
La angiografía por sustracción digital (ASD) es el patrón de oro en la evaluación de la vena cava inferior y las venas hepáticas. Esta modalidad permite evaluar el nivel de la obstrucción, la presencia de una membrana oclusiva, trombo o tumor. Además permite la visualización de venas colaterales intra y extrahepáticas. En esta modalidad puede observarse pobre llenado o ausencia de llenado de las venas hepáticas, estenosis en el ostium de la porción terminal, o un patrón en telaraña por las colaterales entre las vénulas hepáticas y las venas sistémicas (40, 46, 50).
Un estudio de Virmani y colaboradores que compraró la VCT con la ASD, encontró una excelente correlación entre ambas para la detección de estenosis y la clasificación del grado y la extensión de la estenosis de la vena cava inferior (51). La VRM demuestra la morfología de la obstrucción de la vena cava inferior, especialmente para el extremo distal de la obstrucción, con sensibilidad, especificidad, valor predictivo positivo y negativo de 100%, 57,1%, 92,5% y 100%, respectivamente (52).
HISTOPATOLOGÍA
Las alteraciones histológicas pueden ir desde una congestión sinusoidal severa con inflamación, hasta fibrosis y finalmente cirrosis (53). En la mayoría de los casos, la biopsia hepática muestra congestión, pérdida de células hepáticas y fibrosis de predominio centrolobulillar. También puede haber fibrosis perivenular en pacientes diabéticos o alcohólicos (40). Otra característica histológica son los nódulos hepatocelulares que comparten características morfológicas con grandes nódulos regenerativos, hiperplasia nodular focal y adenomas hepatocelulares. Su multiplicidad, la existencia de lesiones mixtas, el potencial de regeneración hepatocelular y la obstrucción portal asociada, sugieren que estos nódulos son regenerativos por naturaleza y condicionados por la perfusión sanguínea alterada (54).
TRATAMIENTO
El tratamiento para el SBC puede dividirse en terapia médica, procedimientos radiológicos y procedimientos quirúrgicos. La terapia de elección depende de las características clínicas y anatómicas individuales, lo que resulta en buenos desenlaces clínicos como lo demuestra una serie de Darwish y colaboradores, donde se alcanzaron tasas de sobrevida a 1 y 2 años de 87% y 82%, respectivamente, con terapias contemporáneas individualizadas. Los objetivos del tratamiento son: prevenir la propagación del trombo, restaurar el flujo de las venas obstruidas, descomprimir el hígado congestivo, y tratar y prevenir las complicaciones relacionadas con retención de fluidos, malnutrición e hipertensión portal (55-56).
Manejo médico
Anticoagulación
La primera medida terapéutica deber ser la iniciación inmediata de anticoagulación con heparinas de bajo peso molecular, seguida de antagonistas de vitamina k con metas de INR de 2 a 3, además de la suspensión de anticonceptivos orales (57-58). Es necesario monitorizar los recuentos de plaquetas, dadas las altas tasas de trombocitopenia inducida por heparina en pacientes con SBC (59-60). Es improbable que la anticoagulación aislada permita una recanalización suficiente de las venas ocluidas o el desarrollo de una circulación adecuada que evite la progresión de la enfermedad. Sin embargo, la terapia solo con anticoagulantes ha demostrado resultados razonables a largo plazo en pacientes seleccionados (61-62). La terapia médica como intervención única se recomienda solo para pacientes asintomáticos sin necrosis hepática en proceso, con función hepática normal y con ascitis de fácil manejo (58).
Es importante considerar el riesgo de la terapia de anticoagulación, especialmente en aquellos pacientes que se presentan con sangrado actual. Se ha demostrado que las várices esofágicas son la principal fuente de sangrado mayor en pacientes con SBC en anticoagulación (63). Se recomienda el tamizaje para várices esofágicas, la profilaxis con betabloqueadores y el tratamiento endoscópico, como se hace de rutina en pacientes cirróticos (64).
Trombólisis
La evidencia con respecto a la terapia trombolítica es poca y limitada a pequeñas series de casos y reportes individuales. Se han utilizado agentes trombolíticos administrados sistémica y localmente. Sin embargo, no hay estudios que comparen la eficacia y otros desenlaces de acuerdo con la vía de administración (65-67). Teóricamente la administración local permitiría una mayor concentración del medicamento en el sitio de acción y mayor eficacia; mientras que la cantidad de medicamento administrado durante infusiones locales generaría una coagulopatía comparable a aquella con la administración sistémica. En conclusión, el riesgo de sangrado es similar. Tampoco hay evidencia que compare diferentes medicamentos (por ejemplo, estreptoquinasa versus rtPA) o diferentes esquemas de infusión. Un estudio publicado en 2004 por Sharma y colaboradores en el que se administró trombólisis a 10 pacientes con rtPA, no encontró beneficios según la vía sistémica o local, excepto en un caso de administración sistémica en el que el resultado fue parcialmente exitoso. Este estudio concluyó que la trombólisis es claramente beneficiosa en la recanalización cuando la detección temprana del trombo y la trombólisis son seguidas por procedimientos de angioplastia con balón o posicionamiento de stent en las venas hepáticas y cuando se realiza con agentes de acción corta. En conclusión, se recomienda la terapia trombolítica con agentes de duración más corta tipo rtPA, sin preferencias en la vía de administración, seguido de procedimientos intervencionistas, teniendo en cuenta que no hay evidencia sólida a favor de alguna vía de administración o de un agente trombolítico específico (68).
Prevención y tratamiento de las complicaciones
Se recomienda el manejo de acuerdo con las guías de práctica clínica de los pacientes con cirrosis (69).
Procedimientos radiológicos
La posibilidad de acceder al sistema venoso hepático por vía intravascular ha permitido la aplicación de procedimientos mínimamente invasivos con el fin de restaurar el drenaje venoso del hígado. Estos procedimientos están asumiendo un papel cada vez más importante en el manejo de los pacientes con SBC de inicio reciente e incluyen la angioplastia con balón, stents y los TIPS (shunt portosistémico transyugular intrahepático) (70).
Angioplastia con balón y stent
La recanalización percutánea (angioplastia y/o stent) de las venas hepáticas o de la vena cava inferior debe considerarse en pacientes con estenosis de longitud corta, y como adyuvante de la terapia médica (71-72). La angioplastia con balón es una medida efectiva para el tratamiento de las obstrucciones membranosas de la vena cava inferior, como lo demuestra un estudio de Yang y colaboradores en el que se incluyeron 42 pacientes, obteniéndose una tasa de éxito del 91% (73). Una cohorte de Li y colaboradores de 101 pacientes encontró una tasa de éxito del 91%, y una permeabilidad a 6, 12 y 24 meses del 84%, 78% y 76%, respectivamente (74). Las reoclusiones de los vasos afectados son un problema mayor de esta modalidad terapéutica, por lo que se recomienda la utilización de stents después de la angioplastia con balón para mantener la permeabilidad (75-76).
Una serie de 115 pacientes en los que se colocó stent en las venas hepáticas y en la vena cava inferior reportó una tasa de éxito de posicionamiento del 87% y 94%, respectivamente. La permeabilidad del stent con una media de seguimiento a 45 meses fue del 96,7% para aquellos dispuestos en la vena cava inferior y del 90,9% para aquellos en las venas hepáticas (77). Si bien estas técnicas se han utilizado típicamente en las formas agudas y subagudas del SBC, la combinación de ambas parece ser segura y efectiva en el tratamiento del SBC crónico con obstrucción de la vena cava inferior (78). Una nueva estrategia terapéutica de predilatación, seguida de trombólisis, ha sido propuesta para el manejo de pacientes con trombosis crónica de la vena cava inferior con resultados esperanzadores (79).
TIPS
En pacientes con falla clínica o técnica para las técnicas mencionadas anteriormente debe considerarse la inserción de TIPS (80). La principal justificación para el uso de esta técnica es su altísima efectividad como método de descompresión esplácnica. Por esta razón se ha utilizado como terapia de emergencia y rescate, y es especialmente útil en el escenario de pacientes con falla hepática fulminante como puente para el trasplante, obteniéndose rápida mejoría clínica y sobre la función hepática (81-83). Los resultados a corto, mediano y largo plazo con el uso de esta modalidad son mixtos. En una serie de Neumann y colaboradores en la que 14 pacientes recibieron TIPS, con una mediana de seguimiento de 50 meses, ningún paciente requirió trasplante. El control de la ascitis se logró en el universo de pacientes con una reducción marcada en el uso de diuréticos y solo un paciente murió cuatro años después del procedimiento por una causa no relacionada con el SBC (84). Un estudio de Attwell y colaboradores incluyó 17 pacientes tratados con TIPS, de los cuales 14 (82%) se estabilizaron inicialmente y los 3 restantes murieron en el primer mes. A los tres años de seguimiento solo el 47% de los pacientes continuaron estables y 23,5% habían muerto. Finalmente cinco pacientes requirieron reinserción por oclusión y cinco más recibieron trasplante (85). Una serie de García-Pagán y colaboradores que evaluó los desenlaces a largo plazo con 124 pacientes, encontró una sobrevida a uno y a cinco años libres de trasplante, de 88% y 78%, respectivamente (80). El principal riesgo de esta terapia es la encefalopatía hepática, además de que la mayoría de pacientes requerirán reintervención en el primer año después de su inserción (81).
Procedimientos quirúrgicos
El manejo quirúrgico del SBC ha evolucionado en las últimas tres décadas. El trasplante ortotópico de hígado puede no estar disponible para todos los pacientes, por lo que se han considerado métodos puente que incluyen los shunts radiológicos y quirúrgicos. Es importante mencionar que la realización de un shunt portosistémico quirúrgico no contraindica el trasplante en el futuro (86).
Shunts portosistémicos
Múltiples técnicas han sido descritas (incluyendo los shunts portocavales, mesocavales y mesoatriales con buenos resultados). El primer reporte de un shunt portocaval se remonta a 1948, pero solo treinta años después se logró demostrar que esta opción era superior a la terapia médica sola (39). Los resultados son esperanzadores y se han alcanzado tasas de sobrevivida a cinco años tan altas como del 90% (87). Un estudio que recoge la experiencia quirúrgica en 1360 pacientes, y que utiliza diferentes técnicas, describió una tasa de complicaciones del 14,8% y de mortalidad perioperatoria del 3,9%. La tasa de éxito fue del 89,4%, mientras que el 6,89% presentó recurrencias, con una media de seguimiento de 6,8 años (88).
Una de las primeras técnicas utilizadas con buenos resultados clínicos y sobre la calidad de vida fueron los shunts portocavales (89). Un estudio de Orloff y colaboradores demostró la efectividad de esta técnica como método decompresivo, con una reducción de la presión portal de 240 a 7 mm de solución salina, antes y después del procedimiento, con una tasa de sobrevida del 92% a 3 años y del 85% a 16 años. Todos los pacientes estuvieron libres de ascitis durante el seguimiento y no requirieron manejo con diuréticos (90).
Otra técnica que ha demostrado éxito es la de shunt mesocaval, reportándose tasas de sobrevida a cinco años hasta del 75% y permeabilidad primaria y secundaria del 70% y el 85%, respectivamente (56, 91). Una opción para los pacientes con obstrucción de la vena cava inferior son los shunts mesoatriales, descritos por primera vez en 1978 (92). Un estudio de Chen y colaboradores comparó a largo plazo los shunt mesoatriales con los mesocavoatriales en el tratamiento de SBC combinado, concluyendo que los mesocavoatriales resultan en una menor tasa de complicaciones posoperatorias y en tasas más altas de sobrevida a 5 años y permeabilidad (93).
Finalmente Orloff y colaboradores reportaron un estudio prospectivo en el que citan la experiencia de treinta y ocho años de descompresión quirúrgica del SBC. Este estudio incluye 77 pacientes divididos en tres grupos: grupo I con 39 pacientes con oclusión aislada de la vena hepática y tratados con shunts portocavales; grupo II con 26 pacientes con oclusión de la vena inferior, donde ocho recibieron shunt mesoatrial y el resto una combinación de shunt portocaval y cavoatrial; y grupo III con 12 pacientes con cirrosis descompensada referidos para trasplante hepático. Las tasas de sobrevida fueron: del 95% para el grupo I, con 36 pacientes libres de ascitis y buena calidad de vida de 5-38 años; 100% para el grupo II de 5-25 años; y del 50% para el grupo III (94).
Trasplante hepático
Esta modalidad es la elección para pacientes que no son candidatos a descompresión por procedimientos radiológicos o quirúrgicos, para aquellos en quienes han fallado estos métodos, y para pacientes con cirrosis descompensada o falla hepática aguda fulminante (14, 95). Un grupo especial de pacientes con pobre pronóstico podría beneficiarse de una intervención temprana más agresiva como el trasplante hepático, como sugiere el análisis de Ratou y colaboradores, elaborado para pacientes con niveles de ALT cinco veces por encima del límite superior, que descienden lentamente (96).
El impacto del trasplante hepático en el SBC es difícil de estimar y desde que se completó el primer trasplante hepático como modalidad terapéutica para esta condición, múltiples estudios han determinado la sobrevivida siguiente (97-99). Un estudio que incluyó 248 pacientes provenientes de 51 centros europeos demostró una sobrevida del 76% a 1 año, 71% a 5 años y 68% a 10 años. El 77% de las muertes ocurrieron en los primeros tres meses, 47% de estas por infección y falla multiorgánica y 18% por falla del injerto o trombosis de la arteria hepática. Los únicos predictores de mortalidad pretrasplante fueron la alteración de la función renal y la historia de shunt (100). Estas tasas de sobrevivida son comparables a las encontradas por Ringe y colaboradores en una serie de 43 pacientes, y similar a la reportada por Shaked y colaboradores de 76% a 3 años (101- 102). Se han reportado tasas de sobrevida a 5 y 10 años hasta del 89,4% y 83,5%, respectivamente (103).
Uno de los factores que ha tenido más impacto en la sobrevivida de estos pacientes es quizá la introducción del puntaje MELD, sin olvidar los avances tecnológicos alrededor del trasplante hepático. El trasplante en la era del MELD se ha asociado con un riesgo significativamente más bajo de pérdida del injerto (hazard ratio HR;, 0,50; 95% intervalo de confianza IC, 0,30-0,86), de muerte (HR, 0,52; 95% IC, 0,29-0,93) y de pérdida temprana del injerto (30 días) (OR, 0,35; 95% IC, 0,16-0,79). La sobrevida del injerto a 3 años en la era del MELD, comparada con la era pre-MELD, es significativamente mayor (68,4% versus 64,5%, p = 0,008); asimismo, la sobrevida de los pacientes a tres años es mayor en la era del MELD (84,9% versus 72,6%, p = 0,023) (104).
La reoclusión es un riesgo latente que se ha observado desde 4 meses hasta 7 años después del trasplante; además, se ha reportado que hasta el 10% de los pacientes puede requerir un nuevo trasplante (105-106). Es justamente por esta razón que se recomienda anticoagulación de por vida (105-107).
Estudios de laboratorio han demostrado una lenta progresión de la enfermedad hepática en pacientes sometidos a shunts. En contraste, los pacientes que son sometidos a trasplante mantienen niveles más altos de albúmina y tienen una mejor función sintética. Es por esto que algunos grupos en el mundo han descrito algoritmos de tratamiento que comienzan con manejo conservador y terminan con trasplante, y se han reportado períodos hasta de 8 años antes del trasplante (105).
PRONÓSTICO
El curso natural de la enfermedad no exhibe buenos resultados. Se ha estimado que la mortalidad a 3 años para los pacientes que sufren formas sintomáticas de la enfermedad y no reciben tratamiento es del 90%. El pronóstico es mejor para los pacientes con formas asintomáticas de la enfermedad. Asimismo se ha relacionado el diagnóstico a edad temprana con un mejor pronóstico, el puntaje de Child-Pugh bajo, la ausencia de ascitis, la ascitis de fácil control, los niveles bajos de creatinina, sodio, albúmina y bilirrubina. Las principales causas de muerte son la falla hepática y el sangrado variceal (58, 108). Un estudio realizado por Langlet y colaboradores (en el que se evaluó el índice pronóstico basado en la edad, puntaje de Child-Pugh, ascitis y creatinina sérica) arrojó que el 25% de los pacientes diagnosticados con SBC fallecieron y el riesgo de muerte era mayor en los primeros dos años del diagnóstico. En este mismo estudio se encontró que los pacientes que estaban en la categoría I (características clínicas compatibles con daño hepático agudo), tenían un índice pronóstico de bajo riesgo (menor de 5,1) y ninguno de ellos falleció, mientras que aquellos que estaban en la categoría III (características de daño hepático crónico y agudo) mostraron un índice pronóstico de alto riesgo (mayor de 5,1) que se correlacionó con tasas de sobrevida de 82%, 65%, 60% a 1, 5 y 10 años, respectivamente, a diferencia de los pacientes en categorías I y II que mostraban tasas de sobrevida mayores o iguales al 90%. Los autores concluyen que el índice pronóstico basado en las características mencionadas, y separando por categorías, es de utilidad para calcular la sobrevida de los pacientes con SBC y que la presencia de shunts no modifica dicha sobrevida (109). Finalmente el pronóstico dependerá de la modalidad del tratamiento empleada y de qué tan oportuno sea el mismo.
REFERENCIAS
1. Budd G. En: On diseases of the liver, 1era Ed. Londres, GB: John Churchill; 1845: pp. 135. [ Links ]
2. Chiari H. Ueber die selbständige Phlebitis obliterans der Hauptstämme der Venae hepaticae als Todesursache. Beitr Pathol Anat Allg Pathol. 1899;26:1-18. [ Links ]
3. Ferral H, Behrens G, Lopera J. Budd-Chiarisyndrome. AJR Am J Roentgenol. 2012;199(4):737-45. [ Links ]
4. Mac Nicholas R, Olliff S, Elias E, Tripathi D. An update on the diagnosis and management of Budd-Chiari syndrome. Expert Rev Gastroenterol Hepatol. 2012;6(6):731-44. [ Links ]
5. Janssen H, García J, Elias E, Mentha G, Hadengue A, Valla D. Budd–Chiari syndrome: a review by an expert panel. Journal of Hepatology. 2003;38(3):364–371. [ Links ]
6. Plessier A, Rautou PE,Valla DC. Management of hepatic vascular diseases.J Hepatol. 2012; 56 Suppl 1:S25-38. doi: 10.1016/S0168-8278(12)60004-X. [ Links ]
7. Aydinli M, Bayraktar Y. Budd-Chiari syndrome: etiology, pathogenesis and diagnosis. World J Gastroenterol. 2007. 21;13(19):2693-6. [ Links ]
8. Plessier A, Valla D. Budd–Chiari Syndrome. Semin Liver Dis 2008;28(3):259-269. [ Links ]
9. Valla D. The diagnosis and management of the Budd-Chiari syndrome: consensus and controversies. Hepatology. 2003;38(4):793-803. [ Links ]
10. Shrestha S, Okuda K, Uchida T, Maharjan K, Shrestha S, Joshi B, et al. Endemicity and clinical picture of liver disease due to obstruction of the hepatic portion of the inferior vena cava in Nepal. J Gastroenterol Hepatol. 1996;11(2):170–179. [ Links ]
11. Valla D. Hepatic venous outflow tract obstruction etipathogenesis: Asia versus the West. J Gastroenterol Hepatol. 2004;19:S204–S211. [ Links ]
12. De Franchis R; Baveno V Faculty. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol. 2010;53(4):762-8. [ Links ]
13. Brancaccio V, Iannaccone L, Margaglione M, Guardascione MA, Amitrano L. Multiple thrombophilic factors in a patient with Budd-Chiari syndrome. Clin Lab Haematol. 2002;24(1):61-3. [ Links ]
14. DeLeve LD, Valla DC, García-Tsao G; American Association for the Study Liver Diseases. Vascular disorders of the liver. Hepatology. 2009;49(5):1729-64. [ Links ]
15. Hirshberg B, Shouval D, Fibach E, Friedman G, Ben D. Flow cytometric analysis of autonomous growth of erythroid precursors in liquid culture detects occult polycythemia vera in the Budd-Chiari syndrome. J Hepatol. 2000;32:574-578. [ Links ]
16. Denninger M, Chait Y, Casadevall N, Hillaire S, Guillin M, Bezeaud A, et al. Cause ofportal or hepatic venous thrombosis in adults: the role of multiple concurrent factors. Hepatology 2000;31:587-591. [ Links ]
17. Janssen HL et. al. Factor V Leiden mutation, prothrombin gene mutation, and deficiencies in coagulation inhibitors associated with Budd-Chiari syndrome and portal vein thrombosis: results of a case-control study. Blood 2000;96(7):2364-8. [ Links ]
18. Muradet. al. Etiology, management, and outcome of the Budd-Chiari syndrome. Ann Intern. 2009;151(3):167-75. [ Links ]
19. Valla D, Le MG, Poynard T, Zucman N, Rueff B, Benhamou JP. Risk of hepatic vein thrombosis in relation to recent use of oral contraceptives. A case-control study. Gastroenterology. 1986;90(4):807-11. [ Links ]
20. Mohanty D, Shetty S, Ghosh K, Pawar A, Abraham P. Hereditary thrombophilia as a cause of Budd-Chiari syndrome: a study from Western India. Hepatology. 2001;34(4 Pt 1):666-70. [ Links ]
21. Minnema MC, Janssen HL, Niermeijer P, de Man RA. Budd-Chiari syndrome: combination of genetic defects and the use of oral contraceptives leading to hypercoagulability. J Hepatol. 2000; 33(3):509-12. [ Links ]
22. Shetty S, Ghosh K. Thrombophilic dimension of Budd chiari syndrome and portal venous thrombosis a concise review. Thromb Res. 2011;127(6):505-12. [ Links ]
23. P. Deltenre, M.H. Denninger, S. Hillaire, M.C. Guillin, N. Casadevall, J. Brière et al. Factor V Leiden related Budd-Chiari syndrome. Gut. 2001;48(2)264–268. [ Links ]
24. Buzas C, Sparchez Z, Cucuianu A, Manole S, Lupescu I, Acalovschi M. Budd-Chiari syndrome secondary to polycythemia vera. A case report. J Gastrointestin Liver Dis. 2009;18(3):363-6. [ Links ]
25. Dayal S, Patti HP, Acharya SK. Polycythemia vera: overt to latent form in a patient with Budd-Chiari syndrome. J Clin Gastroenterol. 1996;22(1):76-7. [ Links ]
26. Wanless IR, Peterson P, Das A, Boitnott JK, Moore GW, Bernier V. Hepaticvascular disease and portal hypertension in polycythemia vera and agnogenic myeloid metaplasia: a clinicopathological study of 145 patientsexamined at autopsy. Hepatology. 1990;12(5):1166-74. [ Links ]
27. Qi X, He C, Han G, Yin Z, Wu F, Zhang Q, Niu J, Wu K, Fan D. Prevalence of paroxysmal nocturnal hemoglobinuria in Chinese patients with Budd-Chiari syndrome or portal vein thrombosis. J Gastroenterol Hepatol. 2013;28(1):148-52. [ Links ]
28. P. Hillmen, S.M. Lewis, M. Bessler, L. Luzzatto, J.V. Dacie. Natural history of paroxysmal nocturnal hemoglobinuria. N Engl J Med. 1995;33:1253–1258. [ Links ]
29. Yılmaz B, Köklü S, Bayraktar Y. Ulcerative colitis presenting with Budd-Chiari Syndrome. J Crohns Colitis. 2013;7(2):e74-5. [ Links ]
30. Boutachali S, Arrivé L. Budd-Chiari syndrome secondary to hepatocellular carcinoma.Clin Res Hepatol Gastroenterol. 2011;35(11):693-4. [ Links ]
31. Bittencourt Mde J, Dias CM, Lage TL, Barros RS, Paz OA, Vieira Wde B. Behçet disease in association with Budd-Chiari syndrome and multiple thrombosis-Case report. An Bras Dermatol. 2013;88(3)448-451. [ Links ]
32. Carvalho D, Oikawa F, Matsuda NM, Yamada AT. Budd-Chiari syndrome in association with Behçets disease: review of the literature. Sao Paulo Med J. 2011;129(2):107-9. [ Links ]
33. Afredj N, Metatla S et al. Association of Budd-Chiari syndrome and celiac disease. Gastroenterol Clin Biol. 2010;34(11):621-4. [ Links ]
34. Witte CL, Witte MH, Dumont AE. Lymph imbalance in the genesis and perpetuation of the ascites syndrome in hepatic cirrhosis. Gastroenterology. 1980;78(5 Pt 1):1059-68. [ Links ]
35. Meacham, G. C., Tillotson, F. W., Heinle, R. W., Hoyumpa, A. M., Schiff, L., Helfman, E. L., & Failing, R. M. Hepatic vein occlusion. Br Med J. 1971;4(5774):550. [ Links ]
36. Tanaka M, Wanless IR. Pathology of the liver in Budd-Chiari syndrome: portal vein thrombosis and the histogenesis of veno-centric cirrhosis, veno-portal cirrhosis, and large regenerative nodules. Hepatology. 1998;27(2):488-96. [ Links ]
37. De, Portmann B, Williams R. Nodular regenerative hyperplasia of the liver and the Budd-Chiari syndrome.Case report, review of the literature and reappraisal of pathogenesis. J Hepatol. 1991;12(1):28-35. [ Links ]
38. Darwish M, Plessier, MD; Hernández-Guerra, MD. Etiology, Management, and Outcome of the Budd-Chiari Syndrome. EN-Vie (European Network for Vascular Disorders of the Liver). Ann Intern Med. 2009;151(3):167-75. [ Links ]
39. Cheng D, Xu H, Lu ZJ, Hua R, Qiu H, Du H, Xu X, Zhang J Clinical features and etiology of Budd-Chiari syndrome in Chinese patients: a single-center study. J Gastroenterol 2013;28(6):1061-7. [ Links ]
40. Aydinli M, Bayraktar Y. Budd-Chiari syndrome: Etiology, pathogenesis and diagnosis. World J Gastroenterol. 2007;13(19):2693-2696. [ Links ]
41. Bolondi L. et. al. Diagnosis of Budd-Chiari Syndrome by pulsed Doppler ultrasound. Gastroenterology. 1991;100(5 Pt 1):1324-31. [ Links ]
42. Liao JT, Xiao Y, Huang TH, Pan RZ, Wang SC, Huang YJ. Color Doppler flow image of Budd-Chiari syndrome. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2007;32(1):170-3. [ Links ]
43. Boozari B, Bahr MJ, Kubicka S, Klempnauer J, Manns MP, Gebel M. Ultrasonography in patients with Budd-Chiari syndrome: diagnostic signs and prognostic implications. J Hepatol. 2008;49(4):572-80. [ Links ]
44. Sakugawa H, Higashionna A, Oyakawa T, Kadena K, Kinjo F, Saito A. Ultrasound study in the diagnosis of primary Budd-Chiari syndrome (obstruction of the inferior vena cava). Gastroenterol Jpn. 1992;27(1):69-77. [ Links ]
45. Zhang R, Qin S, Zhou Y, Song Y, Sun L. Comparison of imaging characteristics between hepatic benign regenerative nodules and hepatocellular carcinomas associated with Budd-Chiari syndrome by contrast enhanced ultrasound. Eur J Radiol. 2012;81(11):2984-9. [ Links ]
46. Patil P, Deshmukh H, Popat B, Rathod K. Spectrum of imaging in Budd Chiari syndrome. J Med Imaging Radiat Oncol. 2012;56(1):75-83. [ Links ]
47. Maetani Y. et. al. Benign hepatic nodules in Budd-Chiari syndrome: radiologic-pathologic correlation with emphasis on the central scar. AJR Am J Roentgenol. 2002;178(4):869-75. [ Links ]
48. Vilgrain Vet. Al. Hepatic nodules in Budd-Chiari syndrome: imaging features.Radiology. 1999;210(2):443-50. [ Links ]
49. Lupescu IG, Dobromir C, Popa GA, Gheorghe L, Georgescu SA. Spiral computed tomography and magnetic resonance angiography evaluation in Budd-Chiari syndrome. J Gastrointestin Liver Dis. 2008;17(2):223-6. [ Links ]
50. Datta DV, Vashishta S, Samanta AK, Chhuttani PN. Diagnostic value of combined transhepatic venography and inferior vena cavography in chronic Budd-Chiari syndrome. Am J Dig Dis. 1978;23(11):1031-41. [ Links ]
51. Virmani V, Khandelwal N, Kang M, Gulati M, Chawla Y. MDCT venography in the evaluation of inferior vena cava in Budd-Chiari syndrome. Indian J Gastroenterol. 2009;28(1):17-23. [ Links ]
52. Lu X et. al. Study on between magnetic resonance venography and digital subtraction angiography on the inferior vena cava obstructive interface morphology of Budd-Chiari syndrome. Zhonghua Gan Zang Bing Za Zhi. 2011;19(12):923-6. [ Links ]
53. Tanaka M, Wanless I. Pathology of the liver in Budd–Chiari syndrome: portal vein thrombosis and the histogenesis of veno-centric cirrhosis, veno-portal cirrhosis, and large regenerative nodules. Hepatology. 1998;27:488–496. [ Links ]
54. Ibarrola C, Castellano VM, Colina F. Focal hyperplastic hepatocellular nodules in hepatic venous outflow obstruction: a clinicopathological study of four patients and 24 nodules. Histopathology. 2004;44:172-179. [ Links ]
55. Darwish S, Plessier M, Hernández M, Fabris F, Eapen C, Bahr M, et al. Etiology, management, and outcome of the Budd-Chiari syndrome. Ann Intern Med. 2009;151(3):167–175. [ Links ]
56. Zimmerman M, Cameron A, Ghobrial R. Budd-Chiari syndrome. Clin Liver Dis. 2006;10(2): 259–273. [ Links ]
57. Plessier A, Sibert A, Consigny Y, Hakime A, Zappa M, Denninger M, et al. Aiming at minimal invasiveness as a therapeutic strategy for Budd-Chiari syndrome. Hepatology. 2006; 44(5):1308–1316. [ Links ]
58. Menon K, Shah V, Kamath P. The Budd-Chiari syndrome. N Engl J Med. 2004;350(6):578–585. [ Links ]
59. Ki M, Chi H, Kim K, Kim B, Jang E, Jeong S. Incidence, Prevalence, and Complications of Budd-Chiari Syndrome in South Korea: A Nationwide, Population-Based Study. Liver Int. 2015; 36(7):1067-73. [ Links ]
60. Randi M, Tezza F, Scapin M, Duner E, Scarparo P, Scandellari R, et al. Heparin-induced thrombocytopenia in patients with Philadelphia-negative myeloproliferative disorders and unusual splanchnic or cerebral vein thrombosis. Acta Haematol. 2010;123(3):140–145. [ Links ]
61. Min A, Atillasoy E, Schwartz M, Thiim M, Miller C, Bodenheimer H. Reassessing the role of medical therapy in the management of hepatic vein thrombosis. Liver Transpl Surg 1997;3(4):423 –429. [ Links ]
62. Darwish S, Valla D, de Groen P, Zeitoun G, Hopmans J, Haagsma E, et al. Determinants of survival and the effect of portosystemic shunting in patients with Budd-Chiari syndrome. Hepatology. 2004;39(2):500–508. [ Links ]
63. Rautou PE, Douarin L, Denninger M, Escolano S, Lebrec D, Moreau R, et al. Bleeding in patients with Budd-Chiari syndrome. J Hepatol. 2011;54(1):56-63. [ Links ]
64. Zaman A, Chalasani N. Bleeding caused by portal hypertension. Gastroenterol Clin North Am 2005;34(4):623–642. [ Links ]
65. Greenwood L, Yrizarry J, Hallett J, Scoville G. Urokinase treatment of Budd-Chiari syndrome. AJR Am J Roentgenol. 1983;141(5):1057–1059. [ Links ]
66. Kuo G, Brodsky R, Kim H. Catheter-directed thrombolysis and thrombectomy for the Budd-Chiari syndrome in paroxysmal nocturnal hemoglobinuria in three patients. J Vasc Interv Radiol 2006;17(2):383–387. [ Links ]
67. Pawlak J, Palester M, Michałowicz B, Elwertowski M, Małkowski P, Szczerbień J. Thrombolytic treatment of Budd-Chiari syndrome with portal venous thrombosis. Pol Arch Med Wewn. 1993;89(2):171–177. [ Links ]
68. Sharma S, Texeira A, Texeira P, Elias E, Wilde J, Olliff S. Pharmacological thrombolysis in Budd Chiari syndrome: a single centre experience and review of the literature. J Hepatol. 2004; 40(1):172–180. [ Links ]
69. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol. 2010;53(3):397–417. [ Links ]
70. Wang Z, Zhang F, Yi M, Qiang L. Evolution of management for Budd-Chiari syndrome: a teams view from 2564 patients. ANZ J Surg 2005;75(1-2):55–63. [ Links ]
71. Eapen C, Velissaris D, Heydtmann M, Gunson B, Olliff S, Elias E. Favourable medium term outcome following hepatic vein recanalisation and/or transjugular intrahepatic portosystemic shunt for Budd Chiari syndrome. Gut. 2006;55(6):878–884. [ Links ]
72. Plessier A. Budd Chiari syndrome. Gastroenterol Clin Biol. 2006;30:1162–1169. [ Links ]
73. Yang X, Cheng T, Chen C. Successful treatment by percutaneous balloon angioplasty of Budd-Chiari syndrome caused by membranous obstruction of inferior vena cava: 8-year follow-up study. J Am Coll Cardiol 1996;28(7):1720–1724. [ Links ]
74. Li T, Zhai S, Pang Z, Ma X, Cao H, Bai W, et al. Feasibility and midterm outcomes of percutaneous transhepatic balloon angioplasty for symptomatic Budd-Chiari syndrome secondary to hepatic venous obstruction. J Vasc Surg. 2009;50(5):1079–1084. [ Links ]
75. Fisher N, McCafferty I, Dolapci M, Wali M, Buckels J, Olliff S, et al. Managing Budd-Chiari syndrome: a retrospective review of percutaneous hepatic vein angioplasty and surgical shunting. Gut. 1999:44(4):568–574. [ Links ]
76. Witte A, Kool L, Veenendaal R, Lamers C, van Hoek B. Hepatic vein stenting for Budd-Chiari syndrome. Am J Gastroenterol. 1997;92(3):498–501. [ Links ]
77. Zhang C, Fu L, Xu L, Zhang G, Jia T, Liu JY, et al. Long-term effect of stent placement in 115 patients with Budd-Chiari syndrome. World J Gastroenterol. 2003;9(11):2587- 2591. [ Links ]
78. Ding P, Han X, Wu G, Li Y, Shui S, Wang Y. Outcome of a retrieval stent filter and 30 mm balloon dilator for patients with Budd-Chiari syndrome and chronic inferior vena cava thrombosis: a prospective pilot study. Clin Radiol. 2010;65(8):629–635. [ Links ]
79. Wang Y, Ding P, Li Y, Han X, Wu G. Comparative study of predilation with stent filter for Budd-Chiari syndrome with old IVC thrombosis: a nonrandomized prospective trial. Eur J Radiol. 2012;81(6):1158–1164. [ Links ]
80. García J, Heydtmann M, Raffa S, Plessier A, Murad S, Fabris F, et al. TIPS for Budd-Chiari syndrome: long-term results and prognostics factors in 124 patients. Gastroenterology. 2008; 135(3):808–815. [ Links ]
81. Casado M, Bosch J, García J, Bru C, Bañares R, Bandi J, et al. Clinical events after transjugular intrahepatic portosystemic shunt: correlation with hemodynamic findings. Gastroenterology. 1998;114(6):1296–1303. [ Links ]
82. Watanabe H, Shinzawa H, Saito T, Ishibashi M, Shirahata N, Miyano S, et al. Successful emergency treatment with a transjugular intrahepatic portosystemic shunt for life-threatening Budd-Chiari syndrome with portal thrombotic obstruction. Hepatogastroenterology. 2000;47(33): 839–841. [ Links ]
83. Shrestha R, Durham J, Wachs M, Bilir B, Kam I, Trouillot T, et al. Use of transjugular intrahepatic portosystemic shunt as a bridge to transplantation in fulminant hepatic failure due to Budd-Chiari syndrome. Am J Gastroenterol. 1997;92(12):2304–2306. [ Links ]
84. Neumann A, Andersen S, Nielsen D, Holland P, Vilstrup H, Grønbæk H. Treatment of Budd-Chiari syndrome with a focus on transjugular intrahepatic portosystemic shunt. World J Hepatol. 2013;5(1):38-42. [ Links ]
85. Attwell A, Ludkowski M, Nash R, Kugelmas M. Treatment of Budd-Chiari syndrome in a liver transplant unit, the role of transjugular intrahepatic porto-systemic shunt and liver transplantation. Aliment Pharmacol Ther. 2004;20(8):867–873. [ Links ]
86. Langnas A, Marujo W, Stratta R, Donovan J, Sorrell M, Rikkers L, et al. Influence of a prior porta-systemic shunt on outcome after liver transplantation. Am J Gastroenterol. 1992;87(6):714–718. [ Links ]
87. Bismuth H, Sherlock D. Portasystemic shunting versus liver transplantation for the Budd-Chiari syndrome. Ann Surg. 1991;214(5):581–589. [ Links ]
88. Xu P, Ma X, Ye X, Feng L, Dang X, Zhao Y, et al. Surgical treatment of 1360 cases of Budd-Chiari syndrome: 20-year experience. Hepatobiliary Pancreat Dis Int. 2004;3(3):391–394. [ Links ]
89. Orloff M, Johansen K. Treatment of Budd-Chiari syndrome by side-to-side portacaval shunt: experimental and clinical results. Ann Surg. 1978;188(4):494-512. [ Links ]
90. Orloff M, Girard B. Long term results of treatment of Budd-Chiari syndrome by side to side portacaval shunt. Surg Gynecol Obstet. 1989;168(1):33–41. [ Links ]
91. Cameron J, Herlong H, Sanfey H, Boitnott J, Kaufman S, Gott V, et al. The Budd-Chiari syndrome. Treatment by mesenteric-systemic venous shunts. Ann Surg. 1983;198(3):335–346. [ Links ]
92. Cameron J, Maddrey W. Mesoatrial shunt: a new treatment for the Budd-Chiari syndrome. Ann Surg. 1978;187(4):402–406. [ Links ]
93. Chen H, Zhang F, Ye Y, Cheng Y, Chen Y. Long-term follow-up study and comparison of meso-atrial shunts and meso-cavo-atrial shunts for treatment of combined Budd-Chiari syndrome. J Surg Res. 2011;168(1):162–166. [ Links ]
94. Orloff M, Isenberg J, Wheeler H, Daily P, Girard B. Budd-Chiari syndrome revisited: 38 years experience with surgical portal decompression. J Gastrointest Surg. 2012;16(2):286–300. [ Links ]
95. Mancuso A. Budd-chiari syndrome management: Timing of treatment is an open issue. Hepatology. 2014;59(3):1213. [ Links ]
96. Rautou P, Moucari R, Cazals D, Escolano S, Denié C, Douarin L, et al. Levels and initial course of serum alanine aminotransferase can predict outcome of patients with Budd-Chiari syndrome. Clin Gastroenterol Hepatol. 2009;7(11):1230–1235. [ Links ]
97. Putnam C, Porter K, Weil R III, Weil R, Reid H, Starzl T. Liver transplantation of Budd Chiari syndrome. JAMA. 1976;236(10):1142–1143. [ Links ]
98. Campbell D, Rolles K, Jamieson N, OGrady J, Wight D, Williams R, et al. Hepatic transplantation with perioperative and long term anticoagulation as treatment for Budd-Chiari syndrome. Surg Gynecol Obstet. 1988;166(6):511–518. [ Links ]
99. Knoop M, Lemmens H, Bechstein W, Blumhardt G, Schattenfroh N, Keck H, et al. Treatment of the Budd-Chiari syndrome with orthotopic liver transplantation and long-term anticoagulation. Clin Transplant. 1994;8(1):67–72. [ Links ]
100. Mentha G, Giostra E, Majno PE, Bechstein W, Neuhaus P, OGrady J, et al. Liver transplantation for Budd-Chiari syndrome: A European study on 248 patients from 51 centres. J Hepatol. 2006;44(3):520–528. [ Links ]
101. Ringe B, Lang H, Oldhafer K, Gebel M, Flemming P, Georgii A, et al. Which is the best surgery for Budd-Chiari syndrome: venous decompression or liver transplantation? A single-center experience with 50 patients. Hepatology. 1995;21(5):1337–1344. [ Links ]
102. Shaked A, Goldstein R, Klintmalm G, Drazan K, Husberg B, Busuttil R. Portosystemic shunt versus orthotopic liver transplantation for the Budd-Chiari syndrome. Surg Gynecol Obstet. 1992; 174(6):453–459. [ Links ]
103. Ulrich F, Pratschke J, Neumann U, Pascher A, Puhl G, Fellmer P, et al. Eighteen years of liver transplantation experience in patients with advanced Budd-Chiari syndrome. Liver Transpl. 2008;14(2):144–150. [ Links ]
104. Segev D, Nguyen G, Locke J, Simpkins C, Montgomery R, Maley W, et al Twenty years of liver transplantation for Budd-Chiari syndrome: a national registry analysis. Liver Transpl 2007; 13(9):1285–1294. [ Links ]
105. Srinivasan P, Rela M, Prachalias A, Muiesan P, Portmann B, Mufti G, et al. Liver transplantation for Budd-Chiari syndrome. Transplantation. 2002;73(6):973–977. [ Links ]
106. Klein A, Molmenti E. Surgical treatment of Budd-Chiari syndrome. Liver Transpl. 2003;9 (9):891–896. [ Links ]
107. Jamieson N, Williams R, Calne R. Liver transplantation for Budd-Chiari syndrome, 1976–1990. Ann Chir. 1991;45(4):362–365. [ Links ]
108. Valla D. Primary Budd-Chiari syndrome. J Hepatol. 2009;50(1):195-203. [ Links ]
109. Langlet P, Escolano S, Valla D, Coste D, Denie C, Mallet A, et al. Clinicopathological forms and prognostic index in Budd-Chiari syndrome. Journal of Hepatology. 2003;39(4)496–501. [ Links ]











 text in
text in