Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.31 no.3 Bogotá July/Sept. 2016
Estadificación del cáncer colorrectal mediante resonancia magnética
MRI Staging of Colorectal Cancer
Felipe Aluja Jaramillo MD. (1), Daniel Upegui Jiménez MD. (2)
(1) Residente radiología e imágenes diagnósticas. Fundación Universitaria Sanitas. Bogotá, Colombia.
(2) Médico radiólogo, subespecialista en abdomen y pelvis, Clínica Universitaria Colombia, Hospital Universitario Mayor Méderi. Profesor de radiología, Fundación Universitaria Sanitas. Profesor de radiología, Universidad del Rosario. Bogotá, Colombia. Correo: e-mail: d_upegui@hotmail.com
Fecha recibido: 17-02-16 Fecha aceptado: 25-07-16
Resumen
El cáncer colorrectal es la cuarta causa de muerte a nivel mundial y la quinta causa de muerte por cáncer en Colombia. La resonancia magnética es la modalidad ideal para la valoración del cáncer colorrectal, ya que permite la estadificación mediante la determinación de la invasión más allá de la muscular propia, la extensión hacia órganos adyacentes, la identificación de pacientes candidatos a quimioterapia o radioterapia prequirúrgica y la planeación del procedimiento quirúrgico. El punto clave se basa en la diferenciación entre los estadios T2 y T3 mediante el uso de secuencias con información T2 de alta resolución. Además de esto, permite la valoración del tamaño y la morfología de los ganglios linfáticos, y aumenta considerablemente la especificidad para la detección de compromiso ganglionar. La resonancia magnética es una técnica con una alta especificidad y una alta reproducibilidad.
Palabras clave
Imagen por resonancia magnética, neoplasias del colon, neoplasias del recto, estadificación de neoplasias.
Abstract
Colorectal cancer is the fourth leading cause of death worldwide and the fifth leading cause of cancer death in Colombia. MRIs are ideal for evaluating colorectal cancer, especially for screening, because they allow staging by determining the extent of any invasion beyond the muscularis and into adjacent organs. This is key for identifying candidates for chemotherapy and/or preoperative radiation therapy and for planning surgical procedures. The key is differentiation between stages T2 and T3 by using T2 sequences with high resolution information. In addition, MRIs allow assessment of the size and morphology of the lymph nodes and greatly increases the specificity of detection of nodal involvement. Magnetic resonance imaging has high specificity and reproducibility.
Keywords
Magnetic resonance imaging, neoplasms of the colon, rectal neoplasms, staging of neoplasms.
INTRODUCCIÓN
El cáncer colorrectal es la cuarta causa de muerte por cáncer a nivel mundial (1,2). En Colombia, su frecuencia ha venido en aumento y actualmente es el cuarto tipo de neoplasia con mayor incidencia y la quinta causa de muerte por cáncer (2-4).
La resonancia magnética se introdujo para la valoración del cáncer de recto por primera vez en 1986 (5-7) y actualmente es considerada la técnica ideal para la valoración de la pelvis en los pacientes con cáncer de recto (8-12). Esta modalidad de imagen se basa en una visualización en múltiples planos, así como en imágenes con alto contraste de tejidos blandos (13,14), que permiten la estadificación local al identificar la invasión más allá de la muscular propia; además, clasifica los pacientes candidatos a quimioterapia o radioterapia prequirúrgica y ayuda en la planeación del procedimiento quirúrgico (15,16). Es una técnica confiable, con buena reproducibilidad y alta especificidad, que alcanza el 92%, especialmente para predecir márgenes de resección negativos mediante la determinación de la relación del tumor con el margen de resección o el compromiso más allá de la capa muscular propia (13,15,16). La presencia de tumor o nódulo a 1 mm del margen de resección aumenta el riesgo de recurrencia (15).
La ventaja de la resonancia magnética radica en la utilización de secuencias que permiten un adecuado contraste entre el tumor y los tejidos blandos circundantes, que no es posible mediante el uso de otras técnicas de imagen como la tomografía axial computarizada (8,17). Se ha demostrado que la distancia del tumor al margen de resección es el factor predictor más importante para la recurrencia local (13,18-21). Además es el método de elección para los pacientes que recibieron radioterapia (22).
Las secuencias de alta resolución con información T2 son la clave para la evaluación del cáncer rectal (8,15). Estas secuencias consisten en imágenes axiales finas (menores de 3 mm), obtenidas de manera ortogonal al plano del tumor, con una resolución de 0,5 a 0,8 mm (15). Mediante esta secuencia es posible diferenciar entre un tumor en estadio T2 (confinado a la pared rectal) y un tumor T3 (con extensión más allá de la muscular propia) (10,15).
La valoración del compromiso y la extensión hacia los ganglios linfáticos sigue siendo un factor determinante y de controversia (15). La resonancia magnética permite no solo la valoración del tamaño de los ganglios, sino también la identificación de la morfología nodal, lo que aumenta considerablemente la especificidad para la detección de compromiso ganglionar (15).
La sensibilidad y especificidad de la resonancia magnética para la detección y estadificación del cáncer de recto es dependiente de la experiencia del radiólogo (8,10,15,23,24). En el estudio de Rafaelsen y colaboradores (25) se demostró que la sensibilidad en la estadificación del tumor para un radiólogo experto es de 96%, mientras que para un radiólogo general es del 77%, y la especificidad era de 74% y 40% respectivamente.
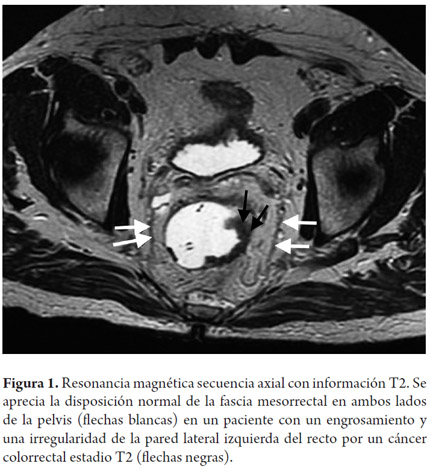
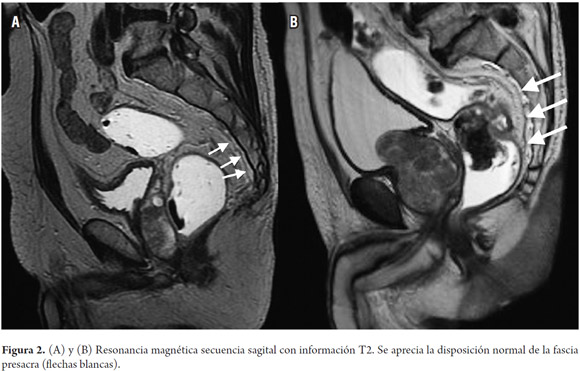
Los elementos que deben ser valorados en una resonancia magnética para cáncer rectal primario son el estadio, la profundidad de la invasión más allá de la muscular propia y la relación del tumor con la fascia mesorrectal (figura 1), la fascia presacra (figura 2), el esfínter anal y las paredes de la pelvis (15).
ESTRUCTURAS PARA VALORAR MEDIANTE LA RESONANCIA MAGNÉTICA
Estadificación tumoral (T)
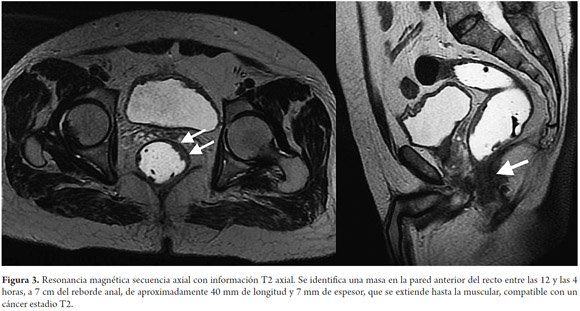
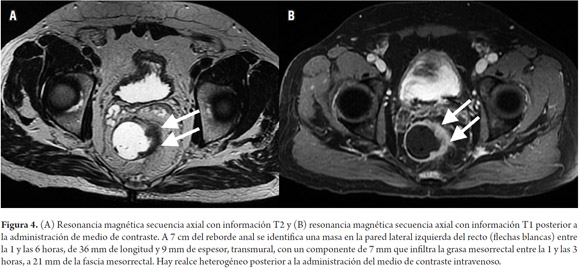
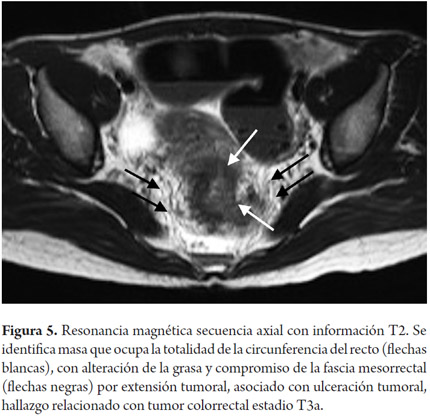
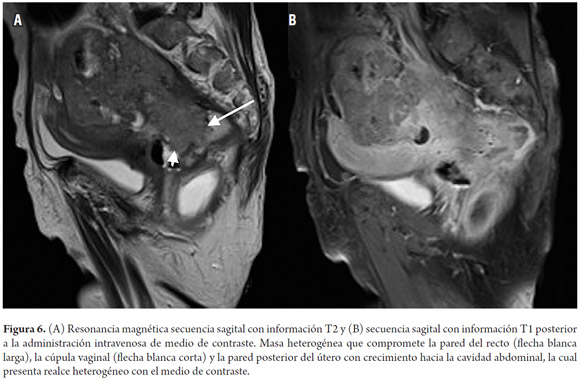
La estadificación del tumor depende directamente de su relación con la capa muscular propia y de la invasión con los órganos adyacentes (8). Un tumor T1 es aquel que se encuentra confinado a la mucosa, un tumor T2 es el que se extiende hasta la muscular propia (figura 3), un tumor T3 invade y se extiende más allá de la muscular propia (T3 temprano menor de 5 mm o T3 avanzado mayor de 5 mm) (figuras 4 y 5) y un tumor T4 es aquel que invade los órganos pélvicos (figura 6) (15). Los vasos pélvicos, la fascia parietal pélvica y la fascia mesorrectal no son considerados órganos (8).
Las definiciones de la estadificación TNM para el cáncer rectal fueron tomadas de los criterios estandarizados para el reporte de resonancia magnética de la Radiological Society of North America para cáncer rectal (standardized MR reporting criteria incorporated into the Radiological Society of North Americas radiology reporting template for primary rectal cancer) (26). Los clínicos y los radiólogos deben tener en cuenta el tipo de clasificación TNM que se está usando para facilitar la interpretación y unificar términos en los reportes imagenológicos (8).
El 80% de los tumores rectales son lesiones en estadio tumoral T3, siendo este un grupo heterogéneo de lesiones que presentan sobrevidas variables dependiendo de la extensión de la invasión más allá de la muscular propia (15). Los estadios T3 que tienen invasión menor de 5 mm tienen una sobrevida similar a los estadios tumorales T2, razón por la cual pueden ser agrupados para fines pronósticos y terapéuticos (15).
El uso de contraste intrarrectal es controversial (27). Pueden utilizarse de 60 a 100 mL de medio de contraste rectal, el cual se compone de gel de ultrasonido a temperatura corporal, que mejora la visualización de tumores polipoides o tumores menores de 3 cm (15,27). Aún no hay consenso sobre el uso de medio de contraste intravenoso (16,27,28).
Para evitar errores debidos al volumen parcial, las imágenes deben ser obtenidas en un plano perpendicular a la capa muscular (8), reconociendo la capa muscular propia como una estructura hipointensa (negra), delgada, que rodea el recto (8). Dentro de los signos que sugieren una extensión más allá de la muscular propia (T3 avanzado) (figura 5) se encuentra la ulceración tumoral, un tumor que ocupe más de la mitad de la circunferencia, un tumor con un mayor compromiso longitudinal, metástasis ganglionares o a distancia (8).
La demostración de grasa entre el tumor y las estructuras adyacentes indica que no hay invasión (8). Los signos más confiables para la detección de invasión son el crecimiento nodular hacia los órganos adyacentes o la obstrucción ureteral que genera hidronefrosis (8,29).
Hacer la diferencia entre lesiones estadio T2 y T3 no siempre es sencillo, ya que las reacciones desmoplásicas o los cambios de fibrosis generan espiculación de la grasa perirrectal y no siempre es posible diferenciar cuando hay o no presencia de componente tumoral en estas lesiones, lo que lleva a una sobrestimación de la estadificación (14,18,23,30-32). Esta situación es particularmente importante en pacientes que hayan sido tratados con radioterapia; en este escenario la presencia de lesiones nodulares, a diferencia de la espiculación, favorece el diagnóstico de residuo o recidiva tumoral sobre los cambios por radioterapia.
Relación de la masa con estructuras adyacentes
Debe tenerse en cuenta la relación del tumor con estructuras adyacentes como lo son la fascia mesorrectal, la reflexión peritoneal, los órganos pélvicos, el esfínter anal y la pared lateral de la pelvis (8,15).
Fascia mesorrectal
La fascia mesorrectal es un punto de referencia anatómica para la evaluación diagnóstica de la extensión tumoral (33,34); este es el factor más importante en cuanto al pronóstico (8) ya que el compromiso de la fascia mesorrectal aumenta el riesgo de recurrencia local y a distancia (8). La fascia mesorrectal corresponde a la capa visceral de la fascia intrapélvica (15). Compone una unidad anatómica diferente al rodear el recto y contener la grasa mesorrectal, ganglios y vasos linfáticos (15). En imágenes de alta definición con información T2 se visualiza como una imagen hipointensa lateral al recto (figura 1) (15).
La relación entre la fascia mesorrectal y el tumor es esencial para la planeación quirúrgica (15). En histología, una distancia mayor a 1 mm entre el tumor y el margen de resección se correlaciona con una menor probabilidad de recurrencia local (15,35). A medida que la distancia sea menor, mayor será la posibilidad de compromiso (8,36). Por este motivo, en secuencias con información T2 de alta resolución, una distancia menor de 1 mm entre el tumor y la fascia mesorrectal indica compromiso; sin embargo, este margen puede cambiar según los diferentes centros (8,15,37-39). Esta medida puede ser tomada desde cualquiera de los siguientes sitios: a) el margen del tumor desde su extensión más allá de la muscular propia, b) depósitos tumorales en el mesorrecto, c) trombo tumoral al interior de una estructura vascular o d) un ganglio linfático de aspecto tumoral (8,15).
Se debe tener en cuenta que la administración de un enema rectal en el momento del examen con sobredistensión del recto puede afectar la distancia entre el tumor y la fascia mesorrectal; sin embargo, no hay estudios que demuestren que este factor sea relevante y en cambio el uso del enema rectal mejora la visualización de las lesiones (8,40).
Reflexión peritoneal
Se localiza desde el aspecto superior de la vejiga hasta el aspecto anterior del recto, formando el saco rectovesical (15). En imágenes de alta definición con información T2 se visualiza como una imagen hipointensa en forma de V en imágenes axiales (15). El compromiso de esta fascia por parte del tumor hace que se estadifique como un estadio T4a (15).
Órganos pélvicos
Los órganos pélvicos más frecuentemente comprometidos durante el cáncer rectal son el útero, la vagina, la próstata y las vesículas seminales (15). La valoración del compromiso tumoral de estas estructuras, así como de la fascia presacra y el compromiso de los nervios sacros, tienen un significado en cuanto a la planeación quirúrgica, especialmente porque al afectar alguno de estos últimos vuelve el tumor irresecable (15).
Esfínter anal
El esfínter anal se compone de un esfínter interno de músculo liso, continuación de la capa circular del recto, y un esfínter externo de músculo estriado compuesto por el elevador del ano y una extensión del músculo puborrectal (15). La ubicación del tumor y el esfínter anal deben ser visualizados en imágenes coronales donde sea posible identificar la relación entre el margen superior del músculo puborrectal con el tumor, para así determinar si es posible realizar una resección quirúrgica (15). Describir la relación del tumor con el esfínter anal es particularmente importante en los casos de tumores que comprometen el recto distal.
Pared lateral de la pelvis
Las estructuras de la pared lateral de la pelvis se encuentran en estrecho contacto con el recto (15). Las arterias y venas ilíacas comunes, externa e interna; los uréteres, el músculo piriforme y obturador, y los nervios sacros, pueden verse comprometidos por tumor (15). El compromiso de la fascia mesorrectal, a nivel del recto superior o inferior (sitios donde no pueden ser diferenciadas sus capas) implica compromiso de la pared lateral de la pelvis (15). Las imágenes coronales y sagitales son las recomendadas para esta valoración, especialmente usando imágenes de alta resolución (15). El uso de campos de visión ampliados lleva a una subestimación de la proximidad del tumor con la pared lateral y, por ende, una subestimación del compromiso de las estructuras de la pared lateral (15).
Compromiso vascular y linfático
La valoración del cáncer de recto debe incluir no solo la estadificación tumoral y el compromiso de estructuras adyacentes, sino también la valoración de estructuras determinantes como los ganglios linfáticos y las estructuras vasculares cercanas.
Invasión vascular
La invasión de estructuras vasculares no es relevante para el tratamiento; sin embargo, desempeña un papel de importancia en cuanto al pronóstico y por ende debe ser valorada en las imágenes (15). El crecimiento perivascular no es sinónimo de crecimiento intravascular (8).
Identificar la invasión en pequeñas estructuras vasculares no es sencillo (15). La presencia de tumor en la luz de estructuras vasculares de mayor tamaño, como la arteria y vena rectal superior o rectal media, son los hallazgos indicativos de invasión tumoral (10,15). Otros hallazgos descritos son el crecimiento nodular en el sitio de crecimiento extramural, la proximidad del tumor a las venas o arterias de la pelvis, la heterogeneidad de la intensidad de señal en el interior de los vasos o el aumento del tamaño de los vasos (8,12,41). Smith y colaboradores (12,41) concluyeron en sus trabajos que cuando dos de estos signos están presentes, el pronóstico es similar a cuando hay invasión vascular evidenciada en histología.
Ganglios linfáticos (N)
Los ganglios linfáticos juegan un papel decisivo en la valoración del cáncer rectal ya que afectan el pronóstico (8). Los grupos que deben ser valorados son: el mesorrectal, el rectal superior, el mesentérico inferior, los ilíacos comunes, los internos y externos, los retroperitoneales e inguinales superficiales (15). La presencia de compromiso de los ganglios linfáticos es un factor pronóstico para la recurrencia de la enfermedad y para la presencia de metástasis a distancia (18,42). Debe identificarse en los grupos ganglionares su aspecto benigno o maligno (15). Si alguno de los ganglios linfáticos se localiza a menos de 1 mm de la fascia mesorrectal se debe incluir en los márgenes de resección para obtener márgenes limpios (15).
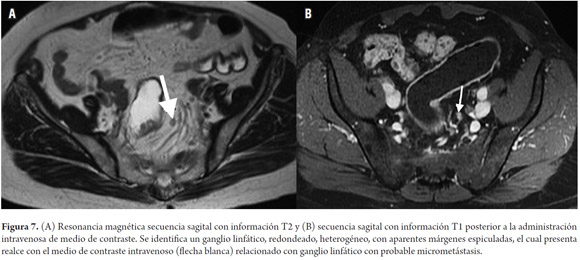
El tamaño de los ganglios linfáticos es un dato de valor limitado para determinar la presencia de metástasis (8,15). Se debe tener en cuenta que hay micrometástasis en ganglios de tamaño normal (5,43,44). Un diámetro de 5 mm tiene una sensibilidad de 68% y una especificidad de 78% para diferenciar ganglios malignos de benignos (8,10,15,45). Este valor no es relevante en el cáncer de recto, ya que entre el 30% al 50% de los ganglios linfáticos con metástasis ocurren en ganglios menores de 5 mm (15,46,47); por lo tanto, la morfología del ganglio linfático, incluyendo los márgenes o contornos y características internas (homogeneidad), son el punto clave para determinar metástasis (8,10,48-51). Un ganglio de aspecto metastásico presenta márgenes espiculados y contenido heterogéneo (15). Las calcificaciones en el interior del ganglio son sugestivas de malignidad (8). A pesar de esto, el problema de basarse en la morfología es que en los ganglios de mayor tamaño no es posible diferenciar entre ganglios neoplásicos o reactivos, y en los ganglios de menor tamaño pueden no identificarse las micrometástasis (figura 7A) (18). Cabe anotar que la sensibilidad de la resonancia magnética ñoñios de menor tamaiferenciar entre ganglios neoplreportada en la literatura para la detección de ganglios linfáticos varía entre el 39% al 95% (5-7,22,52-55).
Se ha usado medio de contraste (gadolinio) para la valoración de los ganglios linfáticos con estudios que reportan una precisión de hasta 70% (figura 7B) (5,8). Heriot y colaboradores reportan una sensibilidad y especificidad superiores al 80% para la detección de compromiso ganglionar cuando se usan antenas intrarrectales (22,56).
EL PRESENTE Y EL FUTURO DE LA VALORACIÓN PREQUIRÚRGICA EN LA RESONANCIA MAGNÉTICA
Las imágenes con información en difusión pueden mejorar la detección de tumores colorrectales (15,57). Esta secuencia además puede ayudar en la identificación y localización del tumor, así como de las metástasis en los ganglios linfáticos (15). Incluso, se ha reportado la utilidad de la secuencia de difusión como predictora de la respuesta a la quimioterapia, basándose en los valores de ADC (8,15,58), como lo expusieron Dzik-Jurasz y colaboradores, quienes encontraron que con valores de ADC bajos se predice una buena respuesta al tratamiento (58). Algunos autores han reportado la utilidad de la respuesta teniendo en cuenta que un aumento rápido en los valores de ADC puede preceder a los cambios en el tamaño tumoral (59). Sin embargo, debe señalarse que hay autores que no han demostrado cambios en la precisión, sensibilidad o especificidad entre secuencias T2 y secuencias de difusión con respecto a la estadificación tumoral (27,60). La mayor limitación de las secuencias de difusión es la presencia de artificios originados en el gas intestinal que puede dificultar la aplicación de la misma para el diagnóstico (15).
Esta secuencia también puede ser utilizada para valoración de los ganglios linfáticos; pero, los resultados en cáncer de recto no han sido plenamente comprobados (8). Los ganglios linfáticos hiperintensos en la secuencia de difusión son considerados como metástasis (61). Autores como Mizukami y colaboradores han descrito una sensibilidad del 97% y una especificidad del 81%; para ello utilizaron resonancia magnética en conjunto con secuencias de difusión para la detección de ganglios linfáticos metastásicos (61).
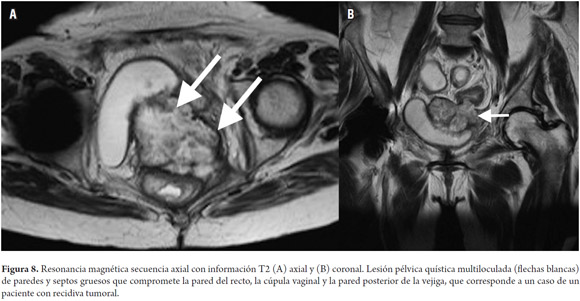
VALORACIÓN DE LA RECURRENCIA EN RESONANCIA MAGNÉTICA
La recurrencia tumoral ocurre en el 70% en los primeros dos años y hasta en un 85% a los tres años (62,63). En los casos de recurrencia la resonancia magnética permite valorar la extensión de la enfermedad, así como el compromiso de órganos adyacentes (62), con una sensibilidad de 80% a 90% y una especificidad de hasta 100% (figura 8) (62,64-66). La recurrencia puede ser clasificada según la localización y el compromiso de estructuras en el plano axial (incluyendo recurrencia en la anastomosis y recurrencia local) en: anterior (involucra órganos localizados anteriores al recto en la pelvis como vejiga, útero, vagina, próstata y/o vesículas seminales), posterior (involucra estructuras localizadas posterior al recto como sacro, coxis o fascia presacra) y lateral (involucra estructuras localizadas lateral al recto como pared de la pelvis, vasos ilíacos, uréteres) (62,67).
Los cambios postquirúrgicos, el tejido de granulación, hematomas residuales, cambios inflamatorios inducidos por radiación y la radioterapia neoadyuvante, producen un aumento en la intensidad de señal en las secuencias con información T2 que puede llegar a ser indistinguible de una recurrencia tumoral (62,68). Este aumento en la intensidad de señal puede persistir hasta por 2 años luego del procedimiento quirúrgico (62,65). Debido a esto, el análisis morfológico y el realce con el medio de contraste se tornan esencialmente importantes para diferenciar los cambios postquirúrgicos de un tumor residual o recidivante. El tumor residual suele tener márgenes redondeados mientras que la fibrosis causa márgenes angulares o espiculados (62). En muchos centros diagnósticos se estima conveniente iniciar el seguimiento imagenológico, al menos 6 meses posteriores a la cirugía o a la última sesión de radioterapia. El uso de la secuencia en difusión mencionada anteriormente demuestra el beneficio para la detección del cáncer colorrectal (62,64).
CONCLUSIONES
La resonancia magnética es el método de elección para la valoración de la pelvis en los pacientes con cáncer colorrectal, ya que permite la predicción de márgenes de resección negativos, la determinación de metástasis a ganglios linfáticos, el compromiso de órganos adyacentes y con las nuevas secuencias incluso puede servir como predictor de respuesta al manejo de quimioterapia. Además de estos aspectos, la resonancia magnética tiene una alta especificidad y una alta reproducibilidad, por lo cual debe utilizarse como la primera línea para la imagenología del cáncer de recto, especialmente cuando la interpretación del estudio se encuentra en manos de un radiólogo experto.
Conflicto de interés
No se declara ningún conflicto de interés durante el desarrollo de este trabajo.
Financiación
La financiación fue asumida en su totalidad por los autores.
REFERENCIAS
1. Jemal A, Bray F, Center M, Ferlay J, Ward E, Forman D. Global cancer statistics. Ca Cancer J Clin. 2011;61:69-90. [ Links ]
2. Ferreira EJ, Meléndez HJ. Características clínicas, demográficas e histopatológicas de los pacientes con cáncer colorrectal del Hospital Universitario de Santander. Revista Colombiana de Cirugía 2012;27(3), 213-220. [ Links ]
3. Sanabria A, Martínez JI, Díaz JA. Cáncer de colon: análisis del costo de enfermedad para los estadios III y IV en Cansercoop IPS. Rev Colomb Cienc Quim Farm 2009;38(2):193-214. [ Links ]
4. Piñeros M, Hernández G, Bray F. Increasing mortality rates of common malignancies in Colombia. Cancer. 2004;101(10):2285-92. [ Links ]
5. Muthusamy VR, Chang KJ. Optimal methods for staging rectal cancer. Clin Cancer Res 2007;13(22):6877s-6884s. [ Links ]
6. Hodgman CG, MacCarty RL, Wolff BG, May GR, Berquist TH, Sheedy PF 2nd, et al. Preoperative staging of rectal carcinoma by computed tomography and 0.15T magnetic resonance imaging. Preliminary report. Dis Colon Rectum 1986;29(7):446-50. [ Links ]
7. Butch RJ, Stark DD, Wittenberg J, Tepper JE, Saini S, Simeone JF, et al. Staging rectal cancer by MR and CT. Am J Roentgenol 1986;146(6):1155-60. [ Links ]
8. Torkzad MR, Pahlman L, Glimelius B. Magnetic resonance imaging (MRI) in rectal cancer: a comprehensive review. Insights Imaging 2010;1(4):245-267. [ Links ]
9. Martling A, Holm T, Bremmer S, Lindholm J, Cedermark B, Blomqvist L. Prognostic value of preoperative magnetic resonance imaging of the pelvis in rectal cancer. Br J Surg. 2003;90(11):1422–1428. [ Links ]
10. Brown G, Richards CJ, Newcombe RG, Dallimore NS, Radcliffe AG, Carey DP, et al. Rectal carcinoma: thin-section MR imaging for staging in 28 patients. Radiology 1999; 211(1):215–222. [ Links ]
11. LeBlanc. Imaging and management of rectal cancer. Nat Clin Pract Gastroenterol Hepatol 2007;4(12):665-676. [ Links ]
12. Smith NJ, Barbachano Y, Norman AR, Swift RI, Abulafi AM, Brown G. Prognostic significance of magnetic resonance imaging-detected extramural vascular invasion in rectal cancer. Br J Surg 2008;95(2):229–236. [ Links ]
13. Beets-Tan RGH, Beets GL. Rectal cancer: how accurate can imaging predict the T stage and the circumferential resection margin. Int J Colorectal Dis. 2003;18(5):385-391. [ Links ]
14. Beets-Tan RGH. MRI in rectal cancer: the T stage and circumferential resection margin. Colorectal Disease. 2003;5(5):392-395. [ Links ]
15. Kaur H, Choi H, You YN, Rauch GM, Jensen CT, Hou P, et al. MR imaging for preoperative evaluation of primary rectal cancer: practical considerations. Radiographics 2012;32(2):389-409. [ Links ]
16. MERCURY Study Group. Diagnostic accuracy of preoperative magnetic resonance imaging in predicting curative resection of rectal cancer: prospective observational study. BMJ 2006;333(7572):779. [ Links ]
17. Matsuoka H, Masaki T, Sugiyama M, Nakamura A, Takahara T, Hachiya J, Atomi Y. Gadolinium enhanced endorectal coil and air enema magnetic resonance imaging as a useful tool in the preoperative examination of patients with rectal carcinoma. Hepatogastroenterology. 2004;51(55):131–135. [ Links ]
18. Beets-Tan RGH, Beets GL. Rectal cancer: review with emphasis on MR imaging. Radiology 2004;232(2):335-346. [ Links ]
19. Quirke P, Dixon MF. The prediction of local recurrence in rectal adenocarcinoma by histopathological examination. Int J Colorectal Dis. 1988;3(2):127–131. [ Links ]
20. Wibe A, Rendedal PR, Svensson E, Norstein J, Eide TJ, Myrvold HE, et al. Prognostic significance of the circumferential resection margin following total mesorectal excision for rectal cancer. Br J Surg 2002;89(8):327–34. [ Links ]
21. Nagtegaal ID, Marijnen CA, Kranenbarg EK, van De Velde CJ, van Krieken JH. Circumferential Margin Involvement Is Still an Important Predictor of Local Recurrence in Rectal Carcinoma: Not One Millimeter but Two Millimeters Is the Limit. Am J Surg Pathol. 2002; 26(3):350–7. [ Links ]
22. Kwok H, Bissett IP, Hill GL. Preoperative staging of rectal cancer. Int J Colorectal Dis. 2000;15:9-20. [ Links ]
23. Beets-Tan RG, Beets GL, Vliegen RF, Kessels AG, Van Boven H, De Bruine A, et al. Accuracy of magnetic resonance imaging in prediction of tumour-free resection margin in rectal cancer surgery. Lancet. 2001;357(9255):497-504. [ Links ]
24. Blomquist L, Machado M, Rubio C, Gabrielsson N, Granqvist S, Holm T. Rectal tumour staging: MR imaging using pelvic phased-array and endorectal coils vs endoscopic ultrasonography. Eur Radiol. 2000;10(4):653-660. [ Links ]
25. Rafaelsen SR, Sorensen T, Jakobsen A, Bisgaard C, Lindebjerg J. Transrectal ultrasonography and magnetic resonance imaging in the staging of rectal cancer. Scand J Gastroenterol. 2008;43(4):440-446.
26. Al‐Sukhni E, Milot L, Fruitman M, Brown G, Schmocker S and Kennedy E. RSNA Radiology Reporting Templates. MR rectum cancer. 2014. Disponible en: http://www.radreport.org/txt/0000068. [ Links ]
27. Kijima S, Sasaki T, Nagata K, Utano K, Lefor AT, Sugimoto H. Preoperative evaluation of colorectal cancer using CT colonography, MRI and PET/CT. World J Gastroenterol. 2014;20(45):16964-16975. [ Links ]
28. Vliegen RF, Beets GL, von Meyenfeldt MF, Kessels AG, Lemaire EE, van Engelshoven JM, Beets-Tan RG. Rectal cancer: MR imaging in local staging is gadolinium-based contrast material helpful? Radiology. 2005; 234(1):179-188. [ Links ]
29. Suzuki C, Torkzad MR, Tanaka S, Palmer G, Lindholm J, Holm T, Blomqvist L. The importance of rectal cancer MRI protocols on interpretation accuracy. World J Surg Oncol. 2008;20(6):6-89. [ Links ]
30. Vogl TJ, Pegios W, Mack MG, Hünerbein M, Adler A, Lobbeck H, et al. Accuracy of staging rectal tumors with contrast-enhanced transrectal MR imaging. AJR Am J Roentgenol. 1997;168(6):1427–1434. [ Links ]
31. Brown G, Radcliffe AG, Newcombe RG, Dallimore NS, Bourne MW, Williams GT. Preoperative assessment of prognostic factors in rectal cancer using high-resolution magnetic resonance imaging. Br J Surg. 2003;90(3):355-364. [ Links ]
32. Meyenberger C, Huch Boni RA, Bertschinger P, Zala GF, Klotz HP, Krestin GP. Endoscopic ultrasound and endorectal magnetic resonance imaging: a prospective comparative study for preoperative staging and follow-up of rectal cancer. Endoscopy. 1995;27(7):469–479. [ Links ]
33. Klessen C, Rogalla P, Taupitz M. Local staging of rectal cancer: the current role of MRI. Eur Radiol. 2007;17(2):379-389. [ Links ]
34. Bisset IP, Chau KY, Hill GL. Extrafascial excision of the rectum: surgical anatomy of the fascia propria. Dis Colon Rectum. 2000;43(7):903–910. [ Links ]
35. Quirke P, Durdey P, Dixon MF, Williams NS. Local recurrence of rectal adenocarcinoma due to inadequate surgical resection: histopathological study of lateral tumour spread and surgical excision. Lancet. 1986;2(8514):996-999. [ Links ]
36. Mathur P, Smith JJ, Ramsey C, Owen M, Thorpe A, Karim S, Burke C, Ramesh S, Dawson PM. Comparison of CT and MRI in the pre-operative staging of rectal adenocarcinoma and prediction of circumferential resection margin involvement by MRI. Colorectal Dis. 2003;5(5):396-401. [ Links ]
37. Valentini V, Aristei C, Glimelius B, Minsky BD, Beets-Tan R, Borras JM, et al. Multidisciplinary rectal cancer management: 2nd European Rectal Cancer Consensus Conference (EURECA-CC2). Radiother Oncol. 2009;92(2):148-163. [ Links ]
38. Taylor A, Slater A, Mapstone N, Taylor S, Halligan S. Staging rectal cancer: MRI compared to MDCT. Abdom Imaging. 2007;32(3):323–327. [ Links ]
39. Kim NK, Min BS, Kim H, Pyo J, Kim MJ, Cha SH. A prospective comparison study for predicting circumferential resection margin between preoperative MRI and whole mount sections in mid-rectal cancer: significance of different scan planes. Eur J Surg Oncol. 2008;34(6):648-654. [ Links ]
40. Slater A, Halligan S, Taylor SA, Marshall M, Distance between the rectal wall and mesorectal fascia measured by MRI: effect of rectal distension and implications for preoperative prediction of a tumour-free circumferential resection margin. Clin Radiol. 2006;61(1):65–70. [ Links ]
41. Smith NJ, Shihab O, Arnaout A, Swift RI, Brown G. MRI for detection of extramural vascular invasion in rectal cancer. AJR Am J Roentgenol. 2008;191(5):1517–1522. [ Links ]
42. Kapiteijn E, Marijnen CA, Nagtegaal ID, Putter H, Steup WH, Rutten HJ, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med. 2001;345(9):638–646. [ Links ]
43. Andreola S, Leo E, Belli F, Bufalino R, Tomasic G, Lavarino C, et al. Manual dissection of adenocarcinoma of the lower third of the rectum specimens for detection of lymph node metastases smaller than 5 mm. Cancer. 1996;15(77):607-12. [ Links ]
44. Monig SP, Baldus SE, Zirbes TK, Schroder W, Lindermann DG, Dienes HP, et al. Lymph node size and metastatic infiltration in colon cancer. Ann Surg Oncol. 1999;6(6):579-81. [ Links ]
45. Bipat S, Glas AS, Slors FJ, Zwinderman AH, Bossuyt PM, Stoker J. Rectal cancer: local staging and assessment of lymph node involvement with endoluminal US, CT, and MR imaging a meta-analysis. Radiology. 2004;232(3):773-783. [ Links ]
46. Kotanagi H, Fukuoka T, Shibata Y, Yoshioka T, Aizawa O, Saito Y, et al. The size of regional lymph nodes does not correlate with the presence or absence of metastasis in lymph nodes in rectal cancer. J Surg Oncol. 1993;54(4):252-254. [ Links ]
47. Dworák O. Number and size of lymph nodes and node metastases in rectal carcinomas. Surg Endosc. 1989;3(2):96-99. [ Links ]
48. Kim JH, Beets GL, Kim MJ, Kessels AG, Beets-Tan RG. High-resolution MR imaging for nodal staging in rectal cancer: are there any criteria in addition to the size? Eur J Radiol. 2004;52(1):78–83. [ Links ]
49. Koh DM, Brown G, Husband JE. Nodal staging in rectal cancer. Abdom Imaging. 2006;31(6):652–659. [ Links ]
50. Jager GJ, Barentsz JO, Oosterhof GO, Witjes JA, Ruijs SJ. Pelvic adenopathy in prostatic and urinary bladder carcinoma: MR imaging with a three-dimensional TI-weighted magnetization-prepared- rapid gradient-echo sequence. AJR Am J Roentgenol. 1996; 167(6):1503–1507. [ Links ]
51. Williams AD, Cousins C, Soutter WP, Mubashar M, Peter AM, Dina R, et al. Detection of pelvic lymph node metastases in gynecologic malignancy: a comparison of CT, MR imaging, and positron emission tomography. AJR Am J Roentgenol. 2001;177(2):343–348. [ Links ]
52. Okizuka H, Sugimura K, Ishida T. Preoperative local staging of rectal carcinoma with MR imaging and a rectal balloon. J Magn Reson Imaging. 1993;3(2):329-35. [ Links ]
53. Chan TW, Kressel HY, Milestone B, Tomochefski J, Schnall M, Rosato E, et al. Rectal carcinoma: staging at MR imaging with endorectal surface coil. Work in progress. Radiology. 1991;181(2):461-7. [ Links ]
54. Indinnimeo M, Grasso RF, Cicchini C, Pavone P, Stazi A, Catalano C, et al. Endorectal magnetic resonance imaging in the preoperative staging of rectal tumors. Int Surg 1996;81(4):419-22. [ Links ]
55. McNicholas MM, Joyce WP, Dolan J, Gibney RG, Mac Erlaine DP, Hyland J. Magnetic resonance imaging of rectal carcinoma: a prospective study. Br J Surg. 1994;81(6):911-4. [ Links ]
56. Heriot AG, Grundy A, Kumar D. Preoperative staging of rectal carcinoma. Br J Surg. 1999;86:17–28. [ Links ]
57. Ichikawa T, Erturk SM, Motosugi U, Sou H, Araki T, Fujli H, et al. High-b-value diffusion-weighted MRI in colorectal cancer. AJR Am J Roentgenol. 2006;187(1):181-184. [ Links ]
58. Dzik-Jurasz A, Domenig C, George M, Wolber J, Padhani A, Brown G, et al. Diffusion MRI for prediction of response of rectal cancer to chemoradiation. Lancet 2002;360(9329):307-308. [ Links ]
59. Hein PA, Kremser C, Judmaier W, Griebel J, Kreczy A, Hub EB, et al. Diffusion-weighted magnetic resonance imaging for monitoring diffusion changes in rectal carcinoma during combined, preoperative chemoradiation: preliminary results of a prospective study. Eur J Radiol 2003;45(3):214-222. [ Links ]
60. Feng Q, Yan YQ, Zhu J, Xu JR. T staging of rectal cancer: accuracy of diffusion-weighted imaging compared with T2-weighted imaging on 3.0 tesla MRI. J Dig Dis. 2014;15(4):188-194. [ Links ]
61. Mizukami Y, Ueda S, Mizumoto A, Sasada T, Okumura R, Kohono S. Diffusion-weighted Magnetic Resonance Imaging for Detecting Lymph Node Metastasis of Rectal Cancer. World J Surg. 2011;35(4):895-899. [ Links ]
62. Sinaiei M, Swallow C, Milot L, Moghaddam PA, Smith A, Atri M, et al. Patterns and Signal Intensity Characteristics of Pelvic Recurrence of Rectal Cancer at MR Imaging. Radiographics 2003;33(5):E171-E187. [ Links ]
63. Palmer G, Martling A, Cedermark B, Holm T. A population-based study on the management and outcome in patients with locally recurrent rectal cancer. Ann Surg Oncol. 2007;14(2):447-454. [ Links ]
64. Lambregts DM, Cappendijk VC, Maas M, Beets GL, Beets-Tan RG. Value of MRI and diffusion-weighted MRI for the diagnosis of locally recurrent rectal cancer. Eur Radiol. 2011;21(6):1250-1258. [ Links ]
65. Tan PL, Chan CL, Moore NR. Radiological appearances in the pelvis following rectal cancer surgery. Clin Radiol. 2005;60(8):846-855. [ Links ]
66. Pema PJ, Bennett WF, Bova JG, Warman P. CT vs MRI in diagnosis of recurrent rectosigmoid carcinoma. J Comput Assist Tomogr. 1994;18(2):256-261. [ Links ]
67. Moore HG, Shoup M, Riedel E, Minsky BD Alektiar KM, Ercolani M, et al. Colorectal cancer pelvic recurrences: determinants of resectability. Dis Colon Rectum. 2004;47(10):1599-1606. [ Links ]
68. Messiou C, Chalmers AG, Boyle K, Wilson D, Sagar P. Pre-operative MR assessment of recurrent rectal cancer. Br J Radiol. 2008;81(966):468-473. [ Links ]











 text in
text in