Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.31 no.4 Bogotá Oct./Dec. 2016
Colitis ulcerativa grave en paciente con infección por virus de inmunodeficiencia humana: reporte de caso
A Case Report of Severe Ulcerative Colitis in an HIV Patient
Yuly Paulin Mendoza J., MD,1 Enrique Ponce de León C., MD,1 Geovanny Hernández C., MD,1 Oscar A. Beltrán, MD,1 Adriana Varón P., MD,1 Martín A. Garzón, MD,1 Jorge A. Ceballos, MD.1
(1) Gastroenterólogos Fundación Cardioinfantil, Unidad de Gastroenterología. Bogotá, Colombia.
Fecha recibido: 14-03-16 Fecha aceptado: 01-11-16
Resumen
Se presenta el caso de un paciente con colitis ulcerativa (CU) grave de nueva aparición y diagnóstico simultáneo de infección por virus de inmunodeficiencia humana (VIH). Dos enfermedades inmunológica y fisiopatológicamente opuestas, que raramente se asocian. Incluso se plantea que en la infección por VIH, la enfermedad inflamatoria intestinal (EII) puede ser menos agresiva. El diagnóstico se convierte en un reto, dado el espectro de enfermedades que pueden afectar el colón en el contexto de infección por VIH. Asimismo, el tratamiento es controversial teniendo en cuenta que el uso de inmunomoduladores o biológicos bloquean otro componente del sistema inmune que podría potenciar el estado de inmunosupresión en este grupo de pacientes. La historia natural, el tratamiento y el pronóstico, continúan siendo un desafío para la evidencia actual.
Palabras clave
Enfermedad inflamatoria intestinal, colitis ulcerativa, virus de inmunodeficiencia humana.
Abstract
We present the case of a patient with severe de novo ulcerative colitis (CU) and a simultaneous diagnosis of Human Immunodeficiency Virus (HIV) infection. These two immunologically and pathophysiologically opposing diseases are rarely found in association, and it has even been suggested that inflammatory bowel disease (IAS) may be less aggressive in HIV infections. The diagnosis is challenging, given the spectrum of diseases that can affect the colon in the context of an HIV infection. Treatment is similarly controversial considering that the use of immunomodulators or biological block another component of the immune system that could enhance the state of immunosuppression in this group of patients. Natural history, treatment and prognosis remain a challenge for currently available evidence.
Keywords
Inflammatory bowel disease, ulcerative colitis, human immunodeficiency virus.
INTRODUCCIÓN
Se considera que la EII se inicia y persiste por una respuesta inmune agresiva o aumentada, mediada por células en respuesta a un antígeno medioambiental desconocido en un huésped genéticamente susceptible (1, 2). En contraste, en la infección por el VIH existe una respuesta inmune escasa o disminuida en el tracto gastrointestinal, secundario a una temprana y profunda pérdida de las células T CD4+, lo que hace que el tracto digestivo sea susceptible a infecciones oportunistas (3, 4).
En la EII, los macrófagos se preparan para la inflamación y producen una variedad de quimiocinas y citocinas, algunas pueden disminuir la expresión de CCR5 y CD4, lo que limita la infectividad de los macrófagos intestinales al VIH. Por otra parte, algunas citocinas proinflamatorias producidas por los macrófagos en la EII, también pueden aumentar la susceptibilidad de los linfocitos CD4+ al VIH debido a la activación celular. El efecto de los macrófagos infectados por el VIH en la patogénesis de EII, aún no está clara por resultados contrapuestos con macrófagos que producen tanto citocinas proinflamatorias (TNFα) y antiinflamatorias (IL-10). Otros mecanismos fisiopatológicos muestran que las células dendríticas intestinales en la EII producen altos niveles de citocinas Th1, tales como IL-2 y IL-23, que pueden aumentar la infectividad celular por VIH, pero en la mucosa de pacientes con VIH, la disminución de las células CD4 puede atenuar la patogénesis de EII debido a la pérdida de la función de la célula T colaboradora. Finalmente, las células T Natural Killer (NK) también pueden tener un papel proinflamatorio en la patogénesis de la CU; sin embargo, en la infección por VIH, existe disminución de las NK que expresan CD4. Entonces, mediante estos mecanismos, el VIH podría atenuar el fenotipo de la CU (4, 5).
La combinación clínica de VIH y EII también conlleva ciertas implicaciones para la aproximación terapéutica, esto se debe a que el papel de los medicamentos biológicos está bien establecido en EII, pero su efecto en la infección por VIH es poco conocido. El objetivo de presentar este caso clínico es revisar los aspectos fisiopatológicos, clínicos y terapéuticos en la presentación concomitante de estas 2 enfermedades.
DESCRIPCIÓN DEL CASO CLÍNICO
Hombre de 53 años, soltero, economista y con tabaquismo activo. Se presentó al servicio de Urgencias con historia de 2 meses de cambios en la deposición con heces encintadas y episodios de rectorragia. En la última semana, tuvo deposiciones de 5 a 8 veces al día con moco y sangre. Al ingreso presentó rectorragia abundante, astenia, adinamia y lipotimia. Al examen físico se encontró deshidratado, con palidez mucocutánea generalizada, somnoliento, taquicárdico e hipotenso sin responder a líquidos cristaloides, presentando inestabilidad hemodinámica con requerimiento de soporte vasopresor con noradrenalina y transfusión de 2 UGRE.
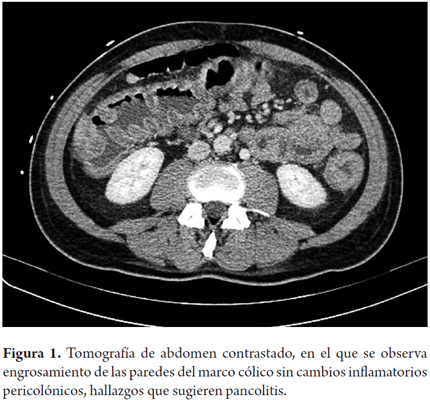
Inicialmente, se consideró choque mixto hipovolémico y séptico de origen gastrointestinal, se inició cubrimiento antibiótico con ampicilina-sulbactam y metronidazol intravenosos y manejo en unidad de cuidado intensivo (UCI). La tomografía computarizada de abdomen informó engrosamiento de las paredes del marco cólico y del recto, con realce anormal de la mucosa, hallazgos compatibles con pancolitis (figura 1).
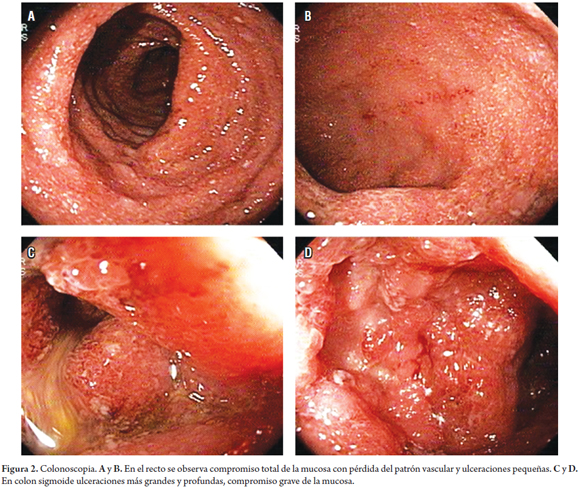
Se solicitó ELISA para toxina de Clostridium difficile y colonoscopia que se realizó una vez estabilizado el paciente. Se encontró compromiso total de la mucosa desde el recto con pérdida del patrón vascular, ulceraciones pequeñas del recto, y ulceraciones más grandes y profundas del colon izquierdo, con pérdida de las haustraciones del trayecto examinado, el procedimiento se suspende en el descendente distal por el compromiso inflamatorio grave de la mucosa (figura 2).
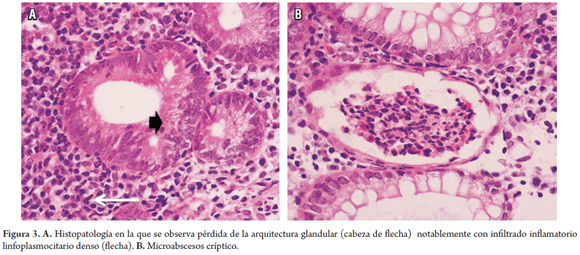
Se tomaron múltiples biopsias que confirman UC grave, con distorsión estructural de las criptas intestinales, disminución de sus ramificaciones y del número de células caliciformes, mezclado notablemente con infiltrado inflamatorio linfoplasmocitario denso, asociado con microabscesos crípticos muy característicos (figura 3).
Todos los hallazgos confirmaron EII de tipo CU grave por clasificación de Mayo (11 puntos) y Trulove Witts (número de deposiciones, rectorragia, anemia, hipoalbuminemia e hipocalemia). Se inició manejo con corticosteroides intravenosos con hidrocortisona 400 mg/día, mesalazina 2 g cada 12 horas en gránulos, reposo intestinal y nutrición parenteral periférica, logrando al tercer día mejoría del estado clínico, pero con persistencia de múltiples deposiciones líquidas con sangre rojo rutilante de hasta 18 deposiciones al día, pese al manejo instaurado. Se descartó megacolon tóxico con radiografía de abdomen simple que fue normal, y se calculó el índice de Ho de 5 con alto riesgo de falla a los esteroides y alta probabilidad de requerir manejo adicional con ciclosporina o terapia biológica. Ante esta posibilidad, se solicitó radiografía de tórax, prueba de tuberculina (PPD), serología para hepatitis B y C, y ELISA para virus de inmunodeficiencia humana (VIH).
Al cuarto día de la hospitalización, el reporte de ELISA VIH salió reactivo, se solicitó Wester Blot como prueba confirmatoria, carga viral para CMV y tinciones especiales, ambas negativas. Preocupó el comportamiento tórpido del paciente con múltiples episodios de rectorragias y ahora condición de inmunosupresión por VIH, en quien se tendría que considerar la posibilidad de terapia de rescate para CU con inmunosupresores. Afortunadamente, no se necesitó y al quinto día el paciente presentó mejoría clínica con disminución del número de deposiciones y menor rectorragia. Se pasó de esteroide IV a oral, con prednisolona 40 mg/día, con evolución clínica adecuada, lo que permitió la disminución progresiva de la prednisolona con descenso de 5 mg semanal hasta 20 mg/día, y luego reducción de 2,5 mg por semana, hasta la suspensión. Continuó solo con mesalazina a 2 g cada 12 horas con buen control de la CU.
Se valoró por Infectología, en donde se confirmó la enfermedad por VIH con Western Blot positivo y recuento absoluto de CD4+ en 445 cel/mm3. Se descartó compromiso infeccioso intestinal por otros gérmenes oportunistas. Ambulatoriamente, se inició manejo para el VIH con terapia antirretroviral con efavirenz asociado con lamivudina y abacavir, con adecuada respuesta continuando en seguimiento y control.
DISCUSIÓN
El diagnóstico de VIH en un paciente con CU cambia el panorama de manejo y enfoque del caso. La pertinencia de realizar el diagnóstico de VIH tempranamente en CU, es motivo de discusiones, debatiéndose el tamizaje dirigido solo a las personas en riesgo en comparación con un tamizaje más sensible y universal en todos los pacientes con CU de forma sistemática, que permita un diagnóstico más oportuno, disminuyendo la probabilidad que el diagnóstico tardío derive posiblemente en peores desenlaces (6).
No se ha establecido la prevalencia de EII en pacientes con infección por VIH; sin embargo, fisiopatológicamente no es una asociación frecuente. Clásicamente, en los pacientes con infección por VIH se describe pérdida profunda y selectiva de linfocitos T CD4+, que deja el tracto intestinal en un estado de paucidad inmune. Por otro lado, la EII se relaciona con diversos factores genéticos, ambientales e inmunológicos que se caracterizan por un estado de sobreactivación inmune (4).
Varios informes de casos describen la tendencia a la remisión sintomática de la EII directamente proporcional al descenso en el conteo de CD4 (7). Se esperaría la modulación de la EII observada en pacientes con una enfermedad que merma el sistema inmune, como la infección por VIH; sin embargo, llama la atención que permanezca controlada o se logre un fácil control, inclusive con recuento de CD4 elevado, como es el caso del paciente usado de ejemplo, o cuando se presenta la reconstitución inmune con el inicio de la terapia antirretroviral (4).
Una de las descripciones más completa sobre los desenlaces, se encuentra en un estudio prospectivo, en el cual se realizó seguimiento y se comparó 20 pacientes con EII y VIH, con 40 pacientes controles, también con EII, pero sin la infección por VIH. En el grupo con VIH la tasa de recaída fue de 0,016 episodios por año en comparación con 0,053 episodios en el grupo control, sin llegar a lograr una significancia estadística (2).
Respecto al tratamiento de la EII en pacientes con VIH mediante el uso de biológicos, es fácil suponer una mayor inmunosupresión; sin embargo, existe evidencia que el TNFα en la infección por VIH contribuye en la patogénesis, promueve la replicación viral y se relaciona con la activación de células T apoptóticas en el proceso del VIH. A su vez, el VIH parece inducir la expresión de TNF, ya sea directamente o al aumentar la activación del receptor de TNF a través de mimetismo molecular (8, 9). De modo que los agentes antiTNFα podrían tener un potencial benéfico en los pacientes con VIH y ser relativamente seguros en los pacientes con EII e infección por VIH concomitante. Hasta el momento, solo se cuenta con series de casos, la mayoría con indicación de tratamiento de enfermedades reumatológicas, sin evidenciar complicaciones infecciosas oportunistas o aumento de la carga viral.
Se examinó el uso de los antiTNF en paciente con recuento más altos de CD4 con o sin terapia antirretroviral, y se confirmó una relativa seguridad de los agentes antiTNF como adalimumab, infliximab y etanercept, con un mínimo impacto sobre la carga viral del VIH o el recuento CD4; sin embargo, el uso de antiTNF permanece limitado en cuanto a su seguridad para los pacientes con recuentos de CD4 bajos y cargas virales altas (4, 10).
Con el reciente uso en EII de los antiα4β7 en natalizumab, vedolizumab y ertolizumab, es importante recordar que el VIH, a través de la proteína de envoltura gp120, se une a la integrina α4β7, la cual sirve como receptor para los linfocitos intestinales. El acoplamiento de α4β7 con el VIH puede resultar en un aumento de la infectividad y contribuir a la disminución de CD4+ células T en la mucosa intestinal (11). Esto sugiere un beneficio potencial en la terapia antiα4β7 en VIH; sin embargo, los estudios actuales son pocos y realizados in vitro en macacos Rhesus con resultados conflictivos, por lo que se requieren más estudios. De momento, las consideraciones fisiopatológicas soportan el uso de los medicamentos α4β7 inhibidores selectivos, como vedolizumab, que podrían llegar a ser herramientas de primera línea en el tratamiento de pacientes con EII infectados por VIH (4).
En cuanto al uso de inmunomoduladores, como azatioprina, los datos también son limitados. Una reciente serie de casos de 7 pacientes en quienes se usó azatioprina por diferentes patologías y manejo concomitante con terapia antirretroviral, con media de duración de 12 meses y con 6 meses de seguimiento luego de su suspensión; no se informaron infecciones oportunistas serias o enfermedades malignas, y se presentaron 2 muertes no asociada con el uso de azatioprina. Los datos se compararon con pacientes controles sin evidenciarse cambios significativos en los conteos celulares o de carga viral (12). Sin embargo, se requiere de estudios con un mayor número de pacientes para dar una recomendación apropiada de su uso.
CONCLUSIÓN
En conclusión, el presente informe de caso destaca la necesidad de desarrollar futuras investigaciones con el fin de establecer la relación entre la patogénesis del VIH y CU, el tratamiento con TAR, biológicos e inmunomoduladores, con la escasa evidencia actual que no permite recomendar la terapia adecuada en estos pacientes.
Presentación del caso
Concurso de Semillero de Líderes, organizado por ABBVIE el día 27 de agosto de 2015.
REFERENCIAS
1. Shih D, Targan S MD. Recent advances in IBD pathogenesis: genetics and immunobiology. Curr Gastroenterol Rep. 2008;10:568-75. [ Links ]
2. Viazis N, Vlachogiannakos J, Georgiou O, et al. Course of inflammatory bowel disease in patients infected with human immunodeficiency virus. Inflamm Bowel Dis. 2010;16(3):507-11. [ Links ]
3. Mehandru S, Poles MA, Tenner-Racz K, et al. Primary HIV-1 infection is associated with preferential depletion of CD4+ T lymphocytes from effector sites in the gastrointestinal tract. J Exp Med. 2004;200(6):761-70. [ Links ]
4. Ho TH, Cohen BL, Colombel JF, et al. Review article: The intersection of mucosal pathophysiology in HIV and inflammatory bowel disease, and its implications for therapy. Aliment Pharmacol Ther. 2014;40(10):1171-86. [ Links ]
5. Mehandru S, Poles MA, Tenner-Racz K, et al. Mechanisms of gastrointestinal CD4+ T-cell depletion during acute and early human immunodeficiency virus type 1 infection. J Virol. 2007;81:599-612. [ Links ]
6. Soria A, Rossi M, Muscatello A, et al. HIV testing: a must for patients with inflammatory bowel disease? Am J Gastroenterol. 2011;106(9):1727-8. [ Links ]
7. Yoshida EMMD, Chan NHLMD, Herrick RABA, et al. Human immunodeficiency virus infection, the acquired immunodeficiency syndrome, and inflammatory bowel disease. J Clin Gastroenterol. 1996;23(1):24-18. [ Links ]
8. de Oliveira Pinto LM. Garcia S, Lecoeur H, et al. Increased sensitivity of T lymphocytes to tumor necrosis factor receptor 1 (TNFR1)- and TNFR2-mediated apoptosis in HIV infection: relation to expression of Bcl-2 and active caspase-8 and caspase-3. Blood. 2002;99:1666-75. [ Links ]
9. Herbein GKK. Is HIV infection a TNF receptor signalling driven disease? Trends Immunol. 2008;29:61-7. [ Links ]
10. Shale MJ, Seow CH, Coffin CS, et al. Review article: Chronic viral infection in the anti-tumour necrosis factor therapy era in inflammatory bowel disease. Aliment Pharmacol Ther. 2010;31(1):20-34. [ Links ]
11. Cicala C, Martinelli E, McNally JP, et al. The integrin alpha4beta7 forms a complex with cell-surface CD4 and defines a T-cell subset that is highly susceptible to infection by HIV-1. Proc Natl Acad Sci USA. 2009;106:20877-82. [ Links ]
12. Chamberlain FE, Dinani N, Jagjit Singh GK, et al. Azathioprine can be safely used in HIV-infected individuals. AIDS. 2014;28(3):447-8. [ Links ]











 text in
text in