Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.31 no.4 Bogotá Oct./Dec. 2016
Algoritmos útiles para el diagnóstico histopatológico de la enfermedad hepática con base en los patrones de daño hepático
Useful Algorithms for Histopathological Diagnosis of Liver Disease Based on Patterns of Liver Damage
Rocío del Pilar López Panqueva, MD (1)
(1) Patóloga, Hospital Universitario Fundación Santa Fe de Bogotá, Universidad de Los Andes. Bogotá, Colombia.
Fecha recibido: 01-11-16 Fecha aceptado: 15-11-16
Resumen
En los anteriores artículos, se revisaron las patologías hepáticas más frecuentes desde el punto de vista morfológico y la importancia de una adecuada correlación, para lograr un mejor entendimiento entre clínicos y patólogos. El ejercicio que se hará a continuación, se basa en establecer una aproximación al diagnóstico histopatológico de algunas de las patologías hepáticas a las que se les realiza biopsias con mayor frecuencia, teniendo en cuenta algoritmos basados en patrones de daño hepático.
Palabras clave
Biopsia hepática, algoritmos, patrones, infiltrados portales, granulomas, reacción ductular, proliferación colangiolar, injuria lobulillar, pigmentos, fibrosis, cirrosis, esteatosis, masa hepática.
Abstract
Previous articles have reviewed the most frequent liver pathologies from the morphological point of view and looked at the importance of adequate correlation for obtaining better understanding between clinicians and pathologists. The next exercise is directed toward histopathological diagnosis of some of the liver diseases for which biopsies are performed most frequently. It takes into account algorithms based on patterns of liver damage.
Keywords
Liver biopsy, algorithms, patterns, portal infiltrates, granulomas, duct reaction, cholangiolar proliferation, lobular injury, pigments, fibrosis, cirrhosis, steatosis, hepatic mass.
PATRONES DE DAÑO HEPÁTICO
El estudio de una biopsia hepática realizado con la simple descripción de lo que se observa en una lámina histológica, tiene un muy limitado valor diagnóstico. El patólogo debe asegurarse del óptimo manejo de la biopsia, de la adecuada fijación, procesamiento, conocer y utilizar los estudios adicionales de histoquímica, inmunohistoquímica o moleculares que pueden aportar valor al estudio, para finalmente identificar y analizar el tipo de injuria que presenta el hígado, concluyendo finalmente en un diagnóstico. Es aquí donde encajar los hallazgos morfológicos de lesión dentro de uno de los patrones de daño hepático, puede lograr una aproximación al diagnóstico, siempre en correlación con la información clínica.
La respuesta hepática a la injuria es limitada, sin importar cuál es la causa desencadenante. Se debe recordar que los cambios morfológicos se resumen en la presencia de edema celular o balonización, esteatosis, colestasis, necrosis y/o apoptosis, inflamación, cambios regenerativos y alteración de la arquitectura con o sin fibrosis. Estas características, presentándose en forma aislada o simultáneamente varias de ellas, dan lugar a patrones de daño hepático; son netamente morfológicas y cada una de ellas engloba varios diagnósticos diferenciales. Analizadas en forma algorítmica, orientan el diagnóstico; el análisis conjunto con la historia clínica puede lograr una aproximación diagnóstica muy acertada.
Los patrones más importantes son:
- Patrón I, infiltrados celulares
- Patrón II, reacción ductular
- Patrón III, cambios mínimos o casi normal
- Patrón IV, injuria o lesión lobulillar
- Patrón V, esteatosis
- Patrón VI, fibrosis
- Patrón VII, presencia de masas
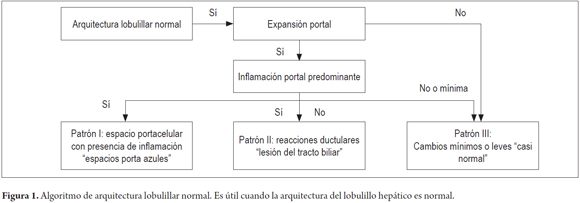
El primer paso consiste en identificar si existe o no alteración de la arquitectura lobulillar normal. Determinar la existencia de espacios porta con presencia de estructuras normales de la triada portal, vena central y trabéculas hepatocelulares uniformemente distribuidas (figura 1).
PATRÓN I: INFILTRADOS INFLAMATORIOS
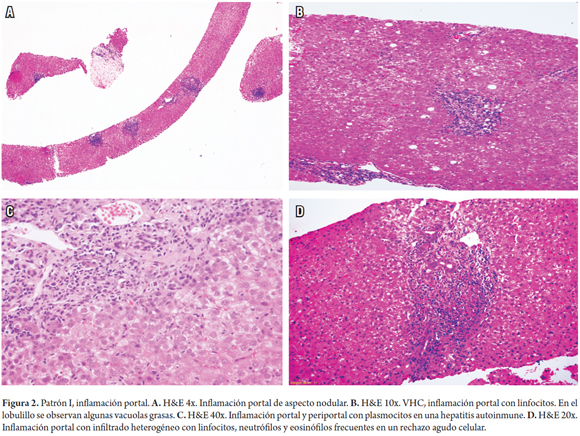
Uno de los hallazgos más frecuentes en la patología hepática, es la presencia de infiltrados inflamatorios portales, estos se observan en una amplia variedad de enfermedades hepáticas que incluyen, principalmente, enfermedades necroinflamatorias, como las hepatitis virales, hepatitis autoinmune y las inducidas por medicamentos, también en enfermedades colestásicas crónicas, como colangitis biliar primaria o la colangitis esclerosante primaria, enfermedades metabólicas de tipo enfermedad de Wilson, deficiencia de α1 antitripsina o condiciones neoplásicas, como infiltración por linfoma, leucemias o síndrome linfoproliferativo postrasplante (figura 2A).
Luego de identificar este patrón de expansión portal celular por inflamación, es importante tener en cuenta otras claves para el diagnóstico histopatológico, como son el tipo de infiltrado, el patrón de compromiso inflamatorio de la placa limitante o del lobulillo, asociación con necrosis y la presencia de fibrosis. Algunas de estas características se trataron anteriormente y se resumirán a continuación:
Inflamación del portal de linfocitos
Esta característica se observa principalmente en las hepatitis crónicas B y C, hepatitis aguda causada por la infección por virus hepatotropos, virus no hepatotropos y toxicidad por medicamentos (figura 2B) (1, 2).
Hepatitis crónica C
- Inflamación portal linfocitaria con agregados o folículos linfoides con centros germinales
- Hepatitis de interfase
- Hepatitis lobulillar con linfocitos en filas indias
- Necrosis y/o apoptosis hepatocelular
- Esteatosis macrovesicular
- Fibrosis según el estadio
Hepatitis crónica B
- Inflamación portal linfocitaria
- Hepatitis de interfase
- Hepatitis lobulillar
- Necrosis y/o apoptosis hepatocelular
- Células en vidrio esmerilado
Inflamación portal con plasmocitos
Son entidades con predominio de plasmocitos. En primer lugar se encuentra la hepatitis autoinmune y otras como colangitis biliar primaria, anteriormente llamada cirrosis biliar primaria, colangitis esclerosante primaria, enfermedad por IgG4, patología del trasplante, enfermedades recurrentes, como la hepatitis autoinmune o colangitis biliar y el rechazo celular tardío rico en plasmocitos (figura 2C) (3-6).
Hepatitis autoinmune
- Infiltrado portal con predominio de plasmocitos muy denso
- Hepatitis de interfase
- Formaciones de rosetoides hepatocelulares
- Hepatitis lobulillar
- Glóbulos hialinos en células de Kupffer
Inflamación portal con eosinófilos
Son numerosas las enfermedades hepáticas que tienen eosinófilos, pero cuando son predominantes, no necesariamente implican toxicidad o hipersensibilidad medicamentosa, también condiciones sistémicas con eosinofilia, gastroenteritis eosinofílica o enfermedades parasitarias infrecuentes, como la esquistosomiasis del sistema portal, puede producir abscesos de eosinófilos. El diagnóstico diferencial también incluye algunos tumores y lesiones seudotumorales que comprometen el hígado, como histiocitosis de células de Langerhans, seudotumor inflamatorio o tumor miofibroblástico, y en el postrasplante, el rechazo agudo celular (figura 2D) (7, 8).
Inflamación portal mixta con linfocitos, plasmocitos y neutrófilos o eosinófilos polimorfonucleares
Característico del rechazo agudo celular, enfermedad de Hodgkin, hepatitis viral y hepatitis inducida por medicamentos.
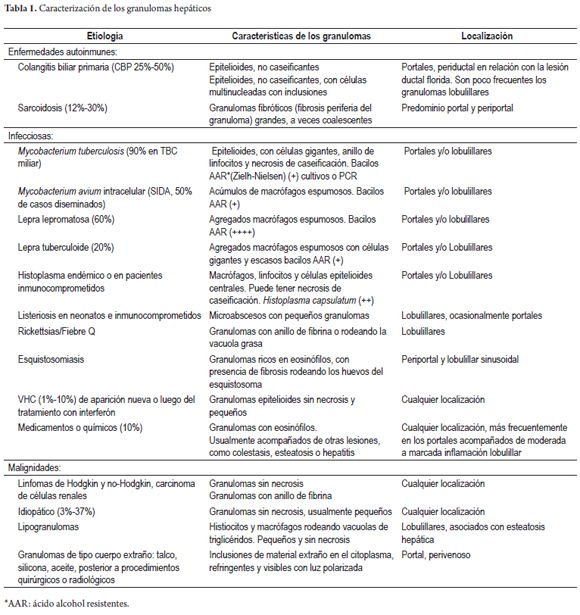
Inflamación con granulomas
La prevalencia de los granulomas se encuentra en un rango que oscila entre 2,4% y 15%, de los cuales, más de 60% es secundario a procesos sistémicos, una tercera parte a condiciones primarias hepáticas y entre 6% a 10% son idiopáticos (7, 9, 10).
Los granulomas, pueden localizarse a nivel portal, en el parénquima o ambos. La localización y las características de los granulomas pueden orientar el diagnóstico. En la tabla 1 se resumen algunas de estas características.
PATRÓN II: REACCIONES DUCTULARES
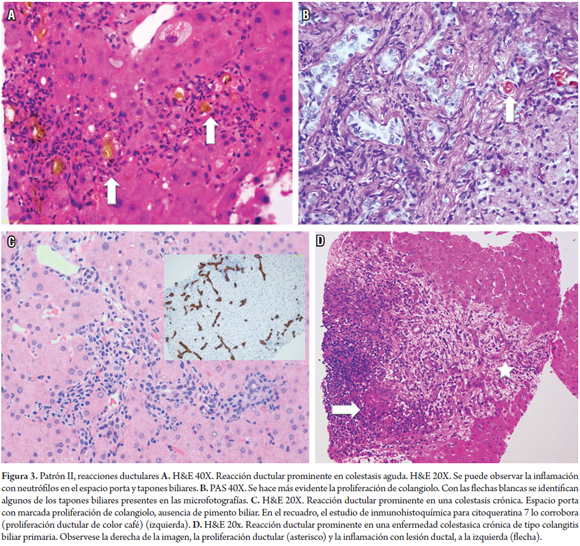
Anteriormente, se utilizaba el término proliferación ductular o colangiolar refiriéndose a la proliferación de pequeños conductos biliares en la periferia de los tractos portales; sin embargo, este patrón no solo incluye la proliferación de colangiolos, sino adicionalmente cambios en el estroma portal, en la interfase y en el parénquima. La combinación de estos elementos ayuda a definir las enfermedades que se caracterizan por una prominente reacción ductular. Se debe recordar que las células del epitelio hepatobiliar responden a la lesión del conducto biliar o de los hepatocitos, que se consideran las células madre progenitoras, también la metaplasia biliar de los hepatocitos de la interfase representa procesos de tipo regenerativo. Cuando existe reacción ductular importante se relaciona, en primera instancia, con enfermedades del tracto biliar agudas o crónicas (11, 12).
Reacción ductular (RD) prominente
Una obstrucción de la vía biliar aguda o crónica por cálculos, parásitos, fibrosis o masas, usualmente no requieren biopsia por tratarse de un diagnóstico claramente clínico y/o de imágenes. Constantemente se encuentran en las biopsias postrasplante o como hallazgo durante una autopsia. Otras causas de RD son la colangitis ascendente, colangitis lenta, hepatitis aguda con necrosis submasiva o masiva y en enfermedades colestásicas crónicas, como colangitis biliar primaria y colangitis esclerosante primaria. La reacción ductular biliar se define como la proliferación de conductos biliares acompañada de neutrófilos y, a su vez, se divide en 3 tipos: tipo I, asociado con obstrucción biliar, tipo II relacionado con hepatitis activa y tipo III asociado con necrosis hepática masiva, esta terminología solo es útil para orientar las posibles etiologías (figura 3) (13-15).
Obstrucción biliar aguda
- Proliferación de conductos que parecen anastomosarse con pequeñas luces
- Marcado edema del estroma circundante
- Infiltrado de neutrófilos variable
- Colestasis canalicular y hepatocelular variable
- Infartos biliares cuando la obstrucción es importante
Colangitis ascendente
- Proliferación de colangiocitos con presencia de neutrófilos intraluminales
- Inflamación aguda del epitelio del conducto
- Dilatación del conducto con atenuación del epitelio
- Colestasis hepatocanalicular variable
- Los infartos biliares periportales son comunes
Colangitis lenta
Se presenta en pacientes con sepsis o sepsis inminente, obstrucción de la vía biliar o por endotoxinas. Se considera una urgencia médica. Presenta proliferación ductular con conductos dilatados llenos de bilis (colestasis ductular), concreciones biliares en el espacio portal o zona de interfase y mínima inflamación.
Hepatitis aguda con necrosis masiva o submasiva
- Reacción ductular prominente por activación de las células madre al tratar de regenerar el parénquima y restaurar su función
- Mínimo edema
- Inflamación leve, usualmente por neutrófilos
- Macrófagos con material PAS diastasa positivo
Obstrucción crónica/colestasis crónica
- Proliferación colangiolar
- Mínimo edema
- Leve inflamación de linfocitos
- Efecto de halo claro en región periportal o periseptal
- Cambio xantomatoso hepatocitario (colestasis)
- Depósito de cobre periportal
- Fibrosis periductal
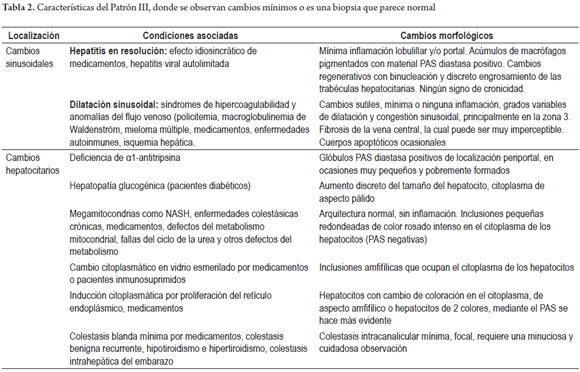
PATRÓN III: CAMBIOS MÍNIMOS O CASI NORMAL
En cerca de 5% de las biopsias se encuentra cambios inespecíficos, infiltrados inflamatorios mínimos portales o lobulillares, o están ausentes, no hay evidencia de fibrosis ni cambios estructurales. En 80% de estos pacientes, existe anomalías persistentes en las pruebas de función hepática y en 20% ascitis inexplicada, que obliga a realizar una biopsia.
Aproximadamente en la mitad de estos pacientes que llevan una adecuada historia clínica y estudios paraclínicos, es posible definir una etiología, como el compromiso hepático en condiciones autoinmunes sistémicas (lupus eritematoso sistémico y artritis reumatoidea) (15%), hepatitis autoinmune, colangitis biliar primaria o sarcoidosis (10%), síndrome metabólico (10%), condiciones inflamatorias crónicas del tracto gastrointestinal (5%), isquemia hepática (1%-5%) e hipertensión portal no cirrótica (1%). Muchas de estas patologías tienen un compromiso heterogéneo y focal, como por ejemplo, las enfermedades colestásicas crónicas y la enfermedad hepática grasa; otras durante su curso clínico tienen períodos de latencia e inactividad.
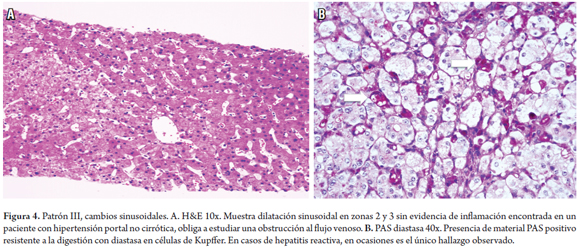
En algunos casos, especialmente en entidades que causan hipertensión portal no cirrótica, los cambios vasculares son sutiles y focales. La dilatación sinusoidal o vasos portales dilatados o con fibrosis pueden pasar fácilmente desapercibidos. En 25% de los casos, durante el curso clínico, las anomalías de las pruebas de función se normalizarán y el otro 25% persistirá por muchos años. La tabla 2 resume los diagnósticos probables y se describen los cambios morfológicos que deben buscarse cuando en la biopsia no se identifican lesiones específicas y luce normal o casi normal la biopsia hepática (figura 4) (7).
PATRÓN IV: INJURIA LOBULILLAR
Inflamación y lesión lobulillar
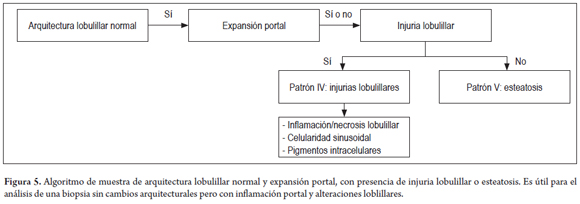
En la figura 5 se muestra un algoritmo con arquitectura lobulillar normal y expansión portal. Se debe buscar la presencia de injuria lobulillar o esteatosis.
Cuando se observa con poco aumento, el lobulillo luce intranquilo, sea porque está ocupado por células inflamatorias o porque hay evidencia de necrosis, significa que existe una lesión o daño lobulillar. Son múltiples las posibilidades y requiere un estudio minucioso con mayor aumento para buscar claves adicionales que orienten el diagnóstico, para el posterior análisis conjunto con la historia clínica.
Algunos ejemplos de este patrón son la hepatitis aguda o subaguda, hepatitis por virus no hepatotrópicos, como citomegalovirus, herpes virus, adenovirus, Epstein-Barr o hepatitis E; compromiso por enfermedades sistémicas, como la enfermedad celiaca, linfomas o leucemia, hipervitaminosis A o por presencia de pigmentos de lipofuscina, cobre o hierro (16-20).
Hepatitis aguda
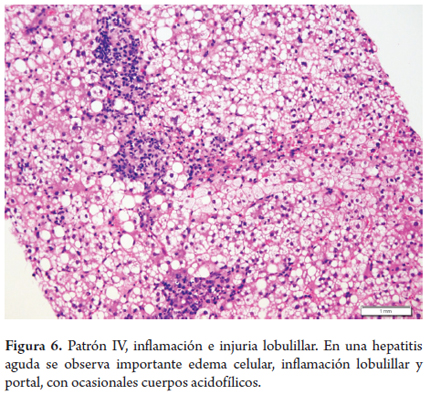
Usualmente no es indicación de biopsia. En raras ocasiones se indica, por ejemplo cuando existe duda o error en el diagnóstico clínico, o cuando, a pesar de estar bien establecido el diagnóstico, el clínico necesita información más certera del estadio o gravedad de la enfermedad, y por último, en el postrasplante. Muestra prominente inflamación lobulillar, inflamación portal linfocitaria leve, edema o balonización hepatocelular, necrosis o apoptosis aislada, dispersa en el lobulillo, cuerpos acidofílicos, acúmulos de macrófagos con material PAS diastasa positivo y colestasis hepatocanalicular, en casos moderados y graves (figura 6).
Hepatitis por virus no hepatotrópicos
- Citomegalovirus (CMV)
Ocurre en pacientes inmunosuprimidos. Se presenta con inflamación portal y lobulillar con linfocitos y neutrófilos, microabscesos de polimorfonucleares neutrófilos localizados en el lobulillo, inclusiones virales de CMV y no hay distribución zonal.
- Herpes simple
Semejante a la hepatitis por CMV, es rara y se observa en pacientes inmunosuprimidos. Produce inflamación y necrosis dispersa en parches en el lobulillo e inclusiones virales o nucleares amfofílicas o eosinofílicas con anillo periférico por marginación cromatínica.
- Adenovirus
Infección rara, usualmente mortal y en pacientes inmunosuprimidos, semejante al herpes virus. Presenta grandes áreas de compromiso parenquimatoso con necrosis sin distribución zonal, inflamación linfocítica en los extremos de las zonas de necrosis y presencia de inclusiones del adenovirus.
Celularidad sinusoidal
Un aumento de las células a nivel del espacio sinusoidal, puede ser un hallazgo sutil, requiriendo análisis con gran aumento; si es muy notoria la celularidad a nivel sinusoidal, se debe pensar en una infección grave o neoplasias.
Se enumeran las condiciones que con más frecuencia producen aumento de la celularidad sinusoidal:
- Enfermedad celiaca
Compromiso hepático hasta en 30% de los pacientes al momento del diagnóstico. Amplio espectro de hallazgos desde una apariencia normal, hepatitis lobulillar, cambios sugestivos de enfermedad autoinmune, como hepatitis autoinmune, cirrosis biliar o colangitis esclerosante primaria asociados o no con fibrosis (19). Presenta células inflamatorias linfoides sinusoidales, escasas células apoptóticas dispersas, leve inflamación portal de linfocitos, cambio graso e hiperplasia nodular regenerativa.
- Hepatitis por virus del Epstein-Barr
En pacientes inmunosuprimidos es más frecuente, pero también puede presentarse en individuos jóvenes aparentemente sanos (20, 21). Presenta numerosas células inflamatorias linfoides sinusoidales, simulando un síndrome parecido a la mononucleosis o patrón predominantemente lobulillar, así como pequeños granulomas epitelioides con anillo de fibrina, ausencia de células apoptóticas o muy ocasionales y dispersas, leve inflamación portal de linfocitos e hibridación localizada (EBER) positiva.
- Linfoma y leucemia
La mayoría son de compromiso secundario. Presentan células linfoides atípicas sinusoidales y/o portal. Es indispensable realizar estudios de inmunohistoquímica y/o citometría de flujo para establecer el fenotipo.
- Hematopoyesis extramedular (HEM)
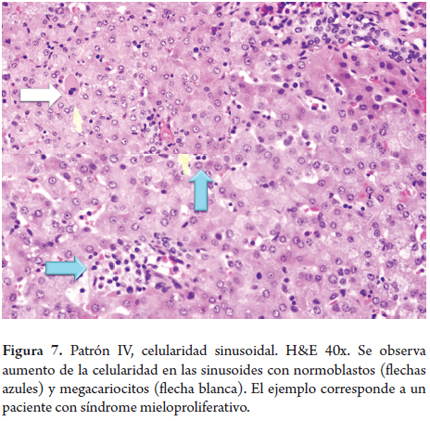
Es un mecanismo compensatorio por el cual se producen células sanguíneas fuera de la médula ósea cuando la producción de médula ósea es incapaz de mantener las necesidades del organismo. La HEM puede observarse en una variedad de trastornos hematológicos, como enfermedades mieloproliferativas, anemia crónica en neonatos y niños con hepatitis gigantocelular o con otras patologías (22, 23). Presenta normoblastos y megacariocitos, evidencia de mielopoyesis y eritropoyesis, en el espacio sinusoidal (figura 7).
- Hipervitaminosis A o lipidosis de células esteladas
En el hígado normal, la vitamina A se almacena en células estrelladas hepáticas, que se activan y adquieren un fenotipo similar a los miofibroblastos, lo que produce matriz extracelular; por lo cual, la toxicidad o hipervitaminosis puede ser grave e incluso llegar a cirrosis (24, 25).
Presenta prominencia de células esteladas en sinusoides en espacio de Dissé, células de núcleos oscuros en forma de media luna por expansión de vacuolas lipídicas dando la imagen de cielo estrellado y proliferación de miofibroblastos, con fibrosis subsinusoidal.
Pigmentos intracelulares
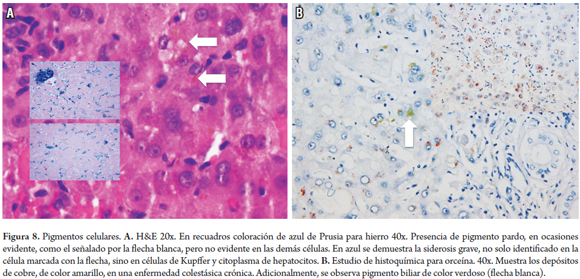
Presencia en células hepáticas, más frecuente en el citoplasma de los hepatocitos, de agregados granulares finos o gruesos que adquieren una coloración variable y que pueden requerir estudios especiales de histoquímica para determinar su etiología. Los más frecuentes corresponden a depósitos de lipofuscina, hierro, cobre o bilis (figura 8).
- Lipofuscina
Es un constituyente normal del hígado adulto, especialmente por envejecimiento (entre la quinta y sexta décadas de la vida), se deposita también en enfermedades hepáticas crónicas como VHC o cirrosis biliar primaria (7). Presenta un aumento del depósito de pigmento granular color oro o café. Se distribuye en las zonas 3 perivenular y 2, o midzonal. En citoplasma de hepatocitos, ocurre cerca de los canalículos biliares o pericanalicular.
- Siderosis o depósito de hierro
Se observa en condiciones primarias, como la hemocromatosis hereditarias y no hereditarias, como siderosis por transfusiones, hemodiálisis, dieta por aumento de la ingesta de hierro; y enfermedades hepáticas, como la esteatohepatitis alcohólica y no alcohólica y la hepatitis C (7, 26). Tiene un depósito de pigmento granular color oro o café, refráctil, de distribución periportal. En la hemocromatosis hereditaria se identifican además en todo el lobulillo. Localizado en el hepatocito a nivel pericanalicular, en formas hereditarias también se deposita en las células de Kupffer, endotelios, células del estroma y del epitelio del conducto. En las siderosis por transfusiones o dieta se localiza en las células de Kupffer. Reactividad con estudio de histoquímica de azul de Prusia.
- Cobre y/o proteína fijadora
Se refleja en enfermedades colestásicas crónicas por interferencia con la excreción o en condiciones hereditarias por defectos en la excreción, como la enfermedad de Wilson (7, 27). Tiene depósitos de pigmento grisáceo en el citoplasma. El cobre se muestra con gránulos de color amarillo ladrillo con los estudios de histoquímica de rodamina, orceína o azul Victoria, o en forma indirecta con depósito de su proteína fijadora con la tinción de aldehído fuscina. Frecuentemente, son PAS diastasa (+). En las enfermedades colestásicas crónicas, se localizan en la zona periportal o en la interfase.
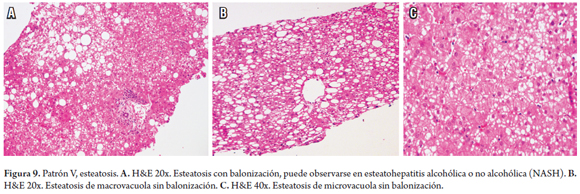
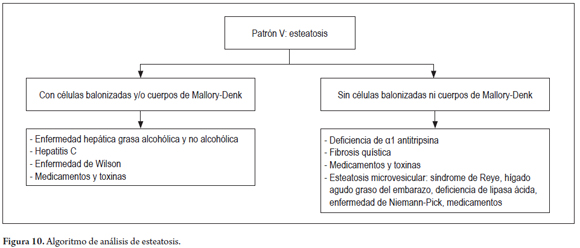
PATRÓN V: ESTEATOSIS
La esteatosis es la acumulación de grasa, hallazgo comúnmente observado en las biopsias. Un algoritmo útil para orientar el diagnóstico, es observar la presencia o no de células balonizadas y cuerpos de Mallory-Denk (figura 9). Este tema se trató extensamente en un artículo anterior (28).
En la figura 10 se presenta el algoritmo utilizado para este patrón.
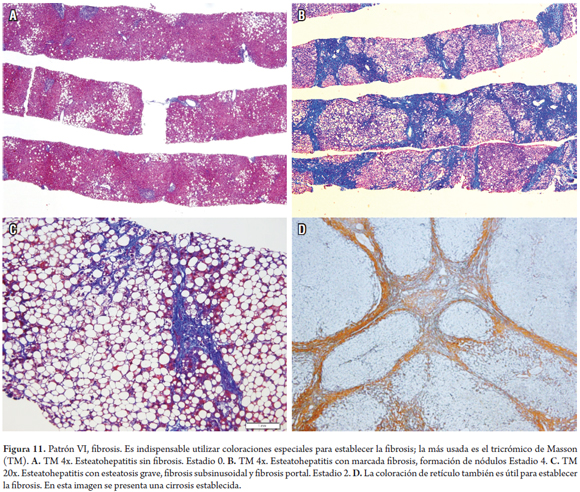
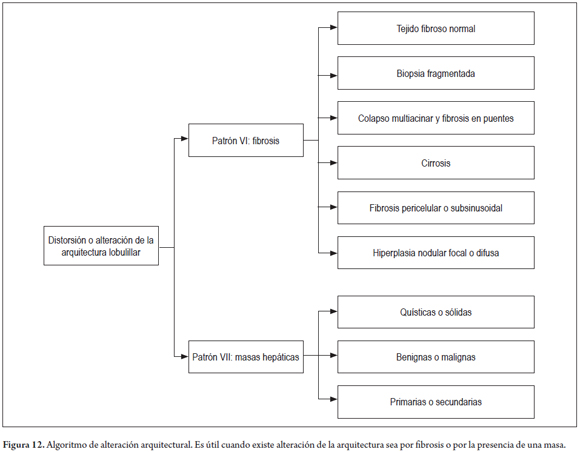
PATRÓN VI: FIBROSIS
La fibrosis es el resultado final de la gran mayoría de las enfermedades hepáticas, no es un patrón de lesión temprana. Determinar el estadio, la cantidad y el tipo de fibrosis es un componente muy importante e indispensable en el análisis de una biopsia. Siempre debe evaluarse utilizando estudios de histoquímica como el tricrómico de Masson, que es el más usado, o con menos frecuencia el rojo Sirius. El patrón de la fibrosis otorga las claves para el diagnóstico y la subclasificación, ayuda a establecer la gravedad de la enfermedad y se correlaciona directamente con la gravedad de la hipertensión portal (figura 11) (7, 29).
La figura 12 muestra el algoritmo utilizado cuando encontramos alteración de la arquitectura lobulillar.
Frecuentemente, las biopsias subcapsulares hacen que se sobreestime la fibrosis en una biopsia. Se considera normal un espesor de hasta 5 mm en la cápsula, observándose mayor cantidad de tejido fibroso en los espacios porta y alrededor de las venas centrales, inclusive la presencia de algunos tabiques fibrosos. Adicionalmente, la cantidad de tejido fibroso también depende del tamaño de los espacios porta y está directamente en proporción al tamaño de las estructuras de la triada portal. Asimismo, los cortes longitudinales que atraviesan la longitud de la biopsia hacen pensar que se trata de tabiques fibrosos o puentes que en realidad no existen.
La fragmentación de las biopsias hepáticas percutáneas es común y aumenta con la progresión de la fibrosis de temprana a avanzada. Los especímenes con importante fibrosis o con cirrosis, se fragmentan más a menudo y de forma más extensa. No siempre es fácil identificar esta posibilidad si no se cuenta con los bordes fibrosos. Una apariencia redondeada, la arquitectura lobulillar alterada (ausencia de vena central o de estructuras de la triada portal) o la trama reticular fragmentada, ayudan a sugerir que se trata de una posible cirrosis, a pesar de no observarse la formación de verdaderos nódulos (30).
Especialmente cuando existe una hepatitis aguda con necrosis del parénquima reciente, hay depósito de colágeno joven (azul claro, con el tricrómico de Masson) que se puede sobreinterpretar y llevar a errores de diagnóstico. El colapso de la trama reticular, ayuda a establecer la verdadera naturaleza de la lesión. Determinar si la fibrosis corresponde al depósito de colágeno maduro, con pérdida de la trama reticular y presencia de proliferación colangiolar en zonas de necrosis y parénquima con ausencia de sus normales estructuras, indica que realmente se trata de fibrosis en puentes con tabiques incompletos o completos (cirrosis).
La fibrosis pericelular o subsinusoidal se observa característicamente en la zona 3 en la esteatohepatitis no alcohólica y alcohólica; en esta última puede progresar, ocluyendo la vena central. También se presenta en enfermedades que causan obstrucción al flujo venoso en forma crónica, como la enfermedad venooclusiva sinusoidal y el síndrome de Budd Chiari; en enfermedades metabólicas, como la enfermedad de Wilson, tirosinemia, galactosemia, entre otras; y en enfermedades infecciosas, como leishmaniosis o sífilis congénita. La fibrosis centrada en el espacio porta ocurre en la enfermedad hepática crónica de cualquier etiología, especialmente hepatitis virales B, C y autoinmune. Inicia en forma irregular en el espacio porta, con extensión periportal, posteriormente desarrolla tabiques porta-porta y, finalmente, portacentrales, hasta conformar nódulos cirróticos regenerativos. El término de cirrosis incompleta o temprana se utiliza cuando la nodularidad no es completa (29).
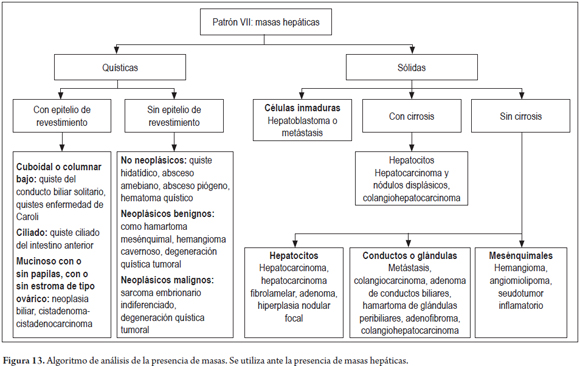
PATRÓN VII: MASAS
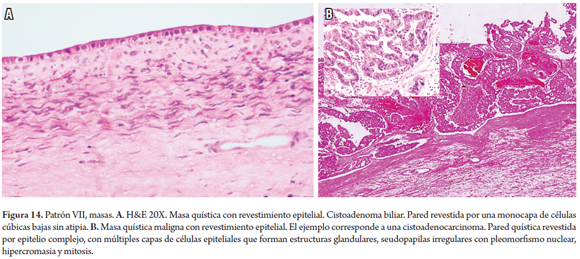
El algoritmo utilizado para el estudio de las masas (figura 13), consiste en determinar si se trata de una masa quística o sólida, observar el tipo de revestimiento epitelial o la célula de origen de la proliferación tumoral (figura 14). Estudios adicionales de histoquímica e inmunohistoquímica pueden ser de utilidad. Adicionalmente, se debe establecer si se trata de una masa primaria o secundaria donde la correlación clínica y de imágenes es fundamental (30, 31).
CONCLUSIÓN
La patología hepática es extensa y compleja; cuando se debe hacer frente al estudio de una biopsia hepática y se analizan los hallazgos morfológicos, resulta de mucha ayuda apoyarse en algoritmos que, de una manera más simple, permite una aproximación al diagnóstico; sin embargo, solo una adecuada correlación entre la histopatología y la historia clínica completa puede lograr óptimos resultados.
REFERENCIAS
1. Villar LM, Medina Cruz H, Ribeiro Barbosa J, et al. Update on hepatitis B and C virus diagnosis. World J Virol. 12 de noviembre 2015;4(4):323-42. [ Links ]
2. Chalasani NP, Hayashi PH, Bonkovsky HL, et al. ACG clinical guideline: the diagnosis and management of idiosyncratic drug-induced liver injury. Am J Gastroenterol. Julio 2014;109(7):950-66. [ Links ]
3. De Boer YS, van Nieuwkerk CMJ, Witte BI, et al. Assessment of the histopathological key features in autoinmune hepatitis. Histopathology. 2015;66:351-62. [ Links ]
4. Manns MP, Lohse AW, Vergani D. Autoimmune hepatitis-Update 2015. Journal of hepatology. 2015;62(1):S100-11. [ Links ]
5. Beuers U, Gershwin ME, Gish RG, et al. Changing nomenclature for PBC: from cirrhosis to cholangitis. Clin Gastroenterol Hepatol. Noviembre 2015;13(11):1867-9. [ Links ]
6. Putra J, Toor A, Suriawinata AA. The utility of repeat liver biopsy in autoimmune hepatitis: a series of 20 consecutive cases. Pathology. Agosto 2016;48(5):449-53. [ Links ]
7. Lefkowitch JH. Scheuer´s liver biopsy interpretation. 9a edición. Philadelphia: Elsevier. 2015. [ Links ]
8. Kleiner DE, Chalasani NP, Lee WM, et al. Drug-induced liver injury network (DILIN) Hepatic histological findings in suspected drug-induced liver injury: systematic evaluation and clinical associations. Hepatology. Febrero 2014;59(2):661-70. [ Links ]
9. Turhan N, Kurt M, Ozin Ozderin Y, et al. Hepatic granulomas: a clinicopathologic analysis of 86 cases. Pathology Research and Practice. 2011;207(6);59-365. [ Links ]
10. Coash M, Forouhar F, Wu CH, et al. Granulomatous liver diseases: a review. Journal of the Formosan Medical Association. Enero 2012;111(1):3-13. [ Links ]
11. Suzuki Y, Katagiri H, Wang T, et al. Ductular reactions in the liver regeneration process with local inflammation after physical partial hepatectomy. Lab Invest. Noviembre 2016;96(11):1211-22. [ Links ]
12. Gouw AS, Clouston AD, Theise ND. Ductular reactions in human liver: diversity at the interface. Hepatology. Noviembre 2011;54(5):1853-63. [ Links ]
13. Li H, Xia Q, Zeng B, et al. Submassive hepatic necrosis distinguishes HBV-associated acute on chronic liver failure from cirrhotic patients with acute decompensation. J Hepatol. Julio 2015;63(1):50-9. [ Links ]
14. Lefkowitch JH. Bile ductular cholestasis: an ominous histopathologic sign related to sepsis and "cholangitis lenta". Hum Pathol. Enero 1982;13(1):19-24. [ Links ]
15. Kirsch R, Yap J, Roberts EA, et al. Clinicopathologic spectrum of massive and submassive hepatic necrosis in infants and children. Hum Pathol. Abril 2009;40(4):516-26. [ Links ]
16. Wang WH, Wang HL. Fulminant adenovirus hepatitis following bone marrow transplantation. A case report and brief review of the literature. Arch Pathol Lab Med. Mayo 2003;127(5):e246-8. [ Links ]
17. Adams DH, Hubscher SG. Systemic viral infections and collateral damage in the liver. Am J Pathol. Abril 2006;168(4):1057-9. [ Links ]
18. Buyse S, Roque-Afonso AM, Vaghefi P, et al. Acute hepatitis with periportal confluent necrosis associated with human herpes virus 6 infection in liver transplant patients. Am J Clin Pathol. Septiembre 2013;140(3):403-9. [ Links ]
19. Marciano F, Savoia M, Vajro P. Celiac disease-related hepatic injury: insights into associated conditions and underlying pathomechanisms. Dig Liver Dis. Febrero 2016;48(2):112-9. [ Links ]
20. Khoo A. Acute cholestatic hepatitis induced by Epstein-Barr virus infection in an adult: a case report. J Med Case Rep. Marzo 2016;10:75. [ Links ]
21. Kinch A, Baecklund E, Backlin C, et al. A population-based study of 135 lymphomas after solid organ transplantation: the role of Epstein-Barr virus, hepatitis C and diffuse large B-cell lymphoma subtype in clinical presentation and survival. Acta Oncol. Mayo 2014;53(5):669-79. [ Links ]
22. OMalley DP. Benign extramedullary myeloid proliferations. Modern Pathology. 2007;20:405-15. [ Links ]
23. Mohyuddin GR, Yacoub A. Primary myelofibrosis presenting as extramedullary hematopoiesis in a transplanted liver graft. Case report and review of the literature. Case Rep Hematol. 2016;2016:9515404. [ Links ]
24. Nollevaux MC, Guiot Y, Horsmans Y, et al. Hypervitaminosis A-induced liver fibrosis: stellate cell activation and daily dose consumption. Liver Int. Marzo 2006;26(2):182-6. [ Links ]
25. Levine PH, Delgado Y, Theise ND, et al. Stellate-cell lipidosis in liver biopsy specimens. Recognition and significance. Am J Clin Pathol. Febrero 2003;119(2):254-8. [ Links ]
26. Alwahaibi NY, Alkhatri AS, Kumar J. Hematoxylin and eosin stain shows a high sensitivity but sub-optimal specificity in demonstrating iron pigment in liver biopsies. Int J Appl Basic Med Res. 2015;5(3):169-71. [ Links ]
27. Karadag N. Tolan K, Samdanci E, et al. Effect of copper staining in Wilson disease: a liver explant study. Exp Clin Transplant. Octubre 2016. [ Links ]
28. López Panqueva RP. Enfermedad hepática grasa. Aspectos patológicos. Rev Col Gastroenterol. 2014;29(1):82-8. [ Links ]
29. Kim NY, Cho MY, Bail SK, et al. Histological subclassification of cirrhosis using the Laennec fibrosis scoring system correlates with clinical stage and grade of portal hypertension. J Hepatol. Noviembre 2011;55(5):1004-9. [ Links ]
30. Malik AH, Kumar KS, Malet PF, et al. Correlation of percutaneous liver biopsy fragmentation with the degree of fibrosis. Aliment Pharmacol Ther. Marzo 2004;19(5):545-9. [ Links ]
31. Bosman FT, Carneiro F, Hruban RH, et al. WHO classification of tumors of the digestive tract. 4a edición. Lyon: IARC. 2010. [ Links ]











 text in
text in