Introducción
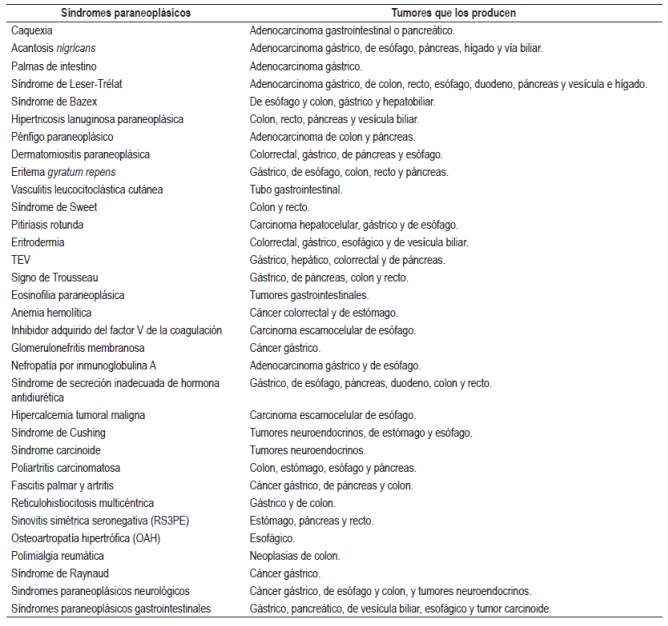
Los síndromes paraneoplásicos (SPN) son un grupo heterogéneo de manifestaciones clínicas que se producen cuando un tumor provoca un daño en un órgano o sistema distante y que no están relacionadas físicamente con el tumor o sus metástasis 1. Esas alteraciones son independientes del efecto local del tumor, la invasión a otros órganos, los déficits nutricionales y las consecuencias derivadas del tratamiento antineoplásico (1, 2). La gran variedad de manifestaciones clínicas es secundaria a la liberación de sustancias por parte de las células neoplásicas malignas 2 que liberan hormonas, péptidos similares a hormonas, factores de crecimiento y citoquinas 1,2,3. Adicionalmente, también participan respuestas inmunitarias que, inicialmente, estaban dirigidas contra las nuevas sustancias o antígenos tumorales (oncoantígenos) y que, por reacción cruzada, terminan lesionando tejidos normales 3,4 y, finalmente, acumulando complejos inmunes 5. Los diferentes SPN se dividen según el órgano o sistema al que afecten y, clásicamente, se clasifican en endocrinometabólicos, dermatológicos, hematológicos, reumatológicos y neurológicos 3. En la presente revisión, se describen los SPN producidos por tumores gastrointestinales (GI).
Caquexia asociada con cáncer (cac)
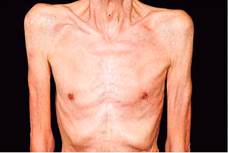
Este es el SPN más frecuente y más conocido, que produce aumento de la morbimortalidad 6,7 y consiste en la pérdida progresiva de masa muscular esquelética, con o sin pérdida de tejido adiposo 6,7. El principal criterio para el diagnóstico es la pérdida involuntaria de peso, superior al 5% del peso usual, en los últimos 6 meses 7 (Figura 1). Se presenta en el 50% de todos los pacientes con cáncer 6,8 y aumenta de manera progresiva conforme avanza la enfermedad 6,9. En las últimas dos semanas de vida, se encuentra en más del 86% de los pacientes con cáncer 6. Es más frecuente en pacientes con adenocarcinoma gastrointestinal o pancreático (7, 10) y, en esos dos tipos de tumores, su incidencia es del 87% al 90% 7,10. Per se, produce la muerte en el 20% de los casos 6,8,9,10. Su patogénesis es multifactorial, y las citoquinas inflamatorias inducidas o producidas por el tumor (tumorkines) desempeñan un papel fundamental 7. Entre esas citoquinas, se destacan el factor de necrosis tumoral alfa (TNF-α), la IL-1, la IL-6 y el interferón 6,7,8. Estas sustancias producen inflamación sistémica 6,7,8,9,10, anorexia 6,9,8,10,11,12, aumento del tejido adiposo pardo 9 y alteración del metabolismo de lípidos, proteínas y carbohidratos 8. Adicionalmente, producen un incremento del gasto energético 6. También se han encontrado otros mediadores, como la UCP3 (uncoupling protein) muscular, en humanos, y la IL-6, en modelos animales 6,10.
Síndromes paraneoplásicos dermatológicos
Representan el segundo tipo de síndrome paraneoplásico más frecuente después de los endocrinos 13. En los tumores GI, actúan como marcadores de dichos tumores y, en muchos casos, permiten detectar oportunamente esas neoplasias 14. Para configurar el síndrome, se deben cumplir los criterios de Curth: ausencia de infiltración directa de células malignas, inicio simultáneo y curso paralelo con el tumor y exclusión de síndromes genéticos 13,15. Las alteraciones dermatológicas más importantes son las siguientes:
Acantosis nigricans (AN)
Consiste en la aparición de placas aterciopeladas con zonas hiperpigmentadas de relieve, simétricas, localizadas en sitios intertriginosos, como axilas, cuello y región anogenital, submamaria o mamilar 14,15,16 (Figura 2). En algunos casos, se presentan proyecciones cutáneas pediculadas, llamadas acrocordones, y lesiones papilomatosas hipopigmentadas en las mucosas 17. En el 35% al 50% de los casos, se encuentra compromiso de la mucosa oral 1,18, aunque también puede comprometer otras mucosas 14,15 y, en el 41% de los casos, se asocia con prurito 19.

Figura 2 Acantosis nigricans. Tomado de: http://www.sanar.org/cuidado-de-la-piel/acantosis-nigricans
Su prevalencia es del 7% al 74% según la población 16. Esta alteración se clasifica en benigna, asociada con obesidad, sindrómica, maligna, acral, unilateral, inducida por medicamentos y mixta 16,17. La forma maligna corresponde al 20% de los casos 20 y se presenta en 2 de cada 12 000 pacientes con cáncer 21. A diferencia de la forma benigna, aparece generalmente en mayores de 40 años 13, sin asociación familiar 17, se inicia de manera espontánea, es extensa y progresa rápidamente (14, 15). Además, sigue un curso paralelo y es un indicador de recurrencia 17.
El 90% de los casos de AN maligna se asocian con neoplasias abdominales, que son gastrointestinales en el 70% al 90 % de los pacientes 13,22. El adenocarcinoma gástrico es el más frecuente, con una participación del 55%-61% 1,13,22, y del 73% en China 23. Las otras neoplasias que también se asocian con esa alteración son las del esófago, el páncreas, el hígado y la vía biliar 13. La alteración se detecta simultáneamente con el tumor en el 30% y el 60% de los casos, pero puede encontrarse antes de la neoplasia en el 17% y el 33% de los casos 16,22. Por lo anterior, la detección de esta lesión amerita una profunda investigación, y más aún en pacientes mayores de 40 años con otro signo paraneoplásico, como la palma de intestino (Figura 3) y el signo de Leser-Trélat (Figura 4), sin una patología benigna que la pueda explicar, como la obesidad y otras endocrinopatías 13,14,16,22.

Figura 3 Palmas de intestino. Tomado de: http://www.handresearch.com/news/hands-on-cancer-hand-palm-cancers.htm
La acantosis nigricans, la queratodermia palmoplantar -conocida también como “palmas de terciopelo o intestino” (tripe palms) y el signo de Leser-Trélat se han relacionado frecuentemente y, aunque su etiología se desconoce, se considera que tienen el mismo mecanismo fisiopatológico, como es la producción de factores de crecimiento por parte del tumor que interactúan con el factor de crecimiento epidérmico (EGF) o su receptor 13,14,15,22. La palma de intestino consiste en un engrosamiento epidérmico rugoso en las palmas, con dermatoglifos prominentes (paquidermatoglifia) 15. Se asocia con malignidad en el 90% de los casos, y el tumor más frecuente es el adenocarcinoma gástrico 16. Puede tener inicio simultaneo (80%), preceder (12%) o aparecer después del desarrollo del tumor (8%) 23.
El signo de Leser-Trélat es la aparición súbita o el aumento del tamaño o el número de múltiples queratosis seborreicas 24. Cuando se asocia con malignidad, se conoce como síndrome de Leser-Trélat24. Sin embargo, en las personas de edad avanzada, es un hallazgo frecuente y, por lo tanto, en ellos la asociación con tumores es controvertida 15. Además, los tumores gastrointestinales también aumentan con la edad y podrían ser alteraciones independientes que coinciden en esos grupos etáreos 15. En las personas jóvenes, no se discute que tengan asociación causal y que sea un verdadero síndrome paraneoplásico 13. El tumor más frecuente es el adenocarcinoma gástrico (45%) 25. Otros tumores asociados son los de colon y recto 13. Es inusual en los tumores de esófago, duodeno, páncreas, vesícula e hígado, así como también en otras neoplasias extradigestivas, como las de pulmón, próstata, vejiga, riñón, ovario, melanoma y neoplasias linfoproliferativas 13,14. Cuando está presente, el tumor tiene un peor pronóstico 15. En el 26% al 51% de los pacientes con este síndrome, hay prurito 19,26.
Acroqueratosis paraneoplásica o síndrome de Bazex (Figura 5)
Es una rara dermatosis psoriasiforme acral simétrica en la que las lesiones son violáceas y descamativas, con bordes definidos que comprometen la superficie nasal y malar, las manos, los pies, las orejas 1,13,15,27 y la región ungueal (paroniquia, onicorrexis y onicolisis) 17. Se diferencia de la psoriasis en que las localizaciones de las lesiones son diferentes 17. El síndrome de Bazex se divide en 3 estadios clínicos: en el primero, la neoplasia es asintomática, y las lesiones solo afectan las regiones más distales; en el segundo, la neoplasia tiene síntomas locales, y las lesiones se prolongan; y, en el tercero, se presenta en neoplasias avanzadas en las que las lesiones pueden comprometer el tronco 17. Se asocia con malignidad en todos los casos descritos 27. En el 80% de los casos, los tumores subyacentes son carcinomas escamocelulares del tubo aéreodigestivo superior y pulmonar 1,13,15,27, con la siguiente distribución: orofaringe y laringe (48%), pulmón (17%), esófago (10%) y localización desconocida (16%) 13,14. Además, se ha relacionado con otros tumores, como adenocarcinoma gástrico, cáncer de colon y cáncer hepatobiliar 14. Es más frecuente en hombres mayores de 40 años 14 y, ocasionalmente, cursa con prurito (18%) 28. Aunque se relaciona con mal pronóstico 27, se ha encontrado que puede preceder al tumor en el 65% de los casos, con una mediana de un año 13,29,30. Con el tratamiento del tumor, esta lesión mejora en el 90%-95% de los casos y puede reaparecer si el tumor recurre; en ese caso, es un marcador de recidiva maligna 15.

Figura 5 Acroqueratosis paraneoplásica o síndrome de Bazex. Tomado de: http://apps.elsevier.es/watermark/ctl_servlet?_f=10&pident_articulo=13136503&pident_usuario=0&pcontactid=&pident_revista=103&ty=112&accion=L&origen=zonadelectura&web=www.elsevier.es&lan=es&fichero=103v100n04a13136503pdf001.pdf
Hipertricosis lanuginosa paraneoplásica
Consiste en la aparición de vello fino y largo no pigmentado, de rápido desarrollo y de predominio en rostro 13 (Figura 6). Se considera que es secundario a citoquinas o a factores de crecimiento secretados por el tumor, los cuales estimulan los folículos pilosos 13,14, y es más frecuente en las mujeres 14. El principal tumor digestivo subyacente es el de colon y recto, superado solo por el carcinoma pulmonar 31,32. Precede el diagnóstico hasta en dos años y medio 13. Cuando se hace el diagnóstico, usualmente el tumor ya es metastásico, por lo cual se considera un síndrome que indica un pronóstico pobre 14. Puede coexistir con AN maligna 14 y con CAC 13. Otros tumores que la originan son el cáncer de páncreas, de vesícula biliar y de mama 13,32.
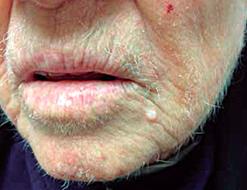
Figura 6 Hipertricosis lanuginosa paraneoplásica. Tomado de: http://www.medigraphic.com/pdfs/cosmetica/dcm-2015/dcm153f.pdf
Pénfigo paraneoplásico (Figura 7)
Es una enfermedad ampollosa acantolítica mucocutánea 15. La forma paraneoplásica compromete principalmente las mucosas y afecta los ojos, con conjuntivitis pseudomembranosa, en el 70% de los casos 18. Involucra tronco, miembros, palmas, plantas, mucosa oral, esófago y genitales 14,15. Se cree que es el resultado de un mecanismo de reacción cruzada de anticuerpos contra desmosomas y hemidesmosomas 33. En un tercio de los pacientes, no hay una neoplasia conocida 33, y la mayoría ocurre en casos de malignidad hematológica (84%). Sin embargo, en el 10%, se asocia con adenocarcinoma de colon y páncreas 15,18.

Figura 7 Pénfigo paraneoplásico. Tomado de: http://actasdermo.org/es/pnfigo-paraneoplsico-sndrome-multiorgnico-autoinmune-paraneoplsico-/articulo/S0001731010003339/
Dermatomiositis paraneoplásica
Es similar a la dermatomiositis (DMM) clásica, una miopatía inflamatoria idiopática, con incidencia de 5 a 10 casos por cada 100 000 habitantes 34. Cuando aparece en personas mayores de 40 años, se asocia con neoplasias malignas, incluidas las gastrointestinales, en el 15%-40% de los casos 15,35. Clínicamente, hay debilidad muscular proximal, rash en heliotropo periorbital, pápulas de Gottron localizadas en nudillos y articulaciones interfalángicas de coloración eritematosa a violácea, y signo de chal o capelina, representado por áreas violáceas con telangiectacias -llamadas “poiquilodermia”- en zonas de exposición solar, además de hiperqueratosis en palmas 14,17. Asimismo, pueden encontrarse alteraciones en las uñas, como engrosamiento de la cutícula, telangiectacias en pliegues ungeales 17 y disfagia en el 10%-20% de los pacientes 34. Los criterios diagnósticos incluyen alteraciones cutáneas, musculares, de la electromiografía, de la biopsia muscular y de las enzimas musculares 17. En la Figura 8, se observa una paciente con eritema violáceo simétrico en los párpados superiores, conocido como rash en heliotropo, además de eritema facial y signo de chal o capelina, representado por eritema violáceo en la región superior del tórax y los brazos.

Figura 8 Dermatomiositis. Tomado de: http://www.elrincon-delamedicinainterna.com/2010/11/exacerbacion-cutanea-de-dermatomiositis.html
Considerando su fuerte asociación con patologías tumorales, se ha recomendado que los pacientes que la presenten sean investigados exhaustivamente en busca de tumores durante los próximos tres a cinco años después de su diagnóstico 36. Los tumores más frecuentes son el adenocarcinoma colorrectal (5%) y el de pulmón (15%) 14. En Japón, el cáncer gástrico se encuentra hasta en el 25% de los pacientes 14. Otras neoplasias asociadas son los tumores de páncreas 37, de mama, de ovario, de nasofaringe, el linfoma no hodgkiniano 15,38,39 y, muy rara vez, de esófago (solo dos casos) 40,41. Los factores predictivos de neoplasias malignas son los siguientes: edad mayor de 50 años, género masculino, úlceras, necrosis cutáneas, disfagia, aumento de la velocidad de sedimentación glomerular (VSG) o de la proteína C reactiva (PCR) 14, anticuerpos anti-155/140 42 y elevación de la creatinfosfoquinasa sérica, 14 la cual tiene la mayor especificidad 17.
Como usualmente los autoanticuerpos característicos contra Jo-1, Mi-2 o SRP 14,39 están presentes en la DMM que no cursa con neoplasias malignas, su ausencia predice una malignidad oculta 15.
Eritema gyratum repens
Es una alteración que consiste en franjas eritematosas con bordes descamativos, serpiginosas, pruriginosas y simétricas que forman anillos concéntricos 13,25 con un patrón de olas o ciprés 17 (Figura 9). Es de rápido crecimiento ( ̴1 cm al día), y el diagnóstico se realiza cuando las lesiones se asocian con eosinofilia 17. En el 80% de los pacientes, hay tumores malignos, por lo cual es de gran importancia, en todos los casos, investigar una neoplasia; las más frecuentes son las de pulmón (32%), seguidas por el cáncer de esófago (8%) y de mama (6%). También se ha observado en casos de cáncer de colon, estómago, recto y páncreas. En el 80% de los pacientes, esta lesión se encuentra 4 a 9 meses antes del diagnóstico del tumor 13,25.

Figura 9 Eritema gyratum repens. Tomado de: https://www.onlinedermclinic.com/archive/erythema-gyratum-repens
Vasculitis leucocitoclástica cutánea
Es la vasculitis que más se ha asociado con neoplasias 1 y que se genera por infiltración de los pequeños vasos sanguíneos, por acumulación de complejos inmunes contra el tumor o de reacción cruzada 1,3. También se la conoce como “vasculitis alérgica”. Clínicamente, hay púpura palpable o pápulas de color vino rojo, que evolucionan a color violáceo y dejan, finalmente, hiperpigmentación (Figura 10). Se asocian con dolor y prurito y se localizan predominantemente en miembros inferiores 1. Aunque la biopsia de piel es el estándar de oro, se debe evaluar la historia clínica y los paraclínicos 17, y solamente buscar los tumores más frecuentes según la edad del paciente 3. Los tumores malignos más frecuentes son las neoplasias hematológicas y los carcinomas de órganos urinarios, tubo gastrointestinal y pulmonar (20%-26%) 1,3.
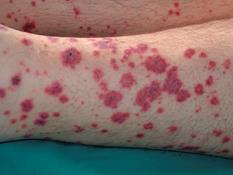
Figura 10 Vasculitis leucocitoclástica cutánea. Tomado de: http://www.actasdermo.org/es/alertas-cutaneas-malignidades-sistemicas-parte/articulo/S000173101200186X/
Síndrome de Sweet
Es una dermatosis reactiva neutrofílica febril aguda y rara que se manifiesta con la aparición súbita de placas o nódulos dolorosos eritematosos brillantes, en ocasiones en forma de pápulas, pústulas o vesículas localizadas en el rostro, el cuello o los miembros superiores 13 (Figura 11). La forma paraneoplásica es más grave y puede afectar el tronco y los miembros inferiores 18. Se presenta con fiebre o febrícula, artralgia migratoria de grandes articulaciones, leucocitosis, neutrofilia y VSG elevada 18, que mejora con corticoides sistémicos 17. La mayoría de las causas son benignas y entre ellas se encuentran las enfermedades autoinmunitarias, las infecciones y los medicamentos 17. Sin embargo, en el 10%-20% de los casos, se asocia con neoplasias hematológicas, aunque también se ha encontrado en tumores de testículo, colon, recto, pulmón, ovario y próstata 18.

Figura 11 Síndrome de Sweet. Tomado de: http://www.elrincondelamedicinainterna.com/2013/03/dermatosis-neutrofilicas.html
Pitiriasis rotunda
Es una enfermedad rara, caracterizada por múltiples placas escamosas en el tronco, de aspecto circular, bien definidas, asintomáticas, sin cambios inflamatorios y que pueden ser hiper o hipopigmentadas 13 (Figura 12). Aparece en personas de 25 a 45 años 43 y se asocia con enfermedades crónicas como malnutrición; infecciones, como tuberculosis; y neoplasias, que incluyen carcinoma hepatocelular, gástrico, de esófago, de próstata, leucemia linfocítica crónica y mieloma múltiple 13.
Eritrodermia
Es una erupción cutánea eritematosa que afecta más del 70% de la superficie corporal 17, con alteración del flujo sanguíneo, alteraciones hemodinámicas y pérdida de proteínas y otros componentes 17. Esta dermatosis reactiva es causada por afecciones previas de la piel, medicamentos, idiopatías y neoplasias 17. Las neoplasias asociadas son leucemia, linfoma y tumores gastrointestinales, como cáncer colorrectal, gástrico, esofágico y de vesícula biliar 3. Un caso típico de eritrodermia se muestra en la Figura 13.
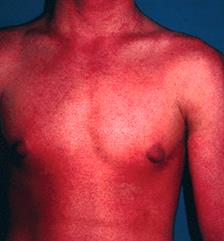
Figura 13 Eritrodermia. Tomado de: http://www.actasdermo.org/es/eritroqueratodermia-simetrica-progresiva-generalizada/articulo/13014775/
Síndromes paraneoplásicos hematológicos
Las complicaciones trombóticas y hemorrágicas constituyen la segunda causa de mortalidad en los pacientes con cáncer 44. El cáncer produce un estado de hipercoagulabilidad 45, por lo que las personas que lo padecen tienen el doble de riesgo de presentar tromboembolismo venoso (TEV) durante su vida, en comparación con las personas sin neoplasias malignas 46. La patogénesis involucra la producción por parte del tumor de sustancias procoagulantes, tales como el factor procoagulante del cáncer y las citoquinas proinflamatorias 45,46. Los tumores más frecuentemente asociados son el carcinoma mucinoso del páncreas, así como también tumores pulmonares 45 y gastrointestinales, como el gástrico 45.
El 92% de los pacientes con cáncer gástrico presentan alteraciones hemostáticas en los análisis de laboratorio y, de estos, el 26,8% tienen manifestaciones clínicas de dichas alternaciones 44, especialmente en estadios avanzados y metastásicos 45. Sin embargo, hay una gran controversia respecto de si se debe buscar un tumor oculto en pacientes con un evento trombotico sin ningún factor de riesgo asociado, ya que, entre el 2,2% y el 12% de los pacientes son diagnosticados con un tumor oculto en los 2 años siguientes a un episodio de TEV 47.
Los tres diagnósticos más comunes de cáncer después de un TEV idiopático son cáncer de pulmón, hepático y colorrectal (18,3%, 12,3% y 10,9%, respectivamente) 46. En un estudio publicado hace más de 10 años, se encontró TEV en el 15% de los pacientes con cáncer y, entre ellos, la distribución de los tipos de cáncer fue la siguiente: páncreas 28%, pulmón 27%, gástrico 13% y de colon 3% 45.
En la actualidad, no se recomienda realizar una investigación exhaustiva de las alteraciones de la coagulación 47, aunque, al respecto, no hay estudios de rentabilidad 48. La sensibilidad en los primeros 2 años de la evaluación de rutina es del 89% (IC del 95%: 67% a 99%) 47, con una prevalencia de cero en personas menores de 40 años 45. Sin embargo, estos pacientes tienen peor pronóstico, y alrededor del 44% tiene metástasis 47,48. Los pacientes con TEV que más se benefician de la búsqueda del tumor son los que no tienen otros factores de riesgo de trombosis 47,48, los mayores de 40 años 45, con larga esperanza de vida y en los que el TEV sea recurrente, o bien que tengan TVP bilateral 47. Los exámenes más rentables son la TAC abdominopélvica y la mamografía, aunque, en el estudio SOMIT, la diferencia no fue estadísticamente significativa 49.
Signo de Trousseau o tromboflebitis migratoria
Es una alteración rara, que se presenta como trombosis venosa superficial migratoria, que afecta el tórax y los miembros superiores 45. Es una señal de advertencia de enfermedad maligna avanzada, en particular de los tumores pancreáticos y pulmonares 50. Se han reportado pocos casos de cáncer gástrico, de colon 50 y de recto 51.
Eosinofilia paraneoplásica
Esta alteración, en general, es asintomática 2,3. Las neoplasias más comúnmente asociadas son los linfomas y las leucemias, pero también puede verse en tumores de pulmón, gastrointestinales y ginecológicos 3.
Adicionalmente, en el cáncer colorrectal y de estómago, se han descrito otras alteraciones, como anemia hemolítica 52. En el carcinoma escamocelular de esófago, puede aparecer un inhibidor adquirido del factor V de la coagulación 53, y esta alteración puede ser asintomática o causar hemorragias potencialmente mortales 53, y se sospecha cuando existe un aumento excesivo de los tiempos de coagulación que no mejora al administrar plasma 53. En otros cánceres gastrointestinales, se ha encontrado leucocitosis 54,55, aunque se discute si realmente puede representar un síndrome paraneoplásico.
Síndromes paraneoplásicos renales
Se ha descrito que el síndrome nefrótico se puede encontrar en el 11%-22% de los pacientes con cáncer 5,56. Los más frecuentes son el cáncer gástrico -en el 25% de los casos-, el pulmonar -en el 15% de los casos- y el linfoma -en el 10% de los casos- 56. Entre todos los pacientes con cáncer, el 50% de los casos de síndrome nefrótico paraneoplásico se asocian con cáncer pulmonar y gastroinestinal 57,58. La principal lesión renal subyacente es la glomerulonefritis membranosa 57,58. La resección quirúrgica del tumor mejora en hasta el 78% de los pacientes, por lo que está indicada incluso si la condición del paciente es mala 56.
Otra patología de importancia es la nefropatía membranosa, la cual representa del 6%-22% de los casos de compromiso renal, y los tumores más frecuentemente asociados son los gastrointestinales, junto con los carcinomas de pulmón y el cáncer de próstata 5. La comprobación de su origen paraneoplásico exige los siguientes tres criterios: mejoría con la resección, recaída con la recurrencia y un vínculo fisiopatológico 5. Existen características que hacen que una neoplasia oculta sea más probable, como la ausencia de anticuerpos anti-PLA2R1, el predominio de depósitos de IgG1/IgG2 o la presencia de más de 8 células inflamatorias por glomérulo 5. Cuando hay proteinuria, el tumor es de mal pronóstico 59. Otras nefropatías descritas son la nefropatía por inmunoglobulina A en el adenocarcinoma gástrico y de esófago 60. En ese tumor, también se ha encontrado glomerulonefritis membranoproliferativa y, además, la de rápida progresión 61. En el cáncer de colon, se ha documentado la enfermedad con cambios mínimos 61.
Síndromes paraneoplásicos endocrinos
Son los síndromes paraneoplásicos más comunes 13, aunque son poco frecuentes en la mayoría de tumores gastrointestinales. Las entidades más frecuentes son las siguientes:
Síndrome de secreción inadecuada de hormona antidiurética (SIADH)
Se presenta como síndrome paraneoplásico entre el 1% y el 2% de los pacientes con cáncer. Las células malignas secretan hormona antidiurética (ADH) 3. Se caracteriza por hiponatremia (sodio plasmático menor de 135 mEq/L, osmolaridad sérica <275 mmol/L) y volemia normal 3,62. Generalmente, es asintomático o se presenta con síntomas leves, como náuseas, debilidad y cefalea, pero, en algunos casos, puede causar deterioro grave del estado de conciencia y convulsiones 3,63. Las características que sugieren el diagnóstico de SIADH son las siguientes: sodio urinario superior a 40 mmol/L o una osmolalidad urinaria superior a 100 mOsm/kg de agua, con función tiroidea normal y cortisol sérico normal 3,62. Este síndrome se ha vinculado más frecuentemente con cáncer de pulmón de células pequeñas, pero también se ha encontrado en tumores del tubo digestivo -los más frecuentes son los de esófago, estómago, páncreas, duodeno, colon y recto- 62,64-66.
Hipercalcemia tumoral maligna
Es uno de los síndromes paraneoplásicos más frecuentes. Se encuentra en el 20%-30% de los pacientes con cáncer 67. Es una alteración ominosa, ya que el 50% de los pacientes que la presentan mueren en los siguientes 30 días 67. El 80% de los casos se deben a secreción tumoral del péptido relacionado con la paratohormona (PTH) 3,67. El diagnóstico se debe sospechar en pacientes con un nivel de calcio sérico superior a los 10,5 mg/dL -el cual se debe corregir con la albúmina 62-, en ausencia de calcio ionizado y acompañado de niveles reducidos de paratohormona sérica (menores de 20 pg/mL) 67. Los síntomas de este síndrome son fatiga, náuseas, vómitos, alteración mental, insuficiencia renal, hipertensión o bradicardia 3. El síndrome es raro en tumores gastrointestinales, aunque se ha encontrado en el 1,3% de los tumores de esófago, especialmente el carcinoma escamocelular 68.
Síndrome de Cushing
Es de origen paraneoplásico en el 5% al 10%, y el resto es de origen no paraneoplásico 3. Cuando es de origen paraneoplásico, la sobreproducción de la hormona corticotropa (ACTH) o de la hormona liberadora de corticotropina (CRF) proviene de las células tumorales 3. Las principales manifestaciones son hipertensión arterial, hipopotasemia, hiperglucemia, atrofia muscular proximal, atrofia cutánea generalizada, estrías violáceas y reducción de la densidad mineral ósea 3. Estos pacientes suelen ser delgados, a diferencia de los afectados por el síndrome de Cushing no paraneoplásico, los cuales presentan obesidad hasta en el 90% de los casos 3. Se debe sospechar una neoplasia extrahipofisiaria cuando hay hipercortisolismo dependiente de la ACTH que no se suprime con dexametasona y cuando en los exámenes por imágenes no se identifican lesiones hipofisiarias 3,69. El tumor más frecuentemente asociado es el de páncreas, el cáncer de pulmón de células pequeñas, el tumor bronquial y los tumores neuroendocrinos gastrointestinales 70. Otros casos esporádicos se asociaron con metástasis de estómago, carcinoma de células escamosas y adenocarcinoma esofágico 69.
Síndrome carcinoide
El cuadro clínico de esta alteración se caracteriza por episodios de enrojecimiento del rostro (flushing), el cuello y la parte superior del tronco, con una duración de 1 a 2 minutos; 15 diarrea, que se presenta en el 85% de los pacientes con enrojecimiento del rostro 71; disnea; broncoespasmo 15 y enfermedad valvular cardíaca 70. Este síndrome se presenta en el 8% al 10% de los pacientes con tumores neuroendocrinos del intestino medio derivados de células enterocromafines 15. Si bien los tumores son más frecuentes en el apéndice (50%), el síndrome se encuentra principalmente en los tumores del yeyuno y del íleon y, cuando está presente, generalmente hay enfermedad metastásica, especialmente en el hígado 31. La sustancia responsable del cuadro clínico es fundamentalmente la serotonina 15,71. El diagnóstico se basa en la detección de ácido 5-hidroxiindolacético en orina de 24 horas, cuya sensibilidad y especificidad son del 80% 71. También es útil la cromogranina sérica, pero no es especifica de este síndrome y tiene una gran cantidad de falsos positivos que reducen su utilidad diagnóstica 71.
Otros síndromes endocrinos asociados con tumores gastrointestinales son la acromegalia por elevación de la hormona de crecimiento y del factor insulínico de crecimiento tipo (IGF-1) 72. Los tumores más frecuentemente asociados son los gástricos y los pulmonares 63. En mujeres con cáncer de colon, se ha encontrado producción ectópica de prolactina, que ocasiona galactorrea y amenorrea y, cuando se presenta en los hombres, produce ginecomastia e hipogonadismo 63. En tumores gástricos y estromales gastrointestinales (GIST), se ha encontrado hipoglucemia 72.
Síndromes paraneoplásicos reumatológicos
Son síndromes infrecuentes. Los mejor documentados se muestran en la Tabla 1y figura 14.
Tabla 1 Síndromes paraneoplásicos reumatológicos

1 Paraneoplásica en el 25% al 31% de los casos 73.
2 Es una afección caracterizada por hipocratismo digital (Figura 15) o acropaquia, poliartralgias y proliferación perióstica 75,76.
3 Generalmente, con manifestaciones atípicas 37,73.
4 En pacientes mayores de 50 años. Clínicamente, es asimétrico y con necrosis digital, de 7 a 9 meses previos al diagnóstico del tumor 73.

Figura 14 El fenómeno de Raynaud consiste en la decoloración transitoria de los dedos de las manos y los pies secundaria a trastornos vasomotores. Clásicamente, tiene tres fases. Se inicia con vasoconstricción, que provoca palidez, seguida de cianosis secundaria a hipoxia del área comprometida y, luego, enrojecimiento cuando cesa la vasoconstricción y la sangre vuelve a fluir. Tomado de: http://angiogrup.es/patologias/arterioaptias/sindrome-de-raynaoud/

Figura 15 Hipocratismo digital. Tomado de: http://www.oncoprof.net/Generale2000/g04_Diagnostic/Symptomes/Index/gb04-symp-ix-01.html
Síndromes paraneoplásicos neurológicos
Son muy raros y afectan del 0,01% al 1% de los pacientes con cáncer 35. Su patogénesis está relacionada con la presencia de antígenos onconeurales, presentes en el sistema nervioso y en el tumor 4,35. En el 60%-70% de los casos, las alteraciones neurológicas se identifican antes que el tumor 4,78. Pueden clasificarse como síndromes clásicos y no clásicos 78. Los clásicos son: encefalomielitis, encefalitis límbica, degeneración cerebelosa subaguda, síndrome de opsoclono-mioclono, neuropatía sensitiva subaguda, pseudoobstrucción intestinal crónica, síndrome miasténico de Lambert-Eaton y dermatomiositis 35. Las neoplasias asociadas incluyen cáncer de pulmón de células pequeñas, timoma, tumores de mama y ginecológicos, linfoma hodgkiniano, mieloma múltiple y cáncer de colon 79.
Aunque no son frecuentes en tumores GI, se han reportado múltiples casos en tumores neuroendocrinos del tubo gastrointestinal, como neuromielitis óptica (intestino delgado) 80, tumores gástricos 81; retinopatía asociada con cáncer (CAR) (intestino delgado) 82 y encefalitis del tronco encefálico (recto) 83.
Sin embargo, existen numerosos reportes de caso en los que se han relacionado con tumores gastrointestinales, los cuales se dividen según el nivel que afecten, como el sistema nervioso central (Tabla 2) o el sistema nervioso periférico (Tabla 3).
Tabla 3 Síndromes neurológicos paraneoplásicos del sistema nervioso periférico.

1Es uno de los síndromes paraneoplásicos neurológicos más frecuentes. Del 15% al 20% de los casos son paraneoplásicos, con predominio en los mayores de 50 años 38
Síndromes paraneoplásicos gastrointestinales
Son una extensión del síndrome paraneoplásico neurológico producto de la neuropatía visceral por daño de las neuronas del plexo mientérico 35. Esta se manifiesta como pseudoacalasia 102, gastroparesia y pseudoobstrucción intestinal 38,103,104. La gastroparesia es la más común 105, a diferencia de la pseudoacalasia paraneoplásica, que es muy rara (1 persona en cada 750 000) 106. Alrededor del 30% de los pacientes tienen alteración de la motilidad 107 y manifiestan estreñimiento grave, distensión abdominal, disfagia, náuseas, vómitos 35 y dolor abdominal 78. Si se detectan anticuerpos anti-HuD o anti-CV2, se debe iniciar la búsqueda de una malignidad 35. Los tumores más frecuentes son cáncer de pulmón de células pequeñas 78 timoma y cáncer de mama 35, pero también se ha relacionado con cáncer gástrico, pancreático, de vesícula biliar, esofágico 108 y tumores carcinoides 103.
Conclusiones
Los tumores del tubo gastrointestinal pueden producir casi cualquier síndrome paraneoplásico, resumidos en la Tabla 4, pero en diferente magnitud, la cual se ha mencionado en detalle en este trabajo. Teniendo en cuenta lo anterior, se debe realizar una búsqueda básica, se deben detectar los signos de alarma y el riesgo de malignidad, y, luego, se debe realizar una búsqueda más específica con los síndromes paraneoplásicos más frecuentes, como la CAC o la AN maligna.











 texto em
texto em