Introducción
La hepatotoxicidad es la lesión causada por la exposición a un medicamento u otros agentes no farmacológicos. La idiosincrasia, edad, género, consumo de alcohol, tabaquismo, uso concomitante de otros fármacos, enfermedad hepática previa o subyacente, factores genéticos y ambientales se consideran factores de riesgo 1,2,3. Aunque la mayoría de los fármacos lipofílicos podría causar hepatotoxicidad 4, los antibióticos, antiinflamatorios no esteroideos (AINE) y anticonvulsivantes son los grupos farmacológicos con una mayor probabilidad 1,5-9. Además, entre los medicamentos administrados por vía intravenosa, los antibióticos y antineoplásicos son los grupos más asociados con toxicidad hepática 10. La hepatotoxicidad puede clasificarse en 2 tipos:
Reacciones intrínsecas: predecibles, dependientes de la dosis, reproducibles, pero con información limitada de su frecuencia de presentación; y
Reacciones idiosincrásicas (inmunes o metabólicas): impredecibles, no dosis-dependiente, no reproducibles y afectan una pequeña proporción de pacientes (entre 1/1000 y 1/100 000 pacientes expuestos) (11-17).
La hepatotoxicidad intrínseca es menos común, mientras que la idiosincrásica es la más asociada con este evento adverso 12,18,19,20. La histología hepática es la herramienta ideal para definir el patrón de toxicidad hepática; sin embargo, en la práctica clínica, la mayoría de las lesiones hepatotóxicas se clasifica de acuerdo con pruebas bioquímicas 21. Según el consenso internacional del Council for Internacional Organizations of Medical Sciences (CIOMS), se considera daño hepático si las enzimas hepáticas se aumentan en más de 2 veces el límite superior normal (LSN); por su parte, el tipo de lesión generada se clasifica en 12,22,23:
Hepatocelular: incremento aislado de alanino aminotransferasa (ALT) >2 veces el LSN o una relación, entre ALT/ fosfatasa alcalina (FA) >5. La ley de Hy considera este tipo de lesión con valores de ALT >3 veces el LSN (24, 25).
Colestásica: incremento aislado de FA >2 veces el LSN o una relación <2.
Mixta: ALT y FA >2 veces el LSN y una relación >2, pero <5.
La hepatotoxicidad se relaciona con disfunción mitocondrial, por inhibición de la respiración celular o alteración en la oxidación β de los ácidos grasos 26,27, lo que genera apoptosis, necrosis, autofagia y, con ello, muerte celular 28,29. Las principales manifestaciones clínico-patológicas de la hepatotoxicidad y sus hallazgos histológicos son:
Hepatitis aguda (caracterizada por inflamación parenquimal, necrosis y células de Kupffer en los sinusoides);
Hepatitis crónica (fibrosis);
Hepatitis fulminante (necrosis e inflamación);
Hepatitis colestásica (inflamación y daño hepático);
Colestasis (tapones biliares en zona 3);
Síndrome de desvanecimiento de conductos biliares (daño en conductos biliares, colestasis e inflamación);
Hepatitis granulomatosa (granulomas en tractos portales o parénquima);
Esteatosis macrovesicular (gotas de lípidos en el citoplasma del hepatocito);
Esteatosis microvesicular (diminutas gotas de lípidos en el citoplasma del hepatocito); y
Esteatohepatitis (esteatosis, inflamación lobular, hepatocitos englobados y fibrosis pericelular) (12,29-31).
Estas manifestaciones se acompañan de signos y síntomas inespecíficos como fiebre, fatiga, náuseas, dolor abdominal, ictericia, orina oscura, prurito, ascitis, encefalopatía y aumento de transaminasas 16,32,33.
Aunque unos 1100 fármacos, excluidas sustancias de abuso y productos naturales, se han asociado con hepatotoxicidad 19; la identificación de este evento adverso es un proceso complejo. Por esto, se requiere de una minuciosa indagación, orientada a identificar cualquier sustancia y a descartar otras causas de hepatopatía 3,8,34. Además, la biopsia hepática es fundamental en la identificación de la hepatotoxicidad 35. Por su parte, la relación cronológica, entre la exposición al agente sospechoso y la reacción hepatotóxica, es clave. Para establecer la probabilidad de que un fármaco esté asociado con hepatotoxicidad, se han desarrollado escalas clínicas, como la Roussel Uclaf Causalita Assessment Method (CIOMS/RUCAM) y la Clinical Diagnostic Scale o Maria-Victorino Scale (M&V CDS). Se considera que la escala CIOMS/RUCAM, por su validez de contenido y de criterio, es la más adecuada y genera resultados compatibles con el juicio médico y la opinión de expertos sobre hepatotoxicidad; sin embargo, debido a lo dispendioso de su aplicación, su utilidad en la práctica clínica es limitada 36,37,38.
El tratamiento de la hepatotoxicidad, debido a la ausencia de una farmacoterapia específica, se fundamenta en suspender el medicamento sospechoso, tratar los síntomas y realizar seguimiento a las pruebas de laboratorio 39. Sin embargo, la utilización de N-acetilcisteína como antídoto para toxicidad por acetaminofén (o en hepatotoxicidad por fenitoína y carbamazepina), o de carnitina para la toxicidad por ácido valproico son algunas excepciones 40.
Un listado actualizado de medicamentos hepatotóxicos y factores asociados podría contribuir a optimizar la identificación y prevención de este evento adverso. Por ello, los objetivos de la revisión fueron: elaborar un listado actualizado de medicamentos asociados con hepatotoxicidad e identificar, de acuerdo con la evidencia científica, los medicamentos con mayor probabilidad de causar hepatotoxicidad. Adicionalmente, sistematizar y precisar información clave como tipo de lesión y probabilidad de ocurrencia, mecanismos fisiopatológicos, manifestaciones clínico-patológicas, variación en las cifras de las enzimas hepáticas, reacción intrínseca o idiosincrásica, factores de riesgo y el desenlace del cuadro.
Método
Búsqueda bibliográfica
Se realizó una búsqueda en PubMed/Medline utilizando los términos Mesh: “liver disease” (drug effects, injuries, pathology) y “drug-induced liver injury”. La búsqueda se filtró por: artículos con palabras clave en el título o resumen, publicados hasta diciembre de 2015 en inglés, español y francés, con acceso al texto completo, que fuesen reportes de casos, revisiones, revisiones sistemáticas, ensayos clínicos, ensayos clínicos controlados, ensayos clínicos aleatorizados, metaanálisis y cartas al editor. Los artículos con evidencia de hepatotoxicidad solo por medicamentos y aquellos considerados relevantes para el tema se incluyeron. Por su parte, se excluyeron los artículos sin relación con los objetivos de la búsqueda, relacionados con hepatotoxicidad por otras sustancias (productos naturales, suplementos dietarios, sustancias de abuso y sustancias industriales), los concernientes a otras causas de enfermedad hepática y los relacionados con ensayos predictivos de hepatotoxicidad o células madre.
Análisis de la información
La elegibilidad de los artículos y la extracción de la información se realizaron por 2 revisores independientes y las discrepancias se resolvieron por un tercer revisor. Se registró, en una base de datos (Excel 2010 para Windows®), el título, autor, año de publicación, tipo de estudio, grupo farmacológico relacionado y cumplimiento de criterios de inclusión para cada una de las referencias encontradas. Además, para los medicamentos hepatotóxicos encontrados se tabuló el grupo farmacológico, código ATC (clasificación Anatómica, Terapéutica, Química, por sus iniciales en inglés), probabilidad de ocurrencia o aparición de hepatotoxicidad, tipo de lesión, probabilidad de aparición del tipo de lesión, mecanismos de hepatotoxicidad, factores de riesgo y manifestaciones clínicas, manejo, desenlace, cifras de enzimas hepáticas y dosis de medicamento. Para los datos numéricos, como los valores de enzimas hepáticas (aspartato aminotransferasa (AST), ALT, FA y bilirrubina total (BT) y los valores de la dosis de medicamento administrado, se calcularon el promedio y la desviación estándar.
Valoración de la aparición de hepatotoxicidad y tipo de lesión
La valoración de la aparición de hepatotoxicidad y del tipo de lesión se basó en la probabilidad de su ocurrencia 41. Se estableció en 3 categorías, de acuerdo con la evidencia encontrada:
Definida: evidencia en metaanálisis, revisiones sistemáticas o ensayos clínicos (aleatorizados o no);
Probable: estudios analíticos o descripción en 3 o más reportes de casos clínicos; y
Posible: menos de 3 casos reportados o por recomendaciones de grupos de expertos (41)
En el caso de medicamentos que presentaron varias referencias con tipos de estudio diferentes, se utilizaron los de mayor nivel de evidencia.
Resultados
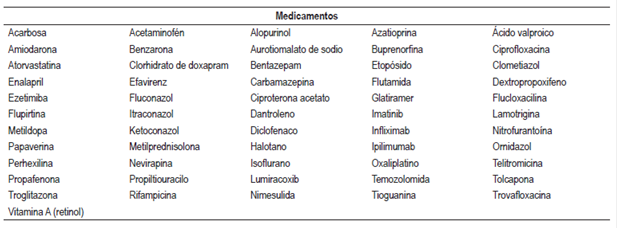
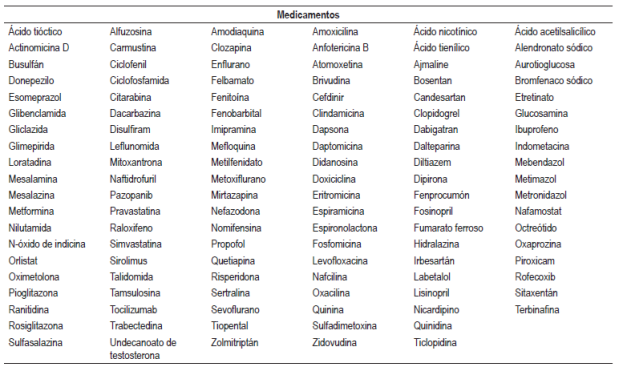
Se identificaron 610 artículos en la búsqueda, se eligieron 402 que cumplían con los criterios de inclusión, se excluyeron 208 y se incluyeron 46 artículos considerados relevantes para la revisión (Figura 1). Se elaboró un listado con 181 medicamentos y 17 formas farmacéuticas combinadas o regímenes terapéuticos con probabilidad de causar hepatotoxicidad, de estos tuvieron probabilidad “definida” 6 medicamentos (metotrexato, minociclina, vancomicina, everolimus, isoniazida y tamoxifeno) y un régimen terapéutico (isoniazida, rifampicina más pirazinamida), 56 medicamentos y 5 formas farmacéuticas combinadas o regímenes terapéuticos “probable”, 119 medicamentos y 11 formas farmacéuticas combinadas o regímenes terapéuticos “posible”.
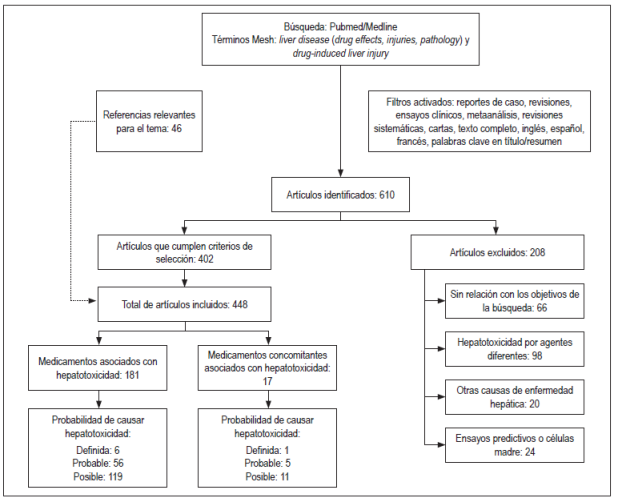
Figura 1 Resultados generales de la revisión estructurada: medicamentos causantes de toxicidad hepática.
Se identificó el tipo de lesión (hepatocelular, colestásica y mixta) causado por cada fármaco, siendo la hepatocelular la más común. Los aspectos encontrados para cada medicamento con probabilidad definida (tipo de hepatotoxicidad, tipo de lesión y su aparición, mecanismo de hepatotoxicidad, factores de riesgo, manifestaciones clínicas y desenlaces) se tabularon (Tabla 1). Los fármacos encontrados se clasificaron según su grupo farmacológico y su código ATC para unificarlos; los fármacos con probabilidad probable se encuentran en la Tabla 2 y los fármacos con probabilidad posible se encuentran en la Tabla 3. Las cifras de enzimas hepáticas y dosis encontradas se hallan en la Tabla 4.
Tabla 1 Medicamentos con probabilidad de causar hepatotoxicidad definida
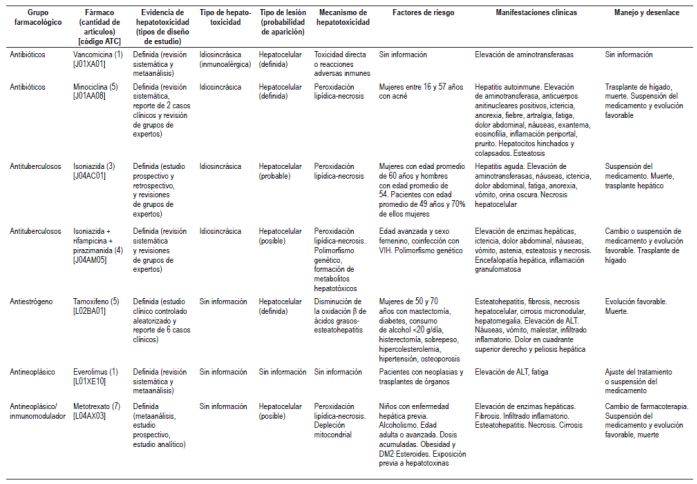
ALT: Alanino amino trasferasa; ATC: Anatomical, Therapeutic, Chemical; DM2: diabetes mellitus tipo 2; VIH: virus de la inmunodeficiencia humana.
Tabla 4 Valores de enzimas hepáticas y dosis asociadas con medicamentos hepatotóxicos
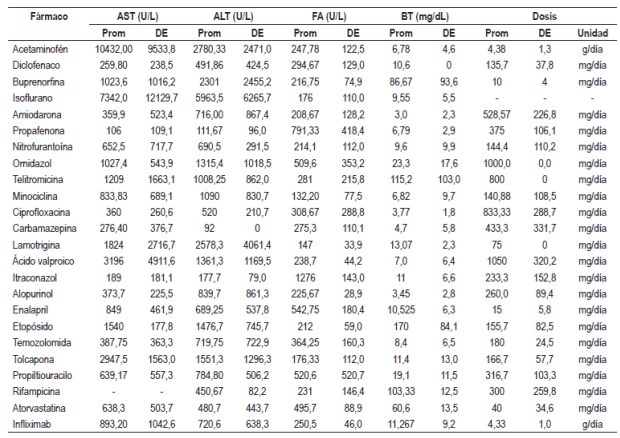
ALT: Alanino amino trasferasa; AST: aspartato amino trasferasa; BT: Bilirrubina total; DE: desviación estándar; FA: Fostatasa alcalina; prom: promedio.
Entre los medicamentos antidiabéticos, se determinó la probabilidad (probable) de causar hepatotoxicidad de acarbosa 42 y troglitazona 43,44 (retirado del mercado); los reportes de caso publicaron lesiones de tipo hepatocelular, colestásica y mixta, acompañadas de ictericia, exantema y fiebre, entre otros. Los antiarrítmicos asociados fueron propafenona 45 y amiodarona, este último con más casos reportados y asociado con elevación de enzimas hepáticas en 15%-55% de los pacientes 46; la suspensión de los medicamentos se asoció con la mejoría de los pacientes, aunque existen reportes de muerte con amiodarona 47. Los antihipertensivos como enalapril elevaron las cifras de enzimas hepáticas y produjeron ictericia y cambios estructurales en el hígado confirmados por biopsia, que llevaron al trasplante y muerte 48. Para metildopa (probable) se identificaron 9 reportes de casos de toxicidad hepática de tipo idiosincrásico 17, con un patrón de lesión hepatocelular especialmente en mujeres, manifestado por ictericia, anorexia y náuseas; además, la biopsia hepática identificó necrosis e infiltrado inflamatorio (49, 50). Con atorvastatina 51 y ezetimiba 52, el tipo de lesión identificado fue hepatocelular, acompañada de elevación de enzimas hepáticas, ictericia, fiebre y astenia.
El propiltiouracilo causó la muerte de un paciente, afectó a mujeres y niñas, generando síntomas como ictericia, prurito y pérdida de peso; se encontraron en las biopsias hepáticas necrosis, fibrosis, infiltrado inflamatorio y ductopenia. La suspensión del medicamento favoreció la evolución de algunas pacientes 53. Con metilprednisolona, se identificaron 4 casos con aumento en los valores de las enzimas hepáticas, debilidad e ictericia en los pacientes, que mejoraron con la interrupción del medicamento 54.
Entre los antibióticos, con la vancomicina 55 y minociclina 56 se identificaron reacciones de tipo idiosincrásico 17,33; la minociclina afectó a mujeres entre los 16 y 57 años con diagnóstico de hepatitis autoinmune. Por su parte, rifampicina causó lesiones hepatocelulares y afectó especialmente a mujeres 57,58. Los siguientes antibióticos se clasificaron como probables causantes de hepatotoxicidad: nitrofurantoína (frecuencia de casos de 12% y de tipo idiosincrásico) 59,60, flucoxacilina (11 casos de tipo idiosincrásico) 61, telitromicina (lesión hepatocelular con elevación de transaminasas y fiebre) 62, ciprofloxacina y trovafloxacina (retirada del mercado). En general, los desenlaces variaron desde una evolución favorable hasta trasplante de hígado o muerte del paciente.
Para el caso de los antimicóticos itraconazol, fluconazol y ketoconazol se identificó daño hepático que mejoró con la interrupción de los medicamentos 63-66. Los agentes antirretrovirales pueden causar hepatotoxicidad dependiente de la dosis, en especial los inhibidores de la transcriptasa reversa análogos de nucleósidos y los inhibidores de proteasa 67. Se reportaron casos con efavirenz y nevirapina, con elevación de transaminasas y una incidencia entre 1% y 14% 9. La coinfección por virus de la hepatitis B o C puede aumentar la hepatotoxicidad con los tratamientos antirretrovirales 68,69.
La quimioterapia ha aumentado la esperanza de vida; sin embargo, su utilización puede causar alteraciones hepáticas en los pacientes 70, que pueden ir desde esteatosis y esteatohepatitis hasta cirrosis 71. En el caso del tamoxifeno, everolimus y metotrexato, la probabilidad fue definida. Medicamentos como flutamida, etopósido, imatinib, ipilimumab, oxaliplatino, temozolomida, tioguanina, glatiramer, azatioprina e infliximab se clasificaron con una probabilidad de causar hepatotoxicidad como probable.
Los AINE se identificaron como un grupo importante que puede causar alteraciones hepáticas 1,72 principalmente de tipo idiosincrásico 73, en casos de abuso o sobredosis 74. Algunos factores de riesgo identificados fueron la edad, género femenino, consumo crónico de alcohol, fármacos concomitantes, enfermedades subyacentes, obesidad, DM2 y resistencia a la insulina 72. Algunos agentes causantes son el diclofenaco, lumiracoxib y nimesulida. Con acetaminofén, reconocido ampliamente como sustancia hepatotóxica intrínseca debido a un metabolito que causa necrosis hepática, se identificaron 14 reportes de casos caracterizados por lesiones hepatocelulares manejadas con N-acetilcisteína y prednisona 75,76, con mejoría de los pacientes.
El halotano fue el anestésico general con mayor probabilidad de causar toxicidad hepática. La predisposición genética, dosis repetidas, obesidad y edad avanzada fueron algunos factores de riesgo. Las mujeres tienen mayor probabilidad de sufrir un daño hepático con estos medicamentos con lesiones de tipo hepatocelular, aumento en las enzimas hepáticas, necrosis, fiebre, ictericia y fatiga 77,78,79.
En el caso de anticonvulsivantes, con ácido valproico se identificó un mayor número de casos de hepatotoxicidad (de tipo hepatocelular) y se manifestó con elevación de transaminasas, dolor abdominal, ictericia y anorexia; además, en las biopsias hepáticas se identificaron esteatosis microvesicular y macrovesicular, necrosis e infiltrado inflamatorio. Este medicamento puede causar lesiones hepáticas en menores de 30 años 80,81. Con carbamazepina se identificaron casos, principalmente de tipo mixto y con formación de granulomas 82,83. La lamotrigina generó casos de hepatotoxicidad idiosincrásica que requirieron trasplante hepático 84,85.
Se encontraron 17 formas farmacéuticas combinadas o regímenes terapéuticos (usados simultáneamente) capaces de causar lesión hepatocelular de tipo idiosincrásico, como en el caso de isoniazida, rifampicina y pirazinamida (probabilidad definida). El evento se manifestó con elevación de enzimas hepáticas, dolor abdominal, ictericia, astenia, náuseas, vómito y necrosis; confirmada por biopsias hepáticas 86,87,88. En el caso de las formas farmacéuticas combinadas de antibióticos, como trimetoprima/sulfametoxazol y amoxicilina/ácido clavulánico, se identificaron casos de toxicidad hepática, de tipo idiosincrásico y clasificada como probable 57. El evento se presentó principalmente en hombres, causando ictericia y prurito; en algunos casos de amoxicilina/ácido clavulánico, el desenlace fue trasplante hepático o muerte 89. El esquema antirretroviral ritonavir, indinavir, darunavir y fosamprenavir se asoció con lesión hepática de tipo hepatocelular, acompañada de necrosis 68,90. El reporte de casos de antineoplásicos (6-tioguanina, daunomicina y citosina arabinosa) usados como parte del régimen terapéutico para la leucemia mieloide en niños causó hepatomegalia, cirrosis y enfermedad veno-oclusiva 91.
Discusión
Los antibióticos, antineoplásicos y antituberculosos fueron los grupos de medicamentos identificados con mayor probabilidad de causar hepatotoxicidad, acorde con los resultados de otras revisiones realizadas previamente 5,23,33,57. Relacionado con los antibióticos, de vancomicina y minociclina se identificó evidencia suficiente de su capacidad de generar hepatotoxicidad idiosincrásica 17,33 y un tipo de lesión hepatocelular 33,55,56,92, la cual se valoró como definida. Por su parte, en el caso de otros antibióticos, en la tetraciclina se identificó su capacidad de generar daño hepático, manifestado como esteatohepatitis 93; pero la búsqueda no arrojó información suficiente para su inclusión.
Los reportes de caso permitieron identificar al tamoxifeno, everolimus y metotrexato como agentes que pueden causar daño en el hígado, con una probabilidad definida. En el caso del metotrexato, un estudio publicado previamente 94, aunque reportó aumento en las enzimas hepáticas, no identificó correlación entre las concentraciones de metotrexato y la probabilidad de causar hepatotoxicidad. Con la información encontrada no fue posible establecer el tipo de hepatotoxicidad para estos 3 medicamentos; sin embargo, el daño tiende a ser de tipo hepatocelular, con elevación en los valores de transaminasas y con un desenlace que puede ir desde la evolución favorable hasta la muerte.
En esta revisión no se encontraron reportes de casos específicos de hepatotoxicidad por isoniazida; aunque, algunos autores afirman que este medicamento causa daño hepático 95. Así, es importante destacar que el uso concomitante de isoniazida, rifampicina y pirazinamida se identificó como causante de una hepatotoxicidad de tipo idiosincrásica y una lesión de tipo hepatocelular 86,87, generando la suspensión de la farmacoterapia.
En esta revisión, para el acetaminofén, identificado como causante de toxicidad hepática, se valoró su probabilidad como probable, debido a que se identificaron solo opiniones de grupos de expertos y reportes de caso. Por esto, la ausencia de evidencia en metaanálisis, revisiones sistemáticas o ensayos clínicos no permitió su clasificación en la probabilidad definida.
En el caso de amiodarona, existen dudas sobre el tipo de hepatotoxicidad que genera. Aunque se encontró información que soporta reacciones de tipo idiosincrásico 32,96-98, también se reportaron reacciones de tipo intrínseco, secundario al depósito del fármaco en el tejido hepático 23.
Existen medicamentos que han sido retirados del mercado mundial o de ciertos países por estar asociados con la probabilidad de causar hepatotoxicidad 99, algunos de estos identificados en esta revisión son el dextropropoxifeno, ketoconazol (aún comercializado en Colombia), nefazodona, propofol y sitaxentán.
La elevación de las enzimas hepáticas estuvo presente en muchos de los reportes de caso, convirtiéndose en un marcador a considerar en caso de sospecha de hepatotoxicidad por medicamentos. En este marco se presentaron las cifras de ingreso de ALT, AST, FA y BT para algunos medicamentos, tomadas de los diferentes reportes de caso; además, se mostraron los datos disponibles de las dosis administradas, información que podría apoyar la hipótesis de la aparición del evento a dosis terapéuticas.
Esta revisión tiene como limitación el uso de solo una base de datos (Pubmed/Medline) para la búsqueda de la información, lo que puede disminuir el número de medicamentos con probabilidad de causar toxicidad hepática e influir en la valoración de la probabilidad encontrada de los medicamentos tabulados. Para disminuir el riesgo de sesgos de información se usó el procedimiento propuesto por Amariles y colaboradores 41 tomando como base la probabilidad de aparición u ocurrencia de hepatotoxicidad, la que se estableció en 3 categorías (definida, probable y posible) de acuerdo con los tipos de estudios publicados (nivel de evidencia) para cada fármaco; y para disminuir el sesgo de confusión entre los medicamentos que se usaron al mismo tiempo, se hace la diferencia entre las formas farmacéuticas combinadas (varios fármacos en una sola forma farmacéutica) y los regímenes terapéuticos.
Conclusiones
Se identificaron más de 180 medicamentos asociados con hepatotoxicidad, de los cuales 6 tienen una probabilidad definida; mientras que en su mayoría la probabilidad es posible. Se aprecia que más del 50% de los medicamentos encontrados se asocia con hepatotoxicidad de tipo idiosincrásico y el sexo femenino con un amplio rango de edad como principal factor de riesgo. Además, la elevación de las enzimas hepáticas, la ictericia y la fiebre hacen parte de los síntomas que más se presentan, generándose lesiones principalmente de tipo hepatocelular, seguidas de necrosis hepática. En la mayoría de los casos, se presenta una adecuada evolución al identificar y suspender el agente causante. La consolidación de la información sobre hepatotoxicidad demostró que diversos grupos de medicamentos tienen mayor evidencia de ser sustancias causantes de toxicidad hepática, aunque para algunas sea escasa la información precisa del mecanismo que explica el desarrollo y aparición del evento.











 text in
text in