Introducción
La terapia supresora de ácido (TSA), conformada por los inhibidores de la bomba de protones (IBP) y los antagonistas de los receptores H2 (AR-H2), es uno de los conjuntos de medicamentos con mayor prescripción en el mundo; su uso se ha considerado seguro debido a sus pocos efectos adversos (cefalea, dolor abdominal, náuseas, diarrea, vómito y flatulencia), lo que ha favorecido su uso indiscriminado en los últimos años 1. El mecanismo de acción de los IBP consiste en el bloqueo irreversible de la bomba H+/K+ ATPasa (adenosina-trifosfatasa) en las células parietales y los AR-H2 bloquean los receptores H2, lo que resulta en la reducción de la secreción de ácido 2.
Por una parte, estudios recientes motivados por el interés de evaluar las repercusiones de este aumento de la prescripción de la TSA han evidenciado que la administración de los IBP y AR-H2 está asociada con la disminución en la absorción de nutrientes como hierro, vitamina B12, calcio y magnesio 3,4,5. Por otra parte, el uso crónico de los IBP se ha asociado con el aumento en el riesgo de fracturas 6; y también existe una asociación positiva de la TSA con el aumento del riesgo de gastroenteritis, infecciones por Clostridium difficile y neumonía adquirida en la comunidad 7,8,9,10, y enfermedad renal crónica 11,12.
En la literatura se ha reportado una prevalencia de prescripción de la TSA que no concuerda con las guías de práctica clínica (GPC) e indicaciones de la Food and Drug Administration (FDA); esta oscila entre el 50% y 70% 13-23, lo que demuestra la alta tasa de sobreúso de estos medicamentos y el potencial riesgo de efectos adversos graves a los que se expone a los pacientes que reciben la TSA sin indicación.
Debido a que existen pocos reportes que evalúen el uso de TSA en Latinoamérica y Colombia, este estudio busca evaluar la prevalencia de prescripción no indicada en un hospital general de cuarto nivel en pacientes hospitalizados.
Métodos
Estudio observacional descriptivo, de prevalencia y de corte transversal, de pacientes que cumplieron los siguientes criterios de inclusión: pacientes adultos hospitalizados en el Hospital Universitario Fundación Santa Fe de Bogotá (HU-FSFB) con prescripción de TSA de novo y que durante su estancia recibieron al menos una dosis de IBP (omeprazol, esomeprazol, pantoprazol o lansoprazol) o AR-H2 (ranitidina). Se determinaron las indicaciones de TSA y se compararon con las indicaciones validadas para establecer la prevalecía de prescripción inapropiada, las razones más frecuentes y la asociación entre variables clínicas con prescripción de TSA inapropiada. Los criterios de exclusión fueron: pacientes con prescripción o consumo previo de estos medicamentos durante al menos 2 semanas, y pacientes internados en unidad de cuidados intensivos (UCI) o con hospitalización menor de 1 día.
Para el tamaño de la muestra, se usó la fórmula de Kanh H. y Sempos C. (1989) para prevalencia puntual, en la que se estableció una población teórica mínima de 271 pacientes, con un error tipo I de 0,05 y una precisión del 90%.
Los datos de las historias clínicas se recolectaron del sistema de información electrónico HIS-ISIS® del HU-FSFB, teniendo en cuenta variables sociodemográficas y clínicas: antecedente de enfermedad ácido-péptica, medicamentos usados, diagnóstico principal de hospitalización, tiempo de hospitalización, tipo de TSA prescrito, dosis, duración de tratamiento, razón de uso de TSA y prescripción al egreso de TSA.
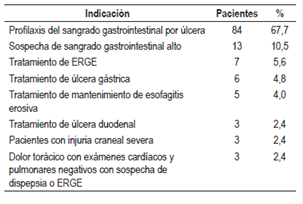
Para este estudio se usó un listado de indicaciones de prescripción de TSA en pacientes hospitalizados con base en las recomendaciones de la FDA, American Gastroenterology Association (AGA), American College of Gastroenterology (ACG) y American Society of Health-System Pharmacists (ASHP), previamente validadas y usadas en otros estudios 19,22,24 (Tabla 1).
Tabla 1 Indicaciones de prescripción de TSA en pacientes hospitalizados según la evidencia 19,22,24*

*FDA, AGA, ACG y ASHP. ERGE: enfermedad por reflujo gastroesofágico.
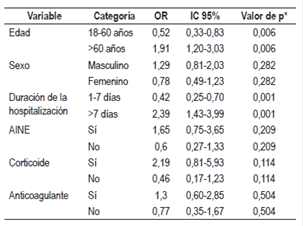
Se realizó un análisis estadístico con medidas de estadística descriptiva de tendencia central y de dispersión, una prueba de chi-cuadrado (χ2) junto con el cálculo de los odds ratio (OR) para establecer la asociación entre las variables de edad, sexo, tiempo de hospitalización y uso de medicamentos ulcerogénicos (antiinflamatorios no esteroideos [AINE], esteroides y anticoagulantes) con prescripción de TSA no basada en la evidencia, y tomando como un valor de p <0,05 como significativo. Se usó el programa estadístico STATA 12.0 para el análisis de los datos.
Este estudio fue aprobado por el comité de ética del HU-FSFB en la reunión del 14 de diciembre de 2015 y cumple con los criterios de buena práctica clínica y declaración de Helsinki 2013.
Resultados
Se incluyeron 306 pacientes que cumplieron los criterios de inclusión y exclusión, entre enero a julio de 2015, con edad de 56,6 (±38) años, 48% de sexo femenino, la mayoría con una formación superior al bachillerato en un 54%, en su mayoría pertenecientes al régimen contributivo con medicina prepagada en un 70.4%.
En cuanto a las variables clínicas, solo 42 (13,7%) de los pacientes, tenían antecedente previo de enfermedad gastrointestinal, siendo la gastritis aguda o crónica la más común en 20 (6,5%), enfermedad por reflujo gastroesofágico en 10 (3,3%) y la úlcera gástrica o duodenal en 9 (3%) pacientes.
Respecto al antecedente de uso de medicamentos ulcerogénicos, 28 pacientes (9,1%) tenían prescrito anticoagulantes, 27 (8,8%) AINE o aspirina y 17 (5,5%), corticoides.
La media de duración de la hospitalización fue de 7,4 días, con mínimo de 1 día y máximo de 55 días. En cuanto al tipo de TSA utilizada, 266 prescripciones (86,9%) se realizaron para los IBP; 28 (10,5%) para los AR-H2 y 12 (4%) para los 2 medicamentos.
Los medicamentos más usados en orden de frecuencia, según dosis y vía, fueron los siguientes: omeprazol 40 mg cada 24 horas vía intravenosa (IV), omeprazol 20 mg cada 24 horas vía oral (VO) y esomeprazol 20 mg cada 24 horas VO; que corresponden a un 32,9%, 17% y 13% del total de prescripciones, respectivamente. Adicionalmente, la vía de administración más comúnmente empleada para el uso de la TSA fue la IV.
La prevalencia de prescripción inapropiada de TSA en los pacientes hospitalizados del HU-FSFB en el período de enero a julio de 2015 fue del 59,5% (Figura 1).
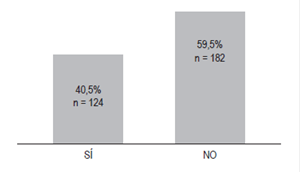
Figura 1 Prescripción de TSA de acuerdo con la evidencia (n=306) 19,22,26. Sí = basada en la evidencia; no = no basada en la evidencia. FDA, AGA, ACG y ASHP.
En cuanto a las razones de prescripción de TSA basadas en la evidencia, en los 124 pacientes, la profilaxis del sangrado gastrointestinal por úlcera fue la más común en 67,7%, seguida de la sospecha de sangrado gastrointestinal alto en un 10,5% (Tabla 2).
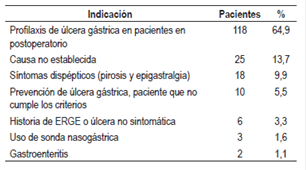
Dentro de las razones de prescripción no basadas en la evidencia, en los 182 pacientes, las más comunes fueron: profilaxis de sangrado gastrointestinal en pacientes en postoperatorio de cirugía de bajo riesgo que no cumplen con los criterios establecidos de profilaxis (64,9%), causa no establecida o no justificada en la historia clínica (13,7%), síntomas dispépticos (pirosis y epigastralgia) (10%) y prevención de sangrado gastrointestinal por úlcera en pacientes que no cumplen criterios (5,5%) (Tabla 3).
Del total de la muestra, 47 pacientes (15,4%) egresaron del hospital con prescripción de TSA que no estaba basada en la evidencia.
Se encontró una asociación entre las variables de edad menor de 60 años (OR: 1,9; IC 95%: 1,2-3,03) y hospitalización menor de 7 días (OR: 2,39; IC 95%: 1,4-3,9) con prescripción inadecuada de TSA, datos estadísticamente significativos. No se encontró asociación con el sexo de los pacientes o uso de medicamentos ulcerogénicos (AINE, anticoagulante o corticoide), usando una prueba de χ2, con un valor de p significativo <0,05 (Tabla 4).
Discusión
La mayor parte de prescripciones de TSA en estos pacientes correspondió a los IBP, que guarda relación con respecto a la descrita en la literatura, en la que la prescripción de los IBP corresponde a un 76%, frente a un 24% de los AR-H213.
La prevalencia de prescripción de TSA no basada en la evidencia en la Fundación Santa Fe de Bogotá es del 59,5%, que es significativamente alta. Sin embargo, dicha prevalencia está de acuerdo con otros estudios como los de Reidd y colaboradores, quienes encontraron que el 50% de los pacientes del hospital de Colorado (Estados Unidos) no tenían una indicación válida para la prescripción de TSA 16; adicionalmente, Gupta y colaboradores reportaron un 73% de prevalencia de indicación inadecuada en el Centro Médico de la Universidad de Florida 19 y en otros centros como el hospital de Singapur se reportó un 55% de uso no apropiado de TSA 20. En Perú, un estudio reportó que el 54,57% de prescripción de los IBP no estuvo basada en GPC 22. En un estudio realizado en el Hospital San Ignacio de Bogotá, la tasa de uso inadecuado fue del 59,7%, muy similar a lo encontrado en este estudio 23. Otro estudio descriptivo que analizó más de 100 000 prescripciones de los IBP en 2010 en Colombia, revisando los datos del sistema general de seguridad social en salud, encontró que el costo anual no justificado asciende a U. S. $2 202 590 25. La prevalencia de prescripción inadecuada de TSA en el hospital está de acuerdo con las prevalencias reportadas en la literatura que oscilan entre el 50% y el 70%, situación que se relaciona con costos elevados no justificados 13-23.
Dentro de las razones de prescripción de TSA basada en la evidencia en este estudio, la causa principal fue la profilaxis de sangrado gastrointestinal en pacientes con factores de riesgo, como el uso de los AINE, consistente con otros estudios como el de Bustamante y Scagliarini 22,26.
En cuanto a las indicaciones no basadas en la evidencia, se encontró que la más frecuente es la profilaxis de sangrado gastrointestinal en pacientes de bajo riesgo, principalmente en postoperatorio, que no cumplen con los criterios de profilaxis, como el uso de los AINE; pacientes con injuria craneal, intubación o quemadura, que concuerdan con los hallazgos de otros estudios, cuyas frecuencias entre el 20% y el 30% muestran que la primera causa es la profilaxis de úlceras de estrés en pacientes de bajo riesgo 19,22,24,26. Así mismo, en un estudio de los pacientes que habían recibido IBP realizado en el servicio de cirugía general del hospital de Lausanne, Suiza, el 79% no tenía factores de riesgo para profilaxis de sangrado gastrointestinal, similar a nuestro estudio 21.
Cuando se revisa en la literatura la incidencia de sangrado gastrointestinal en pacientes de bajo riesgo, solamente un estudio en el que se evaluaron más de 78 000 pacientes que no estaban en UCI encontró que la incidencia de sangrado evidente fue de 0,26% en pacientes que recibieron medicamentos antiácidos con respecto a 0,18% en pacientes sin medicamentos antiácidos, hecho que se traduce en un número necesario a tratar (NNT) de 834 pacientes para prevenir un episodio de sangrado gastrointestinal importante; lo que no es costo-efectivo 14,27.
En este estudio no se encontró una asociación significativa entre la prescripción de la TSA con el uso de medicamentos ulcerogénicos (AINE, anticoagulantes y esteroides), con respecto a otros estudios como el de Gupta, en el que esta causa suma un 15% del total 19; o el de Bustamante, en el que la polifarmacia fue la indicación más importante de prescripción de TSA inapropiada en el hospital de medicina interna 22; y el de Chia y colaboradores, en el que se presentó la asociación en el 35% de los pacientes 20.
Llama la atención que hasta a un 15% de los pacientes se les dio egreso con prescripción de TSA que fue prescrita sin evidencia, aunque menor con respecto a otros estudios como el de Ahrens en Alemania, donde un 58% de 506 pacientes seguidos en 36 centros de atención primaria tenía prescripción de TSA sin indicación basada en la evidencia luego del egreso de hospitalización, lo que puede exponer a los pacientes al uso crónico de un medicamento, con efectos adversos y aumento de costos de manera innecesaria 28.
Por una parte, este estudio está sujeto a limitaciones como el sesgo de información que se encuentra en la revisión de historias clínicas, ya que no siempre se reportan todos los antecedentes o razones para tomar una conducta en el paciente, como la formulación de TSA. Por otra parte, este estudio se limita al servicio de hospitalización del hospital, excluyendo servicios importantes como consulta externa, en la que también se ha reportado sobreúso importante de estos medicamentos.
Este estudio advierte acerca de la elevada prevalencia de prescripción de TSA que no está basada en la evidencia en un hospital general en Colombia, mostrando la baja tasa de conocimiento y seguimiento de las indicaciones aprobadas de prescripción de la TSA. También hace evidente la necesidad de difundir las indicaciones aprobadas ante el personal médico con el fin de disminuir la tasa de indicaciones no apropiadas, el costo asociado y la exposición a riesgos innecesarios que pueden ser graves para los pacientes que reciben estos medicamentos. Por lo anterior sugerimos la creación de GPC adaptadas a nuestro medio que sean aplicables a todos los hospitales del país.











 texto en
texto en