Introducción
El virus de la hepatitis E (VHE) se descubrió en 1983 mediante la autoinoculación de una muestra de materia fecal proveniente de un paciente 1. El voluntario desarrolló un cuadro de hepatitis viral aguda no A, no B, no C. En la década de los años 90 se describió la secuencia viral 2.
La infección por VHE es un problema de salud pública 3. Según la Organización Mundial de la Salud (OMS), se estiman 20 millones de casos por año de infección aguda, principalmente en Asia y África 4. La principal ruta de transmisión es la vía fecal-oral por el consumo de agua contaminada; es frecuente en zonas donde el abastecimiento de agua potable y el tratamiento de agua residual no son adecuados 3,5. También puede presentarse transmisión zoonótica, siendo el cerdo el principal reservorio, por exposición ocupacional, por el consumo de carne de cerdo mal cocida y por agua contaminada con materia fecal de cerdo 5,6.
En Colombia no existe un registro de la infección por el VHE, debido a que no está incluido en las guías de diagnóstico de hepatitis virales; sin embargo, existe evidencia de que el virus circula tanto en población humana como en población porcina y en fuentes de agua de abastecimiento y residuales 3,5-8.
Generalidades y genoma del VHE
El VHE está clasificado en la familia Hepeviridae, género Orthohepevirus, especie Orthohepevirus A9. Es un virus no envuelto de 27 a 34 nm de diámetro; aunque se ha demostrado la presencia de partículas virales con envoltura lipídica que circulan en sangre 10, lo que le permite evadir la respuesta inmune humoral 10,11. Las partículas virales liberadas del hepatocito presentarían una bicapa lipídica transitoria que se pierde durante el paso por el conducto biliar debido a la presencia del ácido deoxicólico y luego en el duodeno por la presencia de proteasas; en las heces estarían presentes las partículas sin envoltura o desnudas 12.
La partícula viral desnuda tiene una alta resistencia a condiciones ambientales; una partícula viral aislada de materia fecal puede mantenerse estable a condiciones de temperatura menores de 56 °C, pero su infectividad se pierde cuando se somete a temperaturas mayores de 60 °C 13, y a 71 °C se logra la inactivación de partículas virales presentes en el hígado de cerdo 14. La partícula de VHE es resistente a pH ácido y alcalino, y a procesos de congelación y descongelación 6.
El genoma del VHE consiste en un ácido ribonucleico (ARN) lineal, de cadena sencilla y de polaridad positiva de aproximadamente 7,2 kb 6; que contiene 3 marcos de lectura abierta (open reading frame): ORF1, ORF2 y ORF3.
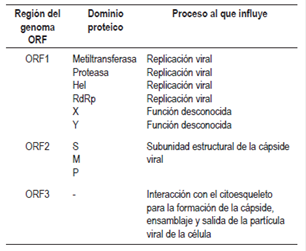
El ORF1 codifica una poliproteína de aproximadamente 1690 aminoácidos indispensables para la replicación del genoma viral 6,15. La poliproteína se conforma de un dominio con función de metiltransferasa (MeT), un dominio con función proteasa, un dominio con función helicasa (Hel) y un dominio con función de polimerasa dependiente de ARN (RdRp); adicionalmente, posee un dominio X y otro dominio Y con función desconocida 6 (Figura 1). No está claro si esta poliproteína se procesa en proteínas individuales o si la actividad de los dominios se conserva en la poliproteína (16 (Tabla 1).
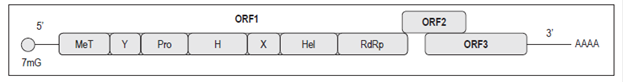
Figura 1 Organización genómica del VHE 17. H: dominio H; Pro: cisteína-papaína proteasa; X: dominio X; Y: dominio Y; 7mG: Cap 7-metilguanina. Modificado de: Panda SK et al. Rev Med Virol. 2007;173:151-80.
El ORF2 codifica la subunidad estructural preORF2, que en su forma glucosilada se autoensambla para convertirse en la subunidad de la cápside viral 6,15. Esta proteína presenta 3 dominios: S, M y P; que están involucrados en el ensamblaje de la partícula viral y en la interacción del virus con la célula huésped 6,16 (Tabla 1).
El ORF3 se superpone parcialmente sobre el ORF2 y codifica una pequeña proteína cuya posible función es la interacción con el citoesqueleto para los procesos de ensamblaje de la cápside y de la partícula viral 6,18 (Figura 1,Tabla 1).
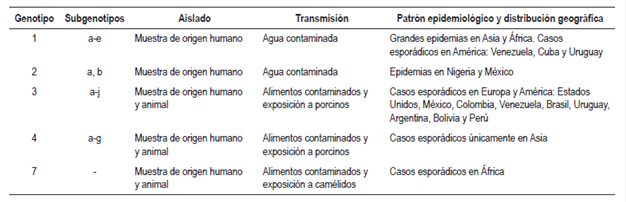
Existe una gran diversidad genética entre las diferentes cepas identificadas tanto en pacientes como en animales domésticos y salvajes tales como cerdos, jabalíes, venados, conejos, mangostas y camellos 19,20. Se han caracterizado en pacientes 4 genotipos con una divergencia nucleotídica menor al 20% en aislados de la región del ORF2 15 (Tabla 2).
Por una parte, los genotipos 1 y 2 se han aislado exclusivamente de muestras de origen humano obtenidas durante epidemias en Asia y África, y en México y Nigeria, respectivamente6,15,21; en Latinoamérica, se han reportado casos esporádicos de infección viral por genotipo 1 en Venezuela, Cuba y Uruguay 22,23,24; adicionalmente, este genotipo ha sido asociado con hepatitis fulminante, abortos y muerte en mujeres gestantes en países como India y Angola 25. Los genotipos 3 y 4 se han aislado en casos esporádicos de hepatitis en humanos, así como en animales domésticos y salvajes, lo que indica su potencial zoonótico 15,20,21. Por otra parte, el genotipo 3 es el que presenta mayor distribución a nivel global en países de Asia, Europa, Oceanía y América; mientras que las únicas evidencias de infección por genotipo 4 se han documentado en Asia 15,21. Recientemente, se identificó el genotipo 7 en un reporte de transmisión zoonótica por el consumo de carne y leche de camello en un paciente proveniente de Emiratos Árabes Unidos, quien había sido sometido a un trasplante de hígado 20 (Tabla 2).
El genotipo 1 se subdivide en 5 subgenotipos (designados con las letras a-e), el genotipo 2 en subgenotipos 2a y 2b, el genotipo 3 en 10 subgenotipos (designados con las letras a-j) y el genotipo 4, en 7 subgenotipos (designados con las letras a-g) 15 (Tabla 2).
Replicación viral
La replicación del VHE comienza con la entrada de la partícula viral a la célula blanco por endocitosis mediada por un receptor (Figura 2); aunque aún no se ha identificado el receptor, se ha propuesto que los proteoglicanos heparán-sulfato (HSPG) y proteínas de choque térmico de 70 kiloDaltons (HSP70) podrían estar implicados como receptores 26.
Una vez la partícula viral se encuentra en el endosoma, debe sufrir procesos de acidificación para la degradación lipídica de la membrana por el contenido del lisosoma, específicamente por la actividad de la lipasa ácida lisosomal (LAL) 10.
Después de la entrada y la descapsidación, los 2 primeros tercios del genoma viral son traducidos para producir la pORF1 17. Una vez sintetizado pORF1, el dominio de la RdRp sintetiza una cadena de ARN complementaria y de polaridad negativa (ARN antigenómico) que sirve como molde para la síntesis de cadenas de ARN subgenómico de 2,2 kb y cadenas de ARN genómico 17. Posteriormente, se traducen las proteínas pORF2 y pORF3 a partir del ARN subgenómico. Los dímeros de pORF2 interactúan permitiendo el autoensamblaje de la cápside; posteriormente, se realiza el empaquetamiento del genoma y la generación de nuevas partículas virales 17,27 (Figura 2).
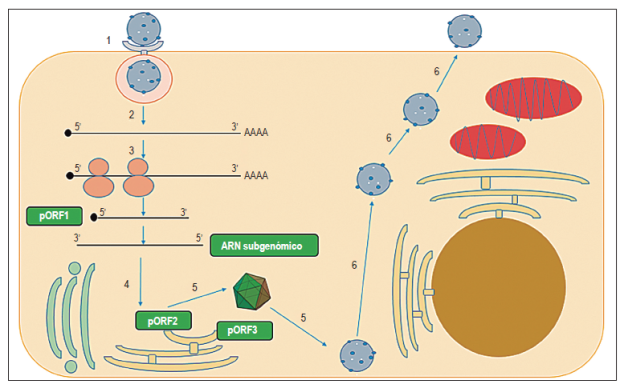
Figura 2 Esquema de la replicación del VHE. 1: entrada de la partícula viral del VHE a la célula blanco de endocitosis, mediada por un receptor; 2: descapsidación y liberación del ARN; 3: traducción de poliproteína no estructural a partir del ORF1 (pORF1) y generación de la cadena molde de polaridad negativa y ARN subgenómico; 4: traducción de pORF2 y pORF3; 5: ensamblaje de la cápside, empaquetamiento del genoma y generación de nuevas partículas virales; 6: salida de las partículas virales de la célula. pORF1: preORF1; pORF2: preORF2; pORF3: preORF3.
La principal célula blanco del VHE es el hepatocito; sin embargo, se ha demostrado replicación extrahepática. Estudios en animales han demostrado la presencia del genoma del VHE en órganos como el intestino delgado, colon, bazo y nódulos linfáticos en cerdos 28 y órganos como el riñón, intestino delgado, bazo y estómago en ratas 29. Adicionalmente, se ha reportado la presencia de ARN genómico y antigenómico en el sistema nervioso central (SNC), lo que demuestra la replicación viral en el cerebro y la médula espinal en roedores, concomitante con necrosis de neuronas, infiltración linfocítica, invasión perineural y daños en la mielina (30.
Epidemiología
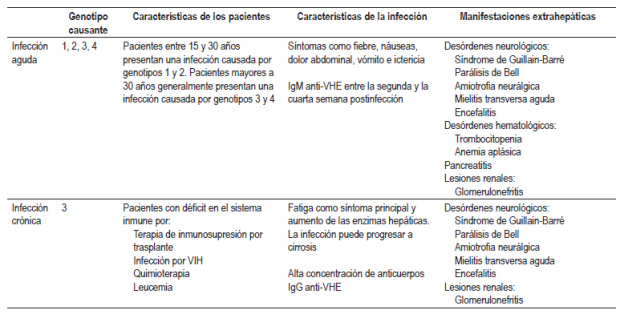
Existen 2 patrones epidemiológicos para la infección por VHE: epidémico y no epidémico 6. El patrón epidémico se ha observado principalmente en India, China, norte y occidente de África, donde la contaminación de los cuerpos de agua es la principal fuente de infección. Usualmente, la población afectada comprende adultos jóvenes entre los 15 y 30 años de edad6,21,31. En Latinoamérica, específicamente en México, solo se notificaron brotes en los años 1986 y 1987 6,21.
El patrón no epidémico se presenta en países industrializados, donde los casos esporádicos pueden relacionarse con el carácter zoonótico de los genotipos 3 y 4 6,21.
En general, en los países en desarrollo donde una parte de la población no tiene acceso al agua potable, las tasas de prevalencia son mayores que en los países desarrollados 6,21. Dentro de las áreas reportadas con alta seroprevalencia en población general adulta se encuentran áreas rurales de Malasia (45%), China (20%-30%), Egipto (26%), India (20%) y Arabia Saudita (17%) 6,21,32. En los países desarrollados se han reportado tasas de seroprevalencia inferiores en la población general adulta: en Estados Unidos 1%-3%, en Alemania 2,1% 6,21,32 y en España 2%-7% 33.
Por una parte, es importante anotar que se observan diferencias en la seroprevalencia de anticuerpos anti-VHE asociadas con riesgo ocupacional, ya que el personal veterinario y granjeros presentan una prevalencia superior a la de la población general 34-36. Un estudio en Estados Unidos demostró que el 27% de los veterinarios de 8 estados con riesgo ocupacional presentaron anticuerpos tipo inmunoglobulina G (IgG) anti-VHE comparado con los datos de seroprevalencia anti-VHE en donantes de sangre en este mismo país 37; adicionalmente, en Moldavia se describe una prevalencia del 51% para anticuerpos tipo IgG anti-VHE en trabajadores de granjas porcícolas comparado con 25% de seroprevalencia en el grupo control, sin exposición ocupacional a porcinos 36. En Colombia se ha demostrado que la prevalencia de anticuerpos tipo IgG anti-VHE para trabajadores de granjas porcícolas varía entre un 11,25% y 15,7% 35,38; por el contrario, se ha reportado una prevalencia de 2,5% para anticuerpos tipo inmunoglobulina M (IgM) anti-VHE en esta misma población 38. Por otra parte, existe evidencia serológica de la infección por este virus en población conviviente con trabajadores de granjas porcícolas en un porcentaje de 5,9 para anticuerpos tipo IgG anti-VHE 38 (Tabla 3).
Tabla 3 Estudios de infección por VHE realizados en Colombia
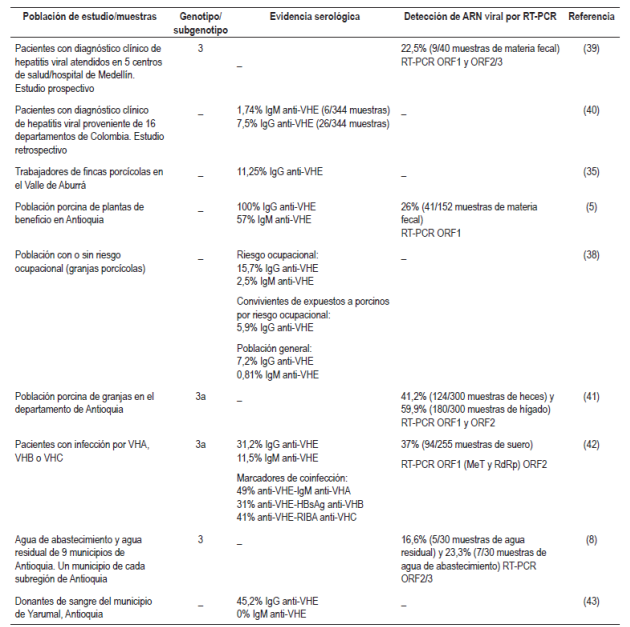
HBsAg: antígeno de superficie de la hepatitis B; RIBA: Recombinant Immuno Assay; RT-PCR: reacción en cadena de la polimerasa con transcriptasa inversa; VHA: virus de la hepatitis A; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
Estudios realizados en el país han reportado una seroprevalencia en población porcina de 100% para anticuerpos tipo IgG y de 57% para anticuerpos tipo IgM anti-VHE. Adicionalmente, hay evidencia molecular que demuestra la presencia del genoma del virus en muestras de heces de población porcina en un rango entre el 26% y el 41%, y en muestras de hígado de la misma población en un 60% 15,44. Las secuencias amplificadas y aisladas de población porcina se agrupan en el genotipo 3 subgenotipo 3a 15 (Tabla 3).
En pacientes existe evidencia serológica y molecular de infección por VHE; se ha reportado la amplificación del genoma viral de 22,5% de las muestras de materia fecal analizadas que permite establecer la circulación de genotipo 3 39. En cuanto a la evidencia serológica, se ha reportado un rango entre 7,5% y 31,2% para anticuerpos tipo IgG anti-VHE y 1,74% y 11,5% para anticuerpos tipo IgM anti-VHE 40,42 (Tabla 3).
Además, en donantes de sangre de zona rural en Antioquia (Yarumal), 45,2% de las muestras analizadas fueron positivas para la presencia de anticuerpos anti-VHE tipo IgG 43 (Tabla 3).
El VHE también ha sido detectado en fuentes de agua de abastecimiento y en agua residual en el departamento de Antioquia. De 60 muestras analizadas, el 20% (12/60) fue positiva para la detección del genoma de VHE por RT-PCR. Se caracterizó el genotipo 3 en las muestras provenientes de los municipios de San Pedro de los Milagros, Venecia y Cisneros 8 (Tabla 3).
Perfil clínico
En la mayoría de los pacientes, el VHE causa una infección autolimitada y generalmente asintomática 6,31. El período de incubación es de 15 a 60 días, con una media de 40 días, en el que se desarrollan los signos y síntomas como fiebre, náuseas, dolor abdominal, vómito, malestar y, en algunos casos, hepatomegalia 6,31,45.
El 75% de los pacientes con una infección aguda presentan ictericia entre la segunda y la cuarta semana después de la infección 6,31 (Tabla 4). El VHE puede detectarse en heces antes del inicio de los síntomas y hasta por 5 semanas después, mientras que el ARN viral en suero es detectable hasta 3 semanas después del inicio de los síntomas 46,47. Los anticuerpos tipo IgM anti-VHE pueden detectarse durante la fase aguda de la enfermedad, específicamente a partir del cuarto día después del inicio de la ictericia y hasta 5 meses después de la infección 48. Los anticuerpos tipo IgG anti-VHE pueden aparecer simultáneamente a la respuesta de anticuerpos tipo IgM, que aumenta a lo largo de la fase aguda y permanece años después de la infección; sin embargo, se desconoce la duración exacta de los anticuerpos tipo IgG 48. La aparición de anticuerpos anti-VHE en suero coincide con el período en el que se elevan las transaminasas en suero 46 (Figura 3).
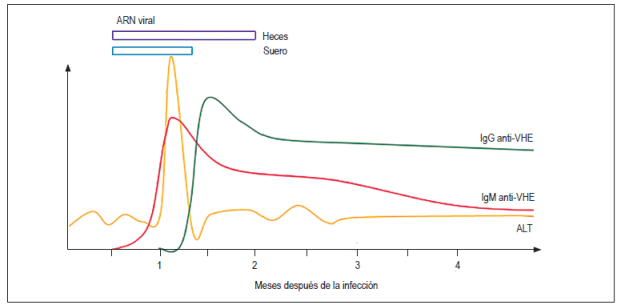
Figura 3 Marcadores serológicos y moleculares en el transcurso de la infección por VHE 49. ALT: alanina aminotransferasa. Modificado de: Aggarwal R. Semin Liver Dis. 2013;331:30-40.
La infección crónica se ha asociado con el genotipo 3 en pacientes que reciben terapia de inmunosupresión por trasplante de órganos, pacientes infectados con el VIH y pacientes que están recibiendo quimioterapia (50-52 (Tabla 4). Se debe tener en cuenta que el peso epidemiológico aún es desconocido, pero se sugiere que los pacientes con terapia de inmunosupresión por trasplante de órganos e infección por VHE pueden presentar una rápida progresión de la fibrosis hepática y evolución a cirrosis 52,53.
Debido a esto, se propone una primera línea de tratamiento que consiste en una reducción de la terapia inmunosupresora, teniendo en cuenta que los medicamentos inmunosupresores como la ciclosporina A, tacrolimus y everolimus favorecen la replicación del VHE; y, por el contrario, el ácido micofenólico bloquea la actividad antiviral 53,54. Si el paciente no logra resolver la infección con esta estrategia, se procede al tratamiento antiviral con ribavirina por 3 meses, que ha demostrado buenos resultados; no obstante, puede presentarse resistencia antiviral asociada con mutaciones como G1634R 53,55. Se ha propuesto la terapia con interferón tipo I pegilado, que ha demostrado in vitro una actividad antiviral moderada contra el VHE 53. Por último, el medicamento sofosbuvir ha demostrado capacidad para inhibir la replicación del virus y la actividad antiviral aumenta cuando se combina con ribavirina 56.
La hepatitis E es clínicamente indistinguible de los otros tipos de hepatitis virales, por lo que el diagnóstico requiere de pruebas serológicas y moleculares 6. Las pruebas serológicas se basan en la detección por inmunoensayo de anticuerpos anti-VHE tipo IgG e IgM, que usan como blanco proteínas recombinantes o péptidos del VHE correspondientes a epítopos de pORF2 6,47,48. Es de resaltar que algunos estudios han demostrado resultados discordantes en la sensibilidad, incluso algunos no detectan anticuerpos tipo IgM en pacientes infectados con VHE, por lo que se genera un resultado de falso negativo. Estas diferencias entre pruebas serológicas disponibles se podrían explicar por la diversidad genotípica; por diferencias en los antígenos utilizados, puesto que los antígenos utilizados en los estuches comerciales solo provienen de genotipo 1 o 3; y por la metodología empleada 47,49; lo que demuestra que las pruebas serológicas disponibles varían en sensibilidad y especificidad, complicando la interpretación de los resultados 47,49. Por tal motivo se recomienda que, siempre que se vaya a hacer un diagnóstico para VHE, se deben emplear tanto las técnicas serológicas como moleculares para garantizar que no existan resultados con falsos negativos 47.
Manifestaciones extrahepáticas
Recientemente, se ha asociado el VHE con manifestaciones extrahepáticas tales como desórdenes neurológicos y hematológicos, lesiones renales y pancreatitis (Tabla 4).
Algunas de las manifestaciones neurológicas observadas en pacientes con infección aguda y crónica causada por VHE son el síndrome de Guillain-Barré, un trastorno autoinmune que afecta principalmente la mielina 57,58; parálisis de Bell, debido al daño o trauma de los nervios faciales que ocasiona parálisis facial 59; amiotrofia neurálgica y neuritis braquial bilateral que afecta principalmente los hombros 57,60; y mielitis transversa aguda causada por un proceso inflamatorio en la médula 61.
En un estudio retrospectivo que incluyó 126 pacientes con infección aguda y crónica por VHE, se reportaron diferentes manifestaciones neurológicas en un 5,5% (7/126) de los pacientes, como el síndrome de Guillain-Barré, neuritis braquial bilateral y encefalitis 62; 3 de los casos correspondían a pacientes con infección aguda por VHE sin ningún tipo de inmunosupresión, mientras que los 4 casos restantes eran pacientes inmunocomprometidos con infección crónica por VHE 62. En este mismo estudio se reportó la presencia de ARN viral en fluido cerebroespinal en 4 pacientes con infección crónica por VHE, lo que sugirió replicación y el posible paso de la barrera hematoencefálica 62.
Con respecto a los desórdenes hematológicos, se han documentado casos de infección aguda por VHE en los que se evidencia trombocitopenia 63, además de anemia aplásica 64.
Se han descrito daños en la función renal en pacientes con infección aguda o crónica por VHE, principalmente en pacientes con trasplante de hígado o pacientes con ingesta de medicamentos que comprometen la función renal 65, causando enfermedades como glomerulonefritis 65.
Por último, se han reportado casos de pancreatitis en pacientes que presentan una infección aguda por genotipo 1 del VHE 66.
Conclusión
Es necesario alertar al personal médico sobre la importancia de incluir el VHE en el diagnóstico de hepatitis virales en Colombia; dado que existe evidencia de la circulación del virus en pacientes, donantes de sangre, trabajadores de granjas porcícolas, población conviviente con trabajadores de granjas porcícolas, población porcina y fuentes de agua de abastecimiento y residual. Aunque esta infección es autolimitada en la mayoría de los casos, también puede progresar a infección crónica o cirrosis. Además, es importante describir la epidemiología de una infección emergente en la población para el control de este virus.











 texto en
texto en