Introducción
La alergia a la proteína de leche de vaca (APLV) es la alergia alimentaria más frecuente en el primer año de vida, puesto que la proteína de la leche de vaca (PLV) suele ser la primera proteína a la cual se enfrenta el niño 1,2. Sin un adecuado diagnóstico y tratamiento, el crecimiento y desarrollo psicomotor pueden verse comprometidos, además de predisponer a otras enfermedades atópicas como el asma, dermatitis atópica y rinitis (marcha alérgica); con deterioro de la calidad de vida y aumento en los costos del tratamiento 1,2.
Recientemente, se ha descrito un aumento en la incidencia de las alergias alimentarias, especialmente en países desarrollados 3,4. En el caso de Colombia, múltiples estudios demuestran un posible incremento en la prevalencia de las mismas 5,6,7. Entre el 5% y el 15% de los lactantes muestran síntomas sugestivos de reacciones adversas a las PLV, mientras que las estimaciones de la prevalencia real de la APLV varían del 2% al 7,5%, cifras que van en aumento en todos los países 8.
La APLV se puede presentar en lactantes alimentados con leche materna o fórmula de leche de vaca y, por lo general, ocurre en las primeras semanas después de la introducción de fórmulas a base de leche de vaca. La APLV se puede encontrar también en lactantes alimentados exclusivamente con leche materna, aunque la incidencia en este grupo es baja (0,5%) y la presentación clínica no es tan severa 9. La presentación es variable y ningún síntoma es patognomónico. Las manifestaciones clínicas se producen principalmente en el tracto digestivo (50%-60%), la piel (50%-60%) y el tracto respiratorio (20%-30%); y, según el grado de severidad, se consideran leves, moderadas o graves 9,10.
Se reconoce que algunos antecedentes familiares y perinatales aumentan la predisposición a la alergia, alterando la permeabilidad y la formación de la microbiota intestinal. Dentro de los factores de riesgo descritos se destaca la presencia de atopia familiar, el nacimiento por cesárea, ser madre >30 años, ser madre fumadora e inicio de sucedáneo de la leche materna en las primeras semanas de vida 11-21, entre otros.
Una buena historia clínica, incluidos los antecedentes familiares de atopia, la suma de otros factores de riesgo y un examen clínico cuidadoso son la clave en el proceso de diagnóstico de la APLV. Las pruebas cutáneas (leche fresca o extractos de leche entera) de parche y la inmunoglobulina E (IgE) específicas tienen una sensibilidad del 31,8% y 90,3%, y especificidad del 20,5% y 88,9%, respectivamente 22.
Un reto doble ciego controlado con placebo es la regla de oro en el diagnóstico de la APLV; sin embargo, en la práctica diaria se realiza un desafío o reto abierto 23. A los lactantes con sospecha de APLV se les retira la PLV durante 2-4 semanas. Aquellos alimentados con fórmula se les suministra una fórmula extensamente hidrolizada (FEH) y se le indica una dieta libre de leche de vaca a la madre lactante, con un suplemento de calcio para evitar complicaciones asociadas. Si existe una APLV, las manifestaciones clínicas desaparecen. A las 4 semanas del retiro se realiza el desafío con la introducción de productos con leche de vaca en la dieta materna en el lactante o fórmulas a base de leche de vaca. La reaparición de los síntomas sugiere, para el presente estudio, el diagnóstico de APLV. Si los pacientes no responden a una FEH, se introducirá una fórmula a base de aminoácidos (FAA).
Un estudio reciente en la población colombiana documentó que durante un período de seguimiento por gastroenterología pediátrica de niños con sospecha de APLV de 14 ± 1,4 meses, 47,5% de los pacientes respondió a una FEH a base de caseína ± lactancia materna. La mayoría de lactantes sin respuesta presentó una mejoría clínica con una fórmula de aminoácidos ± lactancia materna y dieta sin PLV a la madre 21.
No existen estudios en la población colombiana que reporten la respuesta, aceptabilidad y tolerancia a una FEH a base de proteínas de suero de leche de vaca (FEH-S) en pacientes con sospecha de APLV.
Objetivo
Determinar los desenlaces clínicos del tratamiento con una FEH-S (Nutrilón Pepti Junior®) en lactantes (<12 meses) con APLV, atendidos en la consulta externa de la sección de gastroenterología pediátrica de un hospital de referencia.
Materiales y métodos
Se realizó un estudio observacional retrospectivo, tipo serie de casos de lactantes (≤12 meses) con síntomas sugestivos de APLV que consultaron en la sección de gastroenterología pediátrica del HU-FSFB entre enero de 2011 y octubre de 2015, en quienes se realizó un desafío o reto abierto con una FEH a base de suero (Nutrilón Pepti Junior®) ± leche materna. Para el estudio se tomó como diagnóstico de APLV la reaparición de los síntomas por los cuales consultó el paciente después del desafío con PLV, teniendo en cuenta que no se realizó el reto controlado doble ciego con placebo. Se incluyeron aquellos pacientes con diagnóstico de APLV y que tuvieron seguimiento clínico mínimo de 3 meses después del inicio de la fórmula. Se excluyeron los pacientes con sospecha o diagnóstico principal diferente a APLV (p. ej. síndrome de malabsorción, enfermedades metabólicas, hepáticas, renales, entre otras).
La información de las historias clínicas se recolectó por medio de los sistemas de información HIS-ISIS® del HU-FSFB y MEDSYS V4.0® de la Asociación Médica de los Andes (AMA). La información de: datos demográficos, manifestaciones digestivas, tiempo de inicio de síntomas, antropometría y respuesta clínica a la fórmula se registró mediante un cuestionario consignado en una base de datos en Excel 2010.
El estado nutricional para la primera consulta de gastroenterología pediátrica, segunda consulta y la consulta al año de edad se calcularon de acuerdo con el z-score para peso/edad; talla/edad; peso/talla y perímetro cefálico (PC)/edad con el software OMS Anthro versión 3.2.2. (2011).
Los desenlaces clínicos se definieron de acuerdo con el cambio en la mejoría de los síntomas, la diferencia en el estado nutricional antes y después de la intervención, y la aceptabilidad y tolerancia a la fórmula.
El análisis estadístico se realizó con el programa STATA Special Edition 11.1. Se calcularon medidas de tendencia central para las características demográficas de los pacientes. Se realizaron pruebas t de Student para comparar variables cuantitativas de distribución normal. Se consideró estadísticamente significativo un valor de p <0,05. Este estudio fue aprobado por el Comité de Ética Institucional.
Resultados
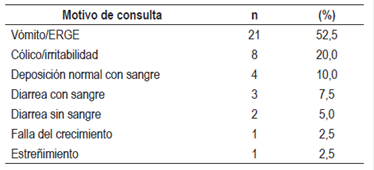
Se diagnosticaron 40 lactantes (42,5% varones) con edad promedio de 3,32 ± 2,37 meses con cuadro clínico de 1,74 ± 1,50 meses de evolución, los cuales se siguieron en la consulta de gastroenterología por 10,65 ± 6,76 meses. Los síntomas que presentaron se resumen en la Tabla 1.
El pediatra sospechó APLV solamente en 8 (20%) pacientes. En los demás pacientes se diagnosticó y trató como ERGE en 21 (52,5%) pacientes; cólico/irritabilidad en 7 (17,5%), rectorragia en 3 (7,5%) y estreñimiento en 1 (2,5%) paciente.
Como parte de la valoración y manejo inicial por pediatría, 6 (15%) pacientes tenían coproscópicos normales, 2 (5%) hemograma con eosinofilia (>300 eosinófilos totales) y 2 (5%) anemia. En 3 (7,5%) pacientes se descartaron alteraciones estructurales anatómicas mediante una radiografía de vías digestivas altas. 19 (47,5%) pacientes recibieron terapia con domperidona; 12 (30%) recibieron terapia supresora de ácido con inhibidor de bomba de protones (IBP); 8 (20%) recibieron bloqueante anti-H2, antiácido y probiótico; 4 (10%) recibieron antiespasmódico; 3 (7,5%) recibieron polietilenglicol y simeticona; y un paciente recibió antibiótico y medicación homeopática.
Ante la sospecha diagnóstica, el pediatra indicó una dieta materna libre de lácteos en 13 (32,5%) pacientes, 11 (27,5%) recibieron fórmulas parcialmente hidrolizadas (Confort®), en 6 (15%) el pediatra indicó una FEH a base de suero y en 1 (2,5%) paciente se suspendió la lactancia materna. En el caso de 7 (17,5%) pacientes que recibieron fórmulas parcialmente hidrolizadas (Confort®) o fórmula de PLV, a sus madres se les ordenó una dieta libre de lácteos.
En la primera valoración por gastroenterología pediátrica, 4 (10%) pacientes cursaban con síndrome broncoobstructivo y en el examen físico se documentaron, 11 (27,5%) pacientes con dermatitis atópica y 5 (12,5%) con eritema perianal y costra láctea. La valoración nutricional determinó que 5 (12,5%) pacientes se encontraban con desnutrición aguda moderada y 9 (22,5%) pacientes estaban en riesgo de desnutrición aguda. 1 (2,5%) paciente estaba en riesgo de sobrepeso.
Los factores asociados con el desarrollo de APLV, en congruencia con lo descrito en la literatura, se muestran en la Tabla 2.
El manejo por gastroenterología pediátrica se realizó entre las siguientes aproximaciones: continuar con la lactancia materna con una dieta materna sin PLV con suplementación de calcio y FEH-S (Nutrilón Pepti Junior ® ), alimentación exclusiva con una FEH-S o paso a una FAA libres por falta de respuesta (Tabla 3).
21 pacientes que consultaron por ERGE/vómito requirieron procinéticos y terapia supresora de ácido transitoriamente. Solo a 5 pacientes se les solicitó IgE específica (con resultados negativos), a 5 hemograma (3 presentaron eosinofilia y 2 anemia), a 3 se les descartó anomalías anatómicas mediante una radiografía vías digestivas altas y 1 requirió la realización de un procedimiento endoscópico que demostró proctocolitis eosinofílica. La alimentación complementaria se inició a los 5,22 ± 0,54 meses. 17 (67,5%) pacientes toleraron el huevo y 25 (62,5%) el pescado antes del primer año de vida. Adicionalmente, se determinó que 14 (35%) pacientes cursaron con dermatitis atópica, 4 (10%) con episodios broncoobstructivos y 3 (7,5%) con rinitis alérgica.
Se comparó el estado nutricional de la primera consulta de gastroenterología (3,3 ± 2,3 meses) con el estado nutricional al año de edad de 24 pacientes con la FEH-S y se encontró una mejoría en el seguimiento posterior con el z-score de peso/edad, peso/talla y PC/edad. El cambio del z-score para talla/edad no fue estadísticamente significativo (Tabla 4).
Tabla 4 Estado nutricional (z-score ± desviación estándar [DE]) en la primera consulta de gastroenterología pediátrica y en el seguimiento posterior al año de edad
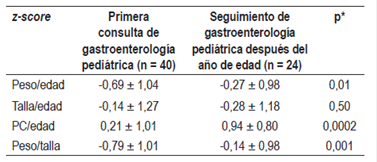
*p <0.05 (prueba t de Student, muestras pareadas).
En el seguimiento de 24 pacientes después del año de edad, se encontró que 19 (79,2%) pacientes toleraron la PLV entre los 12 y 17 meses, 4 (16,6%) entre los 18 y 23 meses, y 1 (4,2%) paciente después de los 2 años.
Discusión
La evidencia actual acerca de la respuesta a una FEH a base de suero es insuficiente. Los hallazgos de este estudio fortalecen la evidencia disponible acerca de los desenlaces clínicos medidos, tanto en mejoría de síntomas como en el estado nutricional de los pacientes tratados con una FEH a base de suero.
Dentro de los principales factores asociados con el desarrollo de APLV (Tabla 2) se encontraron 2 factores modificables: nacimiento por cesárea y exposición temprana a la PLV. El motivo de consulta principal más frecuentemente encontrado fue vómito y regurgitación, seguido de cólico e irritabilidad. Esta información es acorde con lo reportado en la literatura 9,10. Sin embargo, refleja lo poco específico que puede ser el cuadro clínico, además del corto tiempo de evolución de los síntomas, lo cual puede hacer aún más desafiante la sospecha diagnóstica.
Llama la atención que solo en el 20% de los casos el pediatra sospechó de APLV, por lo que en la mayoría de los pacientes se tomaron conductas nutricionales no indicadas en el manejo de la APLV como el cambio a otras fórmulas que contienen PLV e incluso interrupción de la lactancia materna en 1 paciente. Como resultado, la conducta nutricional tampoco fue la más adecuada: se encontró una prevalencia del 20% de terapia con medicamentos antiácidos, que no hacen parte del algoritmo de manejo farmacológico de los síntomas de APLV 23. Lo anterior hace evidente el desconocimiento acerca de este tema desde el ámbito de la pediatría y la atención primaria. Por lo anterior, se hace prioritario el desarrollo de una guía de práctica clínica que estandarice el diagnóstico y manejo de la APLV en nuestro medio desde el primer contacto del paciente con el sistema de salud, con el fin de disminuir la carga de morbilidad asociada con la APLV.
La evaluación clínica detallada en la consulta de gastroenterología pediátrica permitió identificar la concomitancia de diversas manifestaciones atópicas como la dermatitis atópica, los síndromes broncoobstructivos y la rinitis alérgica hasta en el 25% de los pacientes. Este hallazgo concuerda con lo descrito en la literatura acerca de la relación de la APLV con la marcha atópica en la infancia 20.
Un gran porcentaje de los pacientes refirió una mejoría de los síntomas en la segunda consulta con gastroenterología pediátrica, la cual sucedía en la mayoría de los casos entre 30 y 90 días después del inicio del tratamiento. Durante el seguimiento, 37 de los 40 pacientes tuvieron una respuesta positiva al tratamiento con la FEH, entendida como la desaparición de los síntomas por los cuales consultaron inicialmente. Se observó una recuperación nutricional estadísticamente significativa en los z-score de peso/edad y peso/talla, lo cual sustenta la pertinencia y utilidad de este tipo de fórmula dentro del tratamiento de los pacientes con APLV. Además, en términos económicos, su costo es mucho menor en comparación con una FAA libres, la cual es el siguiente escalón de tratamiento si se presenta persistencia de los síntomas, tal como sucedió con los 3 casos restantes del total de la muestra.
La tolerancia al pescado y huevo se presentó antes del año de edad en la mayoría de pacientes y a la PLV antes de los 18 meses en más de la mitad de los casos.
A pesar de que este estudio demuestra una adecuada respuesta clínica con una FEH a base de suero en aquellos lactantes con sospecha de APLV, su naturaleza retrospectiva no permite establecer causalidad. Se requieren ensayos clínicos controlados doble ciego que permitan establecer de forma prospectiva la causalidad entre la exposición a una FEH a base de suero y la resolución de los síntomas de APLV.
Conclusiones
Los principales síntomas de los pacientes incluidos en este estudio y por los cuales consultaron fueron vómito/ERGE, cólico/irritabilidad y deposiciones sanguinolentas. Los principales factores asociados con el desarrollo de APLV identificados en esta población eran modificables. Se encontró una recuperación nutricional y tolerancia a la leche de vaca en un alto porcentaje de lactantes con APLV que recibieron una FEH a base de suero. Los hallazgos de este estudio son congruentes con otros descritos en la literatura mundial.











 text in
text in