Introducción
La enfermedad inflamatoria intestinal (EII) es una patología inflamatoria crónica y recurrente del tracto digestivo, de etiología incierta y, en algunos casos, con afectación de otros órganos. Se considera que la combinación de factores genéticos y medioambientales causan una alteración en la respuesta inmune que termina afectando el tracto gastrointestinal. La colitis ulcerativa (CU) y la enfermedad de Crohn (EC) son los tipos principales de EII.
La incidencia y prevalencia de la EII es mayor en los países industrializados. Sin embargo, actualmente hay una tendencia global al aumento de la incidencia y prevalencia de esta enfermedad, incluidos los países no industrializados. En 1991, en Colombia se publicó un trabajo que describía 108 casos de EII en 2 centros médicos en Bogotá (98 CU, 10 EC) en el período comprendido entre 1968 y 1990 1. En 2010, se describieron a 26 pacientes en Cartagena (20 CU, 6 EC) y se estimó una prevalencia general de 29/100 000 para esta ciudad 2. En el 2010, se publicó un estudio que describió el fenotipo e historia natural de la EII en un centro de referencia en Medellín en 202 pacientes vistos entre el 2001 y el 2009; el 80,7% correspondían a CU y el 15,8% a EC 3.
Este trabajo describe las características de fenotipo y el tipo de tratamiento administrado a 165 pacientes con EII que consultaron entre el 5 de julio del 2013 y el 31 de diciembre del 2016 en un hospital universitario de la ciudad de Bogotá, Colombia.
Materiales y métodos
Se realizó un estudio descriptivo basado en frecuencias y proporciones de pacientes con diagnóstico de EII atendidos en la Clínica Universitaria Colombia (Bogotá) entre el 5 de julio del 2013 y el 31 de diciembre del 2016. Solo se incluyeron pacientes con diagnósticos confirmados de EC y CU, con base en las recomendaciones de las guías europeas para el diagnóstico de la EII 4,5 y que llevaran por lo menos 3 meses de sintomatología.
Resultados
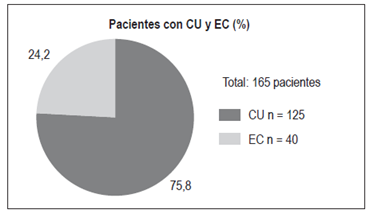
Se evaluaron a 165 pacientes, 125 con CU (75,8%) y 40 con EC (24,2%) (Figura 1).
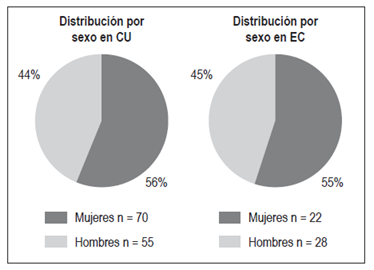
En la distribución por sexo, se encontraron 70 mujeres (56%) y 55 hombres (44%) en CU, y 22 mujeres (55%) y 18 hombres (45%) en EC (Figura 2).
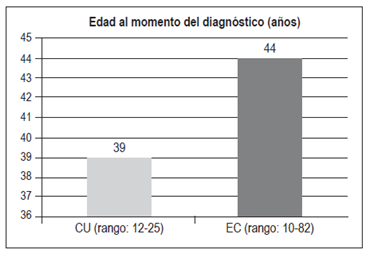
La edad promedio del diagnóstico fue de 39 años (12-75 años) en CU y de 44 años (10-82 años) en EC (Figura 3)
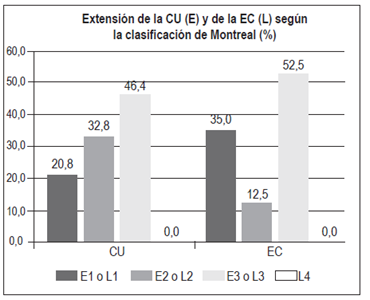
Extensión de la enfermedad (clasificación de Montreal) (Figura 6)
E1 (proctitis): n = 26 (20,8%)
E2 (colitis izquierda): n = 41 (32,8%)
E3 (pancolitis): n = 58 (46,4%)
L1 (íleon): n = 14 (35%)
L2 (colon): n = 5 (12,5%)
L3 (ileocolónica): n = 21 (52,5%)
L4 (tracto digestivo superior aislado): n = 0
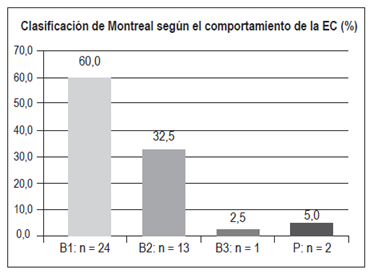
Comportamiento de la EC (Figura 7)
B1 (inflamatorio): n = 24 (60%)
B2 (estenosante): n = 13 (32,5%)
B3 (penetrante fistulizante, diferente a perianal): n = 1 (2,5%)
P (perianal): n = 2 (5%)
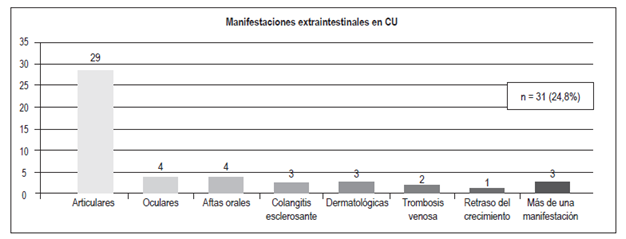
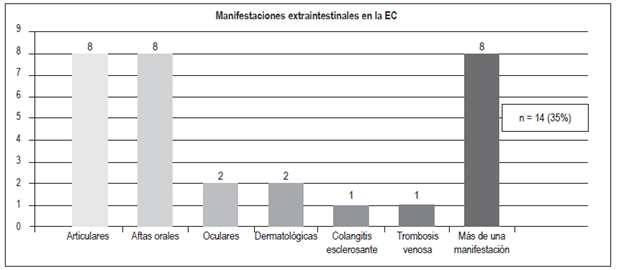
Manifestaciones extraintestinalesFigura 8 Figura 9
Articulares: 29 casos;
Oculares: 4;
Aftas orales: 4;
Colangitis esclerosante: 3;
Dermatológicas (eritema nodoso, pioderma gangrenoso): 3;
Trombosis venosa: 2;
Retraso del crecimiento: 1. 3 pacientes tenían más de 1 manifestación extraintestinal
Articulares: 8;
Aftas orales: 8;
Oculares: 2;
Dermatológicas: 2 (dermatitis herpetiforme, pioderma gangrenoso);
Colangitis esclerosante: 1;
Trombosis venosa: 1. 8 pacientes tenían más de 1 manifestación extraintestinal
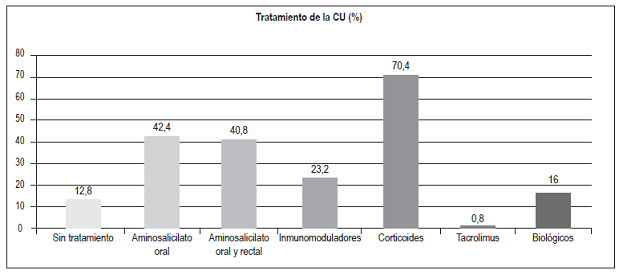
Tratamiento para los pacientes con CU (Figura 10)
Sin tratamiento: 16 (12,8%)
Aminosalicilatos: 104 (83,2%):
Solo oral: 53 (42,4%)
Oral y rectal: 51 (40,8%)
Inmunomoduladores:
Azatioprina, mercaptopurina: 29 (23,2%)
Exposición a corticoides: 88 (70,4%)
Tacrolimus: 1 (0,8%)
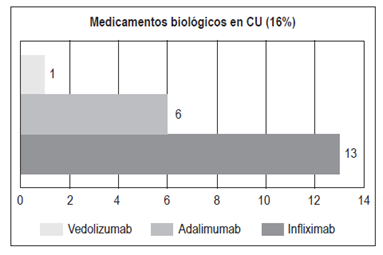
Biológicos: 20 (16%):
Infliximab: 13
Adalimumab: 6
Vedolizumab: 1. El 44% de los pacientes con biológicos recibieron terapia combinada con inmunomodulador
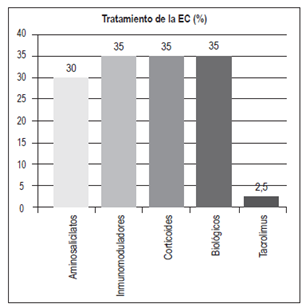
Tratamiento para los pacientes con EC (Figura 11)
Aminosalicilatos: 12 (30%)
Inmunomoduladores: 14 (35%)
Exposición a corticoides: 14 (35%)
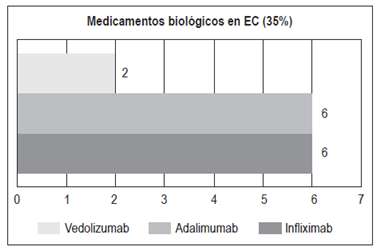
Biológicos: 14 pacientes (35%)
Adalimumab: 6
Infliximab: 6
Vedolizumab: 2. De los pacientes en tratamiento con biológico, 4 (28,5%) estaban bajo terapia combinada con inmunomodulador. 1 paciente recibió tacrolimus (2,5%).
Cirugías
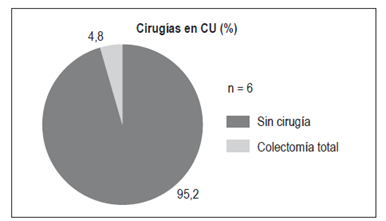
En pacientes con CU: 6 pacientes (4,8%) requirieron colectomía total (Figura 12).
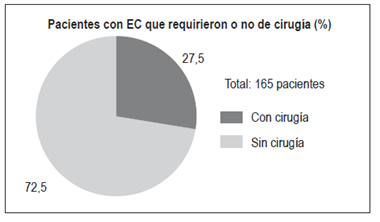
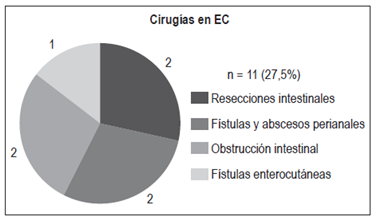
En pacientes con EC: 11 pacientes (27,5%):
Resecciones intestinales: 2
Abscesos y fístulas perianales: 2
Obstrucción intestinal: 2
Fístulas enterocutáneas: 1 (Figuras 13 y 14)
Discusión
La EII es más común en países desarrollados, especialmente en Norteamérica y Europa occidental 6. La incidencia anual de la CU en Norteamérica es de 19 casos por 100 000 habitantes y la prevalencia es de 37-248 casos por 100 000 habitantes. La incidencia en Europa es de 24 casos por 100 000 habitantes, con una prevalencia de 4,9-505 casos por 100 000 habitantes. La incidencia de la EC es similar: 20 casos por 100 000 habitantes en Norteamérica y 12,7 casos por 100 000 habitantes en Europa 7. La incidencia de la EII se ha incrementado a nivel mundial. En Europa, la incidencia de la CU aumentó de 6 casos por 100 000 personas/año y la de EC de 1 caso por 100 000 personas/año en 1962 a 9,8 y 6,3 casos por 100 000 personas/año respectivamente en el 2010 8. Similares resultados se han observado en Estados Unidos 9. La EII era considerada infrecuente en los países orientales; sin embargo, los datos epidemiológicos en Japón, Corea y Hong Kong han mostrado una incidencia aumentada entre 1980 y 2003 10. En estas poblaciones, la incidencia de la CU es mayor que la de la EC y el aumento en la incidencia de la CU casi siempre precede al aumento de la incidencia de la EC por una década 7, hallazgos que pudieran ser similares a lo que está ocurriendo en la población colombiana. Se considera que la occidentalización de los hábitos de vida es un factor que puede influir en el aumento en la incidencia de la EII 6.
Este estudio describe a 165 pacientes con EII pertenecientes a una entidad prestadora de salud que maneja medicina del plan obligatorio de salud y prepagada, valorados en la Clínica Universitaria Colombia en Bogotá. El 75,8% de los casos correspondieron a CU y el 24,2% a EC, lo cual concuerda con otros estudios realizados en Colombia en los que se observa que la CU es más frecuente 1,2,3.
El sexo femenino correspondió al 56% en la CU y al 55% en la EC. En otros estudios se ha encontrado una relación mujer: hombre de 1,3:1 para la EC y sin diferencias de sexo para la CU 11,12,13.
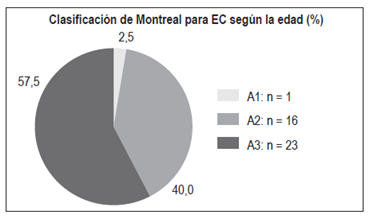
La CU puede comenzar a cualquier edad, aunque es infrecuente antes de los 5 años y después de los 75 años. La incidencia pico sucede en la segunda y tercera décadas de vida, con un segundo pico entre los 60 y 70 años. La EC se presenta con mayor frecuencia entre los 15-30 años, con una edad promedio de 30 años, aunque se ha observado un aumento en el diagnóstico de la EC en pacientes de 60 años y mayores 14,15. En este estudio, la edad promedio en que se hizo el diagnóstico fue de 39 años (12-75 años) para CU y de 44 años (10-82 años) para EC; la mayoría de los pacientes con CU correspondieron al grupo A2 (53%) y en la EC al grupo A3 (57,5%), lo que demuestra una presentación más frecuente en el grupo de mayor edad para la EC, hallazgos similares a los de Juliao 3. Debido a que este estudio se basó en una población atendida por un servicio de gastroenterología para adultos, es de esperar que los grupos A1 (menores de 17 años) tanto para CU como para EC estén subvalorados.
El fenotipo de la EII ha cambiado en los últimos años 16,17. Aunque la extensión de la CU se divide en forma relativamente equivalente entre proctitis, colitis izquierda y pancolitis, la proporción de pacientes que se presentan con pancolitis se ha incrementado en las últimas décadas en países como Dinamarca, donde la pancolitis correspondía al 18% de los casos entre 1962-1987 y se incrementó al 27% entre el 2003-2004 18. En Australia hay predominio de pancolitis: 41% 19. La colitis izquierda es la manifestación inicial más frecuente en Hungría: 50% 20 y Holanda: 52% 21, y la proctitis es la más frecuente en Asia: 37% (19) (Figura 15). En estudios previos en la población colombiana 3 se ha encontrado predominio de la colitis izquierda (45%), mientras que en este estudio la principal manifestación fue pancolitis: 46,4%; y la proctitis fue la menos frecuente: 20,8%.
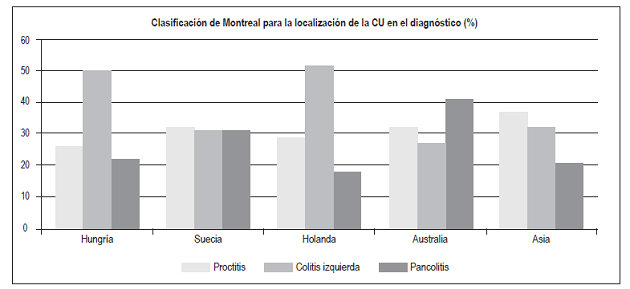
Figura 15 Clasificación de Montreal para la localización de la CU en el diagnóstico. Modificado de: Moran C et al. Gastroenterol Res Pract. 2016;2016:1-9.
Con respecto a la EC, el compromiso ileocolónico fue el más frecuente (52,5%), similar a los hallazgos en estudios de Hungría, Holanda, Australia-Asia (Figura 16) y Colombia (50%) 3,19,20,21. Se encontró un compromiso aislado de íleon en el 35%, aislado de colon en el 12,5% y no se encontraron casos de EC de tracto digestivo alto. El comportamiento de la EC fue principalmente inflamatorio (60%), seguido por un fenotipo estenosante (32,5%), perianal (5%) y fistulizante no perianal (2,5%). Este comportamiento es similar al encontrado en un estudio en Holanda, donde la mayoría de los casos fue de tipo inflamatorio luminal (68%), seguido por el fenotipo estenosante (19%) con una menor proporción de manifestaciones fistulizantes y perianal (11% y 9%, respectivamente). Hallazgos similares se han encontrado en un estudio multicéntrico europeo y en Noruega, con predominio del fenotipo inflamatorio en el 73,7% y 62%, respectivamente; seguidos por el fenotipo estenosante (15,9% y 27%, respectivamente) 22,23. En contraste, el estudio del Dr. Juliao 3 en la población colombiana encontró un porcentaje menor de fenotipo inflamatorio (34,4%), probablemente por el lapso prolongado entre el inicio de la sintomatología y la consulta.
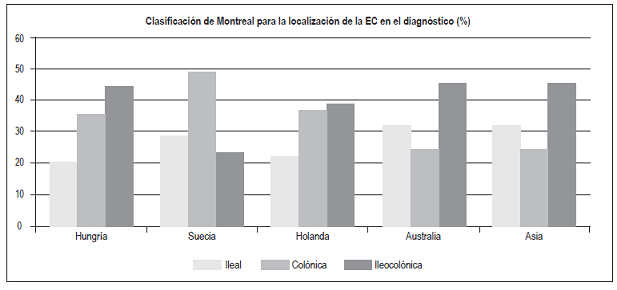
Figura 16 Clasificación de Montreal para la localización de la EC en el diagnóstico. Modificado de: Moran C et al. Gastroenterol Res Pract. 2016;2016:1-9.
Un 50% de los pacientes con EII presentan al menos una manifestación extraintestinal, más frecuentemente en la EC (especialmente con compromiso colónico), en comparación con la CU 24. En el presente estudio se encontró que un mayor porcentaje de pacientes con EC (35%) presentó manifestaciones extraintestinales en comparación con los pacientes con CU (24,8%); las más frecuentes fueron las articulares en ambos grupos (23% en la CU y 20% en la EC) y las aftas orales (3,2% en la CU y 20% en la EC). Estos resultados son similares a los encontrados en la población colombiana y en otros grupos, donde se reportan manifestaciones articulares en un 16%-35% de los pacientes 3,25,26,27. Un mayor porcentaje de pacientes con EC (20%) presentó más de una manifestación extraintestinal; esto sucedió en 3 pacientes con CU (2,4%).
El tratamiento de la CU depende de varios factores 28. La terapia de primera línea son los aminosalicilatos. En este estudio, el 100% de los pacientes recibió en algún momento aminosalicilatos. Por ser un estudio descriptivo, al momento de recolectar la información, el 83,2% de los pacientes recibieron aminosalicilatos (42,4% por vía oral y 40,8% por vías oral y rectal). Un 12,8% no recibió aminosalicilatos debido principalmente a la falta de eficacia del medicamento o al antecedente de colectomía total. El 23,2% de los pacientes recibió un inmunomodulador (azatioprina o 6-mercaptopurina). La exposición a corticoides se observó en el 70,4% de los pacientes y en ningún caso se utilizaron de forma crónica. En los casos refractarios a la terapia inicial (aminosalicilatos e inmunomoduladores), en los pacientes dependientes o refractarios a corticosteroides y en los pacientes hospitalizados con una colitis activa grave que no responde en 3 a 5 días al uso de corticoides endovenosos se indicó el uso de terapia biológica 28. El 16% de los pacientes con CU recibió tratamiento biológico y la mayoría cursaba con pancolitis (75%), el 20% correspondió a E2 y el 5% a E1. El biológico más frecuentemente administrado fue el infliximab (13 pacientes). 6 pacientes recibieron adalimumab y 1 paciente vedolizumab (Figura 17). El 44% de los pacientes con biológicos recibió concomitantemente un inmunomodulador: 61,5% de los pacientes con infliximab y 16,6% de los pacientes con adalimumab. La principal razón para que los pacientes con infliximab no recibieran inmunomodulador fue la presencia de efectos adversos (dolor abdominal, elevación de enzimas hepáticas o toxicidad hematológica). 1 paciente (0,8%) con pancolitis recibió tacrolimus debido a la falta de respuesta al infliximab y 1 paciente recibió vedolizumab como tercer biológico, por falta de respuesta a los 2 antifactor de necrosis tumoral (anti-TNF) y haber rechazado la posibilidad de colectomía.
Para el tratamiento de la EC existen varias alternativas: corticoides, inmunomoduladores y biológicos 29. La mesalazina ha mostrado un beneficio muy marginal en la EC. En un estudio se encontró que la mesalazina era equivalente a la budesonida en la enfermedad ileocecal leve, lo cual podría sugerir un rol para los aminosalicilatos en la EC leve; sin embargo, un metaanálisis confirmó que la budesonida debe preferirse en este escenario clínico. No se ha encontrado una clara evidencia de que la mesalazina sea mejor que el placebo en la EC 29. En este estudio, el 30% de los pacientes con EC recibió aminosalicilatos, el 35% estuvo expuesto a corticoides (21% budesonida y 79% corticoides sistémicos) y un 35% recibió inmunomoduladores (azatioprina o 6-mercaptopurina). En comparación con los pacientes con CU, un mayor porcentaje de pacientes con EC (35%) requirió un tratamiento con biológicos, siendo igual la frecuencia del uso de infliximab y adalimumab (6 pacientes para cada medicamento) (Figura 18). 2 pacientes recibieron vedolizumab: una paciente con intolerancia a infliximab (leucopenia severa) y no respondedora primaria a adalimumab, y un paciente con pérdida de respuesta a infliximab y no respondedor primario a adalimumab. El 28,5% de los pacientes con anti-TNF recibió terapia combinada con un inmunomodulador. 1 paciente (2,5%) recibió tacrolimus.
Entre un 4%-9% de los pacientes con CU requiere cirugía (proctocolectomía) como tratamiento definitivo durante el primer año del diagnóstico y el riesgo de necesitar cirugía después es del 1% por año. Las indicaciones de cirugía pueden ser urgentes (perforación de colon, megacolon tóxico, colitis fulminante refractaria al manejo médico y sangrado no controlado) o electivas (refractariedad al manejo médico, adenocarcinoma de colon y algunos casos de hallazgo de displasia en las biopsias) 30. En este estudio, el 4,8% de los pacientes con CU requirió colectomía total, similar a los datos publicados en otros países y en Colombia (6% en el estudio de Juliao) 3.
A pesar de los avances en el tratamiento médico de la EC, un porcentaje significativo de los pacientes aún necesita alguna cirugía. Un 80% de los pacientes puede requerir al menos un procedimiento quirúrgico a lo largo de su vida, con un riesgo alto de recurrencia posquirúrgica (30% a los 3 años y 60% a los 10 años). El 70% de los pacientes puede necesitar una segunda resección intestinal 31. Las indicaciones de cirugía en EC son variadas: enfermedad obstructiva sin actividad inflamatoria significativa, abscesos, fístulas, la indicación de estenoplastia y la enfermedad perianal 31,32. En este estudio, un 27,5% de los pacientes con EC requirió algún tipo de cirugía: resecciones intestinales por estenosis y masa (n = 2), abscesos y fístulas perianales (n = 2), obstrucción intestinal sin requerimiento de resección intestinal (n = 2) y fístula enterocutánea (n = 1).











 text in
text in