Introducción
El cáncer de primario desconocido (CPD) es un grupo heterogéneo de tumores malignos con confirmación histológica de una de las lesiones metastásicas, en los cuales la lesión primaria no es identificada a pesar de un enfoque diagnóstico estandarizado 1,2. Representa el octavo cáncer más frecuente en el mundo 1, es una neoplasia de mal pronóstico, con supervivencia media de 3 meses 3. En el 10%-30% de los casos, no se logra encontrar el tumor que origina la metástasis aun después realizar una búsqueda exhaustiva con las técnicas más avanzadas -como el perfil molecular- e incluso después de la autopsia 4. Debido a la gran dificultad para encontrar el sitio primario y ofrecer un tratamiento específico, recientemente se han investigado nuevas formas de actuar frente a este tumor en las que se incluyen estudios moleculares, imagenológicos, de inmunohistoquímica y genéticos, que permitan mejorar la supervivencia de estos pacientes 2,4,5,6,7.
Teniendo en cuenta la importancia del tema en la práctica clínica diaria y especialmente en gastroenterología, se decidió realizar la siguiente revisión con el propósito de orientar al clínico sobre el enfoque y el manejo de los pacientes con este tipo de presentación oncológica.
Metodología
Se establecieron estrategias de búsqueda conformadas por los términos cancer of unknown primary, neoplasms, unknown primary [MeSH] en asociación con cada punto de interés y se utilizaron términos MeSH y no MeSH en español y en inglés. Las estrategias de búsqueda utilizadas fueron: neoplasms, unknown primary AND epigenetic; neoplasms, unknown primary AND immunohistochemical diagnosis; neoplasms unknown primary AND molecular diagnosis; neoplasms, unknown primary AND colonoscopy; neoplasms, unknown primary AND diagnosis; neoplasms, unknown primary AND endoscopy; neoplasms, unknown primary AND treatment. Se realizó la búsqueda de la literatura científica en las bases de datos Pubmed, Embase, Cochrane, Science Direct y Lilacs. Los límites empleados fueron idioma español o inglés, especie humanos y fecha de publicación 2012 a 2017. Se incluyeron aquellos artículos que correspondieran a guías de práctica clínica, estudios observacionales, ensayos clínicos controlados y aleatorizados, y revisiones, revisiones sistemáticas o metaanálisis; de estos, se seleccionaron los que los autores consideraron pertinentes. Adicionalmente, los autores agregaron a la revisión algunos de los artículos mencionados en las referencias de las publicaciones seleccionadas en la búsqueda inicial.
El CPD es un tumor muy agresivo y de mal pronóstico, que a pesar de ser la octava causa de cáncer, es la cuarta causa de muerte por cáncer en el mundo 1,2,8. La supervivencia después del diagnóstico varía de 11 semanas a 11 meses 9, con una media de 3 meses 3. Representa el 3% al 5% de todos los tumores malignos 1,2,8. Así mismo, tiene una incidencia de 7 a 12 casos/100 000 habitantes/año 2,10. Cada año en Estados Unidos (EE. UU.) se diagnostican 30 000 nuevos casos 9. A medida que aumenta la edad, aumentan los casos con una edad media de presentación de 60-65 años (1. Además de su agresividad, se añade su capacidad metastásica temprana en localizaciones impredecibles 1,8. Esas metástasis afectan 3 o más órganos en un tercio de los pacientes al diagnóstico 8. Los sitios más frecuentes de las metástasis incluyen el abdomen e hígado, seguidos del tórax, cuello y huesos 11. Desde el punto vista histológico, puede clasificarse en 5 subtipos: el subtipo más frecuente es el adenocarcinoma bien y moderadamente diferenciado (60%), seguido del adenocarcinoma o carcinoma mal diferenciado (29%), carcinoma escamocelular (5%) y las neoplasias malignas mal diferenciadas (5%) 1.
Enfoque inicial
La confirmación histológica y el estudio de inmunohistoquímica del tumor en las metástasis es fundamental y el primer paso para considerar el diagnóstico de CPD, ya que hace parte de la definición del mismo 2. Omitirla sería un grave error que impactaría sustancialmente los desenlaces del paciente, el tiempo de diagnóstico y la realización de exámenes o intervenciones innecesarias, como sucede con mucha frecuencia. No es válida la conducta de ir adelantando antes de la confirmación histológica; es decir, no se justifica realizar endoscopias altas y bajas, y tomografía por emisión de positrones (TEP) mientras se espera el resultado de la biopsia de una metástasis. Igualmente, es necesario realizar la evaluación estándar para poder definir el cáncer de primario desconocido; esta se ha estudiado a profundidad e incluye una historia clínica detallada 1 en la que se evalúan antecedentes familiares y personales de cáncer, síntomas que orientan hacia un probable tumor primario y también factores de riesgo como el tabaquismo 2,12.
El examen físico debe ser completo, se deben buscar masas o adenopatías, y debe incluir la exploración de los senos, piel, pelvis y recto 1,9. No obstante, la importancia de una historia clínica y un examen físico minucioso, de esta enfermedad en particular, con frecuencia no se realiza de esa manera. Si después de lo anterior no se logra saber el origen del tumor primario, se continúa con la siguiente parte de la evaluación estándar, que incluye los siguientes exámenes de laboratorio: hemograma; bioquímica sanguínea 2, que comprende glicemia, electrólitos, calcio, perfil hepático, creatinina, urea y deshidrogenasa láctica 13; uroanálisis; sangre oculta en materia fecal; tomografía axial computarizada (TAC) de tórax, abdomen y pelvis 2,14,15 con contraste 16, excepto en CPD de cabeza y cuello en nivel nodal 1-3, para el que se sugiere que en la TAC se incluya desde la base del cráneo hasta la pelvis 17.
Aun después de los pasos anteriores reglamentarios, complementados con exámenes más avanzados, en el 20% a 50% de los pacientes no se encuentra el tumor que originó la metástasis 18. En estas circunstancias, se estaría realmente ante el diagnóstico verdadero de CPD, siendo esta la definición más estricta 19,20.
Cuando se encuentra el tumor primario en autopsias, los pulmones y el páncreas son los sitios más frecuentes, con un porcentaje de 27% y 24%, respectivamente 4,5. Otros sitios en los que se han encontrado con frecuencia son el riñón y suprarrenales (8%), hígado y vía biliar (8%), colon (7%), sistema genital (7%) y estómago (6%) 4,5.
Fisiopatología
Los eventos biológicos que permiten al tumor primario permanecer oculto luego del desarrollo de metástasis aún no se han definido 16. Incluso luego de la autopsia es posible que no se detecte el primario; en estos casos se han planteado teorías, como la de regresión o involución del primario, o el desarrollo de CPD en células madre con capacidad de diferenciación a múltiples líneas celulares (hígado, músculo, piel o incluso células del tracto gastrointestinal), que pueden estar localizadas en el tejido conectivo luego del nacimiento 7. No hay evidencia de que el CPD sea una entidad biológica diferente, con características genéticas o fenotípicas exclusivas en comparación con otros tumores. Diferentes estudios muestran anormalidades cromosomales y aneuploidias, y sobreexpresión de varios genes que no son específicos del tumor de primario desconocido que, por el contrario, se presentan en otras malignidades 10,16,20. Las mutaciones y alteraciones genéticas encontradas se han dividido en 6 grupos (Tabla 1).
Tabla 1 Mutaciones genéticas encontradas en los CPD
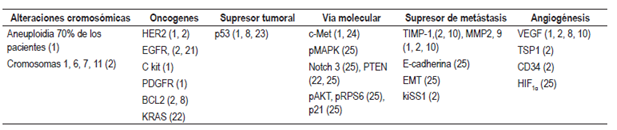
BCL2: célula-B CLL/linfoma 2; C kit: receptor de tirosina cinasa; CD34: cúmulo de diferenciación 34; c-Met: proteína del receptor del factor de crecimiento de hepatocitos; EGFR: receptor de factor de crecimiento epidérmico; EMT: transición epitelial a mesenquimal humano; HER2: receptor 2 de factor de crecimiento epidérmico humano; HIF1α: subunidad alfa del factor 1 inducible por hipoxia; kiSS1: kisspeptina; KRAS: oncogén viral del sarcoma 2 de la rata Kirsten; MMP: metaloproteinasas; Notch 3: neurogenic locus notch homolog protein 3; p21: inhibidor de la quinasa dependiente de ciclina 1A; p53: proteína supresora tumoral p53; pAKT: proteína cinasa B fosforilada; PDGFR: receptor del factor de crecimiento derivado de plaquetas; pMAPK: proteínas cinasas activadas por mitógenos fosforiladas; pRPS6: proteína ribosomal plastidial S6; PTEN: fosfatidilinositol-3,4,5-trisfosfato 3-fosfatasa; TIMP: inhibidor tisular de metaloproteinasas; TSP1: trombospondina 1; VEGF: factor de crecimiento endotelial vascular. Modificado de: Pavlidis N et al. J Adv Res. 2015;6(3):375-82.
Clasificación
Según su pronóstico, el CPD se divide en 2 grupos: el favorable (que representa el 20% de los casos) y desfavorable (que representa el 80% de los casos) 2. La supervivencia promedio de los pacientes en el grupo favorable es de 12 a 36 meses y en el grupo desfavorable es de 6 a 7 meses 19. En el grupo desfavorable, los pacientes usualmente reciben quimioterapia de forma empírica con intención paliativa, pero a pesar de esta tienen un mal pronóstico. Los subgrupos favorables son los más importantes y es a los que van dirigidos todos los esfuerzos, porque al identificarlos, recibirán un tratamiento específico, lo que mejora el pronóstico y algunos pueden tener supervivencia a largo plazo e incluso tener la posibilidad de curación 25-33. Entre ellos se encuentran los siguientes:
Carcinoma pobremente diferenciado de la línea media de células germinales, que predominantemente afecta a hombres; se presenta en la mayoría de los casos como adenopatía mediastinal o retroperitoneal 25,34.
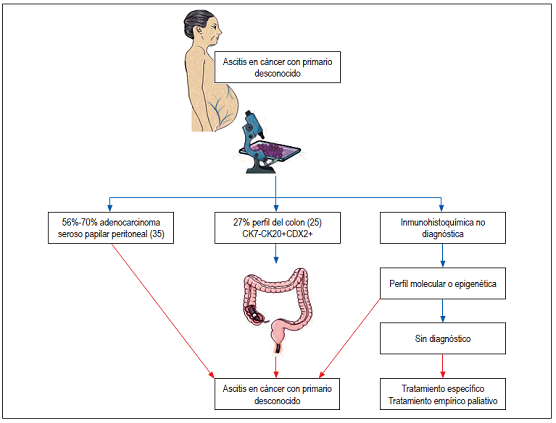
Adenocarcinoma seroso papilar peritoneal, que predomina en mujeres y clínicamente se puede presentar como dolor, obstrucción intestinal, masa o ascitis 35.
Carcinoma escamocelular metastásico de cuello que frecuentemente se manifiesta con adenopatía cervical que, en la mayoría de casos, es única y no dolorosa 1; es más frecuente en hombres (80%) 25.
Carcinomas neuroendocrinos pobremente diferenciados1,2,8, que generalmente se localizan en los ganglios linfáticos, hígado o hueso 25.
Adenocarcinomas que afectan los ganglios axilares en mujeres que tienen comportamiento similar al cáncer de mama 1,8. Después de la mastectomía, se detecta un 70% de tumores ocultos 25.
Adenopatía inguinal aislada cuya patología muestra carcinoma escamocelular, en la que se debe buscar el tumor primario en órganos genitales 1,2.
Hombres con lesiones óseas blásticas con elevación del antígeno prostático cuya patología reporta adenocarcinoma 25.
Adenocarcinoma con diferenciación de colon, que se puede presentar como metástasis hepática (30%), adenopatías abdominales (51%), metástasis de la superficie peritoneal (50%) y ascitis (27%) 25.
Por el contrario, la supervivencia en el grupo de pronóstico desfavorable en promedio es de 6 meses a 7 meses incluso con tratamiento (quimioterapia)1,6,7,24. Los subgrupos de pronóstico desfavorable son:
Adenocarcinoma metastásico en el hígado u otros órganos.
Metástasis cerebral múltiple con diferenciación de adenocarcinoma o escamocelular.
Metástasis pulmonar o pleural múltiple con diferenciación de adenocarcinoma.
Carcinoma pobremente diferenciado.
Carcinoma escamocelular de la cavidad abdominal 25.
No obstante el mal pronóstico, los investigadores no han perdido el interés y, por el contrario, cada día tienen más entusiasmo y se esfuerzan por investigar y desarrollar múltiples pruebas, entre ellas los estudios endoscópicos, imágenes diagnósticas funcionales, inmunohistoquímica, perfil genético y análisis epigenético 6,7,36.
Cuando el grupo de especialistas tratantes no ha hecho la correcta valoración del paciente o existe la posibilidad de investigaciones adicionales, el diagnóstico en esta etapa intermedia sería CPD provisional 13. Si el paciente no ha sido valorado antes, es en este momento en el que debe ser remitido a oncología. Las indicaciones de los diferentes estudios se describen a continuación.
Marcadores tumorales
Los marcadores tumorales se han estudiado ampliamente y en la actualidad se considera que tienen baja sensibilidad, especificidad 13 y bajo valor predictivo positivo (VPP) 25. No se consideran diagnósticos, por tanto, no se recomiendan, excepto en las siguientes situaciones:
Carcinoma de línea media para verificar la diferenciación germinal, en el cual se solicita gonadotropina coriónica humana subunidad β (BHCG) 2 y alfa fetoproteína (AFP) (1).
AFP cuando se sospecha hepatocarcinoma 2, la cual en títulos altos es específica para este tipo de tumor, aunque no se presenta en todos ellos 9.
Antígeno prostático específico (PSA) en hombres con enfermedad metastásica predominantemente ósea con compromiso blástico 13,16.
El antígeno carbohidrato (CA) 125 y CA 15-3 deben interpretarse con cautela dada su limitada especificidad 2,13.
Procedimientos diagnósticos
Colonoscopia
No se realiza rutinariamente ya que no es costo-efectiva 37 y la endoscopia digestiva alta tiene precisión, sensibilidad y especificidad bajas 25. Se recomienda realizar estos 2 exámenes solamente en pacientes con síntomas significativos que sugieran patologías en esos sitios del tracto digestivo y en pacientes con sangre oculta positiva en materia fecal 10 o con hallazgos compatibles por imagen o por histopatología (inmunoperfil sugestivo de adenocarcinoma de colon) 14 (Figuras 1 y 2).
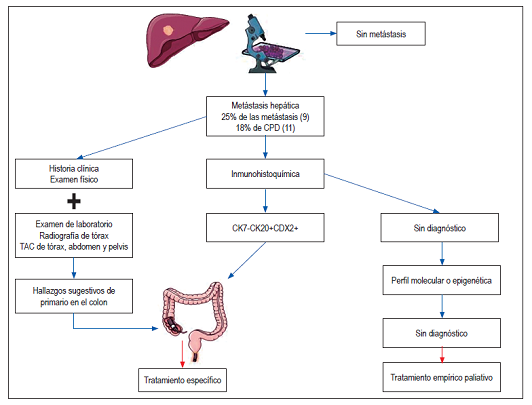
Figura 1 Esquema diagnóstico de metástasis hepática con perfil de adenocarcinoma de colon. CDX2: caudal-related homeobox transcription factor 2; CK: citoqueratina.
Broncoscopia
Se realiza en pacientes con factor de transcripción tiroideo 1 positivo, que indica un posible origen pulmonar 1,15,16 y CK 7 positiva 25. En pacientes con adenopatía cervical con histología escamocelular, se debe realizar una panendoscopia, que consiste en laringoscopia indirecta y directa, broncoscopia y endoscopia digestiva alta 17,38.
Estudios imagenológicos
TAC de tórax, abdomen y pelvis
En ausencia de contraindicaciones, deben realizarse con contraste como estándar en todos los pacientes 16.
Ecografía testicular
Está indicada en los pacientes con tumor metastásico con diferenciación germinal o en el carcinoma de la línea media 1,13.
Mamografía
Realizarla de rutina es una conducta errónea 13. Solamente se indica en presencia de síntomas, hallazgos positivos en el examen físico o en la histopatología, y especialmente en pacientes con adenopatía axilar 16.
Resonancia magnética (RM) de mama
Está indicada en tumores primarios desconocidos con adenopatía axilar, cuando la mamografía es normal. De esta forma, se pueden detectar hasta un 70% de tumores ocultos 39.
TEP con 5-fluorodesoxiglucosa
Su uso está actualmente limitado a pacientes con carcinoma escamocelular de primario desconocido metastásico de cuello 40,41. En estos pacientes puede ayudar a guiar la biopsia, determinar la extensión de la enfermedad, facilitar la planeación de la radioterapia y ayudar en el seguimiento de estos pacientes. Se ha encontrado que la TEP puede detectar el primario en un 30%-45% de los casos incluso cuando otros estudios imagenológicos no han sido conclusivos, otros estudios favorecen la TEP sobre la panendoscopia en este tipo de pacientes 40,42. Aparte de esta indicación, el rol de la TEP no es claro 16.
TEP con galio
Otro escenario en que la TEP es útil es el tumor de diferenciación neuroendocrina, en el que la mejor imagen diagnóstica es la PET/TAC DOTA NOC (gallio (68)Ga-labeled [1, 4, 7, 10-tetraazacyclododecane-1, 4, 7, 10-tetraacetic acid]-1-NaI(3)-octreotide), que es más precisa que el Octreoscan, TAC y RM 1,16,43,44. El Octreoscan tiene una tasa de detección del 39% en CPD con diferenciación neuroendocrina 45 y la PET/TAC DOTA NOC en CPD con diferenciación neuroendocrina tiene sensibilidad del 94%, especificidad del 86%, VPP del 91%, valor predictivo negativo (VPN) del 92% y precisión del 91% 43.
Inmunohistoquímica
La inmunohistoquímica es un procedimiento utilizado por los patólogos, que se basa en la utilización de anticuerpos dirigidos contra las queratinas (familia de proteínas que componen los filamentos intermedios expresadas en carcinomas), factores de transcripción, marcadores de membrana, nucleares y citoplasmáticos, que se usan para definir la diferenciación celular 46.
Es fundamental que el patólogo tenga una adecuada muestra de tejido e información clínica. Con la inmunohistoquímica, el tumor primario se encuentra en el 25%-30% de los casos 16; aunque en un metaanálisis reciente se encontró que el rendimiento para detectar el primario puede ser de 65,6% 47. A pesar de ser el algoritmo más aceptado, se requieren más estudios para establecer si la identificación del tumor primario en grupos que no son de buen pronóstico o ciertos tipos de tumor para los que no hay un tratamiento específico mejora los desenlaces de los pacientes 1,2,48.
Clásicamente, se ha sugerido que el patólogo siga un algoritmo diagnóstico cuando utiliza inmunohistoquímica, y el algoritmo de Pavlidis es el más frecuentemente utilizado 1. Este algoritmo tiene 3 pasos: el primero diferencia linfoma, sarcoma y melanoma, los cuales tienen un manejo diferente a los carcinomas; el segundo diferencia los tipos de carcinoma en adenocarcinoma, carcinoma escamocelular, neuroendocrino, tiroideo, renal, hepatocelular y germinal; y el tercero diferencia el tipo de adenocarcinoma, que es muy importante, ya que representa el 80% de los tumores metastásicos con primario desconocido 49. En el primer paso (Tabla 2) se diferencia el linfoma mediante cúmulo de diferenciación (CD) 45 o antígeno leucocitario común, ya que los linfomas pueden ser positivos para las CK (2); si es positivo para carcinoma, se continúa con el segundo paso 2,9,25.
Tabla 2 Primer paso con inmunohistoquímica

AE1-AE3: acidic and basic subfamilies of cytokeratin; HMB-45: anticuerpo monoclonal humano melanoma black; S100: multigenic family of non-ubiquitous Ca(2+)-modulated proteins . Modificado de: Pavlidis N et al. Lancet. 2012;379(9824):1428-35.
El segundo y tercer pasos que determinan la diferenciación de carcinomas y adenocarcinomas 1,25 se muestran respectivamente en las Tablas 3 y 4.
Tabla 3 Segundo paso con inmunohistoquímica

HepPar1: anticuerpo hepatocyte paraffin 1; OCT4: octamer-binding transcription factor 4; p63: oncogene belonging to the p53 gene family; pCEA: carcinoembrionario policlonal canalicular; PGP9.5: protein gene product 9.5; RCC: marcador de carcinoma renal; TTF1: factor de transcripción tiroideo 1. Modificado de: Pavlidis N et al. Lancet. 2012;379(9824):1428-35.
Tabla 4 Tercer paso con inmunohistoquímica
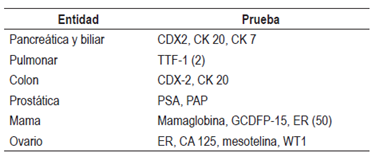
ER: receptor de estrógenos; GCDFP-15: gross cystic disease fluid protein-15 ; PAP: fosfatasa acida prostática; TTF-1: factor de transcripción tiroidea 1; WT1: proteína del tumor de Wilms. Modificado de: Pavlidis N et al. Lancet. 2012;379(9824):1428-35.
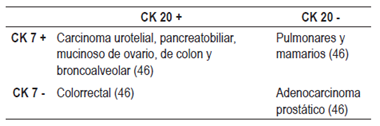
Otra forma de clasificar los tumores es según las CK 7 y 20, con las que se han creado 4 grupos de tumores (Tabla 5) que pueden sugerir un origen tumoral (9,50). Las CK no son completamente específicas, por lo que no deben ser usadas para invocar un sitio primario en la ausencia de un soporte morfológico o inmunohistoquímico (46).
Perfil molecular
Varios estudios de expresión génica están disponibles en la actualidad; se ha validado su efectividad en identificar el primario en pacientes con primario conocido, con una precisión de un 85% a 90%. En el caso de pacientes con CPD, se identifica un probable primario en el 70% a 75% de los casos 28 mediante tecnología de reacción en cadena de la polimerasa (PCR) en tiempo real de ARN mensajero (mRNA) o micro-ARN (miRNA) o microarrays2,9. Sin embargo, su impacto y beneficio al dirigir el tratamiento de acuerdo con el resultado del posible primario sigue siendo cuestionable y no probado en ensayos aleatorizados 27,28. Un estudio prospectivo no aleatorizado fase II de 252 pacientes sugiere que la supervivencia puede mejorarse con estos estudios, en particular para pacientes con tumores sensibles a la quimioterapia al compararse con cohortes históricas. Sin embargo, estos estudios son susceptibles de sesgos, variables de confusión, dada la gran heterogeneidad de primarios desconocidos 16.
Actualmente, se está llevando a cabo en Europa un ensayo clínico fase III para demostrar el beneficio del tratamiento dirigido (por estudio de perfil molecular) frente al tratamiento empírico-NCT01540058 27.
La posible indicación está dada cuando la inmunohistoquímica y los exámenes de rutina no han logrado establecer un tumor primario 48,51. Aunque no se consideran estudios que deban realizarse de rutina en todos los pacientes, de acuerdo con las guías internacionales 28.
Tratamiento
En los subgrupos con pronóstico desfavorable o cuando no se ha podido establecer el tumor primario, el tratamiento de elección es la quimioterapia paliativa basada en platino y taxano 2. Se han estudiado otros esquemas de quimioterapia; sin embargo, en una revisión realizada en el 2000, no se encontró evidencia de superioridad de ningún esquema de quimioterapia en los que se incluyeron sales de platino, taxanos o agentes citotóxicos de nueva generación (gemcitabina, alcaloides de la vinca o irinotecán)27,52,53. Las tasas de respuesta están alrededor del 20%, con supervivencia media de 6 a 7 meses 1, con o sin quimioterapia 1,25. Sin embargo, en oncología se valoran otros objetivos terapéuticos como la calidad de vida relacionada con la salud, el control de síntomas, los resultados indirectos, la seguridad y los resultados percibidos por los pacientes 54. Una prolongación modesta de la supervivencia y paliación de los síntomas con preservación de la calidad de vida es el objetivo real en estos pacientes, aunque en raros casos se ha reportado curación 27.
Por su parte, los subgrupos favorables reciben principalmente tratamiento regional con cirugía o radioterapia y quimioterapia 1. La supervivencia es similar a la de los tumores metastásicos del mismo origen 48 y el tratamiento también es similar. A continuación, se describe el tratamiento.
Carcinomas pobremente diferenciados de la línea media
El carcinoma de la línea media recibe quimioterapia con platino, con esquemas similares a los que se utilizan en tumores de células germinales extragonadales; con respuestas completas de un 20% y parciales de un 25%, y con supervivencia media de 12 meses. Se han reportado tasas de cura de un 10% a 20% 1,8,55.
Adenocarcinomas en mujeres con compromiso ganglionar axilar
Los pacientes con adenopatía axilar se tratan como cáncer de mama y pueden requerir disección ganglionar axilar completa, mastectomía y radioterapia de mamas, quimioterapia adyuvante o terapia hormonal. Cuando esté indicado, es apropiado el uso de trastuzumab (anticuerpos HER2). La supervivencia a los 5 años es de 72% y a 10 años de 60% 1,18, aunque la recaída es hasta del 55% en las pacientes sin terapia local 25.
Carcinomas escamocelulares en ganglios inguinales
En la adenopatía inguinal se realiza resección y radioterapia con o sin quimioterapia 1. La supervivencia a 5 años se ha estimado de un 20% 55.
Carcinomas escamocelulares en ganglios cervicales
Para la adenopatía cervical se realiza disección radical del cuello, con o sin amigdalectomía bilateral y radioterapia 1. En casos seleccionados, se realiza quimioterapia basada en cisplatino concomitante con radioterapia 25. Con estos tratamientos se logra un control locorregional de 80% a 90% de los casos, con supervivencia a los 5 años >65% 25.
Adenocarcinoma papilar de la cavidad peritoneal
El adenocarcinoma papilar peritoneal seroso se maneja como un cáncer de ovario estadio III y IV con cirugía y quimioterapia basada en platino y paclitaxel. Un 30% a 40% de los pacientes obtiene respuesta completa y un 70% respuestas parciales, con supervivencia media de 36 meses. Un 16% de los casos tiene supervivencia a largo término 7,8,25.
Carcinomas neuroendocrinos
En los tumores con diferenciación neuroendocrina se administra quimioterapia basada en platinos, taxanos, 5-fluorouracilo o capecitabina, temozolomida o irinotecán, con supervivencia media de 15 meses, con respuestas completas hasta de un 21% 7 y el 13% de los pacientes presenta supervivencia a largo plazo 18. En el caso de carcinomas neuroendocrinos bien diferenciados, la supervivencia a los 5 años puede ser >50% 7.
Adenocarcinomas con inmunoperfil de cáncer de colon
La metástasis con inmunoperfil de cáncer de colon se tratan como un cáncer de colon metastásico con una supervivencia media de 20 a 36 meses, con tasas de respuestas completas de un 15% y parciales de un 35% 25.
Conclusión
El tumor metastásico con primario desconocido causa temor en el paciente y en el médico, pero en esta revisión el médico tiene una guía del enfoque inicial, la posterior clasificación y la indicación de estudios complementarios; además, en ella se destacan los avances científicos recientes que se enfocan en nuevos métodos de diagnóstico y tratamiento dirigidos.











 texto em
texto em