Introducción
La colangitis esclerosante primaria (CEP), descrita por primera vez en la década de 1850, es una enfermedad inflamatoria crónica, progresiva y fibrosante que afecta principalmente al epitelio biliar, produciendo estenosis, dilataciones multifocales y destrucción de los conductos de todo el árbol biliar; especialmente los conductos medianos y largos, lo cual conduce a colestasis 1,2,3,4.
Usualmente, los pacientes son asintomáticos; no obstante, las manifestaciones clínicas comúnmente reportadas al momento del diagnóstico son fatiga, fiebre, ictericia, prurito y vago malestar abdominal superior 5. Esta patología cuenta con gran variabilidad en su historia natural; sin embargo, los individuos afectados eventualmente tendrán complicaciones, como la cirrosis biliar y malignidades intrabdominales 1,2,4,5. Actualmente no hay una terapia efectiva, el único tratamiento implementado es el manejo sintomático con ácido ursodesoxicólico y el trasplante hepático; sin embargo, la patología recurre en 30% al 50% de los pacientes en los 10 años luego del trasplante, lo cual se traduce en un pobre pronóstico 2,5.
En la era pretrasplante, la principal causa de muerte de los pacientes con CEP era la falla hepática, pero actualmente es el colangiocarcinoma (CCA), una neoplasia maligna de comportamiento agresivo originada en los colangiocitos que puede tener una ubicación intrahepática, extrahepática o hiliar. Este último, también conocido como tumor de Klatskin, es el más común, con aproximadamente dos terceras partes de los casos reportados 6,7,8.
Los pacientes con CEP tienen un riesgo de por vida del 5%-10% de desarrollar CCA, y este es 398 veces mayor si se compara con la población general 6,9. Esta es la importancia de la presente revisión, para la población general, el CCA es un tumor maligno gastrointestinal raro, pero para los pacientes con CEP, esta es una comorbilidad de gran importancia y la principal causa de muerte 6,10.
Epidemiología
Los datos epidemiológicos de la CEP tienen una variación geográfica importante; sin embargo, estudios recientes de población general hechos en Holanda, EE. UU. y Reino Unido han reportado una prevalencia que va de 3,85 a 6 casos por cada 100 000 habitantes, y una incidencia de 0,1 a 0,5 casos por cada 100 000 habitantes, sugiriendo que la variación geográfica inicialmente descrita se debía a que algunos datos provenían de estudios realizados en centros de salud especializados en enfermedades del hígado, lo que generaba un sesgo sobre la situación real en población general 6,11,12.
Es bastante conocida la asociación de la CEP con la enfermedad inflamatoria intestinal (EII) en 60%-80% de los casos, la cual suele aparecer antes, y casi siempre con colitis ulcerativa del lado derecho 5,11. Los pacientes con CEP tienen un riesgo de mortalidad 4 veces mayor comparado con la población general, y la principal causa es el colangiocarcinoma (CCA) (32%), seguido por la falla hepática (18%), complicaciones de trasplante hepático (9%) y cáncer colorrectal (CCR) (8%) 13.
La CEP es la condición predisponente más común para el CCA en el mundo occidental 9. Ocurre en 1%-2% de los pacientes anualmente después del diagnóstico, y con frecuencia se detecta dentro de los primeros 1 a 3 años tras el diagnóstico inicial, con un riesgo acumulativo de 20% 30 años después 5,13. Acorde a esto, se encuentra que aproximadamente 50% de los casos de CCA se diagnostica conjuntamente con la CEP o en el año siguiente 13,14. No obstante, la incidencia de CCA en pacientes con CEP no se correlaciona con el diagnóstico de la misma a una edad temprana, pues se ha observado que en estos casos la enfermedad cuenta con un fenotipo menos agresivo, mientras que si se detecta en una edad más tardía es más probable que se asocie con malignidades hepatobiliares y descompensación hepática 15. Por ello, es necesario tener un alto índice de sospecha de CCA poco después de detectar CEP en personas mayores6,15,16.
Adicionalmente se ha documentado que la presencia simultánea de EII aumenta el riesgo de colangiocarcinoma, principalmente si se trata de una colitis ulcerativa, pues los cuadros que se acompañan de enfermedad de Crohn tienen un comportamiento más benigno 6,17. En términos de mortalidad a nivel global, las neoplasias malignas hepatobiliares representan 13% de las muertes relacionadas con cáncer y, de estas, 10%-20% se atribuye al CCA, el cual tiene una edad media de diagnóstico de 50 años, y suele ocurrir primero que la cirrosis cuando se asocia con CEP (Figura 1) 13,18.
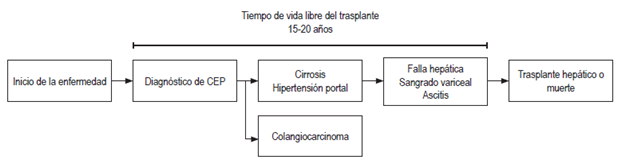
Figura 1 Historia natural de la colangitis esclerosante primaria. El CCA en pacientes con CEP con frecuencia se detecta dentro de los primeros 1 a 3 años luego del diagnóstico inicial, a una edad media de 50 años, y suele ocurrir primero que la cirrosis. CEP: colangitis esclerosante primaria.
Su incidencia mundial varía ampliamente, según los factores de riesgo que existan, desde 0,5 a 1,5 casos por 100.000 habitantes en el mundo occidental donde la CEP es el factor de riesgo más importante, hasta 113 casos por 100 000 en Tailandia debido a la presencia endémica del trematodo Opisthorchis viverrini que se ha reconocido como agente causal del CCA 16.
El Opisthorchis viverrini es un trematodo o duela, considerado carcinógeno humano por la Agencia Internacional para la Investigación en Cáncer (luego que se encontrara una correlación directa positiva entre la incidencia de CCA y la prevalencia de infección por O. viverrini en diferentes regiones de Tailandia). Infecta a humanos, gatos o perros que consumen en su dieta pescados de agua dulce (segundo huésped intermediario); en especial, los pertenecientes a la especie Cyprinidae o carpas, crudos o mal cocidos con metacercarias 19,20. Al ser estos ingeridos por el hombre (huésped definitivo) eclosionan en el duodeno y migran a través de la ampolla de Vater hacia el conducto biliar, allí maduran y se convierten en adultos que pueden vivir hasta 20 años, y que generan luego infecciones crónicas asintomáticas (20-40 años), fibrosis periductal avanzada, colecistitis y/o CCA 19,20,21.
Este parásito se localiza principalmente en Tailandia, Laos, Camboya, Vietnam, China y Corea, donde se ha llegado a encontrar que de 8 millones de personas infectadas, 5 mil llegan a tener CCA (cifras de Tailandia) por medio de 3 mecanismos principales: el primero hace referencia al daño mecánico generado en el epitelio de los conductos por las actividades alimentarias del parasito; en el segundo mecanismo se encuentra la respuesta inmune formada a partir de la infección que lleva a inflamación-regeneración-fibrosis; y en el tercer mecanismo se describen moléculas excretadas/secretadas por el parásito que originan efectos tóxicos o carcinogénicos en el huésped, entre ellas la granulina, un factor de crecimiento del parásito que produce proliferación de células humanas 19,20,21.
Actualmente no existe una vacuna que evite la infección por este parásito. Sin embargo, tiene un tratamiento farmacológico con praziquantel, antihelmíntico que en quimioterapia preventiva en dosis única de 40 mg/kg tiene un porcentaje de cura del 96%. No obstante, el uso excesivo de este medicamento puede reducir la eficacia del mismo e inducir inflamación del sistema biliar; además, a pesar que se logre eliminar el parásito del organismo, los cambios hepatobiliares generados no se resuelven en todas las personas tratadas, y la reinfección es frecuente19,20,21. Esta es información de gran importancia ya que en los últimos años se ha aumentado la ingesta de pescado crudo e importado en nuestro medio 22.
Patogénesis
Los mecanismos fisiopatológicos que llevan al desarrollo de la CEP no son del todo conocidos; sin embargo, se reconoce que es una enfermedad provocada por desencadenantes ambientales en personas genéticamente susceptibles 23. Hasta el momento se ha reportado que la existencia de una predisposición genética principalmente asociada con algunas variantes del HLA, la posibilidad de una translocación bacteriana que altere el microambiente de los hepatocitos, la toxicidad generada por la bilis retenida y el desarrollo de una respuesta inmunológica anormal son todos factores críticos en la génesis de esta patología 16,24,25. Todo lo anterior conlleva al establecimiento de un microambiente inflamatorio permanente que altera muchas cosas, entre ellas, la división celular, y este es probablemente el origen del CCA en personas con CEP, donde se sigue la secuencia de inflamación-displasia-carcinoma. La inflamación a través del daño al ADN, evasión de la apoptosis, promoción de la proliferación celular y neoangiogénesis favorece el nicho carcinogénico. Trabajos recientes han puesto de relieve que las vías inflamatorias son esenciales no solo en el desarrollo del cáncer, sino también en la invasión y migración de tejidos 18.
Otros factores reportados en la literatura que detallan este proceso de una forma más específica son los siguientes: activación de la enzima óxido nítrico sintasa mediada por citocinas inflamatorias que provocan daño del ADN e inhibición de las enzimas encargadas de su reparación; y factor de crecimiento de los hepatocitos, que se ha postulado como mediador paracrino del estroma, regulando la invasión del tumor y metástasis 18. La colestasis también influye a través de la activación de vías de señalización que aumentan la proliferación celular. Además, se han identificado mutaciones en la proteína isocitrato deshidrogenasa relacionadas con aumento de los niveles de p53 e hipermetilación del ADN, lo que probablemente tenga relación con el desarrollo del cáncer 9,18.
Diagnóstico
El pilar fundamental en el manejo integral de los pacientes con CEP consiste en diagnosticar tempranamente los casos de CCA, pues como se ha descrito en el presente artículo, debido a su comportamiento agresivo constituye la principal causa de muerte en este grupo de pacientes; sin embargo, actualmente su diagnóstico es un reto para el equipo médico tratante, porque puede confundirse fácilmente con alteraciones benignas de las vía biliar, lo que genera que muchas veces se diagnostique en etapas tardías, cuando ya hay invasión neoplásica, lo que limita aún más las posibilidades terapéuticas y ensombrece el pronóstico 26.
Diferentes estudios han reportado que factores como el tabaquismo, alcoholismo y ciertas variantes genéticas aumentan el riesgo de sufrir CCA 16,27. No obstante, la utilidad clínica de esto es poca debido a la alta incidencia de esta neoplasia en todos los pacientes con CEP, razón por la cual la tamización de rutina se recomienda en todos los casos, independientemente de la presencia o ausencia de otros factores de riesgo 16.
Actualmente no hay ninguna prueba totalmente sensible y específica para el diagnóstico del CCA, ni tampoco existen guías que propongan un enfoque basado en la evidencia para la vigilancia de estos pacientes 28. Sin embargo, en la literatura existen varios enfoques propuestos para este fin que combinan diferentes modalidades de pruebas diagnósticas para aumentar su rendimiento (Figura 2).
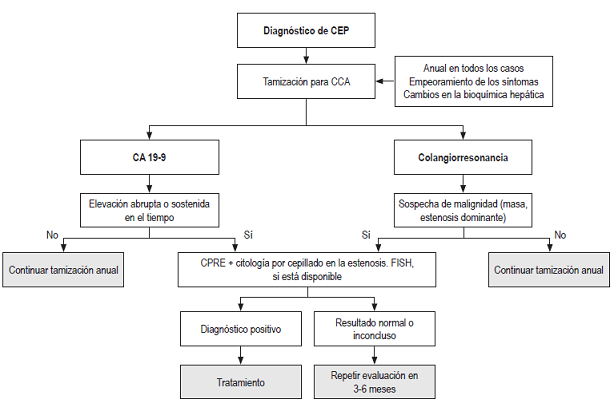
Figura 2 Diagnóstico de colangitis esclerosante primaria. CEP: colangitis esclerosante primaria; CCA: colangiocarcinoma; CPRE: colangiopancreatografía retrógrada endoscópica; FISH: hibridación fluorescente in situ.
Para iniciar la vigilancia se recomiendan medidas no invasivas, como estudios de imagen a intervalos regulares. El ultrasonido hepatobiliar o la colangiopancreatografía por resonancia magnética (CPRM) son métodos útiles; sin embargo, esta última es mejor para identificar lesiones de menor tamaño. Además, aporta información sobre la intensidad y realce de la lesión, lo que puede ser de ayuda para el diagnóstico diferencial, razón por la cual se considera el estudio ideal 29. En términos estadísticos, la CPRM tiene una sensibilidad del 89% con especificidad del 75%, mientras que el ultrasonido hepatobiliar cuenta con 53% de sensibilidad y 94% de especificidad, según un estudio publicado en 2008 30.
Estas dos estrategias pueden visualizar una masa, un pólipo o estenosis dominantes del árbol biliar, que se definen como un estrechamiento en el diámetro del conducto biliar común de 1,5 mm o menos, y/o 1 mm o menos en los ductos hepáticos, estos hallazgos aumentan la sospecha de CCA, pero no son confirmatorios 31. En estos casos es útil hacer una colangiopancreatografía retrógrada endoscópica (CPRE) acompañada de una citología por cepillado sobre las partes estenóticas para intentar esclarecer el diagnóstico 32.
Un metaanálisis publicado en 2014, que incluyó 747 sujetos con CEP, mostró una sensibilidad y especificidad para la citología de cepillo positiva de 43% y 93%, respectivamente; sin embargo, es importante anotar que este procedimiento puede arrojar resultados indefinidos; es decir, mostrar hallazgos de células atípicas u otras características sospechosas, pero no definitivas de malignidad, punto en el cual no hay pautas establecidas para el manejo 32.
Existen estrategias que aumentan el rendimiento y precisión de la citología. Actualmente, la más usada es la hibridación fluorescente in situ (FISH), una herramienta que se fundamenta en la capacidad que poseen los ácidos nucleicos para hibridarse entre sí con cadenas complementarias, y funciona mediante la elaboración de sondas que se unen a secuencias específicas del cromosoma y emiten fluorescencia 33. Entre sus aplicaciones se encuentra que permite identificar aneuploidías en las células de la muestra, un hallazgo que puede sugerir la presencia de CCA. Se demostró que juntas (citología y FISH) tienen una sensibilidad y especificidad para la detección de CCA de 46% y 88%, respectivamente, cuando se encontraba polisomía cromosómica 26,34.
Hasta el momento, el único biomarcador recomendado de rutina es el antígeno de carbohidrato (CA) 19-9, que sirve como alternativa o complemento a la imagenología, pero su rendimiento no es el mejor debido a que en presencia de CCA puede estar normal, o en casos de colangitis, aumentarse 26. Se han propuesto diferentes valores como límite para los exámenes de tamización: valores mayores de 20 UI/mL reportan una sensibilidad de 78% y especificidad de 67%, mientras que mayores de 130 tienen una especificidad de 100%, pero la sensibilidad es solo del 13% 26. Sin embargo, hay que tener presente que aproximadamente 7% de los pacientes con CEP presenta un polimorfismo en el gen FUT3, lo que conlleva a que no expresen el epítope del CA 19-9 35.
Estos procedimientos de tamización deben realizarse durante todo el curso de la enfermedad, pero principalmente los primeros 2 años, cuando la incidencia de CCA es mayor, y también cuando hay empeoramiento de los síntomas, cambios en los parámetros colestásicos séricos o aumento del CA 19-9 de forma rápida o persistente en el tiempo 26,28.
Tratamiento
La terapia disponible para el CCA se puede clasificar en curativa y paliativa. La terapia curativa fundamentalmente se basa en la resección quirúrgica, pero esta solo es viable un 25% a 35% de los casos, pues requiere que sea un tumor localizado, sin metástasis a nódulos linfáticos, y que además la función hepática esté preservada, pues la cirrosis y la hipertensión portal son marcadores de mal pronóstico 36,37.
Estudios demuestran que, en pacientes bien seleccionados, la supervivencia a los 5 años de la resección del CCA es del 27% a 44%. Además, se ha postulado la opción de complementar la intervención quirúrgica con terapia adyuvante (quimioterapia o radioterapia) para mejorar el rendimiento de la cirugía 38.
La segunda intervención curativa es el trasplante hepático; aunque antes el CCA se consideraba como una contraindicación absoluta, ahora pacientes con estadios tempranos de la enfermedad, en especial con CCA perihiliar menor de 3 cm, pueden recibir un trasplante, el cual, al complementarse con terapia coadyuvante, genera una tasa de supervivencia libre de recurrencia de 65% 39,40. También existen estrategias terapéuticas locales, como ablación por fotodinamia, radiación externa, radioembolización y altas dosis de braquiterapia, entre otros; sin embargo, la mayoría se ha evaluado por estudios retrospectivos o de pequeña muestra poblacional, lo que no permite tener información de alta calidad que respalde su uso y aporte información sobre los posibles efectos adversos a corto y largo plazo 38.
Por su parte, en la terapia paliativa se busca mejorar la condición general de los pacientes o alargar un poco la esperanza de vida. Para eso se cuenta con quimioterapia sistémica, consistente en la combinación de cisplatino y gemcitabina, la cual demostró un aumento en la esperanza de vida de 3-6 meses en un ensayo clínico de 2010, lo que fue luego reproducido en un estudio japonés 41,42. En caso que el paciente tenga insuficiencia renal se ha propuesto reemplazar el cisplatino por oxaliplatino 43. De igual forma, la gemcitabina como monoterapia se recomienda en pacientes ancianos con gran compromiso de su estado general de salud. Al revisar la información referente al uso de medicamentos de segunda línea se encuentra que existen propuestas como las fluoropirimidinas, pero actualmente no se cuenta con información suficiente que valide dicha aplicación 44. Finalmente, la obstrucción maligna de la vía biliar es una complicación tardía de los diferentes tipos de neoplasias, entre ellas el CCA. Hoy en día se aconseja el uso de stents o prótesis biliares mediante procedimientos endoscópicos para el manejo de la ictericia y prurito secundario a la obstrucción de la vía biliar por el tejido neoplásico, produciendo una mejoría temporal de los síntomas 26.
Perspectivas futuras
Teniendo en cuenta que el éxito de la terapia curativa depende del estadio en el cual se diagnostique el CCA, las investigaciones actuales se centran en el desarrollo de métodos diagnósticos eficientes y poco invasivos, como el uso de estudios de proteómica en orina, suero o bilis, con el fin de detectar paneles específicos de péptidos correlacionados con el CCA, implementación de microRNA no codificantes, como biomarcadores biliares de malignidad, o análisis de microvesículas extracelulares en muestras de bilis para diferenciar estenosis benignas de las que no lo son 10,45.
Con respecto al tratamiento se ha encontrado que el uso de ciertas moléculas, como el factor de crecimiento epitelial y el factor de crecimiento endotelial vascular, no han aportado resultados positivos 44. Por ende, se espera que haya un mayor avance en esta u otras áreas de investigación, y se reconoce la necesidad de realizar estudios que ofrezcan mejores posibilidades para los pacientes con CEP y CCA.











 text in
text in 


