Introducción
El virus de la hepatitis B (VHB) representa un problema de salud en el mundo. Se estima que 2000 millones de personas han estado expuestas al virus y 240 millones siguen crónicamente infectadas 1, siendo la infección viral crónica más frecuente 2. El 15 %-40 % de los que tienen infección crónica progresa a cirrosis y sus complicaciones, incluido hepatocarcinoma 3. En 2013 produjo 686 000 muertes 3, esta cifra representó un incremento de 33 % entre 1990 y el 2013 3. En 2005 la prevalencia en Centroamérica era menor del 2% y en Suramérica era del 2 % al 4 % 3. En éste último se producen 400 000 casos nuevos cada año 3. No obstante las recomendaciones para la vacunación universal contra el VHB, esta profilaxis no ha sido ampliamente implementada en los países con mayor prevalencia por falta de recursos económicos y logísticos 3.
El VHB es miembro de la familia Hepadnaviridae, cuyos miembros son virus de ácido desoxirribonucleico (ADN) pequeños (3200 pares de bases), hepatotropos, con envoltura externa 4,5. El ADN es parcialmente de doble cadena y de cadena simple, y tiene una plantilla transcripcional que es el ADN circular covalentemente cerrado (ADNccc), el cual se introduce muy rápidamente en el núcleo del hepatocito durante la infección aguda 6. Pertenece al género Orthohepadnavirus, que infecta mamíferos, y el género Avihepadnaviridae, que afecta a las aves 4. Se considera que este virus se originó en África hace por lo menos 40 000 años 6. Tiene 10 genotipos (A-J), el A es frecuente en Norteamérica, Norte de Europa y África; el B y C, en Asia 4,7. En algunos estudios se ha encontrado asociación entre el genotipo y la progresión de la enfermedad y respuesta al interferón 4. Los genotipos C y F se asocian más frecuentemente con el hepatocarcinoma, así como también algunos subgenotipos del tipo A. Por su parte, el genotipo A tiene riesgo de progresar a infección crónica 4,7; sin embargo, cualquier infección aguda puede progresar a infección crónica, independientemente del genotipo 4.
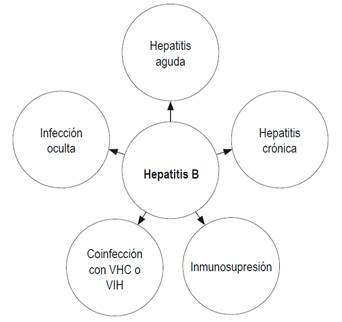
Se transmite fundamentalmente por vía sexual, perinatal y por rutas parenterales permucosa o percutánea a través de lesiones con elementos cortopunzantes contaminados con sangre infectada 8. Esta última forma de transmisión incluye las punciones accidentales en los ambientes hospitalarios con instrumental médico quirúrgico contaminado, procedimientos de manicura, pedicura, tatuajes, drogadicción intravenosa (al compartir jeringas contaminadas) y piercings, entre otros 8. La contaminación con tales procedimientos ha disminuido conforme se han divulgado los riesgos inherentes a los mismos, se ha implementado la esterilización de instrumentales médicos y se ha prohibido el reuso de agujas 9. De igual manera se ha logrado disminuir la transmisión sexual con la educación acerca de la utilización de medidas de protección sexual 8,9. El 95% de los casos de transmisión vertical ocurre durante el parto vaginal y el 5 % por transmisión intrauterina 8. El espectro clínico de la infección por el VHB incluye hepatitis aguda (HBA), hepatitis crónica (HBC) e infección oculta 10. Así mismo, puede producir cirrosis, hepatocarcinoma y compromiso de órganos extrahepáticos 11,12,13,14.
Por el impacto y la complejidad de la infección por este virus, en la presente revisión se discuten los diferentes exámenes utilizados para diagnosticar la infección en los diferentes escenarios encontrados en la práctica diaria (Figura 1).
Hepatitis B aguda
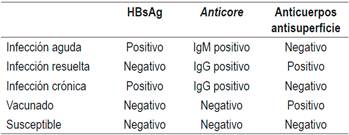
El diagnóstico se establece con la positividad simultánea del antígeno de superficie (HBsAg) y del anticore inmunoglobulina M (IgM) 15. El HBsAg es la marca serológica de la infección por el VHB 15. Sin embargo, hay casos en los cuales el HBsAg desaparece rápidamente sin la aparición del anticuerpo antisuperficie, lo cual corresponde al período de ventana inmunológica, en la cual la única evidencia de infección aguda por el VHB es el anticore IgM 15. Este anticuerpo aparece 2 semanas después del HBsAg y puede persistir hasta 2 años 16. El HBsAg es detectable 1 a 10 semanas después del contacto infectante 2. La detección del anticore IgM coincide con los síntomas generales y el aumento de las aminotransferasas 14.
La resolución de la HBA se caracteriza por desaparición del HBsAg, aparición de anticuerpos anti-HBsAg, anticore inmunoglobulina G (IgG) y normalización de los niveles de alanina-aminotransferasa (ALT) 14,15. Este perfil, en realidad, indica una cura aparente, que se ha definido como curación funcional17. Se ha encontrado que, no obstante la presencia de marcadores de desaparición de la infección, en el núcleo del hepatocito persiste el ADNccc, como un episoma o minicromosoma a partir del cual se genera ácido ribonucleico (ARN) y de este ADN, iniciándose la replicación viral 18. Este ADNccc persiste indefinidamente en el huésped después de las primeras 24 horas de la infección 18. Ese reservorio del VHB puede reiniciar su replicación si los mecanismos inmunológicos de defensa son bloqueados, como sucede con los diferentes tratamientos inmunosupresores, ya que la inmunidad del huésped controla esas células infectadas 19.
Recientemente, el concepto de curación funcional se ha redefinido como la pérdida del HBsAg con o sin aparición del anticuerpo anti-HBsAg, ADN indetectable en suero, pero con persistencia del ADNccc6,13. En contraste con la curación funcional, la curación total es la curación funcional más la eliminación del ADNccc 20,21. En la actualidad es imposible curar la infección por el VHB porque los medicamentos disponibles no pueden eliminar el ADNccc y solo suprimen la replicación viral 19,22. La eliminación del ADNccc es la meta ideal del tratamiento de la infección crónica por el VHB 6,19.
Cuando hay reactivación del VHB en una infección crónica, el anticore IgM puede ser positivo en 10 %-15 % de los pacientes 16, indistinguible de una infección aguda 15,16,23,24. Algunas características serológicas pueden ayudar a diferenciarlas. En la infección aguda, la IgM es pentamérica con un peso molecular de 19 S y en la crónica es monomérica con un peso molecular de 7-8 S 16). Títulos mayores de 1:1000 se ven en el 80 % de las infecciones agudas, con una sensibilidad y especificidad de 96,2 % y 93,1 %, respectivamente, cuando se determinan por inmunoensayo enzimático 23. Títulos de IgM menores de 1:1000 se ven en el 70 % de los casos de hepatitis B crónica (HBC) que tiene exacerbación aguda 23,24.
Hepatitis B crónica
La infección crónica por el VHB (HBC) existe cuando el HBsAg persiste positivo después de 6 meses de una infección aguda 8,9,14. Su aparición depende de la interacción entre el VHB y el sistema inmune. La probabilidad se aumenta con la inmadurez inmunológica o los estados de inmunosupresión 25. En el recién nacido, aparece en el 98% de los infectados; en los niños de 1 a 5 años, en el 20 %-30 %, contrastando con menos del 5 % en los adultos inmunocompetentes 26,27. Un resumen de la interpretación de los diferentes hallazgos de la serología del VHB se muestran en la Tabla 1.
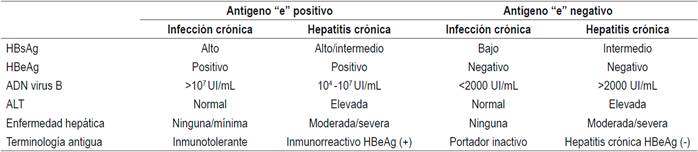
La Asociación Europea para el Estudio del Hígado (EASL) clasifica la HBC en 4 tipos de acuerdo con la positividad del antígeno “e” y la presencia o no de enfermedad hepática 28 (Tabla 2). Esta nueva clasificación reemplaza la nomenclatura anterior de portador inactivo, inmunotolerante, entre otras.
El tratamiento está indicado en las siguientes situaciones 28:
Todos los pacientes con o sin antígeno “e” que tengan hepatitis crónica (ADN >2000 UI/mL, ALT por encima del límite superior normal y/o necroinflamación hepática moderada o fibrosis);
Pacientes con cirrosis compensada o descompensada, independientemente del nivel de ADN o de ALT;
Pacientes con ADN >20 000 UI/mL y ALT >2 veces el límite superior normal, independientemente del grado de fibrosis;
Pacientes con antígeno “e” positivo e infección crónica (ALT persistentemente normal) y niveles elevados de ADN si son mayores de 30 años, independientemente de la severidad de la histología hepática;
Pacientes con infección crónica, antígeno “e” positivo o negativo, que tengan historia familiar de hepatocarcinoma, cirrosis y manifestaciones extrahepáticas, aunque no cumplen las indicaciones típicas de tratamiento.
Se recomienda que los pacientes con HBC que no cumplen los criterios mencionados sean controlados periódicamente según las siguientes características:
Infección oculta por vhb (iovb)
La IOVB se sospechó en los setenta y, debido al interés por la misma, se produjo una publicación sobre el tema en 1999 29. Inicialmente se definió cuando el HBsAg es negativo y ADN del VHB es positivo en el hígado, con o sin ADN detectable en el suero30,31. Sin embargo, por la dificultad y riesgos de la biopsia hepática para identificar el ADN del VHB en ese tejido, y por la falta de estandarización para el ADN hepático, se aceptó que el ADN de suero reemplazara al ADN hepático 31,32. Además, la determinación en suero tiene adecuada estandarización y sensibilidad 31,32. La carga viral usualmente es menor de 200 UI/mL y en más del 90% es 20 UI/mL 33. Las alteraciones básicas de la IOVB son HBsAg negativo y ADN positivo en suero (30). Adicionalmente, puede ser seropositiva o seronegativa si tiene o no anti-HBc IgG y/o anticuerpos antisuperficie positivos 30,34,35. La mayoría de pacientes seropositivos tuvo infección crónica y el HBsAg desapareció espontáneamente 34,35. El HBsAg desaparece anualmente en el 0,5 %-2,2 % 31. Los seropositivos tienen un perfil de citocinas diferentes a los seronegativos 36. Los primeros tienen menor expresión de interferón gamma (IFN-γ) de células T específicas de VHB36. Por otras características vistas en modelos animales de IOVB, se presume que los seropositivos y seronegativos tienen diferentes formas de contagio 37,38. Los seropositivos son la mayoría de los pacientes (80 %) 34.
La EASL tipifica la IOVB en la quinta fase de la infección crónica por el VHB, caracterizada por la pérdida del HBsAg y positividad para el anticore con o sin anticuerpos antisuperficie 30. En esos pacientes, el ADNccc es el responsable de la IOVB 30-35. La detección del ADN durante el período de ventana serológica de la infección aguda, cuando el HBsAg es negativo, es una “falsa infección oculta” por el VHB 30.
Las consecuencias de una IOVB incluyen la posibilidad de transmisión de la infección por transfusiones, inducción de hepatocarcinoma y reactivación de la infección con cualquier tipo de inmunosupresión 31,37. En inmunocompetentes, la IOVB es inofensiva. Cuando hay reactivación, reaparecen los marcadores típicos de una infección manifiesta 38. Los exámenes iniciales para investigar la IOVB son el HBsAg y el anti-HBc total. Por definición, el HBsAg debe ser negativo e independientemente del resultado del anticore total, se debe investigar el ADN del VHB. Sin embargo, para evitar retrasos en el diagnóstico, esos exámenes deben hacerse simultáneamente. Si se cumplen los criterios mencionados de IOVB, se establece el diagnóstico 30. Si todos los exámenes son negativos, el paciente es susceptible y debe ser vacunado contra la HB 39,40,41.
La IOVB es asintomática, por lo cual debe investigarse en los siguientes pacientes de alto riesgo 42: infectados con virus de la inmunodeficiencia humana (VIH), hepatitis C crónica, inmunosuprimidos, hepatocarcinoma, hemodiálisis, cirrosis criptogénica, enfermedad hepática crónica sin causa identificada, trasplantados o programados para trasplante y los que recibirán inmunosupresión de cualquier tipo 42.
El riesgo de la IOVB en los pacientes con hepatitis C (VHC) es que, al eliminar al virus C con los antivirales de acción directa, se puede reactivar el VHB y producir insuficiencia hepática aguda con severidad variable, que puede incluir la muerte 43,44,45. En 2016 la Food and Drug Administration (FDA) hizo una alerta después de recopilar 24 casos entre 2013-2016 46. En la mitad de esos pacientes la reactivación se identificó oportunamente y fueron tratados inmediatamente con tenofovir/entecavir, con lo que se logró una mejoría clínica y disminución de la carga viral. Los otros pacientes recibieron tratamiento tardío, 2 fallecieron y 1 recibió trasplante hepático 46. Por las consecuencias mencionadas, la FDA recomienda que todos los pacientes con infección crónica por el virus C en tratamiento se les debe solicitar ADN del VHB y vigilarlos estrechamente con perfil hepático, y recomendarles que consulten inmediatamente si aparecen síntomas de daño hepático (ictericia, malestar, fiebre, entre otros). Si se identifica reactivación, deben recibir tratamiento urgente con tenofovir o entecavir (47.
Anti-hbc aislado
El antígeno core es un componente interno del VHB; sin embargo, es el más inmunogénico de todos 48. Los anticuerpos contra el antígeno core se producen en todos los pacientes infectados, independientemente de que resuelvan o no la infección aguda 48. Como se mencionó previamente, en la infección aguda, el anticuerpo es IgM y, conforme la infección se resuelve, los niveles del mismo disminuyen progresivamente y son reemplazados por los de la clase IgG, los cuales pueden persistir durante toda la vida del paciente 49,50. Por ese comportamiento se consideran los marcadores serológicos más confiables de la infección por el VHB y se denominan los marcadores epidemiológicos de la misma 49.
El hallazgo de anticuerpos anticore total, sin HBsAg y anticuerpos antisuperficie, se denomina anticore aislado50,51, el cual ocurre principalmente en grupos de riesgo: usuarios de drogas recreativas endovenosas, VHC, VIH, hemodiálisis, receptor de trasplante de órgano sólido y embarazadas 51.
La prevalencia del anticore varía de 1 %-32 % 50. Su hallazgo representa un reto para el clínico, ya que puede corresponder a diferentes situaciones 51:
Infección resuelta (lo más frecuente);
Falso positivo, situación frecuente en personas de regiones con baja prevalencia del VHB (50,51;
Infección aguda, en la cual el anticore IgM explica la positividad del anticore total;
Infección crónica con niveles bajos de replicación, este es el grupo de mayor riesgo en caso de requerir inmunosupresión 52;
Los mecanismos implicados se explican a continuación.
Falso positivo
Aunque los inmunoensayos actualmente utilizados para identificar el anticore total son altamente específicos, durante su ejecución se pueden producir errores y dar resultados incorrectos 50. Por lo anterior se recomienda confirmar sus resultados en una segunda muestra de suero 50,61. El método relacionado con falsos positivos es el inmunoensayo enzimático, menos específico que el radio-inmunoensayo 62,63, pero este último no está disponible en los diferentes laboratorios 50. Por esta razón, la recomendación de repetir la prueba utilizándolo como un segundo método rara vez se podría realizar 51.
Coinfección con VHC o VIH (54-60)
La coinfección con el VHC o el VIH puede interferir con replicación del VHB y la respuesta inmunológica del huésped, al inducir una regulación negativa de los genes del VHB o modular la respuesta inmunológica contra el VHB 50.
Con el VHC, se ha demostrado una inhibición recíproca entre ambos virus 54,55. Las proteínas centrales del VHC inhiben la replicación del VHB y la síntesis del HBsAg 55,57. En la infección VIH, el único marcador de la infección por el VHB puede ser el anticore aislado 50,58. Por lo anterior, se recomienda que cuando se investigue el VHB en un paciente con VIH se incluya el ADN del VHB.
La evaluación de un paciente con anticore positivo se muestra en la Figura 2 61.
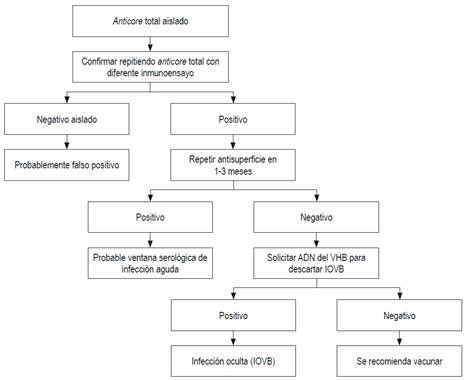
Figura 2 Evaluación de anticore positivo. Modificado de: Pondé RA et al. Arch Virol. 2010;155(2):149-58.
Una síntesis del significado del anticore aislado se muestra en la Tabla 3.
Reactivación de la infección
La reactivación del VHB se describió hace más de 50 años en individuos que aparentemente se habían curado de la infección aguda y recibieron inmunosupresión 64,65. La inmunocompetencia controla el VHB y, cuando esa se pierde, el virus se puede reactivar 66,67. La pérdida de la inmunocompetencia puede ser espontánea o inducida por inmunosupresores 67,68.
Las asociaciones científicas tienen diferentes recomendaciones sobre los exámenes del VHB que deben solicitarse antes de iniciar inmunosupresión 28,68,69,70 (Tabla 4).
Tabla 4 Recomendaciones de asociaciones científicas
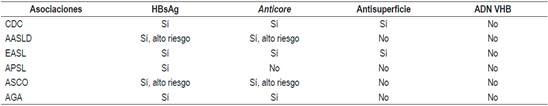
AASLD: Sociedad Americana para el Estudio de las Enfermedades del Hígado; AGA: Asociación Americana de Gastroenterología; APSL: Asociación del Pacífico Asiático para el estudio del Hígado; ASCO: Sociedad Americana de Oncología Clínica; CDC: Centro para el Control de Enfermedades.
Esas diferencias probablemente se deben a la falta de estudios prospectivos y a la diversa prevalencia del VHB en los continentes o países 69. En la guía del Pacífico asiático no se solicita el anticore total, porque en esa región el VHB tiene una altísima prevalencia: alrededor del 30 % 71. Con base en evidencia publicada, a todos los pacientes que vayan a ser sometidos a quimioterapia o inmunosupresión se les debería solicitar HBsAg, anticore total y anticuerpos antisuperficie. Si tienen anticore positivo aislado, debe solicitarse ADN 72,73,74. Esas recomendaciones también son válidas para los pacientes que tengan enfermedades concomitantes que alteren la inmunidad 72,73,74. El riesgo de reactivación depende del perfil serológico y del tipo de quimioterapia. Los esquemas de inmunosupresión que más inducen reactivación son los que incluyen rituximab, un anticuerpo monoclonal quimérico contra la proteína CD20, expresada principalmente en la membrana plasmática de las células B 74,75,76,77. Recientemente, la AGA ha publicado las guías sobre inmunosupresión e infección por el VHB, en la cual se dan recomendaciones con base en la estratificación del riesgo de reactivación 68,69. En las Figuras 3, 4 y 5 se presentan las recomendaciones 72.
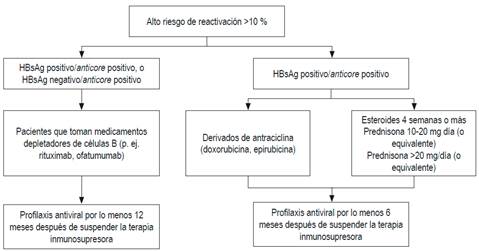
Figura 3 Pacientes con alto riesgo de reactivación del VHB. Modificado de: American Gastroenterological Association. Gastroenterology. 2015;148(1):220.
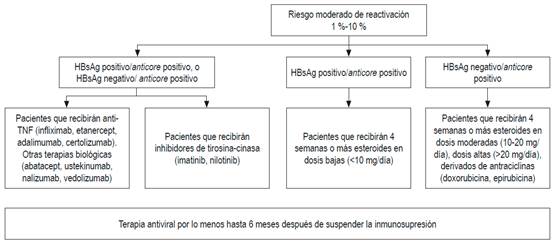
Figura 4 Pacientes con riesgo moderado de reactivación del VHB. anti-TNF: inhibidor del factor de necrosis tumoral. Modificado de: American Gastroenterological Association. Gastroenterology. 2015;148(1):220.
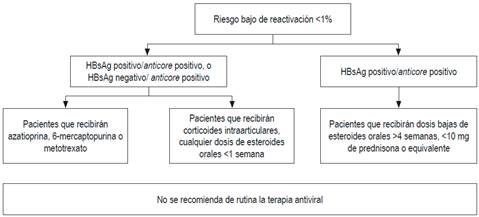
Figura 5 Pacientes con bajo riesgo de reactivación. Modificado de: American Gastroenterological Association. Gastroenterology. 2015;148(1):220.
Si el HBsAg es positivo y no se hace profilaxis antiviral, el riesgo de reactivación es de 30 %-80 % y se debe dar tratamiento con adefovir o entecavir 73. El origen de la reactivación es el ADNccc. El nivel de los anticuerpos antisuperficie disminuye el riesgo de reactivación 68,69. En un estudio se encontró que ninguno de los 10 pacientes con niveles de anticuerpos antisuperficie por encima de 100 UI/mL tuvo reactivación del VHB 74. La reactivación se identifica por los cambios en el ADN y la ALT 68. En los pacientes con HBsAg positivo con anticore positivo y ADN positivo, la reactivación se confirma si el ADN se eleva 1 Log (10 veces) o el ADN se hace positivo si antes era negativo 69,76. La ALT se puede elevar 3 o más veces por encima del límite superior normal. Cuando esas enzimas se elevan, los pacientes tienen un peor pronóstico 76. Las manifestaciones clínicas de la reactivación van desde un cuadro asintomático hasta insuficiencia hepática aguda y muerte 76,77. La recomendación de la AGA es dar tratamiento profiláctico, en vez de hacer seguimiento, con monitorización del ADN 68.
Cuando se hace monitorización y se espera la reactivación para dar tratamiento, la conducta se denomina tratamiento diferido68. La reactivación también se puede presentar en pacientes que han tenido infección aguda resuelta, con evidencia serológica de cura funcional (HBsAg negativo, antisuperficie positivo con anticore positivo o negativo) (75,76,77. En esos casos, el VHB se puede reactivar en el 16%, si reciben quimioterapia que contenga rituximab 75. En esos pacientes con infección resuelta, la recomendación es monitorizar el ADN viral cada 4 semanas y si aparece (se vuelve positivo), debe darse terapia para el VHB 76. Recientemente, en pacientes de ese tipo se comparó la estrategia de monitorización frente al tratamiento profiláctico 78. A los 18 meses de seguimiento, hubo reactivación en 3/28 pacientes del grupo de monitorización frente a 0/33 de quienes recibieron terapia profiláctica con tenofovir 78. Aunque la diferencia no fue estadísticamente significativa, se necesita un estudio con mayor tamaño de muestra para determinar cuál es la mejor opción o si no hay diferencias. En ese último caso, la elección dependerá del costo de los medicamentos frente a la determinación del ADN cada 4 semanas.
En los pacientes que tienen marcadores de infección, la recomendación es antivirales contra el VHB, como se mencionó. Los medicamentos recomendados son adefovir y entecavir, por su baja capacidad parta inducir resistencia del VHB. No obstante el alto riesgo de reactivación, la disponibilidad de guías de práctica clínica sobre el tema 68,75 y la investigación del VHB entre los oncólogos de Estados Unidos es subóptima 79.
Otros marcadores de la infección por el vhb
Antígeno relacionado con el core del VHB (AgRC)
Este es un nuevo marcador de la infección por VHB que permite monitorizar y ayudar a establecer su pronóstico 80. Se describió por primera vez en 2002 81. Su concentración sérica tiene excelente correlación con el ADN del VHB en la sangre y, comparado con este, es superior para determinar la replicación viral y el ADNccc intrahepático 82. El ADN y el HBsAg en sangre son un reflejo del ADNccc intrahepático; sin embargo, el AgRC es más sensible que esos 2 marcadores clásicos. El 78 % de los pacientes que tienen ADN negativo por el tratamiento antiviral sigue teniendo positivo el AgRC 83. En otro estudio, Lai y colaboradores 84 encontraron que el 51 % de los pacientes en quienes se negativizó el ADN por el tratamiento tenía ADNccc positivo en el hígado.
Similares al anterior, otros estudios han demostrado que no hay correlación entre la desaparición del ADN en suero y la desaparición del ADNccc intrahepático 80. En cambio, el AgRC es un mejor reflejo del ADNccc 80. En pacientes con HBsAg negativo y anticore positivo, con ADN negativo y AgRC positivo al recibir quimioterapia, la tasa de reactivación puede llegar al 40 % 85. Por la mayor sensibilidad del AgRC como marcador del ADNccc, se le considera una nueva y muy prometedora herramienta, que permitiría monitorizar mejor el tratamiento de la infección crónica por el VHB, así como también de mucha utilidad en la IOVB y para la monitorización de la reactivación del VHB 80.











 text in
text in