Introducción
Helicobacter pylori es una bacteria gramnegativa, microaerófila y capaz de colonizar el estómago 1. Produce gastritis crónica, úlceras pépticas, cáncer gástrico (CG) y enfermedades hematológicas 1,2,3. Representa la infección bacteriana crónica más común en el ser humano después de Streptococcus mutans, productor de las caries dentales 4; en 2015 había aproximadamente 4400 millones de personas infectadas 5). El continente más afectado es África y el menos afectado es Oceanía, con prevalencias de 70 % y 24 %, respectivamente 5. Nigeria tiene la prevalencia más alta (87,7 %) y Suiza, la más baja (19 %). En los países con alta incidencia de CG, la prevalencia de H. pylori es el doble que la de los países con baja incidencia de ese tumor 6,7. La mejoría de las condiciones sanitarias y la erradicación de los infectados identificados disminuyen la prevalencia de la infección 7. La tasa de reinfección posterradicación se relaciona con el nivel socioeconómico de los diferentes países 8,9,10. En Japón es del 2 % y en América Latina del 8 % 8,9.
El papel etiológico de H. pylori en gastritis crónica y úlceras pépticas fue demostrado por Warren y Marshall en 1984 11. Por este hallazgo recibieron el premio Nobel de medicina en el 2005 12. El 20 % de todos los infectados desarrollará alguna enfermedad digestiva como úlceras pépticas, CG o linfoma MALT (linfoma de tejido linfoide asociado a mucosa) gástrico 13,14,15,16. En 1994 la Organización Mundial de la Salud (OMS) clasificó a H. pylori como un carcinógeno tipo I o carcinógeno definido 17. Para muchos países latinoamericanos, incluida Colombia, el CG es un problema de salud pública; y en la reciente guía colombiana de práctica clínica sobre CG, se recomienda erradicar H. pylori en todos los infectados para disminuir el riesgo de ese tumor 18. Países como Taiwán y China han demostrado que erradicar H. pylori disminuye la incidencia de CG en 25 % y 39 %, respectivamente 19. El reciente consenso de Kioto ratificó la recomendación de erradicar H. pylori a todos los infectados, independientemente de la severidad de la gastritis y los síntomas 20. Pero todavía no se dispone de esquemas con eficacia superior al 98 %, exigida para las enfermedades infecciosas y, por el contrario, frecuentemente su éxito es 80 % o menos (inaceptable) 3,21.
Los frecuentes fracasos de las terapias utilizadas están relacionados con factores del microorganismo y del huésped 21-30. Los factores de H. pylori incluyen su hábitat ácido, microaerofilia, formación de biofilm (que lo protege de los antibióticos), alta carga bacteriana, con múltiples individuos durmientes (etapa no replicativa), evasión inmunológica y resistencia a los antibióticos 21,22,23. Este último es el factor más importante 21-25. La resistencia a la claritromicina, metronidazol 21-24 y más recientemente a quinolonas 22 ha originado terapias cada vez menos eficaces a nivel mundial 3,4,21-27.
En el presente artículo se revisarán los conceptos básicos de las terapias de erradicación y los factores adicionales implicados en el éxito de los tratamientos.
Inhibición profunda de la secreción de ácido
Los inhibidores de la bomba de protones (IBP; omeprazol, esomeprazol, lansoprazol, rabeprazol, entre otros) son medicamentos fundamentales en los diferentes esquemas de tratamiento. Al inhibir la secreción del ácido gástrico y elevar el pH por encima de 6, se aumenta la replicación de H. pylori y se aumenta la eficacia de los antibióticos 3,24-30. Sin embargo, la eficacia de los IBP es influida por el metabolismo de los mismos en el citocromo P450 (CYP450) y del genotipo particular de CYP219C, y otros como CYP3A4, ABCB1 y niveles de IL- 1β 24-30. De todos estos, el CYP2C19 es el más importante 24-29 y el impacto es mayor con los esquemas que utilizan omeprazol y lansoprazol, y menos en los que se incluyen esomeprazol y rabeprazol 25,26,27. Este último medicamento tiene un metabolismo independiente de ese sistema enzimático 25,26,27. Con base en el polimorfismo genético del CYP2C19, los individuos se clasifican en 3 categorías de metabolizadores de los IBP: metabolizadores rápidos (MR), metabolizadores intermedios (MI) y metabolizadores lentos (ML) 2,28-30, los cuales varían en las diferentes poblaciones 28-31. Los asiáticos tienen alta prevalencia de ML; mientras que en las poblaciones caucásicas la mayoría es MR 29,30. Sin embargo, cuando el lansoprazol o el omeprazol, se dosifican 4 veces al día, hay suficiente supresión de ácido en los MR de 24,26,27.
Estudios realizados en Japón hace más de 20 años demostraron que la erradicación de H. pylori con terapia dual (amoxicilina e IBP) varía según el CYP2C19 27,28, siendo 28 %, 60 % y 100 %, respectivamente en los MR, MI y ML; y de manera similar se comportó la curación de las úlceras pépticas 28. En un metaanálisis reciente 29, se encontró que las tasas de éxito terapéutico de los MR fueron inferiores a las de los MI independientemente del tipo de IBP que se tomara 28. No se observaron diferencias significativas para esomeprazol y rabeprazol 29. En Corea del Sur se ha encontrado que un factor de riesgo para falla del tratamiento de erradicación es ser MR (Odds ratio [OR]: 1,84; intervalo de confianza [IC] 95 %: 1,04-2,39) 30. Sin embargo, el efecto del CYP2C19 puede ser superado con dosis altas del IBP; por ejemplo, 40 mg de omeprazol 2-3 veces al día o dosis equivalentes de otros IBP 21.
Vonoprazán es un nuevo IBP que inhibe la secreción de ácido bloqueando competitivamente la unión del potasio, en la adenosina-trifosfatasa (ATPasa) de la célula parietal 31. Supera algunos inconvenientes de los IBP convencionales tales como vida media corta, máxima inhibición de la secreción de ácido después de 4-5 dosis, necesidad de envoltura protectora del ácido y, adicionalmente, su actividad es independiente del polimorfismo de CYP2C19 32,33. En Japón está aprobado para el tratamiento de úlceras pépticas, enfermedad por reflujo gastroesofágico, profilaxis y tratamiento de lesiones gastroduodenales por antiinflamatorios no esteroideos (AINE), y para erradicar H. pylori34,35.
En un estudio japonés 35, la erradicación con un esquema que incluyó vonoprazán fue 92 % frente a 75,9 % en el grupo que recibió lansoprazol. Cuando se incluyó en terapias de segunda línea el éxito fue de 98,0 % 35. Un metaanálisis reciente encontró que las terapias con vonoprazán son más eficaces que las que utilizan los IBP convencionales 36.
Particularidades de los antibióticos
La variedad de antibióticos para erradicar H. pylori es pequeña, lo que varía son las combinaciones y sus dosis 19,21-24,37.
Amoxicilina
Es un derivado de la penicilina, inhibe la síntesis de la pared bacteriana y tiene vida media aproximada de una hora 21. Tiene efecto bactericida dependiente del tiempo y cuando se administra 3 o 4 veces al día logra una concentración mínima inhibitoria (MIC) adecuada y sostenida 26,30. Estas características farmacocinéticas contrastan con la dosificación tradicional de 2 veces al día 26. La formulación adecuada debe ser 3 o 4 veces al día para mantener los niveles terapéuticos permanentemente 21,26,30,38. La resistencia primaria de H. pylori a este antibiótico es muy rara a nivel mundial. En América Latina es 4 % 39 y en Colombia <2 % 40. Por ese perfil, es un excelente medicamento que puede utilizarse incluso en terapias de segunda línea después de un esquema previo fallido en el cual se hubiera utilizado 37,40.
Claritromicina
Es un macrólido que actúa uniéndose a la unidad 50S del ribosoma bacteriano 41. Desde hace varias décadas se utiliza a nivel mundial en la terapia triple estándar (TTE) 21-25. Su vida media es aproximadamente 5 horas y se puede administrar 2 veces al día 26. Por su amplia prescripción para múltiples enfermedades, H. pylori ha desarrollado una alarmante resistencia a nivel mundial 41. En Japón aumentó de 1,8 % en 1996 a 27,1 % en 2008 42. En China la resistencia era de 14,8 % en 2000 y en 2014 de 52,6 % 41. En América Latina es en promedio 12 % hasta 2011 32 y en Colombia 25 % 43. A comienzos del 2017, la OMS incluyó a H. pylori resistente a claritromicina en la lista de los 16 microorganismos que amenazan a la humanidad 44 y para los cuales se necesitan estrategias terapéuticas urgentes con el fin de erradicarlas.
Metronidazol
Es una prodroga que produce rupturas en la doble cadena de ácido desoxirribonucleico (ADN) bacteriano 9. Su vida media plasmática es cercana a 8 horas, por lo cual podría administrarse 2 o 3 veces al día 26. La resistencia primaria a este es muy alta en muchos países: Turquía, Irán, China y América Latina. 21. En dicho continente la resistencia promedio es de 53 %, siendo Colombia el país con la resistencia más alta reportada (83 %) 39. Es el único medicamento cuya resistencia in vitro puede vencerse aumentando la dosis y la duración del tratamiento 45. En terapia cuádruple, 500 mg 4 veces al día o 400 mg 4 veces al día durante 14 días logra un éxito de 92 % aun con cepas resistentes 46, que es similar a la encontrada cuando no hay resistencia al mismo 47. Con esa posología, en regiones con alta resistencia al metronidazol las terapias cuádruples con bismuto tienen eficacia superior a 85 % con una duración de 10-14 días 48-52.
Quinolonas
Estos medicamentos actúan en la ADN girasa causando rupturas en el ADN bacteriano 26. Su efecto bactericida depende más de la Cmax que del tiempo por encima de la MIC, por lo cual la dosis puede ser una vez al día 26. Su principal representante es la levofloxacina, que se ha utilizado en esquemas de segunda línea o en primera línea cuando las tasas de resistencia a claritromicina son superiores a 15 % o hay alergia a la penicilina 40,46. Similar a la claritromicina, por su amplio uso en otras enfermedades especialmente otorrinolaringológicas, H. pylori ha desarrollado gran resistencia a nivel mundial 20. En América Latina la resistencia promedio es del 15 % 39 y en Bogotá (Colombia) del 27 % 48,49.
Tetraciclina
Sus representantes más importantes son la tetraciclina y doxiciclina. Actúan uniéndose a la subunidad 30S del ribosoma bacteriano bloqueando la síntesis proteica 26. Su vida media aproximada es 6 horas, pudiéndose administrar 2 o 3 veces al día, aunque lo más utilizado es 3 a 4 veces al día 26. La resistencia primaria es muy infrecuente y no representa un inconveniente para su utilización 46. En América Latina la resistencia promedio es del 6 % 39.
Bismuto
Las sales de este medicamento se utilizan en gastroenterología desde el siglo XIX 47, particularmente como tratamiento primario o adyuvante de la dispepsia y las úlceras pépticas, hasta su reemplazo posterior y paulatino por antiácidos 47. Las sales más populares son subcitrato, subnitrato y subsalicilato 47. Estas se hidrolizan en el estómago, formando polímeros insolubles con efecto bactericida, cuyo mecanismo de acción más importante para H. pylori es impedir el ingreso de hidrogeniones al citoplasma y, de esa manera, impedir su replicación 50,51. Hasta el momento no se ha informado resistencia de H. pylori a este medicamento y su seguridad y tolerancia han sido demostradas 38,50.
La terapia exitosa con este medicamento para erradicar H. pylori se desarrolló en Australia por Borody en 1989 46. Ese esquema incluía 3 medicamentos: subcitrato de bismuto, metronidazol y tetraciclina 46. Posteriormente, se adicionó IBP y se extendió a 14 días, para recuperar la eficacia disminuida por la resistencia a metronidazol 47. La posología de este esquema es compleja por su duración y el gran número de tabletas al día: 2 tabletas de bismuto 4 veces al día, tetraciclina 500 mg 4 veces al día, metronidazol 500 mg 3 veces al día y el IBP 2 veces al día, lo cual incide notablemente en la adherencia al mismo. Adicionalmente, también produce efectos adversos, por lo cual se han implementado diferentes estrategias como la educación del paciente y disminución de la duración a 7-10 días, y también disminuyendo la dosis del metronidazol cuando la resistencia al mismo es baja y, finalmente, el desarrollo de una cápsula (PYLERA) que contiene los 3 medicamentos originales 46,47. La eficacia esperada de la terapia cuádruple con bismuto por 14 días es superior a 95 %, aunque exista alta resistencia a metronidazol 52. Esta terapia cuádruple se recomienda como esquema de segunda línea o de primera línea cuando hay alergia a la penicilina, la resistencia a claritromicina es superior a 15 % o cuando exista resistencia dual a claritromicina y metronidazol 46. También se recomienda como terapia de segunda de segunda línea cuando una terapia de primera línea ha fallado previamente 46.
Un uso reciente del bismuto es adicionarlo a las distintas terapias triples para contrarrestar las resistencias a claritromicina y a levofloxacina 53,54. En la guía colombiana se recomienda esta estrategia 55. Los estudios iniciales con ese concepto se hicieron en Italia y posteriormente en España 56. En China 57 y en Turquía 58 no se ha demostrado la ventaja de adicionar bismuto a las terapias triples de primera línea cuando hay resistencia a claritromicina o a levofloxacina.
Rifabutina
Es un metabolito de la rifampicina, cercano a la rifamicina 59. Fue descubierto hace más de 20 años y usado en el tratamiento de erradicación de H. pylori en esquemas de cuarta línea o de salvamento 40,59,60,61. Tiene baja biodisponibilidad y gran volumen de distribución 59. Se caracteriza por tener mayor capacidad de penetración intracelular y distribución tisular que la rifampicina, probablemente por ser más lipofílico 59. Actúa en la subunidad β de la ARN-polimerasa dependiente del ADN bacteriano, inhibiendo la síntesis y transcripción de proteínas 59,61,62. La resistencia de H. pylori a este medicamento es del 1 % 50. Tiene como inconvenientes el alto costo y que no está fácilmente disponible en todas partes. Produce efectos adversos en más del 20 % de los pacientes, siendo el más temido la mielotoxicidad, que se presenta con dosis de 600 mg al día o más y que desaparece al suspenderlo 63.
Furazolidona
Es un antimicrobiano de amplio espectro, perteneciente a la familia de los nitrofuranos 64. Inhibe la monoaminooxidasa y es muy eficaz contra diversos microrganismos y muy económico 64,65,66. Su desventaja es su falta de disponibilidad 64-66. En gastroenterología se utilizó inicialmente para tratar enfermedades diarreicas 67. Tiene eficacia demostrada contra H. pylori, especialmente asociado con bismuto 67, aunque frecuentemente produce efectos adversos al interactuar con derivados de la soya y los quesos maduros; puede producir desde síntomas leves como náuseas, emesis y hasta crisis hipertensivas y convulsiones 64,67. Este medicamento ha sido ampliamente usado en esquemas de tratamiento en China, Irán 64-68 y también en Colombia. La resistencia reportada en China es de 0 % a 1 % y en América Latina, particularmente en Brasil, de 3 % en promedio 39,67.
Duración de los esquemas de erradicación
La duración inicial de la TTE era 14 días, pero por la presión de la industria farmacéutica, se acortó a 7 días porque le traía ventajas comerciales. Sin embargo, se asoció con menor eficacia. Las revisiones sobre las terapias de 7 días indujeron a aumentar la duración a 10 días, aunque su éxito disminuyó progresivamente conforme aumentó la resistencia a claritromicina, metronidazol y últimamente a levofloxacina 46. En la última década su eficacia ha sido inaceptable (<80 %) 45. Desde el IV consenso de Maastricht se recomendó extender la duración a 14 días para aumentar la eficacia 5 % en promedio 53. La mayoría de los estudios eran consistentes en la ventaja de una mayor duración 24. Un metaanálisis de Cochrane en 2013 69 demostró que la TTE de 14 días era superior a las de 7-10 días con una diferencia del 10 % 69. Conforme se extendió a más días, también aumentaron los eventos adversos de 15,5 % a 19,4 %, aunque no se tradujo en abandonos del tratamiento 69. En otros tipos de esquemas, también se ha demostrado mayor éxito con la duración de 14 días frente a terapias más cortas, excepto probablemente para la terapia cuádruple con bismuto, cuya duración de 10 días que sigue siendo eficaz 70. La recomendación actual en los consensos internacionales más importantes sobre erradicación de H. pylori52,54,71 y de la guía colombiana 55 es que la duración para todas las terapias sea de 14 días, excepto los que contienen rifabutina, que pueden ser de 10 días 38,53,54,70,71.
Terapias de erradicación: ¿cuál primero?
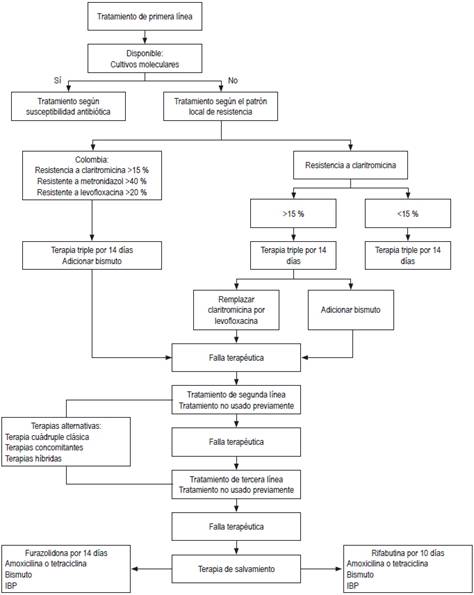
Idealmente, el tratamiento de H. pylori debería ser similar a cualquier enfermedad infecciosa, basada en pruebas de susceptibilidad 16. Sin embargo, los cultivos de biopsias gástricas o métodos moleculares (reacción en cadena de la polimerasa [PCR], hibridación in situ) para investigar la susceptibilidad 55,72,73 no están disponibles en todos los sitios y esto obliga a iniciar el tratamiento empíricamente 46,47. Ante esta realidad, la recomendación es que la elección de las terapias debe tener en cuenta el patrón de resistencia local a los antibióticos e idealmente que la eficacia de los esquemas utilizados haya sido demostrada independientemente de consensos o guías internacionales. Los tratamientos elegidos deben tener eficacia mínima del 90 % 74. Hasta el momento, ningún esquema es 100 % eficaz, por lo cual se necesitan tratamientos de segunda, tercera línea y de rescate o salvamento 40. Los diferentes tipos de esquemas se describen a continuación.
Terapia cuádruple clásica
Su duración es de 14 días. Consta de IBP 2 veces al día + bismuto subsalicilato (550 mg 4 veces/día o 2 veces al día) + metronidazol (500 mg 3 veces/día) + tetraciclina HCl (500 mg 4 veces/día) 11,46,53,54,56,70,71. El bismuto se puede dar 2 veces al día.
Terapia híbrida
Se compone de 2 fases de 7 días de duración cada una 11,66,74. En los primeros 7 días: amoxicilina en dosis estándar u optimizadas (3 o 4 veces al día) más IBP 2 veces al día y en la última semana se adicionan 2 antibióticos diferentes, usualmente claritromicina (500 mg) + metronidazol/tinidazol (500 mg), cada uno 2 veces al día. Su eficacia es del 97 % 75. Cuando hay resistencia combinada a claritromicina y a metronidazol superior al 9 % (resistencia dual), la eficacia es menor al 90 % 66. Recientemente, en Colombia se investigó una terapia híbrida de 15 días que logró una eficacia de 94 % 76. La posología de esta terapia es la siguiente: amoxicilina 500 mg 4 veces/día + esomeprazol 40 mg 2 veces/día 15 días. En los últimos diez días se administra subsalicilato de bismuto 2 tabletas 2 veces/día + doxiciclina (Vibramicina®) 100 mg 2 veces/día.
Terapia concomitante
Este es el esquema más utilizado, combina los IBP con amoxicilina, claritromicina y metronidazol 46,53,54,70,71. Es recomendada porque la resistencia dual a claritromicina y metronidazol es infrecuente 26,46,53,54,70,71. Cuando hay resistencia dual, la eficacia disminuye notablemente 66,74,77. La eficacia global es 88 %-90 % 38,46. Como se ha comentado, la adición de bismuto a las distintas terapias triples para contrarrestar las resistencias a claritromicina y a levofloxacina 53,54 ha sido una nueva estrategia que inició en Europa 56 y actualmente es válida y recomendada en la guía colombiana 55.
Terapia triple estándar
Este esquema fue muy popular en las últimas décadas; incluye IBP, amoxicilina y claritromicina 53,54,55,70,71. Sin embargo, en la actualidad para el uso de dicho régimen terapéutico, este debe administrarse durante 14 días; lo anterior es válido cuando el nivel de resistencia de claritromicina local es <15 %. El esquema sería: amoxicilina 3-4 veces/día + IBP 2 veces/día + claritromicina 500 mg 2 veces/día 53,54,55. Si la resistencia es >15 %, se debe adicionar bismuto subsalicilato (Bisbacter®) 2 tabletas masticadas antes del desayuno y de la cena. O cambiar la claritromicina por levofloxacina 500 mg al día. Si la resistencia a levofloxacina es >20 %, se podría mantener, pero adicionando bismuto en la misma posología descrita anteriormente.
Elección para primera, segunda y tercera línea
Tratamientos de primera línea
Es el esquema terapéutico que se da inicialmente. Como se mencionó, debería basarse en pruebas de susceptibilidad 10,46. Cuando se hace de esa manera, la eficacia por intención de tratar (ITT) es de 94,7 % (IC 95 %: 88,8 %-100 %) y por protocolo (PP) es de 96,4 % (IC 95 %: 91,5 %-100 %) frente a 71,9 % (IC 95 %: 60,2 %-83,5 %) y 73,2 % (IC 95 %: 61,5 %-84,8 %) con las terapias empíricas 78. Cuando la resistencia a claritromicina es <15 % se puede utilizar la terapia triple con claritromicina más amoxicilina e IBP por 14 días 53. Si es >15 % se recomienda remplazar este medicamento por levofloxacina o como alternativa adicionar bismuto 53,54,70,71, 2 tabletas de subsalicilato (Bisbacter®) masticadas antes del desayuno y de la cena.
En Colombia, la tasa de resistencia a claritromicina es de 20,5 % 79, a levofloxacina 27,3 % 80 y a metronidazol >80 % 43. Con este perfil de resistencia en particular, la recomendación es adicionar a las terapias triples de 14 días subsalicilato de bismuto, 2 tabletas 2 veces al día. Las terapias cuádruples con bismuto no necesitan pruebas de susceptibilidad 52.
Tratamientos de segunda y de tercera línea
Cuando fracasa el tratamiento de primera línea, el de segunda línea se elige entre cualquiera de los esquemas que no tengan los antibióticos utilizados en la de primera línea. De la misma forma, también se eligen los tratamientos de tercera línea. Otras terapias elegibles pueden ser la cuádruple clásica, concomitantes o híbridas 40.
Tratamientos de rescate (salvamento)
Estos tratamientos son de cuarta línea, cuando 3 tratamientos previos han fallado 40. Los antibióticos para estos esquemas son furazolidona o rifabutina 53,54,70,71,81.
Con furazolidona, la dosis recomendada es 100 mg 3 veces al día por 14 días 43,64,65,66. Se utiliza en terapias cuádruples con bismuto (2 a 4 veces al día), con amoxicilina o tetraciclina más IBP 43,64-66. Este medicamento ya se utilizó en Colombia en terapia cuádruple por 14 días y la tasa de erradicación fue de 86 % (IC 95 %: 65 %-94 %) con amoxicilina 82 y 91 % con tetraciclina 83. El esquema sería de la siguiente manera: Amoxicilina 850 mg 3 veces al día (o 500 mg cada 6 horas) más furazolidona 100 mg 3 veces al día más subsalicilato de bismuto 2 tabletas con el desayuno y con la cena, más IBP 2 veces al día. En los alérgicos a la penicilina, se cambiaría la amoxicilina por tetraciclina 500 mg cada 6 horas.
No obstante su eficacia, la furazolidona es subutilizada por el temor a sus efectos adversos. Además, se ha especulado que podría tener efectos oncogénicos 63,65; sin embargo, no hay evidencias de esa posibilidad 66,84,85. Al respecto, la Agencia Internacional de Investigación en Cáncer de la OMS (IARC) la tiene incluida en la categoría 3, es decir, “No clasificable como carcinógeno para los humanos” 84. Estudios más recientes han ratificado su seguridad 46,64,84.
Rifabutina
El esquema con este medicamento es el siguiente: rifabutina 150 mg 2 veces/día, más amoxicilina más IBP por 10 días 86. Esta triple terapia tiene eficacia del 79 % 55, cuando se utiliza como recate después de 3 o 4 terapias previas fallidas. La adición de bismuto aumenta la eficacia a 96,6 % 87. La rifabutina se decide en pacientes con patologías importantes o serias en quienes las terapias previas hallan fallado, tales como úlceras pépticas complicadas, linfoma MALT gástrico o antecedente de CG 55. Un flujograma sugerido para tratar H. pylori se muestra en la Figura 1 y los respectivos esquemas mencionados en el mismo son los descritos previamente.
Probióticos
Los probióticos son microorganismos vivos o sustancias producidas por estos que tienen efectos benéficos 21,88. Se han utilizado como adyuvantes en la terapia antibiótica de erradicación de H. pylori. Se les atribuyen beneficios tales como la estimulación de la respuesta inmune, modulación de la microbiota y disminución de efectos adversos de los antibióticos 21. La especie más estudiada es Lactobacillus spp., que en algunos estudios ha mejorado la tasa de eficacia 88. Otros estudios y metaanálisis han confirmado el beneficio de los probióticos incluyendo también Biffidobacterium spp. y Saccharomyces boulardii88,89. Este último tipo de probióticos ha llamado la atención recientemente, se ha evidenciado en un metaanálisis realizado en 2015 con más de 2200 participantes, en el grupo de suplementación con estos microorganismos hubo un riesgo relativo (RR) de éxito en la erradicación de H. pylori de 1,11 (IC 95 %: 1,06-1,17); y RR de efectos adversos relacionados con la terapia de 0,44 (IC 95 %: 0,31-0,64), específicamente diarrea: 0,51 (IC 95 %: 0,42-0,62). 89 El mecanismo de acción de estos no es del todo claro y hasta ahora se han estudiado múltiples cepas, dosis, tiempos de duración de la terapia probiótica como coadyuvante 90.
Actualmente se tiene un escenario poco claro en relación con una recomendación uniforme de estos productos. En el consenso de Maastricht se consideró que solo algunas cepas específicas de los probióticos antes nombrados son útiles para incrementar la eficacia y reducir la ocurrencia de efectos adversos relacionados con los antibióticos 52. Sin embargo, ni en el consenso de Toronto ni en la guía española se recomiendan los probióticos 54,71.
Importancia del biofilm
Similar a otros microorganismos como Pseudomonas aeruginosa, Staphylococcus aureus, entre otras, H. pylori produce biofilm, que consiste en agregados de organismos que crecen unidos entre sí, aprovechando las superficies o interfaces 91. El biofilm es un componente antiguo e integral en el ciclo de vida procariota y en la actualidad es visto como un factor de virulencia independiente, siendo reconocido como causa de exacerbación de infecciones respiratorias crónicas 4. El biofilm favorece notablemente a H. pylori: dificulta la llegada de los antibióticos a la bacteria, disminuye su replicación por la limitación de nutrientes y lo protege contra la respuesta inmune celular y humoral 91.
Para debilitar la protección del biofilm de H. pylori, se ha utilizado el mucolítico N-acetilcisteína (NAC) antes de iniciar los antibióticos 92 En un ensayo clínico sin cegamiento publicado en 2010 se usó esta estrategia cuando un tratamiento previo había fallado y logró una eficacia del 65 % en el grupo de NAC frente al 20 % en el grupo control 93. Otras estrategias han sido utilizar otras sustancias y enzimas degradantes del biofilm en estudios in vitro, con resultados aún pendientes por validar en ensayos clínicos 4.
Vacunas
La vacunación ha surgido como una nueva alternativa en la lucha contra la resistencia bacteriana, pero enfocada en la prevención 94. Contra H. pylori se han probado vacunas en modelos animales logrando una protección aceptable 23. En humanos, los resultados son variables, dependiendo de la ruta de la inmunización y los antígenos utilizados 95. Recientemente, en el primer ensayo clínico aleatorizado doble ciego se obtuvo eficacia en la inmunogenicidad en el 71 % a 1 año y 55 % a 3 años 96. Hasta el momento no se dispone de una vacuna definitiva 97.











 text in
text in